蒺藜苜蓿、天蓝苜蓿、金花菜基因组SNP穿梭标记开发
2017-04-14任海龙魏臻武陈祥扬州大学动物科学与技术学院江苏扬州225009新疆农业科学院海南三亚农作物育种试验中心海南三亚57204
任海龙,魏臻武,陈祥(.扬州大学动物科学与技术学院,江苏 扬州 225009;2.新疆农业科学院海南三亚农作物育种试验中心,海南 三亚 57204)
蒺藜苜蓿、天蓝苜蓿、金花菜基因组SNP穿梭标记开发
任海龙1,2,魏臻武1*,陈祥1
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.新疆农业科学院海南三亚农作物育种试验中心,海南 三亚 572014)
蒺藜苜蓿是继拟南芥和水稻之后又一个进行全基因组测序的植物,利用蒺藜苜蓿的基因组序列,开发出可以在其他豆科植物上应用的分子标记,即穿梭标记,已成为缺乏基因组信息或基因组复杂的豆科植物基因组学及分子遗传学研究的有效手段。天蓝苜蓿和金花菜是我国最重要的两种一年生苜蓿,由于缺乏有效的分子标记,这两种苜蓿在基因组水平上的研究很少。SLAF-seq是近年来开发出的一种简化基因组测序技术,具有高通量、准确性、成本低、周期短的优点,已在众多物种的全基因组SNP标记开发上得到应用。本研究通过SLAF-seq技术对12份蒺藜苜蓿、天蓝苜蓿和金花菜材料进行简化基因组测序,共得到28.04×106个读长的测序数据,276432个高质量的SLAF标签,其中58748个SLAF标签为多态性标签,平均测序深度为17.44。在58748个多态性SLAF标签中,共检测出次要基因型频率(MAF)大于0.05的SNP标记189133个。本研究开发出的SNP标记可用于一年生苜蓿的遗传多样性、遗传图谱构建和重要农艺性状的QTL定位等的研究,其种间穿梭的特性可为苜蓿属种间基因组排列顺序、系统进化关系、比较图谱构建等方面的研究提供帮助。
蒺藜苜蓿;天蓝苜蓿;金花菜;SLAF;SNP
苜蓿属(Medicago)大约有87个种,包括了最重要的豆科牧草——紫花苜蓿(Medicagosativa)和豆科模式植物——蒺藜苜蓿(Medicagotruncatula),在农业和畜牧业生产中占有重要地位[1]。按照生育期的长短,苜蓿属植物可分为一年生苜蓿(annual medic)和多年生苜蓿(perennial medic),其中大部分为一年生苜蓿[2]。一年生苜蓿被广泛应用于欧洲和澳大利亚的草地农业系统,但是国内对一年生苜蓿的研究却很少。
蒺藜苜蓿是继拟南芥和水稻之后又一个进行全基因组测序的植物[3],因其具有基因组小(500 Mb)、遗传转化效率高、生长周期短、自花授粉等优点,使之成为豆科生物学和基因组学研究的模式植物[4]。相对于另一种豆科模式植物——百脉根(Lotuscorniculatus),蒺藜苜蓿与许多重要豆科作物的亲缘关系更近,表现出更好的共线性关系,被认为是豆科比较基因组学研究的重要工具[5]。利用蒺藜苜蓿的基因组序列,开发出可以在其他豆科植物上应用的分子标记,即穿梭标记,已成为缺乏基因组信息或基因组复杂的豆科植物基因组学及分子遗传学研究的有效手段[6-8]。天蓝苜蓿和金花菜是我国分布最广泛的两种一年生苜蓿[4]。天蓝苜蓿(Medicagolupulina)在全世界广泛分布,除用于建植草地收获饲草外,更多用于冬季裸露土地的覆盖等生态保护上。因其匍匐生长和侵占性强的特点,天蓝苜蓿还可以与其他作物间作套种,起到肥土和抑制杂草的作用[9-10]。现遍及我国东北、华北、西北和云贵高原,生态类型十分丰富[11]。金花菜(Medicagopolymorpha)起源于地中海和相邻的干旱、半干旱地区,由于其低光周期敏感性和春化性而广泛分布于世界各地[12]。除能固定大气中的N2,生产出高质量的牧草外[13],还具有土壤修复、培肥地力、防止水土流失等作用,被广泛应用于牧草、饲料、绿肥、草地农业系统、冬季覆盖作物和救荒牧草等领域[14-16]。除此之外,金花菜还有很多优良的农艺性状:如土壤和气候的适应性[17]、持久性、良好的冬季生长能力和耐放牧等[18],可用于过度放牧或焚烧后退化草场的恢复[16],被认为是苜蓿改良的重要遗传资源[19]。现在我国的江浙地区和云南的栽培面积较大。目前,除蒺藜苜蓿外,其他一年生苜蓿的研究主要还是集中在耕作制度、栽培措施和生产应用上,基因组水平上的研究很少,缺少有效的分子标记是其中主要的原因之一。
单核苷酸多态性(single nucleotide polymorphism,SNP)是近年来发展起来的第三代分子标记。具有数量多、分布广、高通量、易于分型和自动化等特点,被广泛应用于分子遗传学的各个领域[20-21]。得益于下一代测序(next-generation sequencing,NGS)技术的飞速发展,全基因组尺度的海量SNP标记开发已成为可能[22]。但是,基于重测序技术的SNP标记开发费用较高,并且仅限于已经完成全基因组测序的物种[21]。因此,以部分序列代替全基因组序列的简化基因组测序技术得到迅速发展。其中SLAF-seq(specific length amplification fragment sequencing)[23]技术因其具有通量高、准确性高、成本低、周期短的特点,已在众多作物的SNP标记开发上得到应用[24-27]。本研究利用 SLAF-seq技术,以1份蒺藜苜蓿、1份天蓝苜蓿和10份金花菜资源为材料,通过限制性酶切片段的双端测序,获得理想的SLAF标签,进而开发高质量的SNP穿梭标记,为基于SNP标记的一年生苜蓿系统进化关系、遗传多样性、遗传图谱构建、重要农艺性状的QTL定位和比较基因组学等研究工作奠定基础。
1 材料与方法
1.1 试验材料
试验材料为来自不同地区的3种一年生苜蓿,分别为蒺藜苜蓿材料1份,天蓝苜蓿材料1份和金花菜材料10份,其中金花菜材料来自于我国5个省份或直辖市,详细信息见表1。以上材料均由扬州大学草业科学研究所提供。

表1 供试一年生苜蓿名称与来源Table 1 Name and origin of tested annual medics
1.2 田间种植情况
试验地位于江苏省扬州市扬州大学扬子津东校区(东经119°26′,北纬32°23′),土壤为沙壤土,肥力中等。12份一年生苜蓿材料于2014年10月进行播种,12月采集叶片,翌年4月完成收获。播种前每份材料都经过了至少2代单粒传繁育,以保证试验材料的纯度。
1.3 基因组DNA 的提取与检测
一年生苜蓿的DNA提取参照改良的CTAB法[28]。提取的DNA浓度和质量用紫外分光光度计ND-1000(NanoDrop, Wilmington, DE, USA)和1%的琼脂糖凝胶电泳检测。
1.4 SLAF文库构建及测序
以蒺藜苜蓿的基因组为参考基因组,利用北京百迈客生物科技有限公司研发的酶切预测软件进行酶切预测,确定最适的酶切方案。酶切方案需满足以下四点:1)位于重复序列的酶切片段比例尽可能低;2)酶切片段在基因组上尽量均匀分布;3)酶切片段长度与实验体系的吻合程度高;4)最终获得酶切片段(SLAF标签)数满足实验要求。
根据选定的最适酶切方案,对检测合格的各样品基因组DNA分别进行酶切实验。对得到的酶切片段(SLAF标签)进行3′端加A处理、连接Dual-index测序接头、PCR扩增、纯化、混样、切胶选取目的片段,文库质检合格后用IlluminaHiSeq TM 2500 进行 PE125 bp测序,测序数据已提交到NCBI数据库 (索取号:SRP082533)。为评估建库实验的准确性,选用拟南芥(Arabidopsisthaliana)的基因组作为对照(Control),进行相同的处理参与建库和测序。
1.5 SLAF标签的获得和SNP标记的开发
利用Dual-index对测序得到的原始数据进行识别,得到各个样品的读长数据。对过滤完接头的测序读长进行测序质量和数据量的评估。通过拟南芥(control)数据的比对效率来评估酶的酶切效率,判断实验过程的准确性和有效性。根据序列相似性将各样品的读长进行聚类,聚类到一起的读长来源于一个SLAF片段(SLAF标签)。由于同一SLAF标签在不同材料间的序列相似度高于同一材料不同SLAF标签的相似度,所以根据序列相似度可确定不同的SLAF标签。同一个SLAF标签在不同样品间序列有差异即可定义为多态性的SLAF标签。再根据多态性SLAF标签序列上的差异进行SNP标记的开发。
2 结果与分析
2.1 SLAF建库评估
通过对蒺藜苜蓿基因组进行电子酶切预测, 确定了RsaⅠ和HaeⅢ的双酶切方案为最适的SLAF标签建库酶切方案,该方案的酶切片段长度为314~414 bp,预测到了117528个SLAF标签,这些SLAF标签在基因组上分布均匀,位于重复序列区域的SLAF标签比例仅为6.19%(表2)。本实验的SLAF建库以相同条件处理下的拟南芥为对照,拟南芥酶切片段的双端比对效率为83.41%,酶切效率为97.79%(表3),说明RsaⅠ和HaeⅢ的双酶切实验对3种一年生苜蓿酶切片段的建库效率很高。
2.2 测序数据及SLAF标签分析
经过文库构建和测序,共获得28.04×106个读长数据(表4)。其中,蒺藜苜蓿获得了1560664个读长数据;天蓝苜蓿获得了1643954个读长数据,金花菜材料的读长数据范围在1584219个到5157030个之间,平均每个材料产生2483115个读长数据。测序质量值(Q)是评估高通量测序单碱基错误率的重要指标,测序质量值越高对应的碱基测序错误率越低。如果某碱基测序出错的概率为0.001,则该碱基的质量值Q应该为30。本实验测序质量值Q30的范围在83.43%至86.40%之间,均值为85.14%,且所有样品的Q30值均在80%以上,说明测序碱基错误率低,所获测序数据合格。测序数据的GC含量范围在37.35%至39.03%,均值为 38.22%,GC含量普遍不高,说明达到测序要求。
通过对测序片段的聚类分析,本次实验共开发得到276432个SLAF标签(表5)。其中,蒺藜苜蓿获得了100007个SLAF标签, 天蓝苜蓿获得了100085个SLAF标签,金花菜获得的SLAF标签数量在104196到116918之间,高于前两种一年生苜蓿,这与金花菜参试材料的数量较多有关。另外,测序深度的增加也会一定程度提高同质材料中SLAF标签的开发数量。本实验中一年生苜蓿材料SLAF标签的测序深度在12.04到36.97之间,平均测序深度为17.44,其中金花菜材料“温岭”和“楚雄”达到了30以上,说明本次实验的测序质量较高。

表2 酶切预测确定的酶切方案信息统计Table 2 Information prediction according to the enzyme digestion method
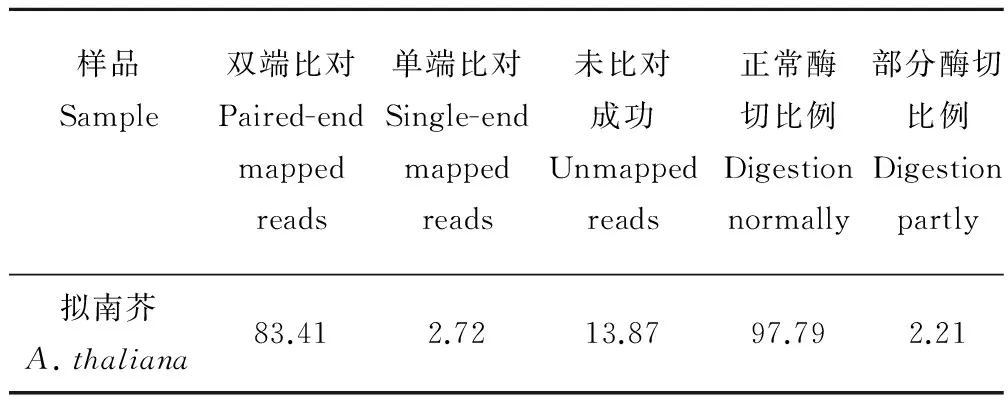
表3 拟南芥测序读长比对结果Table 3 The alignment results between obtained reads and its genome sequences in Arabidopsis %

表4 测序质量评估结果Table 4 Quality assessment of sequencing
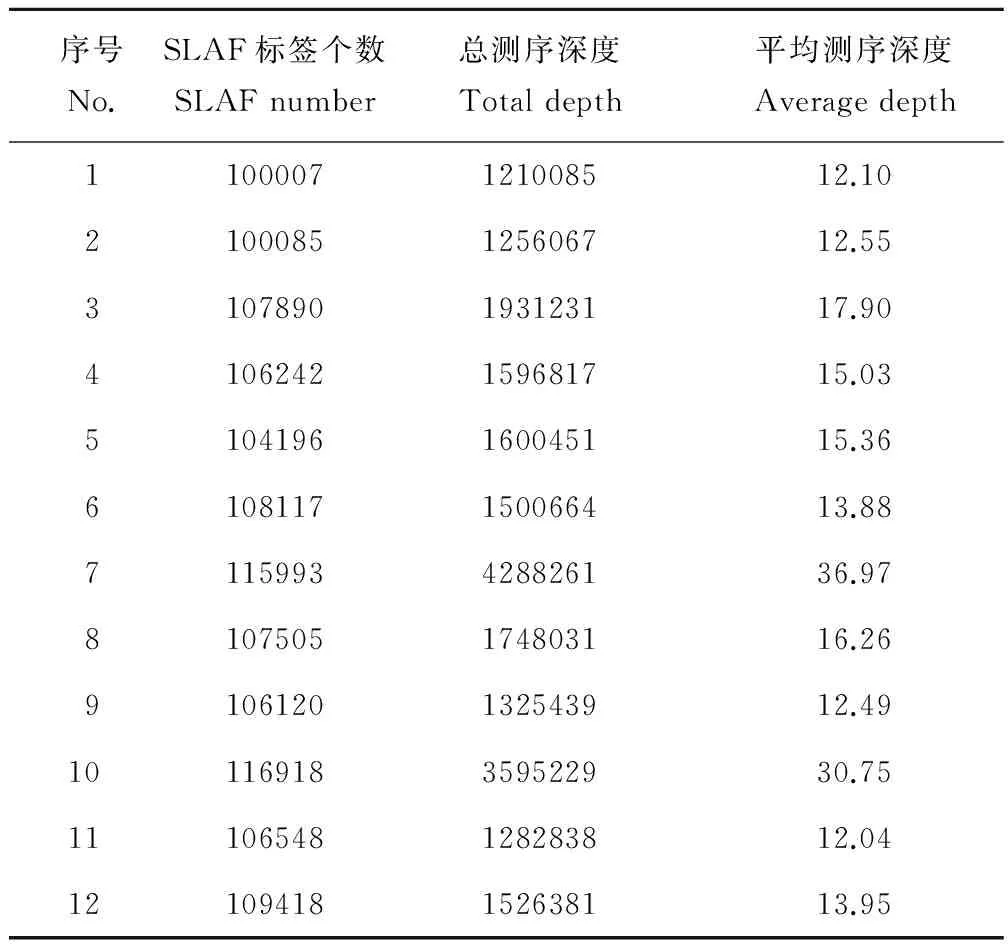
表5 各材料SLAF标签信息统计Table 5 Evaluation of SLAF for each accession
获得的全部276432个SLAF标签可以分成多态性标签、非多态性标签和重复性标签3种类型(表6)。其中多态性SLAF标签共计58748个,占全部SLAF标签数量的21.25%,可用于后续SNP标记的开发。

表6 不同类型SLAF数量统计Table 6 Different types of SLAF tags
2.3 基于SLAF标签的SNP 标记开发
根据开发得到的58748个多态性SLAF标签的信息,按照次要基因型频率(MAF)>0.05 进行筛选,共得到 189133个高质量的种间SNP穿梭标记。其中蒺藜苜蓿获得了89433个SNP标记,天蓝苜蓿获得81203个SNP标记,金花菜材料获得了130054个到154110个不等的种间SNP标记(表7)。
从表7中可以看出,蒺藜苜蓿和天蓝苜蓿的SNP完整度,即SNP的数量要明显低于金花菜。由于12份一年生苜蓿材料的SLAF标签数量差别不大,因此造成SNP标记数量差异的原因可能与苜蓿种间多态性SLAF标签的数量和突变类型不同有关。表明材料间亲缘关系的远近会影响SLAF-seq技术开发SNP标记的数量,材料间亲缘关系越远,开发出的SNP标记数量越少。此外,SNP的数量和测序深度也有一定关系,来自“温岭”和“楚雄” 金花菜材料的平均测序深度是其他金花菜材料的2.32倍,SNP标记的开发数量也相应增加了17.18%。

表7 各材料SNP标签信息统计Table 7 Evaluation of SNP for each accession
3 讨论
3.1 SLAF-seq技术SNP标记开发的可行性
SLAF-seq技术是以生物信息学为基础的简化基因组测序技术。包括通过模拟酶切确定酶切方案,酶切片段的双端测序,对照基因组的测序质量评估,SLAF标签的获得等步骤,可在全基因组尺度上进行海量SNP标记的开发。因其具有通量高、准确性高、成本低、周期短等优势,已在多种作物上取得良好效果。如Zhang等[24]通过SLAF-seq策略构建了第一张芝麻高密度遗传图谱,图谱中93.03%的标记类型是SNP标记;Li等[25]运用SLAF-seq技术,将5785个SNP标记成功整合到了一张由SLAF标签构建的大豆遗传图谱上,并利用这些标记对异黄酮含量相关基因进行了QTL定位;Wei等[26]运用同样策略,构建了一张由1800个SNP标记组成的黄瓜遗传图谱,并对黄瓜果实长度、重量等性状进行了基因定位。最近,苏文瑾等[27]通过SLAF-seq技术从300份甘薯种质资源中获得了795794个高质量SNP标记,为后续甘薯的遗传学研究奠定了基础。众多研究表明,SLAF-seq技术已成为大规模SNP标记开发的有效方法。本研究通过SLAF-seq技术,成功地开发了189133个覆盖蒺藜苜蓿、天蓝苜蓿和金花菜3种一年生苜蓿全基因组的SNP穿梭标记,为一年生苜蓿大规模的分子标记开发提供了可行策略。
3.2 SNP标记在一年生苜蓿上的应用展望
3.2.1 在系统进化关系研究上的应用前景 苜蓿属植物种间和种内遗传变异巨大,且存在种间杂交现象,造成了苜蓿属植物分类的困扰和争议[29]。传统的分类学为认识和利用苜蓿属植物提供了帮助,但也带来了一定程度的混乱。例如,部分胡卢巴属植物与苜蓿属植物具有相同的弹花机制,使两属间的界限十分模糊[30];依赖荚果螺旋形态分类,又将黄花苜蓿(Medicagofalcata)和杂交苜蓿排除在苜蓿属之外[31];糙边苜蓿(Medicagomurex)同时具有2n=14和2n=16两种染色体类型,紫花苜蓿同时具有二倍体和四倍体,按照染色体数目的分类也行不通。Yoder等[32]的研究认为全基因组水平的分子标记可为苜蓿属植物,特别是一年生苜蓿的分类和种属间亲缘关系的确定提供可行策略。毫无疑问,作为基因组中最广泛的变异形式,SNP标记将为一年生苜蓿的系统进化研究提供帮助。
3.2.2 在遗传多样性研究上的应用前景 一年生苜蓿在表型和农艺性状上存在着丰富的遗传变异,在过去的几十年中,科研人员一直十分重视其遗传多样性的研究。以金花菜为例,1994年Bullitta等[12]利用12个生化标记,对意大利撒丁岛不同气候和土壤条件下的45份金花菜自然群体进行了遗传变异情况的分析;随后,Hannachi等[33]采用6个酶标记对来自突尼斯的16份金花菜资源也进行了类似的研究;2000年Paredes等[34-35]利用12个同工酶标记研究了智利41个金花菜自然群体的遗传多样性,并进一步用40对RAPD(random amplification polymorphic DNA)标记对其中36份金花菜资源进行了验证。最近,Chu等[36]利用从蒺藜苜蓿基因组中开发的5对SSR(simple sequence repeats)标记,对来自中国8个金花菜个体进行了遗传多样性研究。然而,传统分子标记的数量有限,在作物遗传多样性的研究中难免力不从心,甚至得到不可靠的结论。数以万计的SNP标记,将为一年生苜蓿遗传多样性的研究提供可靠手段。
3.2.3 在遗传图谱构建上的应用前景 遗传图谱是进行QTL定位、基因图位克隆以及分子标记辅助育种的基础。蒺藜苜蓿的遗传图谱已经成为豆科作物重要农艺性状基因定位的重要工具[37]。然而,由于缺乏有效的分子标记,其他一年生苜蓿尚未有遗传图谱的报道。2014年,Li等[38]利用另一种简化基因组测序技术(genotyping-by-sequencing,GBS),成功将3591个SNP标记铆钉在2130 cM的紫花苜蓿遗传图上,构建了迄今为止密度最高的紫花苜蓿遗传图谱,证明了SNP标记在苜蓿遗传图谱应用上的巨大潜力。一年生苜蓿多为纯合二倍体,相对于杂合四倍体紫花苜蓿,利用SNP标记构建遗传图谱将更为简单有效。
3.2.4 SNP穿梭标记的应用前景 穿梭标记是比较基因组学研究的重要工具,利用穿梭标记可以对近缘物种间的基因组结构、基因组排列顺序等进行比较分析,发掘物种进化过程中的基因组片断缺失、倍增、倒位以及转位等信息,还可以与模式物种建立比较图谱,实现在基因组信息缺乏的物种中克隆重要的功能基因[39]。作为模式植物,从蒺藜苜蓿基因组中开发出的分子标记已在众多豆科作物中得到应用[6-8,36]。蒺藜苜蓿与天蓝苜蓿和金花菜同属一年生苜蓿,亲缘更近[40],由此推断蒺藜苜蓿与天蓝苜蓿和金花菜的比较基因组学研究将更为有效。
4 结论
本研究通过SLAF-seq技术对12份蒺藜苜蓿、天蓝苜蓿和金花菜材料进行简化基因组测序,共得到28.04×106个读长的测序数据,276432个高质量的SLAF标签,其中58748个SLAF标签为多态性标签,平均测序深度为17.44。在58748个多态性SLAF标签中,共检测出189133个高质量的SNP穿梭标记。本研究开发出的SNP穿梭标记,将为今后一年生苜蓿的系统发生学、遗传多样性、遗传图谱构建和重要农艺性状的QTL定位及比较基因组学等研究提供帮助。
References:
[1] Steele K P, Ickert-Bond S M, Zarre S,etal. Phylogeny and character evolution inMedicago(Leguminosae): Evidence from analyses of plastid trnK/matK and nuclear GA3ox1 sequences. American Journal of Botany, 2010, 97(7): 1142-1155.
[2] Brummer E C, Bouton J H, Kochert G. Analysis of annualMedicagospecies using RAPD markers. Genome, 1995, 38(2): 362-367.
[3] Chen A M, Lian R L, Sun J,etal. Leguminous model plant-Medicagotruncatula. Plant Physiology Communications, 2006, 42(5): 997-1003. 陈爱民, 连瑞丽, 孙杰, 等. 豆科模式植物——蒺藜苜蓿. 植物生理学报, 2006, 42(5): 997-1003.
[4] Wei Z W, Gai J Y. Model legume:Medicagotruncatula. Acta Prataculturae Sinica, 2008, 17(1): 114-120. 魏臻武, 盖钧镒. 豆科模式植物——蒺藜苜蓿. 草业学报, 2008, 17(1): 114-120.
[5] Young N D, Cannon S B, Sato S,etal. Sequencing the genespaces ofMedicagotruncatulaandLotusjaponicus. Plant Physiology, 2005, 137(4): 1174-1181.
[6] Choi H K, Kim D, Uhm T,etal. A sequence-based genetic map ofMedicagotruncatulaand comparison of marker colinearity withM.sativa. Genetics, 2004, 166(3): 1463-1502.
[7] Gupta S, Prasad M. Development and characterization of genic SSR markers inMedicagotruncatulaand their transferability in leguminous and non-leguminous species. Genome, 2009, 52(9): 761-771.
[8] Gupta D, Taylor P W J, Inder P,etal. Integration of EST-SSR markers ofMedicagotruncatulainto intraspecific linkage map of lentil and identification of QTL conferring resistance to ascochyta blight at seedling and pod stages. Molecular Breeding, 2012, 30(1): 429-439.
[9] Feng Y Q, Cao Z Z. Advanced studies onMedicagolupulinautilization. Pratacultural Science, 2005, 22(2): 16-20. 冯毓琴, 曹致中. 天蓝苜蓿栽培利用的研究进展. 草业科学, 2005, 22(2): 16-20.
[10] Hively W D, Cox W J. Interseeding cover crops into soybean and subsequent corn yields. Agronomy Journal, 2001, 93(2): 308-313.
[11] Feng Y Q, Cao Z Z, Jin J F. Analysis on Correlation Traits Affecting Single Yield ofMedicagolupulinaL[C]. Hohhot: The Second Conference of The Chinese Society of Grass and The International Symposium, 2004. 冯毓琴, 曹致中, 金巨芳. 影响天蓝苜蓿单株产量诸因素的相关性分析[C]. 呼和浩特: 中国草学会二次会议暨国际学术研讨会, 2004.
[12] Bullitta S, Floris R, Hayward M D,etal. Morphological and biochemical variation in Sardinian populations ofMedicagopolymorphaL. suitable for rainfedMediterraneanconditions. Euphytica, 1994, 77(3): 263-268.
[13] Khaef N, Sadeghi H, Taghvaei M. Effects of new strategies for breaking dormancy of two annual medics (MedicagoscutellataandMedicagopolymorpha). American-Eurasian Journal of Agricultural and Environmental Sciences, 2011, 11: 626-632.
[14] Denton M D, Hill C R, Bellotti W D,etal. Nodulation ofMedicagotruncatulaandMedicagopolymorphain two pastures of contrasting soil pH and rhizobial populations. Applied Soil Ecology, 2007, 35(2): 441-448.
[15] Nichols P G H, Loi A, Nutt B J,etal. New annual and short-lived perennial pasture legumes for Australian agriculture-15 years of revolution. Field Crops Research, 2007, 104(1): 10-23.
[16] Graziano D, Di Giorgio G, Ruisi P,etal. Variation in pheno-morphological and agronomic traits among burr medic (MedicagopolymorphaL.) populations collected in Sicily, Italy. Crop and Pasture Science, 2010, 61(1): 59-69.
[17] Ewing M A, Robson A D. The effect of nitrogen supply on the early growth and nodulation of several annualMedicagospecies. Crop and Pasture Science, 1990, 41(3): 489-497.
[18] Loi A, Howieson J G, Cocks P S,etal. The adaptation ofMedicagopolymorphato a range of edaphic and environmental conditions: effect of temperature on growth, and acidity stress on nodulation and nod gene induction. Animal Production Science, 1993, 33(1): 25-30.
[19] Scarpa G M, Pupilli F, Damiani F,etal. Plant regeneration from callus and protoplasts inMedicagopolymorpha. Plant Cell, Tissue and Organ Culture, 1993, 35(1): 49-57.
[20] Wang J, Luo M C, Chen Z,etal. Aegilops tauschii single nucleotide polymorphisms shed light on the origins of wheat D-genome genetic diversity and pinpoint the geographic origin of hexaploid wheat. New Phytologist, 2013, 198(3): 925-937.
[21] Kumar S, Banks T W, Cloutier S. SNP discovery through next-generation sequencing and its applications. International Journal of Plant Genomics, 2012, doi: 10.1155/2012/831460.
[22] Etter P D, Bassham S, Hohenlohe P A,etal. SNP discovery and genotyping for evolutionary genetics using RAD sequencing. Molecular Methods for Evolutionary Genetics, 2011, 772: 157-178.
[23] Sun X, Liu D, Zhang X,etal. SLAF-seq: an efficient method of large-scale de novo SNP discovery and genotyping using high-throughput sequencing. PLoS One, 2013, 8(3): e58700.
[24] Zhang Y, Wang L, Xin H,etal. Construction of a high-density genetic map for sesame based on large scale marker development by specific length amplified fragment (SLAF) sequencing. BMC Plant Biology, 2013, 13(1): 141. doi:10.1186/1471-2229-13-141.
[25] Li B, Tian L, Zhang J,etal. Construction of a high-density genetic map based on large-scale markers developed by specific length amplified fragment sequencing (SLAF-seq) and its application to QTL analysis for isoflavone content inGlycinemax. BMC Genomics, 2014, 15(1):1086. doi: 10.1186/1471-2164-15-1086.
[26] Wei Q, Wang Y, Qin X,etal. An SNP-based saturated genetic map and QTL analysis of fruit-related traits in cucumber using specific-length amplified fragment (SLAF) sequencing. BMC Genomics, 2014, 15(1): 1158. doi:10.1186/1471-2164-15-1158.
[27] Su W J, Zhao N, Lei J,etal. SNP sites developed by specific length amplification fragment sequencing (SLAF-seq) in sweet potato. Scientia Agricultura Sinica, 2016, 49(1): 27-34. 苏文瑾, 赵宁, 雷剑, 等. 基于SLAF-seq技术的甘薯SNP位点开发. 中国农业科学, 2016, 49(1): 27-34.
[28] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research, 1980, 8(19): 4321-4326.
[29] Lu X S. The exploration and classification of genetic resources of genusMedicagoin China. Chinese Journal of Grassland, 2009, 31(5): 17-22. 卢欣石. 中国苜蓿属植物遗传资源分类整理探究. 中国草地学报, 2009, 31(5): 17-22.
[30] Deng C H, Cui D F, Yang H J,etal. Studies on morphological characters and numerical classification ofMedicagoL. andTrigonellaL. species. Journal of Plant Resources and Environment, 2010, 19(4): 1-11. 邓超宏, 崔大方, 羊海军, 等. 苜蓿属和胡卢巴属植物的形态特征及数量分类研究. 植物资源与环境学报, 2010, 19(4): 1-11.
[31] Lu X S. Status of germplasm classifications for genusMedicago. Acta Agrestia Sinica, 2009, 17(5): 680-685. 卢欣石. 苜蓿属植物分类研究进展分析. 草地学报, 2009, 17(5): 680-685.
[32] Yoder J B, Briskine R, Mudge J,etal. Phylogenetic signal variation in the genomes ofMedicago(Fabaceae). Systematic Biology, 2013, 62(3): 424-438.
[33] Hannachi A S, Boussaid M, Marrakchi M. Genetic variability organisation and gene flow in natural populations ofMedicagopolymorphaL. prospected in Tunisia. Genetics Selection Evolution, 1998, 30(1): 121-135.
[34] Paredes M, Becerra V, Correa P,etal. Isozymatic diversity in accesions ofMedicagopolymorphacollected along an environmental gradient in Chile, and its relationship with other species ofMedicago. Revista Chilena de Historia Natural, 2000, 73(3): 479-488.
[35] Paredes M, Becerra V, Rojo C,etal. Ecotypic differentiation inMedicagopolymorphaL. along an environmental gradient in central Chile. RAPDs studies show little genetic divergence. Euphytica, 2002, 123(3): 431-439.
[36] Chu H J, Yan J, Hu Y,etal. Cross-species amplification of 92 microsatellites ofMedicagotruncatula. Molecular Ecology Resources, 2010, 10(1): 150-155.
[37] Thoquet P, Ghérardi M, Journet E P,etal. The molecular genetic linkage map of the model legumeMedicagotruncatula: an essential tool for comparative legume genomics and the isolation of agronomically important genes. BMC Plant Biology, 2002, 2(2): 385-391.
[38] Li X, Wei Y, Acharya A,etal. A saturated genetic linkage map of autotetraploid alfalfa (MedicagosativaL.) developed using genotyping-by-sequencing is highly syntenous with theMedicagotruncatulagenome. G3: Genes|Genomes|Genetics, 2014, 4(10): 1971-1979.
[39] Zhao J R. Study on Cross-species Markers Related to Disease Resistance Between Soybean andMedicagotruncatula[D]. Nanning: Guangxi University, 2007. 赵金荣. 大豆与豆科模式物种蒺藜苜蓿间与抗病相关的穿梭标记研究[D]. 南宁: 广西大学, 2007.
[40] Bena G, Prosperi J M, Lejeune B,etal. Evolution of annual species of the genusMedicago: a molecular phylogenetic approach. Molecular Phylogenetics & Evolution, 1998, 9(3): 552-559.
Cross-species markers developed from genome sequencing inMedicagotruncatula,MedicagolupulinaandMedicagopolymorpha
REN Hai-Long1,2, WEI Zhen-Wu1*, CHEN Xiang1
1.CollegeofAnimalScience&Technology,YangzhouUniversity,Yangzhou225009,China; 2.HainanCenterofXinjiangAcademyofAgriculturalSciences,Sanya572014,China
Medicagotruncatulais another whole genome sequenced species next toArabidopsisthalianaandOryzasativa. Studying genomics and genetics using cross-species markers developed fromM.truncatulahas become an important strategy for species with more complex genomes or for legumes with less well understood genome.M.lupulinaandM.polymorphaare the most important annual medics in China. However, limited by molecular marker, little research has been done on genome scales in these species. Specific length amplification fragment sequencing (SLAF-seq) possesses significant advantages including development of markers with high throughput, high accuracy, low cost and time saving which has been successfully used in single nucleotide polymorphism (SNP) development in many species. In this study, 28.04×106reads were obtained from a collection of twelve ofM.truncatula,M.lupulinaandM.polymorphaaccessions using SLAF-seq. The average sequencing depth was 17.44, and 276432 high-quality SLAFs were developed, among which 58748 SLAFs were polymorphic. Further 189133 cross-species SNPs were identified from these polymorphic SLAFs with minor allele frequencies (MAFs)>0.05. These SNPs can be used in genetic diversity, genetic linkage mapping and QTL mapping of important agronomic traits in annual medic. They will also convey benefits for the study of genome orders, system evolution, and comparative map construction.
Medicagotruncatula;Medicagolupulina;Medicagopolymorpha; SLAF; SNP
10.11686/cyxb2016400
http://cyxb.lzu.edu.cn
2016-11-01;改回日期:2016-12-26
江苏省科技支撑计划项目(BE2012340)和新疆维吾尔自治区公益性科研院所基本科研业务费项目(KYGY2016121)资助。
任海龙(1985-),男,黑龙江阿城人,助理研究员,在读博士。E-mail: renhailong_2006@163.com*通信作者Corresponding author. E-mail: zhenwu_wei@hotmail.com
任海龙, 魏臻武, 陈祥. 蒺藜苜蓿、天蓝苜蓿、金花菜基因组SNP穿梭标记开发. 草业学报, 2017, 26(4): 188-195.
REN Hai-Long, WEI Zhen-Wu, CHEN Xiang. Cross-species markers developed from genome sequencing inMedicagotruncatula,MedicagolupulinaandMedicagopolymorpha. Acta Prataculturae Sinica, 2017, 26(4): 188-195.
