六种粘液种子性状多样性及其对绵羊瘤胃消化的反应
2017-04-14王树林娜丽克斯外里鲁为华王伟强汪传建石河子大学动物科技学院新疆石河子83003石河子大学信息科学与技术学院新疆石河子83003
王树林,娜丽克斯·外里,鲁为华*,王伟强,汪传建(.石河子大学动物科技学院,新疆 石河子 83003;.石河子大学信息科学与技术学院,新疆 石河子 83003)
六种粘液种子性状多样性及其对绵羊瘤胃消化的反应
王树林1,娜丽克斯·外里1,鲁为华1*,王伟强2,汪传建2
(1.石河子大学动物科技学院,新疆 石河子 832003;2.石河子大学信息科学与技术学院,新疆 石河子 832003)
以条叶车前、伊犁绢蒿、涩芥、播娘蒿、异果芥和群心菜这6种粘液种子为研究材料,首先对其进行种子性状观测,然后将其置入永久性绵羊瘤胃瘘管内进行不同时间段的消化处理,并对处理前后的种子进行吸水率、粘沙率、粘液含量、萌发率等指标的测定,以期揭示这6种粘液种子对绵羊瘤胃消化的反应,并丰富有关植物种子消化道传播的内容。结果表明,这6种种子表层粘液物质都能被绵羊瘤胃液消化,且消化后的种子颜色变深。异果芥种子粘液构成其种翅附属结构,不同处理时间其宽度差异显著(P<0.05),长和高差异均不显著(P>0.05),而其他5种种子长、宽、高(厚)差异均不显著(P>0.05)。粘液量随消化时间的增加而减少,且二者之间符合形如y=-1.98+48.26e-x/8.40(R2=0.95441,P=0<0.01)的指数函数关系,随粘液量的减少,种子吸水率和粘沙率也减少,且二者随消化时间的变化分别符合形如y=90.04+428.03e-x/4.43(R2=0.75934,P=0<0.01)和y=-0.71+342.76e-x/5.05(R2=0.81124,P=0<0.01)的指数函数关系。消化后的粘液种子萌发率显著降低(P<0.05),可萌发种子集中在0~12 h处理时间段内,但仍有部分种子经消化道作用后成功“逃逸”,这为草食动物对其进行消化道传播提供了可能。
粘液种子;瘤胃消化;形态特征;吸水率;粘沙;萌发;消化道传播
遇水能分泌粘液的种子称为粘液种子[1]。种子或果实粘液是在种皮或果皮外层细胞的高尔基体内产生并分泌到细胞腔内或细胞壁层的吸湿膨胀的一类多糖类物质[2]。具有粘液种子的植物多分布在干旱区,已有报道表明灯心草科(Juncaceae)、十字花科(Brassicaceae)、爵床科(Acanthaceae)、车前科(Plantaninaceae)、唇形科(Lamiaceae)、玄参科(Scrophulariaceae)和菊科(Asteraceae)的很多植物能够产生粘液种子[3],种子产生粘液是植物应对干旱少雨的恶劣环境的有效对策之一[4]。种皮粘液物质的存在对荒漠植物种子的扩散、定居、防御捕食、萌发及幼苗存活等具有重要的生态意义[2]。粘液物质可以使种子迅速吸水膨胀,并能通过粘沙(土)而使种子大粒化,有利于种子萌发和幼苗建成。但是,粘液层的存在一方面为种子萌发提供了良好的条件,另一方面降低了种子的流动性,限制了该类种子的远距离扩散,进而影响到该类植物种群新生境的拓殖。
种子传播是指种子从母株脱离后散布到其他生境位点的过程,是恢复生态学、植物生态学和保护生物学研究中最受关注的内容。动物在种子传播过程中起到重要作用,在热带和亚热带,80%~90%的植物依赖于动物传播以实现更新[5]。动物传播粘液种子的方式可分为两种:一种为体外传播,指粘液种子遇湿分泌粘液后粘附在鸟类羽毛、喙或动物皮毛上进行传播;另一种为动物消化道传播(endozoochore),是指种子被食草(果)动物所采食,经过消化道作用以后,通过反刍或粪便排出体外的现象[6]。尤其是后者,传播距离较远,并且覆盖种子的粪便能为种子提供天然保护层和萌发所需的各种营养成分,对植物种群更新和荒漠植被恢复具有重要意义。有研究报道,粘液种子的天然种衣结构在家畜消化道内可以起到保护种子不受深度伤害,并能使在特定时间段排出的种子仍然保持活力[7],因此,草食动物可以通过消化道传播而作为粘液种子的传播者,但目前此方面的报道较匮乏。本研究正是基于消化道传播的原理展开,把粘液种子与消化道传播进行结合研究,以车前科的条叶车前(Plantagolessingii)、菊科的伊犁绢蒿(Seriphidiumtransiliense)、十字花科的涩芥(Malcolmiaafricana)、播娘蒿(Descuminiasophia)、异果芥(Diptychocarpusstrictus)、群心菜(Cardariadraba)这6种粘液种子为研究材料,用尼龙袋法[8]进行瘘管羊瘤胃消化,明确不同粘液种子对瘤胃消化的反应,以丰富有关植物种子消化道传播的内容。
1 材料与方法
1.1 研究材料
实验所用到6种种子均为2015年6-7月采集于新疆石河子市南山牧场(E 84°58′-86°24′,N 43°26′-45°20′,海拔2252 m),分别是条叶车前、伊犁绢蒿、播娘蒿、涩芥、异果芥、群心菜;它们隶属于3个科,分别为车前科、十字花科、菊科。这6种种子遇水均能分泌粘液,为草地常见良等牧草,家畜采食率较高[9]。
1.2 种子瘤胃消化及回收
种子瘤胃消化采用瘤胃瘘管尼龙袋法[8]。选用3只体重为(52.0±2.97) kg左右的安装了永久性瘤胃瘘管的哈萨克羊,代谢笼内单笼饲养。投放种子前预饲1周,每只羊每天饲喂精料200 g,苜蓿(Medicagosativa)干草1.8 kg,自由饮水。实验开始后将种子放入尼龙袋内(尺寸6 cm×9 cm,孔径40~50 μm),每种种子每个处理1000粒,用尼龙线扎口后绑在铁链上。将尼龙袋在晨饲前(9:00)由瘤胃瘘管投入到瘤胃中,铁链末端用尼龙线连接一铁夹子,固定在瘤胃瘘管外部背毛上,以防止链条脱落入瘤胃内[10]。共设置0、4、8、12、16、20、24、36和48 h这9个处理时间。试验期间正常饲喂。到相应处理时间后分别从3只羊瘤胃内各取出1个尼龙袋(代表3个重复)。种子取出后用自来水冲洗干净,放在实验室内自然干燥后于4 ℃冰箱中保存备用。
1.3 种子形态特征的测定
分别用1/10000电子天平和体视显微镜测量种子的千粒重和长、宽,用游标卡尺测量种子高度,并观察有无附属结构。
1.4 种子粘液量观测
挑选各时间段处理的每种种子10粒浸入蒸馏水中,待种子吸水饱和后(约2 h[10-11]),于体视显微镜下观察粘液消失状况。再挑选各时间段处理的每种种子100粒,用1/10000电子天平称其重量。之后将种子放入培养皿中,向培养皿中加水至淹没种子,待种子吸水饱和后,将种子取出,用擦镜纸将种子表面残留的粘液物质擦拭干净,然后将其放入25 ℃烘箱中干燥至恒重,再用1/10000电子天平称其重量。根据公式(1)计算粘液占种子重量的百分率:
粘液百分率(%)=[(去粘液前重量-去粘液后重量)/去粘液前重量]×100
(1)
1.5 种子吸水量测定
挑选各处理时间的每种种子100粒,用1/10000电子天平称其重量(M1)后,装入塑料圆柱筒(直径2 cm,高3 cm)内,圆柱筒一端蒙上一层尼龙布(孔径40~50 μm),用1/10000电子天平称其重量(M2),将圆柱筒插入蒸馏水中,待种子吸水饱和后,取出圆柱筒,用滤纸将柱筒周围多余的水擦去,放在1/10000电子天平上称其重量(M3)[12]。根据公式(2)计算吸水率:
吸水率(%)=[(M3-M2)/M1]×100
(2)
1.6 种子粘沙量测定
挑选各处理时间的每种种子100粒,在1/10000电子天平上称其重量。在高5.9 cm、直径6.6 cm的圆筒形金属罐中放置粒径小于0.25 mm的风干沙,沙层厚度4.5 cm,将称重后的种子均匀摆放在沙层表面,每种种子3罐(3个重复),再铺上一层厚度为5 mm的沙层。之后用喷壶往罐中浇水,至水淹没沙层表面,使沙层全部浸透。完成上述操作后,将金属罐置于室内自然干燥。待完全干燥后,用0.25 mm粒径土壤筛轻轻筛出(或挑出)种子,观察粘沙情况,并用1/10000电子天平称量重量[13]。根据公式(3)计算粘沙率:
粘沙率(%)=[(粘沙后重量-粘沙前重量)/粘沙前重量]×100
(3)
1.7 萌发率的测定
挑选各处理时间的每种种子100粒,用纸上法(top paper, TP)[14]进行萌发,重复3次。根据采集地植被生长气候条件设置15 ℃/25 ℃变温和8 h光照/16 h黑暗[10],胚根出现1~2 mm即可认为已经萌发,每24 h进行萌发检测,统计萌发个数并将已萌发种子移除,到连续40 d后不再有种子萌发为止。根据公式(4)计算萌发率:
萌发率(%)=(发芽种子数/种子总数)×100
(4)
1.8 数据处理
采用Excel 2007输入整理数据,采用SPSS 13.0和Origin 8.0软件进行单因素方差分析和作图。
2 结果与分析
2.1 不同消化时间下的种子形态学特征
通过对消化前后种子形态特征进行观察和测量,发现只有异果芥种子具有种翅这一附属结构,且不同处理时间种子的长、宽、高和千粒重不同。处理前长度最大的是条叶车前(3.73 mm),最小的是涩芥(1.12 mm),二者相差约3倍;宽度最大的是异果芥(2.18 mm),最小的是播娘蒿(0.40 mm),二者相差约5倍;高(厚)度最大的是群心菜(0.94 mm),最小的是涩芥(0.37 mm),二者相差约3倍;千粒重最大的是条叶车前(2.06 g),最小者是播娘蒿(0.18 g),二者相差约11倍。不同处理时间6种种子的长度和高(厚)度之间均差异不显著(P>0.05),由于异果芥具有种翅附属结构,故除异果芥外,其他5种种子宽度之间差异均不显著(P>0.05)。随着消化时间增加,粘液物质逐渐被消化,故种子千粒重逐渐减小,处理48 h的千粒重和处理前相比均差异显著(P<0.05)(表1)。
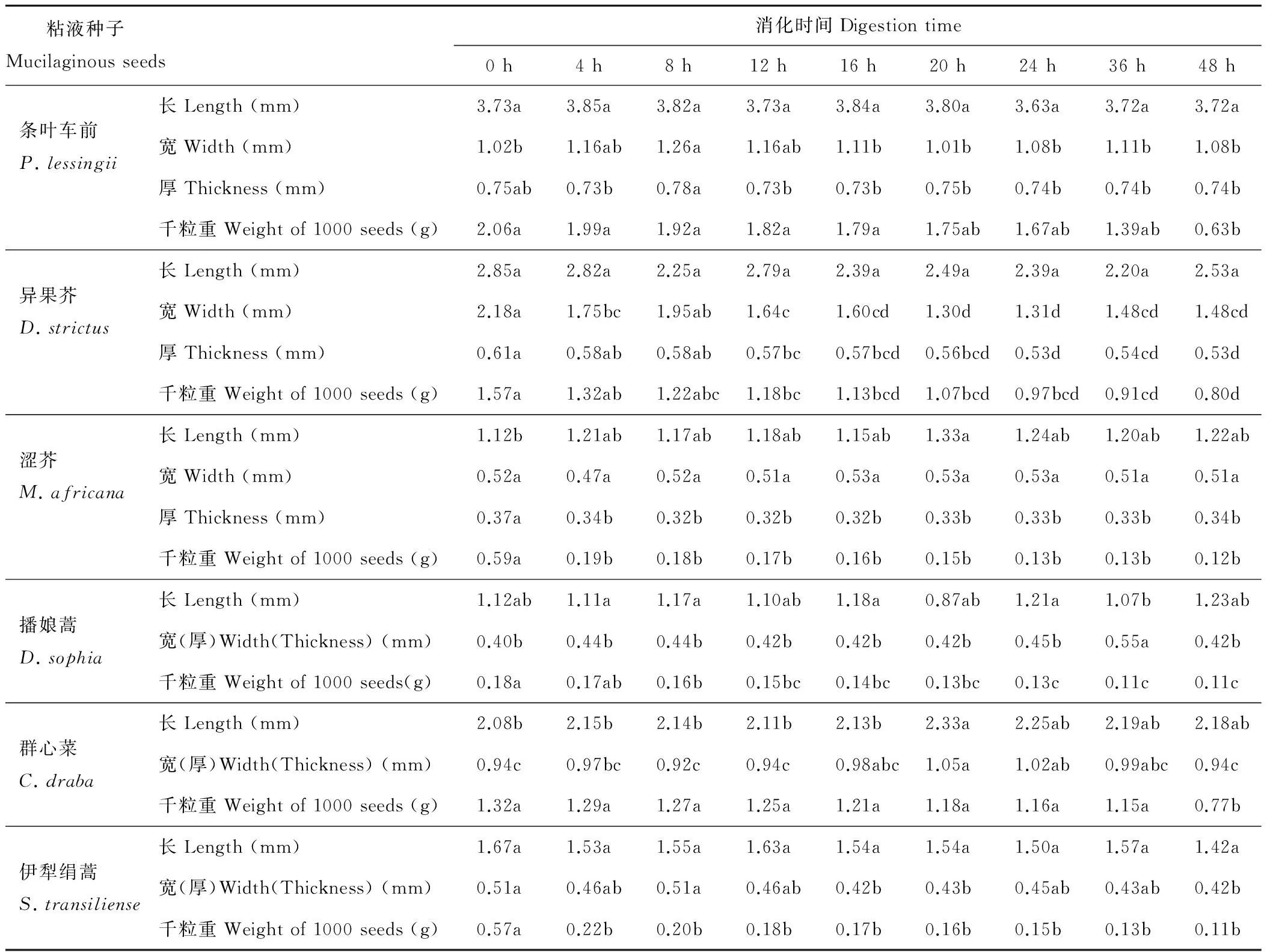
表1 不同处理时间种子形态学特征Table 1 Morphological characteristics of six kinds of mucilaginous seeds as influenced by digestion time
注:同行不同小写字母表示不同处理之间差异显著(P<0.05),下同。
Note: Different lowercase letters within the same row indicate significant differences between digestion time treatments at the 0.05 level. The same below.
2.2 不同消化时间下种子粘液层变化特征
经过不同消化时间处理后粘液种子的粘液层明显发生变化,首先是随着消化时间的增加,种子表层粘液物质逐渐消失,即这6种粘液种子的粘液都能被绵羊瘤胃液消化;伊犁绢蒿、群心菜、播娘蒿、涩芥在消化8 h后表层粘液已被消化殆尽,条叶车前粘液层较厚,消化时间持续到12 h时表层粘液才被彻底消化,异果芥种子表面的粘液物质构成种翅这一附属结构,当消化时间持续到48 h后种翅才被彻底消化;其次是种子表面颜色也发生明显变化,播娘蒿、条叶车前、涩芥种子表面由处理前的亮黄色逐渐变成黑褐色;群心菜种皮由处理前的亮红色逐渐变成暗黑色,异果芥种翅消失的同时种皮颜色也逐渐变成暗黄色(图1)。进一步对各处理时间的每种粘液种子的粘液量进行测量并对测量结果进行拟合,发现粘液量随消化时间的变化符合形如y=-1.98+48.26e-x/8.40(R2=0.95441,P=0<0.01)的指数函数关系(图2)。

图1 不同处理时间粘液种子形态特征Fig.1 Morphological characteristics of mucilaginous seeds as affected by digestion time A: 涩芥 M. africana; B: 播娘蒿 D. sophia; C: 伊犁绢蒿 S. transiliense; D: 异果芥 D. strictus; E: 条叶车前 P. lessingii; F: 群心菜 C. draba.
2.3 不同处理时间粘液种子吸水率和粘沙率
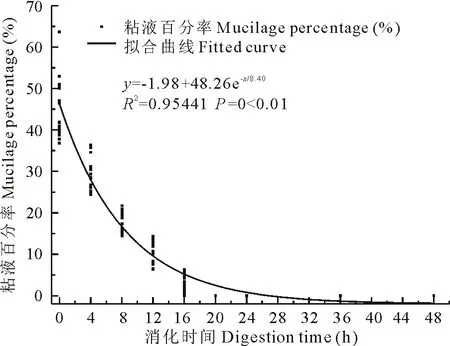
图2 不同处理时间粘液种子粘液百分率Fig.2 Mucilage percentage as affected by digestion time
粘液物质的吸水和粘沙是粘液种子的两个重要特征,粘液物质在种子吸水膨胀过程能吸收大量水分,即粘液种子对水分的吸收主要集中于种皮表面的粘液层,因此吸水率也逐渐降低;粘沙是粘液种子特有的性质,随消化时间增加粘液种子的粘液量逐渐减少,粘沙能力逐渐减弱直至丧失。对各处理时间的粘液种子进行吸水率和粘沙率的测定并对测定结果进行拟合,发现二者随消化时间的变化分别符合形如y=90.04+428.03e-x/4.43(R2=0.75934,P=0<0.01)(图3A)和y=-0.71+342.76e-x/5.05(R2=0.81124,P=0<0.01)(图3B)的指数函数关系。
2.4 萌发率的测定
种子经过消化道消化后能够萌发是实现消化道传播的前提,随着消化时间增加,6种粘液种子的萌发率均逐渐降低。异果芥处理8 h后萌发率降为0;播娘蒿和伊犁绢蒿处理12 h后萌发率降为0;条叶车前处理16 h后萌发率降为0;涩芥处理20 h后萌发率降为0;群心菜在处理48 h后萌发率仍能达到16.67%。将这6种种子按萌发率高低分为3组:高萌型(80%~100%)、中间型(30%~80%)、低萌型(0~30%),则条叶车前、群心菜、伊犁绢蒿属于高萌型,涩芥属于中间型,异果芥和播娘蒿属于低萌型。单因素方差分析结果显示,异果芥、涩芥、播娘蒿和伊犁绢蒿处理4 h萌发率即出现差异(P<0.05),条叶车前处理8 h萌发率出现差异(P<0.05),群心菜处理48 h萌发率才出现差异(P<0.05)(表2)。

图3 不同处理时间粘液种子吸水率(A)和粘沙率(B)Fig.3 Water absorption rate (A) and sand adherence rate (B) as affected by digestion time

表2 不同处理时间粘液种子的萌发率Table 2 Germination rates of six types of mucilaginous seeds as affected by digestion time %
3 讨论
3.1 瘤胃消化对粘液种子形态特征的影响
种子形态特征是种子与其生长环境长期相互作用的结果,不同植物种子的形态特征不仅会影响种子的萌发特性,同时对种子的散布方式也有一定的影响[10]。通过对6种粘液种子经过绵羊瘤胃消化前后的形态特征的观察发现,除异果芥外,其他5种种子长、宽、高(厚)差异均不显著(P>0.05),这是因为5种种子都不具备附属结构,而粘液膜通常生长在次生细胞壁中,几乎没有由次生细胞壁通过形态变化而形成的粘液膜,种子表皮细胞中的粘液从裂缝中挤出,粘液仅限在亚表皮产生,表皮由于粘性细胞的膨胀而破裂[15],表层粘液在干燥时仅为一层膜状胶质。异果芥种子的表层粘液物质构成其种翅,一方面这种结构有利于种子在空中飞行实现远距离传播,还可增加种子与地面的摩擦,从而更有利于种子的散布与萌发[10];另一方面,粘液种子种皮粘液的化学成分主要是果胶类多糖物质,如半乳糖醛酸和纤维素等[2],反刍家畜瘤胃环境具有消化这类物质能力[7],因此其消化前后种子宽度差异显著(P<0.05),长和高差异不显著(P>0.05)。
3.2 粘液种子粘液物质的功能
本研究通过对6种种子消化前后粘液量的测定,结果表明粘液量随消化时间的增加而减少,再次说明种子粘液逐渐被家畜瘤胃环境所消化[7]。但是粘液物质的存在对种子至关重要。首先,它可以调控种子吸水过程,而吸水是种子萌发的前提。通过对6种种子消化前后的吸水率进行测定,结果表明种子吸水率随消化时间增加而减少,这是因为随消化时间延长种子表面的粘液物质逐渐减少,而对于粘液种子而言,种子表面粘液物质的吸水能力远高于种子自身,其吸收的水分在种子的吸水过程中占主导地位[11,16],因此粘液量减少的同时种子吸水率也逐渐减少。然而吸水率的减少必然影响种子的萌发。伍晨曦等[11]通过对小车前(Plantagominuta)萌发策略的研究发现粘液物质的存在能保证种子表面有足够的有效水分,减缓种子在干旱胁迫下萌发的不良影响,保障种子正常吸水。同时其保水能力还可使种子在干旱少雨的荒漠环境中有效利用有限的降雨,不至于快速死亡,保持生命力和活力。当外部环境干旱胁迫程度加剧时,粘液物质强吸水作用与种子本身争夺水分,使种子内部水分含量减少,减缓种子萌发速率,避免种子在恶劣环境中大批萌发而导致种群灭绝。对抱茎独行菜(Lepidiumperfoliatum)[17]种子粘液物质的研究也得出类似结论。
其次,粘液种子的粘液具有粘沙功能,而粘沙是粘液种子特有的属性。本研究通过对6种种子消化前后粘沙率的测定,结果表明粘沙率随消化时间的增加而减少,这是因为随消化时间的增加种子粘液量减少,粘液量越少种子粘沙率也越低[3]。而粘沙率的降低必然会影响种子萌发和传播。据已有研究报道,具粘液种子的植物大多数分布在干旱荒漠区[1,18-21]。当粘液种子遇湿粘沙后,粘附于种子上的沙粒不仅增加种子重量,还加大该单元的体积和表面积。体积的增加限制了种子在土壤中的深埋,种子通过这种途径将种子保留在土壤表面以保证种子萌发所需的光照条件[14]。粘沙还能促进种子大粒化,防止风将其移位并进一步传播;风洞实验表明白沙蒿(Artemisiasphaerocephala)粘液种子的启动风速由粘沙前的5.14 m/s提高到粘沙后的7.17 m/s,抗风能力明显提高[18],且粘附的沙粒形成一层保护层,避免种子受到风蚀或蚂蚁等昆虫采食[15]。
3.3 粘液种子的消化道传播
种子经过消化道作用后能够萌发是实现消化道传播的前提。通过对6种粘液种子消化前后的萌发率测定,结果表明6种种子的萌发率随消化时间的延长,粘液量降低的同时萌发率都逐渐降低,即同具粘液种子相比,去粘液种子萌发率降低[11,16],这可能是因为天然种衣结构在家畜消化道内起到了保护种子不受深度伤害并能使其在特定时间段内排出的种子仍然保持活力[7]。但群心菜萌发率降低速度最慢,即抵抗瘤胃消化能力最强,究其原因,首先是因为其种子形状接近圆形,而种子形状在很大程度上影响到其在消化道内滞留时间的长短,因为尽管摄入初期的咀嚼过程会对种子产生一定的破坏作用,但是,同后期在消化道内严酷的环境相比较,这种破坏便显得微不足道[28]。动物消化道传播种子效果实际上是由种子形状是否有利于其快速通过消化道而决定的[22-27]。主流观点认为,圆形种子通过消化道的速度要快并且回收后的萌发率高[29]。其次,群心菜种皮较厚,具有类似于豆科植物种子的硬实现象,草食动物的消化过程能通过软化种皮或者打破休眠从而增加硬实种子的萌发率[24,30-31]。相比之下,同为十字花科的播娘蒿、涩芥和异果芥三者的萌发率随消化时间的增加显著降低(P<0.05),首先是因为播娘蒿和涩芥的种子形状为椭圆形,通过消化道的时间较长,其次是二者的种皮较薄,同具有高强度种皮保护的种子比较,柔软种皮不能为种子提供有效的保护[23]。异果芥虽具有种翅,但经瘤胃消化后其萌发率降低最快,8 h即降为0,原因可能是种翅结构在其种子传播过程中起作用[10],而在抵抗瘤胃消化方面作用不明显。
本研究发现,条叶车前种子结构特殊,种子背腹压扁,背部隆起,腹面凹陷,边缘内卷,似舟状。干燥的条叶车前种子表面有光泽,并具可见的胚。当种子遇水后,其表面的粘液物质迅速吸水膨胀包裹在整粒种子周围[11]。当条叶车前种子表面粘液物质被消化完(12 h),瘤胃液直接与其种胚接触而将其消化,故萌发率在粘液物质消失后降为0。伊犁绢蒿隶属于菊科,本研究其粘液种子在瘤胃处理12 h后萌发率降为0,这与其种子形状近似椭圆形和种皮厚度较薄有关[23,29]。
植物种子传播有效性是评估草食动物通过消化道传播对植物种群更新贡献的关键指标,它包括传播数量和质量两方面[34]。种子在动物体内的平均滞留时间(mean retention time, MRT)是影响传播有效性的重要指标[35]。将绢蒿种子直接投喂给绵羊,结果发现摄食6 h后便有大量种子排出,至10 h达到高峰,此时粪便中可萌发种子数量最多,每100 g粪便可萌发种子数量达到60粒,至14 h数量开始下降,到36 h每100 g粪便中只有1~2粒可萌发种子,48 h后再无可萌发种子排出[7]。本实验通过对6种粘液种子的绵羊消化道处理研究发现,可萌发种子集中在0~12 h这段时间内,即虽然经消化道作用后种子萌发率显著降低(P<0.05),但仍有部分种子成功“逃逸”。此外,因为母株的J-C效应,即由于母株的郁闭和母株附近存在大量的植物病原菌,使得母株附近种子和幼苗的死亡率特别高[36-37],粘液种子借助草食动物的消化道传播能很好地逃避这一弊端。再者,草食动物倾向于将种子定向排放在空旷地[38],并且覆盖种子的粪便能为种子提供天然保护层和萌发所需的各种营养成分。由于消化道传播存在以上优势,且对粘液植物种群更新和植被恢复具有重要意义,这为草食动物对粘液种子进行消化道传播提供了可能。
4 结论
将粘液繁殖体(myxospermy)与消化道传播(endozoochore)结合研究是本实验最大的特色。以条叶车前、异果芥、涩芥、播娘蒿、群心菜、伊犁绢蒿这6种粘液种子为研究材料,采用瘘管羊瘤胃消化处理,并对处理前后种子的形状特征、吸水率、粘沙率、粘液含量、萌发率等指标进行测定,主要结论如下:
1)这6种粘液种子表层粘液物质都能被绵羊瘤胃液消化,且随消化时间延长,种皮颜色变深,纹理模糊,种翅等附属结构消失。
2)这6种粘液种子表层粘液物质含量随瘤胃消化时间的变化符合形如y=-1.98+48.26e-x/8.40(R2=0.95441,P=0<0.01)的指数函数关系,种子吸水率和粘沙率消化时间之间分别符合形如y=90.04+428.03e-x/4.43(R2=0.75934,P=0<0.01)和y=-0.71+342.76e-x/5.05(R2=0.81124,P=0<0.01)的指数函数关系。
3)瘤胃处理后可萌发种子多集中在0~12 h处理时间段内,即使是相同科的植物在抵抗瘤胃消化方面能力也不相同,但这6种粘液种子均可通过草食动物消化道进行传播。
References:
[1] Ma J L, Liu Z M. Myxospermy and its ecological function. Chinese Journal of Ecology, 2006, 25(11): 1400-1404. 马君玲, 刘志民. 粘液繁殖体及其生态功能. 生态学杂志, 2006, 25(11): 1400-1404.
[2] Liu X F, Tan D Y. Ecological significance of seed mucilage in desert plants. Chinese Bulletin of Botany, 2007, 24(3): 414-424. 刘晓风, 谭敦炎. 荒漠植物种子粘液的生态学意义. 植物学报, 2007, 24(3): 414-424.
[3] Liu Z M, Yan Q L, Luo Y M,etal. Comparison of mucilage produced by achenes of 5Artemisiaspecies under different rainfall treatments. Acta Ecologica Sinica, 2005, 25(6): 1497-1501. 刘志民, 阎巧玲, 骆永明, 等. 不同降水量处理时5种蒿属植物瘦果粘液溶出. 生态学报, 2005, 25(6): 1497-1501.
[4] Huang Z Y, Gutterman Y. Water absorption by mucilaginous achenes of artemisia monosperma: floating and germination as affected by salt concentrations. Israel Journal of Plant Sciences, 1999, 47(1): 27-34.
[5] Jordano P. Frugivores and seed dispersal: mechanisms and consequences for biodiversity of a key ecological interaction. Biology Letters, 2011, 7(3): 321-323.
[6] Oudtshoorn K V R V, Rooyen M W V. Dispersal Biology of Desert Plants[M]//Dispersal Biology of Desert Plants. Berlin Heidelberg: Springer, 1998.
[7] Lu W H, Wan J J, Yang J J. Morphological and physiological characteristics ofSeriphidiumtransilienseseed and response of endozoochorous by sheep. Highlights of Science Paper Online, 2015, (8): 500-509. 鲁为华, 万娟娟, 杨洁晶. 伊犁绢蒿种子形态/生理学特征及其对绵羊消化道传播的响应. 中国科技论文在线精品论文, 2015, (8): 500-509.
[8] Han J G. Grassland Science[M]. Beijing: China Agriculture Press, 2007. 韩建国. 草地学[M]. 北京: 中国农业出版社, 2007.
[9] Yu L, Lu W H, Yan P,etal. Resources and assessment of natural grassland in Shaertao mountain, Zhaosu county in Xinjiang. Chinese Journal of Grassland, 2014, 36(6): 4-11. 于磊, 鲁为华, 阎平, 等. 新疆昭苏县境沙尔套山天然草地牧草资源与评价. 中国草地学报, 2014, 36(6): 4-11.
[10] Yang J J, Wan J J, Nalikesi,etal. Seed morphology and effect of sheep rumen digestion on germinability of 28 grass of Tianshan. Acta Prataculturae Sinica, 2015, 24(2): 104-115. 杨洁晶, 万娟娟, 娜丽克斯, 等. 28种植物种子形态学性状及其萌发对绵羊瘤胃消化的反应. 草业学报, 2015, 24(2): 104-115.
[11] Wu C X, Sun Y, Feng G. Water absorbance features of mucilage on the seeds of a desert ephemeral plant,PlantagominutaPall, and its role in germination of the seeds under drought stress. Acta Ecologica Sinica, 2009, 29(4): 1849-1858. 伍晨曦, 孙羽, 冯固. 小车前(PlantagominutaPall)种子表面粘液物质的吸水特性及其对种子在干旱环境中萌发的影响. 生态学报, 2009, 29(4): 1849-1858.
[12] Deng W, Jeng D S, Toorop P E,etal. A mathematical model of mucilage expansion in myxospermous seeds ofCapsellabursa-pastoris(shepherd’s purse). Annals of Botany, 2012, 109(2): 419-427.
[13] Liu Z M, Yan Q L, Luo Y M,etal. A comparative study on mucilaginous diaspores of four plant species. Chinese Journal of Applied Ecology, 2004, 15(10): 1869-1872. 刘志民, 阎巧玲, 骆永明, 等. 四种植物粘液种子粘液的比较研究. 应用生态学报, 2004, 15(10): 1869-1872.
[14] State Bureau of Technical Supervision. GB/T 3543. 4-1995, Rules for the Inspection of the National Standard of the People’s Republic of China Crop Seed Germination Test[S]. Beijing: China Standards Press, 1995. 国家技术监督局. GB/T 3543. 4-1995, 中华人民共和国国家标准农作物种子检验规程发芽试验[S]. 北京: 中国标准出版社, 1995.
[15] Van R V O K, Van R M W. Dispersal Biology of Desert Plants[M]. Berlin Heidelberg: Springer, 1999.
[16] Abduwayit A, Tursunay Y, Halida Z,etal. Studies on relationship between the natural seed coat and moisture ofSeriphidiumtransiliense. Arid Zone Research, 2000, 17(4): 53-56. 阿衣古力·阿不都瓦依提, 吐尔逊娜依, 哈丽旦, 等. 伊犁绢蒿种子天然种衣与水分关系初步研究. 干旱区研究, 2000, 17(4): 53-56.
[17] Sun Y. Eco-Adaptability of Mucilaginous Seeds Germination in EphemeralAlyssumminus[D]. Urumchi: Xinjiang Agricultural University, 2012. 孙颖. 短命植物新疆庭荠粘液种子的萌发生态适应性[D]. 乌鲁木齐: 新疆农业大学, 2012.
[18] Huang Z Y, Gutterman Y, Hu Z H,etal. Seed germ inArtemisiasphaerocephalaI. the structure and function of the mucilaginous achene. Acta Phytoecologica Sinica, 2001, 25(1): 22-28. 黄振英, Gutterman Y, 胡正海, 等. 白沙蒿种子萌发特性的研究 I. 粘液瘦果的结构和功能. 植物生态学报, 2001, 25(1): 22-28.
[19] Witztum A, Evenari M. Integumentary mucilage as an oxygen barrier during germination ofBlepharispersica(Burm.) Kuntze. Botanical Gazette, 1969, 130(4): 238-241.
[20] Osborne D J. A. Fahn plant anatomy 4th Edn. 1990 pergamon press chichester 588 hardback £57. 50, US $99. 00; paperback £24. 95, US £49. 95. Endeavour, 1991, 15(2): 98.
[21] Liu Z M, Yan Q L, Luo Y M,etal. Screening on myxospermy of 124 species occurring on the sandy habitats of western Horqin Steppe. Journal of Desert Research, 2005, 25(5): 716-721. 刘志民, 闫巧玲, 骆永明, 等. 科尔沁沙地124种天然植物粘液种子的甄别. 中国沙漠, 2005, 25(5): 716-721.
[22] Janzen D H. Dispersal of small seed by big herbivores: foliage is the fruit. American Naturalist, 1984, 123(3): 338-353.
[23] Lu W H, Wan J J, Yang J J,etal. Review of endozoochory of plant seeds by herbivores. Acta Prataculturae Sinica, 2013, 22(3): 306-313. 鲁为华, 万娟娟, 杨洁晶, 等. 草食动物对植物种子的消化道传播研究进展. 草业学报, 2013, 22(3): 306-313.
[24] Blackshaw R E, Rode L M. Effect of ensiling and rumen digestion by cattle on weed seed viability. Weed Science, 1991, 39(1): 104-108.
[25] Gardener C J, Mcivor J G, Jansen A. Survival of seeds of tropical grassland species subjected to bovine digestion. Journal of Applied Ecology, 1993, 30(1): 75-85.
[26] Doucette K M, Mccaughey W P. Seed recovery and germination of reseeded species fed to cattle. Journal of Range Management, 2001, 54(5): 575-581.
[27] Cosyns E, Delporte A, Lens L,etal. Germination success of temperate grassland species after passage through ungulate and rabbit guts. Journal of Ecology, 2005, 93(2): 353-361.
[28] Claudia M. Endozoochory by native and exotic herbivores in dry areas: consequences for germination and survival ofProsopisseeds. Seed Science Research, 2008, 18(2): 91-100.
[29] Whitacre M K, Call C A. Recovery and germinability of native seed fed to cattle. Western North American Naturalist, 2006, 66(1): 121-128.
[30] Wang Y, Hou Y, Li X Y,etal. A study on the relationship between the pod, seed development and the occurrence of seed hardiness ofMelissttusruthenicus. Acta Prataculturae Sinica, 2012, 21(3): 303-307. 王颖, 侯宇, 李晓宇, 等. 扁蓿豆荚果和种子发育及硬实发生的关系. 草业学报, 2012, 21(3): 303-307.
[31] Isselin-Nondedeu F, Bédécarrats A. Soil microtopographies shaped by plants and cattle facilitate seed bank formation on alpine ski trails. Ecological Engineering, 2007, 30(30): 278-285.
[32] Huang Z Y, Gutterman Y. Germination ofArtemisiasphaerocephala(Asteraceae), occurring in the sandy desert areas of Northwest China. South African Journal of Botany, 1999, 65(3): 187-196.
[33] Song M F, Liu H L, Zhang D Y,etal. Screening and comparison on myxospermy of 120 species occurring on the Junggar Desert. Journal of Desert Research, 2009, 29(6): 1134-1140. 宋明方, 刘会良, 张道远, 等. 准噶尔荒漠120种植物粘液种子的甄别与比较. 中国沙漠, 2009, 29(6): 1134-1140.
[34] Li N, Zhong M, Leng X,etal. Seed dispersal effectiveness of plant by frugivores: A review. Chinese Journal of Ecology, 2015, (7): 2041-2047. 李宁, 钟明, 冷欣, 等. 食果动物传播植物种子的有效性. 生态学杂志, 2015, (7): 2041-2047.
[35] Warner A C I. Rate of passage of digesta through the gut of mammals and birds. Nutrition Abstract and Review, 1981, 51: 789-820.
[36] Janzen D H. Herbivores and the number of tree species in tropical forests. American Naturalist, 1970, 104: 501-528.
[37] Connell J H. On the role of natural enemies in preventing competitive exclusion in some marine animals and in forest trees. Center Publishing & Documentation Wageningen, 1970, 298: 298-312.
[38] Martínez I, García D, Obeso J R. Differential seed dispersal patterns generated by a common assemblage of vertebrate frugivores in three fleshy-fruited trees. Ecoscience, 2008, 15(2): 189-199.
Morphological characteristics of six kinds of mucilaginous seeds and their response to digestion in the rumen of sheep
WANG Shu-Lin1, Narkes Wali1, LU Wei-Hua1*, WANG Wei-Qiang2, WANG Chuan-Jian2
1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China; 2.CollegeofInformationScienceandTechnology,ShiheziUniversity,Shihezi832003,China
An experiment has been undertaken to compare the morphological characteristics of mucilaginous seeds from six plant species (Plantagolessingii,Seriphidiumtransiliense,Malcolmiaafricana,Descuminiasophia,DiptychocarpusstrictusandCardariadraba) and to study their digestion in the rumen of sheep. After determining their morphological characteristics, seeds were put into nylon bags which were then placed in the rumen of sheep through a fistula. The bags were removed at different times and then the mucilage percentage, water absorption rate and sand adherence rate of the seeds were determined. The results were compared with seeds that had not been digested. The results showed that mucilage on the seed surface of all six species was digested by the rumen fluid of sheep. The seeds became dark after digestion. The seed wings ofD.strictusconsisted primarily of mucilage. As a result, the width ofD.strictusseeds changed significantly as digestion time increased (P<0.05). In contrast, the length and thickness ofD.strictusseeds were not significantly affected by digestion time (P>0.05). Digestion time had no significant effects on the length, width and thickness of seeds of the other five plant species (P>0.05). The mucilage percentage, water absorption rate and sand adherence rate decreased as digestion time increased. The relationship between mucilage percentage and digestion time is expressed as the equationy=-1.98+48.26e-x/8.40, wherexis time in hours (R2=0.95441,P=0<0.01). The relationship between water absorption rate and digestion time is expressed by the equationy=90.04+428.03e-x/4.43 (R2=0.75934,P=0<0.01). The relationship between sand adherence rate and digestion time is expressed as the equationy=-0.71+342.76e-x/5.05 (R2=0.81124,P=0<0.01). Seed germination rates decreased significantly after digestion (P<0.05), with the largest decreases occurring when digestion time was >12 h. Although seed germinability decreased after passage through the rumen, the survival of some seeds indicates that grazing sheep are a possible pathway for seed dispersal.
mucilaginous seeds; rumen digestion; morphological characteristics; water absorption; sand-holding capacity; germination; endozoochore
10.11686/cyxb2016185
http://cyxb.lzu.edu.cn
2016-05-03;改回日期:2016-06-07
国家自然科学基金(31360568;31560659)资助。
王树林(1992-),男,河南信阳人,在读硕士。E-mail: 2294997914@qq.com*通信作者Corresponding author. E-mail: winnerlwh@sina.com
王树林, 娜丽克斯·外里, 鲁为华, 王伟强, 汪传建. 六种粘液种子性状多样性及其对绵羊瘤胃消化的反应. 草业学报, 2017, 26(4): 89-98.
WANG Shu-Lin, Narkes Wali, LU Wei-Hua, WANG Wei-Qiang, WANG Chuan-Jian. Morphological characteristics of six kinds of mucilaginous seeds and their response to digestion in the rumen of sheep. Acta Prataculturae Sinica, 2017, 26(4): 89-98.
