特丁噻草隆光催化降解动力学的研究
2017-04-14周文常
周文常,阳 海
(湖南工程学院 化学化工学院, 湘潭 411104)
特丁噻草隆光催化降解动力学的研究
周文常,阳 海
(湖南工程学院 化学化工学院, 湘潭 411104)
以特丁噻草隆为目标,探讨了光催化技术降解的可行性、降解动力学优化及初步降解途径.通过单因素实验,探讨了催化剂用量、pH值、温度和底物浓度等因素对其光催化降解动力学的影响,通过中心复合实验,建立光催化降解模型,并对模型进行准确性验证.结果表明:特丁噻草隆符合Langmuir-Hinshelwood动力模型,其光催化降解一级动力学速率常数为0.03506 min-1,并在碱性条件下降解速率较快,其降解速率常数为0.03899 min-1;同时降解速率随着底物浓度的增加而减少.最后,特丁噻草隆降解的最佳条件为:TiO2浓度2.7 g/L,温度45 ℃,底物浓度30 μmol/L,溶液初始pH=6.7.
特丁噻草隆;光催化降解;动力学
特丁噻草隆是一类新型的杂环取代脲类除草剂,因其药效高、毒性小等优点而被广泛应用于农业、牧业除草.但它也因抑制微生物活性及可致癌性而受到了广泛的关注[1]. 并且很难直接用传统的生化法处理.使它在土壤及水体中的污染成为环境污染治理中最大难题之一[2].
本文以灭生性的特丁噻草隆为研究对象,用光催化技术探讨其降解的可行性,降解动力学优化和降解初步途径,旨在寻求光催化降解基本规律和建立光催化降解模型,为以后光催化处理农药废水及环境水体中的残留农药提供充分的理论依据和实验数据,这对环境保护和生态环境具有深远的意义.
1 实验部分
1.1 实验仪器与试剂
光化学反应仪配制BILON反应器,光源专用控制器和循环水泵(上海比朗仪器有限公司),Cometro 6000高效液相色谱配有6000 PVW UV/Vis检测器(美国Cometro公司),氙灯(上海亚明灯泡有限公司,300 W,Emax=360 nm),PHS-3C型精密酸度计(上海雷磁仪器厂),0.22 μm有机相针式滤器(上海安谱科学仪器有限公司).
特丁噻草隆(湖南化工研究院提供),光催化剂TiO2(Degussa P25),甲醇和为HPLC色谱纯(天津市科密欧化学试剂有限公司),纯净水(华润怡宝食品饮料有限公司),NaOH、HCl为分析纯.
1.2 光催化实验
先用纯净水配制100 μmol/L特丁噻草隆溶液,取该溶液100 mL置于光催化反应器中,加入一定量的TiO2粉末,调整光源与反应容器的距离为15.5 cm.避光搅拌20 min,使其均匀分散在溶液中后进行光催化降解实验,并每隔一定时间取一定量反应液过滤,用高效液相色谱进行分析.
1.3 分析测试
特丁噻草隆定量分析采用CoMetro 6000高效液相色谱,柱温为23 ℃,色谱柱为Diamonsil C18,反相柱(5 μm),150 mm×4.6 mm,流动相为甲醇:水=75%:25%(V/V),紫外检测器波长为256 nm,流速1.0 mL.min-1,进样量20 μL[3].
此条件下测得特丁噻草隆的保留时间为2.82 min,光催化降解残留量按保留时间采用峰高测定.溶液初始pH值用NaOH和HCl调配,用精密酸度计测定.
1.4 实验设计
论文采用中心复合实验设计,用Design-experiment Version 8.0软件对实验数据进行分析.
论文中采用降解率考量特丁噻草隆光催化降解效果.
降解率=(降解前特丁噻草隆的量-降解后特丁噻草隆的量)/ 降解前特丁噻草隆的量
2 结果与讨论
2.1 特丁噻草隆的光解与光催化降解的对比
根据S.Parra的研究报道[4]表明:暗吸附在很大程度上对除草剂农药的高效光降解作用没有影响,因而可以忽略.从图1中可看出,在没有催化剂的作用下,经过60 min反应,光解的效率只有17.87%,而在有催化剂的情况下有89.39%的特丁噻草隆被光催化降解.

图1 特丁噻草隆的光解曲线
2.2 特丁噻草隆的光催化降解动力学分析
研究表明,光催化反应过程可用L-H动力学模型来表征.对多相光催化反应而言,TiO2悬浮体系中DegussaP25光催化剂颗粒粒径非常小,此时的扩散速度比表面化学反应过程的速度快得多.光催化降解速率方程可表示为:
r=-dc/dt=kΚC/(1+KC)
(1)
式中:r为总反应速率,t是光催化降解时间,k是反应速率常数,C为底物浓度,K为Langmuir常数.论文中,特丁噻草隆浓反应浓度很低,可忽略KC.由(1)得到假一级动力学方程表达式为:
r=-dc/dt=kΚC=k1C
(2)
对(2)两边积分得:
ln(Ct/C0)=k1t+consant
(3)
根据(3),利用ln(C/C0)对反应时间作图,如图2所示.得到方程:y=-0.02724-0.03506x,R=0.99046.由以上结果可知,特丁噻草隆的光催化降解符合假一级动力学,其降解速率常数为0.03506 min-1.并由图2可知,特丁噻草隆在紫外光下难降解,经60 min后,其降解率仅17.87%.

图2 特丁噻草隆光催化降解动力学曲线
2.3 单因素实验
2.3.1 催化剂浓度对降解动力学的影响
从图3可知,特丁噻草隆的降解速率随催化剂浓度的增加而增加,当浓度为2.0 g/L时,降解率达到最大值为90.37%,反应速率常数为0.04266 min-1,此时继续增大浓度时而降解率反而降低.这是因为随着催化剂浓度的增加,光催化的活性位点也增加,降解加快.但当浓度增加到一定量时,溶液的透光性变差,部分催化剂被遮盖而接触不到紫外光,使部分催化剂未被完全激活[5],降解速率反而下降.所以,催化剂的最佳浓度为2.0 g/L.

图3 催化剂用量对光催化降解速率的影响
2.3.2 底物浓度对降解动力学的影响
从图4可知:当底物浓度由25 μM提高到300 μM时,降解速率由0.06702 min-1降至0.01681 min-1.
式(1)、(2)中,k1为假一级动力学常数(min-1),k是内反应速率(μM/min),而K则特丁噻草隆在光催化剂表面的Langmuir-Hinshelwood吸附常数(μM-1)[6,7].由1/k1对底物浓度C作图得图5.从图5中可看出1/k1与初始浓度C有很好的线性关系,通过直线的斜率和截距算出k为6.31 μM·min-1,K为0.012 μM·min-1.

图4 溶液初始浓度对降解速率的影响

图5 底物初始浓度与1/k1的关系
2.3.3 溶液初始pH值对降解动力学的影响
从图6可知:当pH值从3.0增加到5.0,降解速率从0.01345 min-1增加到0.03555 min-1,继续再增加到7.0时,降解速率下降到0.02896 min-1,而当pH值继续增加到9.0时,反应速率最大为0.03899 min-1,但pH值增加到11.0时,降解速率则降为0.03784 min-1.这可能是由于在酸性条件下,特丁噻草隆分子中的杂原子吸收质子而带正电荷,和同样带正电荷的光催化剂表面排斥,导致了相对较低的降解速率[8];另一方面,在强碱性条件下,较高浓度的OH-在阻碍UV光线达到光催化剂表面的同时还能产生可以活性氧物种淬灭剂CO32-,从而降低降解速率[5].
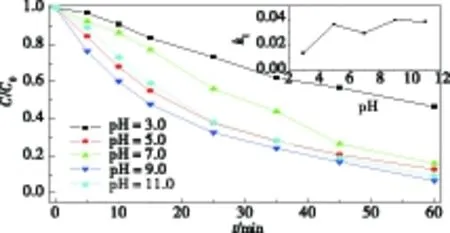
图6 溶液初始pH值对降解速率的影响
2.3.4 温度对特丁噻草隆解动力学的影响
由图7可知,当溶液温度由0 ℃升高到50 ℃时,其反应速率常数由0.02372 min-1增加到0.09227 min-1.这是随温度的升高,光催化剂活性位增加,从而使光催化反应效率增加.

图7 温度对特丁噻草隆光催化降解速率的影响
2.4 中心复合实验
以上探讨了催化剂用量、温度、溶液初始pH和底物浓度对光降解的影响,但并未考虑影响因子之间的相互作用对光催化降解的影响[9].近年来,中心复合实验已被广泛用于建立数学模型来优化反应条件[10-13].为了优化降解条件,通过此实验对光催化降解动力学进行了进一步的研究.
2.4.1 实验变量选取及取值范围
表1为底物浓度、催化剂浓度、溶液初始pH值和水体环境温度四个变量的取值范围和编码水平,时间60 min时特丁噻草隆光催化降解率(%)为响应值.

表1 各变量范围设计及编码水平
2.4.2 实验运行表及实验结果
按照中心复合实验设计方法:
N=2n+2n+C0
(6)
式中:N为实验设计的实验组数,n为设计实验的变量数,2n是轴点;C0是设计实验的中心点.本实验中选取5个中心点,4个变量数,由(6)易知,实验设计的数目为29组.表2为实验运行表及实验结果.

表2 实验运行表及实验结果
通过处理实验数据,得出光催化降解模型的数学表达式:
Y=0.32+0.0473x1+0.142x3+0.014x2-2.97×103x4+5.18×103x1x3+1.58×104x1x2-2.502×104x1x4-3.543×104x3x2+1.265×104x3x4+1.323×105x2x4-0.0129x12-0.0107x32-1.012×104x22+3.654×106x42
2.4.3 响应轮廓图
由图8可知:随着底物浓度的增加,降解率逐步降低.这再一次证实了底物浓度对光催化降解有显著影响.当催化剂浓度在2.7g/L左右时,降解率最大达到100%.当底物浓度小于90μM/L时,催化剂用量对其光催化降解影响显著,降解率可达到95%以上.
由图9可知:随溶液pH值的增加,光催化降解率逐步提高,当pH>8.5时,特丁噻草隆光催化降解率逐步降低,其中pH在6.75~8.50时,其光催化降解率达到88%以上.这是因为随着pH的增加,溶液中的羟基自由基增加,使更多的底物参与光催化反应,所以光催化降解率上升[14].
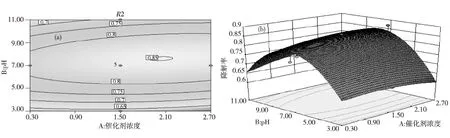
图9 (a) TiO2浓度与溶液初始pH相互作用的轮廓图;(b) TiO2浓度与溶液初始pH相互作用的响应曲面
3 结论
(1)特丁噻草隆的光催化降解可用L-H动力学模型来描述,其方程式为:y=-0.02724-0.03506x,R=0.99046,其降解速率常数为0.03506 min-1.
(2)特丁噻草隆在碱性条件下降解速率较快,其降解速率常数为0.03899 min-1;同时其降解速率随着底物浓度的增加而减少.
(3)特丁噻草隆光催化降解的最优条件为:TiO2浓度2.7 g/L、底物浓度30.0 μM、溶液初始pH=6.7、温度45 ℃.
[1] Mackay, D W, Shiu Y k Ma C. Illustrated Handbook of Phyrsico-Chemical Properties and Environmental Fate for Organic Chemicals[M]. New York: 1997.
[2] 邵科隆.杂环除草剂废水的O3/UV处理特性及其处理工艺的研究[D].大连理工大学硕士学位论文,2009.
[3] 韩海涛,刘 婕, 徐伟松,等. 特丁噻草隆高效液相色谱分析方法研究[J].农药科学与管理,2012,33 (11):36-38.
[4] Patta, S. J. Olivero,C.Pulgrarin.Relationships Between Physicochemical Properties and Phtotor-Eactivity of Four Biorecalcitrant Phyenylurea Herbicides in Aqueous TiO2Suspension[J].Appl Catal B,2002,(36):75-78.
[5] Tennakone K, Tilakaratne CTK, Kottegoda I R M. Photomineralization of Tebuthiuron by TiO2-supported Catalyst[J]. Water Res, 1997, 31:1909-1912.
[6] Mahalakshmi A, Arabindoo B, Palanichamy A, et al. Photocatalytic Degradation of Tebuthiuron Using Semiconductor Oxides[J]. J. Hazard. Mater,2007,143 (1-2):240-245.
[7] Tennakone K, Tilakaratne C T K, Kottegoda I R M. Photomineralization of Tebuthiuron by TiO2-supported Catalyst[J]. Water Res,1997, 31 (8):1909-1912.
[8] Katsumata H, Matsuba K, Kaneco S, et al. Degradation of Tebuthiuron in Aqueous Solution by Fe(III) Aquacomplexes as Effective Photocatalysts[J]. J. Photochem. Photobiol. A-Chem,2005,170(3):239-245.
[9] 阳 海,曾 健, 黎 源,等. 氙灯/TiO2体系下敌草隆光催化降解动力学的研究[J]. 环境科学, 2013,34(8): 207-212.
[10]安继斌. 水体中典型有机污染物的光催化降解动力学及降解机理研究[D].兰州理工大学硕士学位论文,2011.
[11]Ahmadi M, Vahabzadeh F, Bonakdarpour B, et al. Application of the Central Composite Design and Response Surface Methodology to the Advanced Treatment of Olive Oil Processing Wastewater Using Fenton’s[J]. J Hazard Mater, 2005,123: 187-195.
[12]Lu L A, Kumar M, Tsai J C, et al. High-rate Composting of Barley Dregs with Sewage Sludge in a Pilot Scale Bioreactor[J]. Bioresour Technol, 2008, 99:2210-2217.
[13]Lu L A, Ma Y S, Kumar M, et al. Photo-Fenton Pretreatment of Tebuthiuron-Analyses Via Experimental Design,Detoxification and Biodegradability Enhancement[J]. Sep and Purif Technol, 2011, 81:325-331.
[14]Zhu X, Yuan C, Bao Y, et al. Photocatalytic Degradation of Pesticide Pyridaben on TiO2Particles[J]. J Mol Catal A: Chem, 2005, 229:95-105.
Photocatalytic Degradation Kinetics of Tebuthiuron in TiO2Aqueous Solution
ZHOU Wen-chang1, YANG Hai1
(College of Chemistry and Chemical Engineering, Hunan Institute of Engineering, Xiangtan 411104, China)
Tebuthiuron is selected as target compound to study the degradation possibility and kinetics by photocatalytic technology. Firstly, the effects of various parameters, such as catalyst amount, pH value, temperature, the concentration of tebuthiuron on photocatalytic degradation kinetics are studied by single-variable-at-a-time method. Subsequently, the semiempirical expression is obtained and then its accuracy is evaluated. The results indicate that the degradation of tebuthiuron follows pseudo first-order kinetics by using Langmuir-Hinshelwood model and the pseudo-first-order rate constants is 0.03506min-1. The photocatalytic degradation rate of tebuthiuron is fast in alkaline solutions, and its photocatalytic degradation rate constants is 0.03899min-1. In addition, the photocatalytic degradation rate decreases with the increasing of tebuthiuron concentration. Lastly, the optimal experiment conditions for photocatalytic degradation of tebuthiuron are obtained as follows:TiO2at 2.7g/L, initial tebuthiuron concentration of 30μmol/L, temperature 45℃ and pH value at 6.7.
tebuthiuron; photocatalytic degradation; kinetics
2016-09-18
湖南工程学院青年科研项目(XJ1516);湖南工程学院大学生研究性学习和创新性实验计划项目(66).
周文常(1975-), 女,博士研究生,研究方向:光催化降解技术在工业废水中的应用及其纺织品的生态染整加工.
X592
A
1671-119X(2017)01-0060-05
