“未知溶液的离子鉴别”教学设计
2017-04-14曾瑶
曾瑶

摘要:以“未知溶液的离子鉴别”为例,探讨如何通过“从做中学”的实验探究手段构建及巩固《化学1》中的核心观念“微粒观”和“分类观”。通过设计半开放式实验,引导学生在自主探究中构建核心观念,并发展自己的能力,使学生真正成为学习的主体。
关键词:微粒观;分类观;离子鉴别;半开放式实验
文章编号:1008-0546(2017)04-0070-04 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2017.04.024
一、指导思想与理论依据
杜威的“从做中学”的教学理论,提供了一种构建化学核心观念的方法。“从做中学”也就是“从活动中学”“从经验中学”,它使得知识的获得与活动联系了起来,学习者能从那些真正有教育意义和有兴趣的活动中学习,从而有助于学习者的成长和发展。
在化学学科中,这种活动就是实验探究,因此“从做中学”就是“从实验中学”,以实验探究的方式来构建和落实核心观念。本课就是以实验“未知溶液的离子鉴别”为载体,通过实验探究来构建和落实“分类观”和“微粒观”。在本实验探究中,首先由教师提出问题“如何鉴别未知溶液中的阴阳离子”并提供试剂,学生明确问题并设计方案,接着通过共同讨论进一步改进和优化实验方案,并通过动手实验来验证方案是否可行、是否能够解决问题,最后进行归纳总结,得到“未知溶液的离子鉴别”的一般规律。这就是著名的“从做中学”的五步教学法,让学生从半开放式实验中建立起“分类观”和“微粒观”。为了进一步巩固和落实这两个核心观念,本课最后设计了“未知固体的组成推断”的练习。通过这种“从做中学”的方式,教学不再是简单地注入知识,而是运用一种最有效的方法,引导学生在自主探究中构建核心观念,并发展自己的能力,使学生真正成为学习的主体。
二、教学内容及学生情况分析
授课内容为人教版《化学1》复习课“未知溶液的离子鉴别”,共2课时,授课时间安排在学习完必修1所有课程之后。
离子反应是整个高中阶段的一个非常重要的知识点,贯穿、延伸于中学化学元素化合物学习的始终。在人教版《化学1》中的第二章第二节引入离子反应,学生通过宏观反应现象开始认识“微粒”及其相互作用,从而建立起“微粒观”,有了离子的概念,并学会离子反应方程式的书写。在第三章和第四章金属和非金属化合物的学习中,学生了解常见阴阳离子的鉴别方法和具备相应的实验技能。然而由于高一学生接触离子反应的时间较短,没有形成系统的微粒观,不能从微粒的角度全面理解物质性质,不能从离子的角度看待问题、分析问题和解决问题。
本课作为必修1的复习课,在学生已建立的离子反应基础上,首先以“未知溶液的离子鉴别”为载体,以学生自主探究为手段,以任务为驱动,应用“分类观”和“微粒观”,解决未知溶液的离子鉴别的现实问题,帮助学生建立未知溶液的离子鉴别的一般程序和思路。第二部分则加大难度到“未知固体的组成推断”,进一步巩固并加深对“微粒观”和“分类观”的认识,从而在理解的基础上深化对离子的认识,提高学生解决问题的综合能力,引导学生有效进行整个高中阶段的化学学习,具有承前启后的作用。
三、教学目标
(1)知识与技能:了解溶液中常见阴阳离子的种类及鉴别方法;学会常见离子检验的实验技能。
(2)过程与方法:通过方案设计、实验验证和归纳总结的过程学习离子鉴别的基本思路;培养学生通过观察实验现象,判断溶液中离子是否存在的能力。
(3)情感态度与价值观:体会分类观在离子鉴别中的应用;体會实验是研究物质的重要方法;体会小组合作的学习方式在化学课程的重要意义,培养团队合作意识。
四、教学重难点
(1)教学重点:溶液中常见阴阳离子的鉴别方法,未知溶液的离子鉴别一般思路。
(2)教学难点:分类观在离子鉴别中的应用,未知固体分子式的推断。
五、教学过程
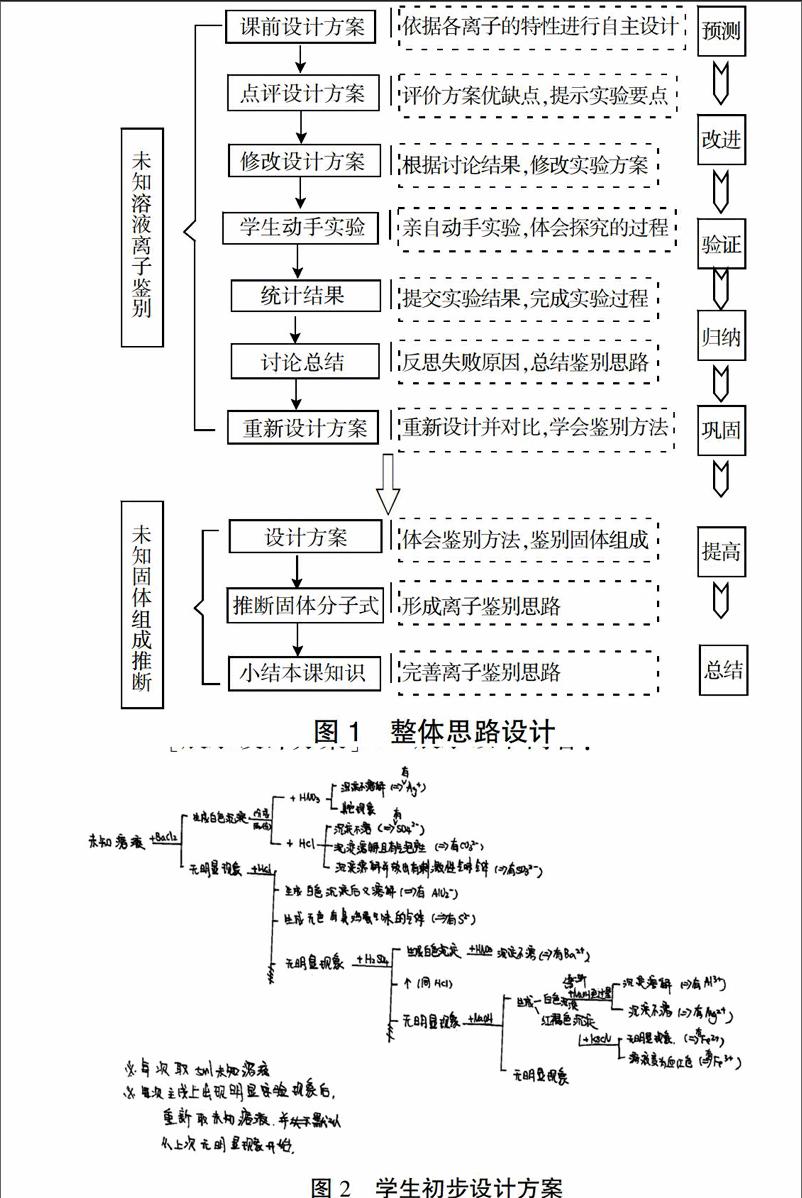
1. 整体思路设计(图1)
2. 教学活动的具体实施
(1)课前预习,布置任务
[任务1]PPT展示以下内容:
实验名称:未知溶液的离子鉴别
实验提供药品:一未知无色溶液25mL:含有两种阳离子和两种阴离子,溶液中离子浓度均大于0.1mol/L;(不考虑H+及OH-)。
稀溶液各25mL:HCl,H2SO4,HNO3,NaOH,Na2CO3,KSCN,AgNO3,BaCl2,pH试纸及实验室常见仪器。
实验设计中用流程图表示鉴别步骤。
实验完成目标:通过所提供试剂,将未知溶液的离子鉴别出来,并填在给定表格里。
已知:2Al3++3CO32-+3H2O[=]2Al(OH)3↓+3CO2↑
[学生]以小组为单位,自主讨论、设计实验方案,并于课前提交实验设计报告。
[设计意图] 学生已学习过常见金属及非金属的性质,可据此完成初步的实验方案设计。
(2)提出问题,引入新课
[引入]在上几周的课程中,我们已经学习了金属以及非金属的性质,而在水溶液中,这些金属以及非金属元素主要是以离子形式存在。为了检验是否掌握,现提供常见试剂和仪器,设计实验将溶液中的两种阴阳离子分别鉴别出来。
[设计意图]结合学生学过的金属与非金属性质和离子反应,提出一个实际问题,引入新课。
[任务2]这是某一组的实验设计方案,每组对照自己的设计,讨论一下这个实验设计的优点,并指出这个实验设计的错误。
[展示设计方案]PPT展示以下内容:
[学生]观察,思考,分组讨论,在方案上标记,总结,汇报。
[设计意图]以一个小组设计方案为例,引导学生找出方案的优点,存在的错误(现象结论不匹配,试剂滴加顺序错误,重要离子的遗漏等),得到一个初步可行的方案。
[学生]思考,小组讨论,回答问题。
[追问]提问取试剂时量的多少,反应容器选用试管还是烧杯。
[讲解]无明显现象也是一个重要的实验现象,从无明显现象虽然不能推断出溶液中含有什么离子,但有时候可以推测出一定不含某些离子。因此实验记录时,不能忽视对无明显现象的记录和分析。
[设计意图]强调对定性试管实验量的概念,以及对无明显现象的记录及分析。
(3)学生动手实验
[任务3]小组改进实验设计。
[学生]思考,分组讨论,完成实验设计的修改。
[教师]巡视,适当帮助学生进行方案修改。
[设计意图]根据讨论的结果,对本组方案进行改进,保证方案的可行性。巡视时重点留意实验设计较薄弱的小组,适当引导帮助修改方案。
[引导]实验是检验设计是否可行的唯一标准,下面我们就通过实验来验证一下。
[任务4]学生分组实验。
[学生]动手实验,记录实验现象,上传实验记录至在线文档,鉴别结果登记在黑板。
[教师]巡视学生实验,确保学生实验过程规范操作,督促及时做好实验记录。
[设计意图] 利用实验检验方案是否可行,观察NaOH从少量到过量的实验现象的异同,体会实验在化学学习中的作用。
[公布结果] 此无色溶液中存在的四种离子为Al3+、NH4+、SO42-和Cl-。
[引导]实验结果错误的小组,结合在线文档中的实验记录,引导学生分析错误原因。
[设计意图]根据实验结果总结小组完成情况,对鉴别结果出现错误的小组通过查看实验记录,引导学生自己分析出现错误的原因。
(4)总结离子鉴别思路
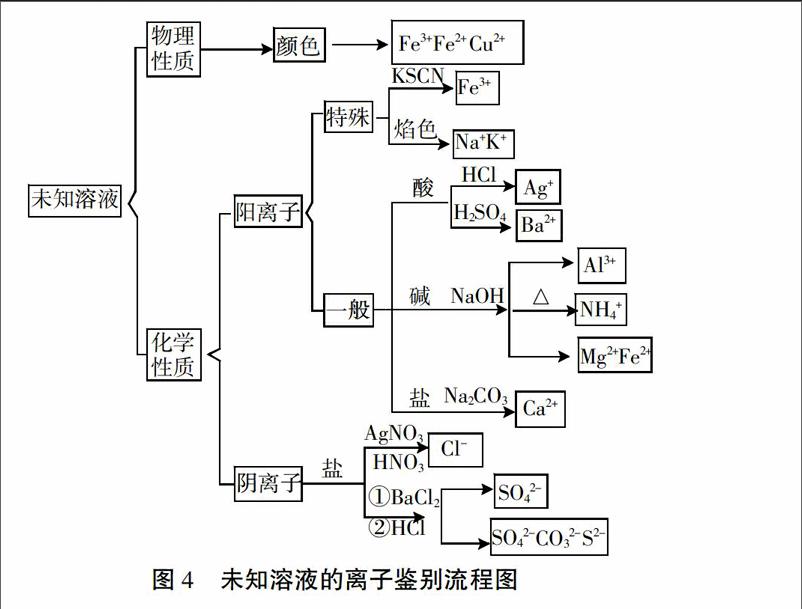
[引导] 现在我们来总结一下未知溶液的离子鉴别的思路。对未知溶液进行分析,从性质入手,可以分为哪两类?
[学生]物理性质和化学性质。
[提问]对于物理性质,可以观察溶液的颜色,判断出哪些离子的存在?
[学生]Fe3+,Fe2+ 和Cu2+。
[设计意图]引导学生对未知溶液进行分类,先从物理性质入手,通过颜色判断Fe3+,Fe2+ 和Cu2+ 的存在。
[引导]为了便于鉴别,可以把溶液中的离子分成两类,分别是什么?
[学生]阳离子和阴离子。
[设计意图]通过分类观,对溶液的离子进行阴阳离子分类后再逐一鉴别。
[引导]对于阳离子,第一步总是先把有特殊颜色反应的离子先鉴别出来。这种特殊的阳离子是什么?鉴别需要滴加的是?
[学生]Fe3+,用KSCN溶液鉴别。
[提问] 另外还有两种阳离子无法通过滴加试剂产生沉淀,但有一种特殊的方法来鉴别,这种方法是什么?
[学生]焰色反应来鉴别Na+和K+。
[讲解]对于其他阳离子,没有特殊的颜色反应,我们只能通过出现沉淀和气体的现象来鉴定。通常我们将滴加试剂分成酸、碱、盐三类,依次滴加,根据现象具体判断。
[提问]常见的酸有哪些?能鉴别出哪些离子?
[回答]可以用盐酸来鉴别Ag+,H2SO4来鉴别Ba2+。
[提问]常见的碱呢?滴加之后有可能出现什么现象?证明有哪些离子?
[学生]NaOH溶液,先产生白色沉淀后消失的是 Al3+,白色沉淀不消失的是Mg2+,白色沉淀迅速變成灰绿色,最后变成红褐色是Fe2+,加热后使湿润的石蕊(pH)试纸变蓝的是NH4+。
[讲解]鉴别Al3+注意滴加NaOH溶液从少量到过量;鉴别NH4+离子一定要加热,pH试纸需润湿。
[提问]还有一种常见的盐能很快鉴别一种常见的阳离子,这种盐和对应的阳离子是什么?
[学生]用Na2CO3溶液鉴别Ca2+。
[设计意图]通过分类观,将滴加试剂分为酸、碱、盐三类,再根据现象依次鉴别。
[提问]对于阴离子,常见的阴离子都有相应的试剂和对应的现象可以鉴别,比如Cl-,如何鉴别?
[学生]用HNO3酸化的AgNO3溶液可以鉴别Cl-。
[提问]最后,可以通过先加BaCl2溶液,再滴加稀盐酸将其他常见的阴离子都鉴别出来,可能出现哪些现象,说明有哪些离子存在?
[学生]先滴加BaCl2溶液再滴加稀盐酸,白色沉淀不消失的是SO42-,白色沉淀消失,产色无色气味的是CO32-,有刺激性气味的气体的是SO32-,有臭鸡蛋气味的是S2-。
[设计意图]常见阴离子种类较少,并基本可以通过对应的试剂一一鉴别,直接引导学生对常见的阴离子归纳,逐一进行鉴别。
[总结]未知溶液的离子鉴别是从溶液可能含有的离子出发,对离子进行分类,再选择相应的试剂根据实验现象来判断是否存在该离子。
(5)重新设计方案,加深理解
[任务5]根据未知溶液的离子鉴别思路,重新设计本实验的实验方案,并写出对应的实验现象,判断溶液中的阴阳离子。
[讲解]重新设计的实验方案只需要四步实验,依次滴加KSCN、NaOH溶液并加热、AgNO3溶液和稀硝酸、BaCl2溶液和稀盐酸,就可以将溶液中的四种离子鉴别出来,相比于学生最初的实验设计,思路清晰,方法简单。
[设计意图]让学生重新设计实验方案,对比最初的方案,体会刚总结的离子鉴别思路的简明高效。
[总结]未知溶液的离子鉴别,不是根据提供的试剂进行随机滴加,根据现象来判断离子种类;而是需要根据溶液中可能存在的离子先进行分类,并选择对应的试剂,根据现象来进行判断。
[设计意图]再次总结升华离子鉴别的思路,强调分类观的思想。
(6)巩固练习,提高拓展对未知固体的鉴别
[任务6]现有一浅绿色固体,为无机复盐。已知复盐是由两种金属离子(或铵根离子)和一种酸根离子构成的盐。请利用实验室常见试剂及仪器设计方案检验该无机复盐离子的组成。
[学生]小组讨论,设计方案。
[提示]对于固体,一定要先溶解成溶液再进行实验。
[设计意图]学生再次体会离子鉴定流程图的思路,巩固并提高难度。
[任务7]已知该复盐的摩尔质量为392 g/mol,含有6个结晶水,下图是某同学对该复盐进行检验的实验步骤及现象。请推测该复盐的化学式。
[学生]复盐化学式是(NH4)2Fe(SO4)2·6H2O。
[设计意图]引入具体实例,再次让学生体会离子鉴别的流程。加大难度,将离子鉴别推广到固体化学式的测定,小结本课内容,及时巩固加深印象。
3. 板书设计
六、教学反思
1. “从做中学”落实核心观念
离子反应是人教版必修1中的经典内容,教学资源较多,然而大多教学设计存在的主要问题是强调离子反应的书写、条件等知识点,而忽略了让学生从离子这一微观角度来认识物质,用离子反应解决实际问题的能力的培养。在本教学设计中,以“未知溶液的离子鉴别”为载体,以半开放式实验探究为手段,以七个任务为驱动,激发学生的好奇心,促使学生主动进入分析问题和解决问题的活动中。学生从课前主要关注单纯物质的性质,到设计最初方案时开始关注离子的性质,通过实验探究经历离子鉴别的过程,最终巩固总结,能够从“分类观”和“微粒观”的角度理解未知溶液的离子种类并掌握离子鉴别的一般流程,从而对物质的认识从感性上升为理性。
2.“从做中学”学生收获颇丰
课后调查问卷表明学生“从做中学”收获很大,完成了本课的三维目标。学生写到“通过实验设计时锻炼了分析问题的能力,通过实验操作复习和掌握很多离子的性质,帮助记住很多离子反应方程式。”“分析能力变强,考虑问题更全面。”“学习了分类的方法对未知溶液进行鉴别,相比课前自己设计的方案中胡乱滴加试剂,更有逻辑更高效率。”
通过“从做中学”这种自主探究的方式,激发学生的学习兴趣,让学生真正成为学习的主体,整个教学中通过“做”的过程,促进“思”的升华,最终完成对“学”的积累,达到巩固落实“分类观”和“微粒观”的目的,培养学生综合运用知识解决实际问题的能力。
参考文献
[1] 刘鸿雁.杜威的“从做中学”理论在高职教学中的应用研究[J].读与写杂志,2010,7(7):75
[2] 王磊,张毅强,乔敏.观念建构为本的化学教学设计研究[J].化學教育,2008,29(6):7-12
