miRNAs与肝细胞癌的相关性研究进展
2017-04-14孙嘉玲孙海涛陈冠新贺松其
孙嘉玲,文 彬,孙海涛, 陈冠新,贺松其
(1.南方医科大学中医药学院,广东 广州 510515;2.中国人民解放军四五八医院中医科,广东 广州 510602)
◇讲座与综述◇
miRNAs与肝细胞癌的相关性研究进展
孙嘉玲1,文 彬2,孙海涛1, 陈冠新1,贺松其1
(1.南方医科大学中医药学院,广东 广州 510515;2.中国人民解放军四五八医院中医科,广东 广州 510602)
原发性肝细胞癌是全球最常见的恶性肿瘤之一。肝细胞癌起病隐匿,早期临床症状多不明显,造成早期发现及诊断的难度较大,确诊时多属中晚期,且由于肝细胞癌的高侵袭转移和高复发率,导致肝细胞癌的死亡率极高。MicroRNAs(miRNAs)是长约22个核苷酸的高度保守的内源性非编码单链小RNA。肝脏内存在大量miRNAs,miRNAs不仅可以调节肝脏的生长发育,还与肝细胞癌的形成密切相关。在肝细胞癌形成的过程中,miRNAs可作为致癌基因或抑癌基因调节肿瘤细胞的分化、增殖、肿瘤形成、血管生成及侵袭和转移等。近十年来,随着对miRNAs在肝细胞癌形成过程中的分子机制研究的深入,越来越多研究表明,miRNAs可成为早期诊断肝细胞癌的灵敏的生物指标和有效的治疗靶点。
miRNAs; 肝细胞癌; 致癌基因; 抑癌基因; 诊断; 治疗
原发性肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝细胞癌)是全球最常见的恶性肿瘤之一,每年因肝细胞癌死亡的人数高居世界恶性肿瘤死亡人数的第3位,而在发展中国家发病率最高。目前,肝细胞癌的主要治疗方法包括手术切除、肝移植、介入治疗、放疗、化疗及免疫治疗等方法。但由于肝细胞癌早期症状多不明显,造成早期发现及诊断的难度较大,确诊时多属中晚期,失去了手术切除的时机。而且肝细胞癌术后5年的复发率高达70%[1]。高复发率和高侵袭转移导致肝细胞癌的死亡率极高。因此,我们迫切需要找到对肝细胞癌早期诊断灵敏的生物指标和更好的治疗方法。近十年来,随着对miRNAs在肝细胞癌形成过程中的分子机制研究的深入,越来越多研究表明,miRNAs可能成为早期诊断肝细胞癌的灵敏的生物指标和有效的治疗靶点。
1 miRNAs的生物学特点及功能定位
MicroRNAs(miRNAs)是长约22个核苷酸的高度保守的内源性非编码单链小RNA。miRNA基因在细胞核内由RNA聚合酶Ⅱ转录成pri-microRNA,随后被RNase Ⅲ家族的核酸内切酶Drosha和DGCR8剪切成长约70个碱基大小的发夹结构前体pre-microRNA,后由Exportin-5蛋白和Ran-GTP蛋白从核内转运到胞质中,被核糖核酸酶Ⅲ Dicer加工成长约22个核苷酸的双链miRNA,其中一条成熟的miRNA通过形成RNA-induced silencing complex(RISC)复合体与靶mRNA的3′untranslated region(3′UTR)结合,另一条miRNA则降解[2-3]。miRNA不参与编码蛋白,而是通过与靶mRNA的3′UTR序列特异性互补结合,使靶mRNA降解或抑制其翻译,在转录后水平调节相关基因的表达。
miRNAs可以调节细胞生命过程的各个方面,包括分化、发育、代谢、增殖和凋亡等[4]。miRNAs具有强大的调节作用,单个miRNA可直接调节上百种蛋白的表达[3]。肝脏内存在大量miRNAs,与肝脏的生长发育密切相关,如:miR-122参与调节肝细胞的生长、分化、脂质代谢、应激反应等;miR-33、miR-27、miR-378、miR-34和miR-21参与调节肝脏的代谢。大量研究表明,在肝组织中异常表达的miRNAs与肝脏疾病(包括病毒性肝炎、肝纤维化、肝细胞癌等)的发病机制密切相关[5]。Calin等[6]发现miRNAs基因并不是随机分布在人类基因组上的,超过50%的miRNAs基因分布于与癌症密切相关的人类基因组区域或脆性位点。在肝细胞癌形成的过程中,miRNAs可作为致癌基因或抑癌基因,与相应的靶基因结合,调节靶基因的表达,通过相关的信号通路,调节肝细胞癌细胞的分化、增殖、肿瘤形成、血管生成、侵袭和转移等。
Long non-coding RNA (lncRNA)是长度大于200个核苷酸的内源性非编码RNA。近年来,研究发现lncRNAs在多种肿瘤的发展中起重要作用,包括肝细胞癌。异常表达的lncRNAs可通过与miRNAs或mRNAs相互作用形成lncRNA-miRNA-mRNA interactions,参与调节肝细胞癌的发生发展和侵袭转移。miRNAs可与lncRNAs直接结合在转录后水平调节lncRNAs的表达。PTENP1、HULC、GAS5、loc285194、HOTAIR、HOTTIP等lncRNAs已在许多肿瘤中被确认为是miRNAs的靶基因[7-9]。Tsang等[7]发现在肝细胞癌中,miR-125b可抑制致癌lncRNA HOTTIP的表达。Ge等[8]发现miR-192和miR-204可通过Argonaute 2(AGO2)-mediated RNA interference(RNAi)通路来抑制HOTTIP的表达从而达到抑制肝癌细胞增殖的目的,并认为miR-192/-204-HOTTIP轴有可能成为肝细胞癌预测预后及治疗的靶标。
2 miRNAs在肝细胞癌中的异常表达
2.1 肝细胞癌中miRNA表达谱的变化 Murakami等[10]首次在肝细胞癌上运用miRNA基因芯片技术,通过测量25组肝细胞癌组织和相邻的非肿瘤组织的miRNA表达谱,发现与非肿瘤组织相比,肝细胞癌组织中3种miRNA(miR-18、pre-cursor miR-18、miR-224)表达上调,5种miRNA(miR-199a*、miR-195、miR-199a、miR-200a和miR-125a)表达下调,四种miRNA(miR-92, miR-20, miR-18 和 precursor miR-18)的表达水平与肝细胞癌的分化程度相关。Murakami等还用miRNA表达谱通过SVMs技术对肝细胞癌和非肝细胞癌组织进行分类,预测精度可达97.8%。自此,越来越多研究涉及到肝细胞癌的miRNA表达谱,发现miRNA的异常表达是肝细胞癌的一个常见特征。Katayama等[11]首次对40例具有不同临床特征的肝细胞癌患者(12例感染HBV,12例感染HCV,16例无HBV和HCV感染)的肿瘤组织和非肿瘤组织的miRNA表达谱和以上40例肝细胞癌患者的肿瘤组织与正常肝组织的miRNA表达谱分别进行两两比较,发现与肝细胞癌发病机制相关的miRNAs可能参与了早期肝细胞癌形成的过程,并在肝细胞癌和慢性肝脏疾病中起不同作用,异常表达的miRNAs(miR-18b*、miR-296-5p、miR-557、miR-581、miR-625*、miR-1228、miR-1249、miR-2116*)可作为慢性肝脏疾病的新型生物标志物,而miR-129*、miR-146b-3p和miR-448可成为肝细胞癌的新型生物标志物(在有HBV或HCV感染和无HBV、HCV感染的肝细胞癌中都适用)。
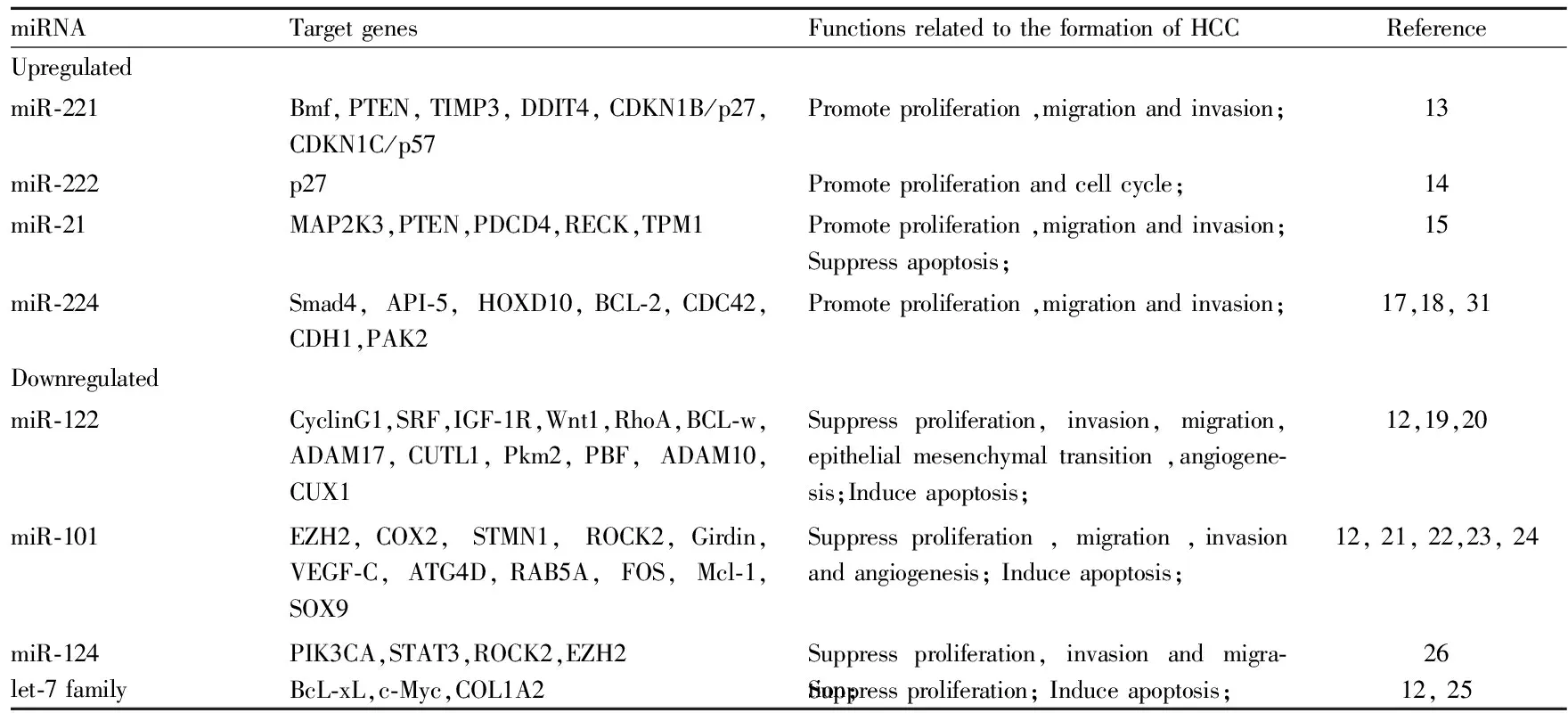
2.2 在肝细胞癌中作为致癌基因的miRNAs 研究表明[3,12],miR-221、miR-222、miR-21、miR-10a、miR-10b、miR-224、miR-34a、miR-519a、miR-130a都是常见的在肝细胞癌组织中表达增多的miRNAs。其中,miR-221表现最明显,miR-221在70%-80%的肝细胞癌样本中都明显增加。作为致癌基因,miR-221可通过下调CDKN1B/p27、CDKN1C/p57、DDIT4、PTEN、TIMP3、Bmf等抑癌基因的表达来促进肝细胞癌细胞的增殖[13]。在体内实验方面, Callegari等[13]用miR-221过表达的转基因小鼠模型,通过免疫印迹法和免疫染色法证实miR-221可下调CDKN1B/p27、CDKN1C/p57、Bmf等靶蛋白。而且,在过表达miR-221的转基因小鼠中,过表达的miR-221可使50%雄鼠自发形成小的可见的肝肿瘤。在用致癌物DENA诱导产生肝细胞癌的小鼠中,过表达的miR-221能明显促进肿瘤的发展。此外,miR-222可通过下调靶基因p27的表达来促进肝细胞癌HepG2细胞的增殖[14]。miR-21通过抑制靶基因MAP2K3的表达来促进肝细胞癌HepG2细胞的增殖[15]。miR-10b通过在转录后水平下调靶基因HOXD10的表达来上调RhoC、uPAR、MMPs的表达,通过HOXD10/RhoC/uPAR/MMPs通路来促进肝细胞癌的侵袭和转移[16]。miR-224可通过激活AKT信号通路来促进肝细胞癌的发展。还可通过与靶基因Bcl-2、CDC42、CDH1、PAK2结合来促进肝细胞癌细胞的增殖、侵袭、转移和抗凋亡[17]。Lan等[18]首次提出自噬可以有选择地通过一个自噬体调节降解系统调节miR-224的表达。在此基础上,Lan等还提出在HBV相关肝细胞癌中,异常的自噬活动(低自噬活性)会导致miR-224的积累和减少靶基因Smad4的表达,促进肝细胞癌的发生和侵袭转移。
2.3 在肝细胞癌中作为抑癌基因的miRNAs 近年来,大量研究发现miR-122、miR-101、let-7家族和miR-124在肝细胞癌组织中的表达普遍减少[3,12],并可作为抑癌基因调节肝细胞癌的发生、发展、转移、侵袭。miR-122构成了肝脏miRNA总数的70%,属于肝脏特有的miRNA。作为抑癌基因,miR-122在肝细胞癌中主要通过调节与细胞增殖、分化、侵袭转移、凋亡、血管生成等过程密切相关的靶基因(包括CyclinG1、SRF、IGF-1R、Wnt1、ADAM10、ADAM17、CUTL1、CUX1、Pkm2、PBF等)的表达,来抑制肝细胞癌的发生发展[19]。Wang等[20]通过在Sk-hep-1和Bel-7402两种肝细胞癌细胞株中转染miR-122,使miR-122过表达,观察到两种细胞株呈明显上皮细胞样形态变化,出现间叶-上皮转化(mesenchymal-epithelial transition ,MET),发现miR-122可由上游转录因子HNF4α触发MET并以RhoA为靶基因来抑制肝细胞癌细胞的侵袭转移。Zheng等[21]用鼠原位肝移植瘤模型验证了miR-101不仅可以抑制肝细胞癌的生长,还可以抑制肝内转移和肺、纵膈的远处转移,并用鸡胚绒毛尿囊膜模型验证了miR-101可抑制血管生成。随后, Zheng等验证了miR-101不仅可抑制致癌基因EZH2、COX2和STMN1的表达,还可直接下调ROCK2的表达来抑制Rho/RacGTPase的激活。miR-101还可通过下调Girdin蛋白、VEGF-C的表达来抑制肝细胞癌的侵袭和转移[22-23]。此外,Xu等[24]发现miR-101可增强由顺铂诱导肝细胞癌细胞凋亡的作用,并提出miR-101可能是通过下调靶基因RAB5A、STMN1和ATG4D的表达来抑制肝细胞癌细胞的自噬而起作用的。共同转染let-7g和let-7i可通过抑制BcL-xL蛋白表达,抑制肝细胞癌BEL-7402细胞增殖,促进细胞的凋亡[25]。miR-124可通过抑制致癌基因PIK3CA、STAT3、ROCK2和EZH2的表达来抑制肝细胞癌的生长、侵袭和转移[26]。
3 miRNAs与肝细胞癌的早期诊断及防治
3.1 肝细胞癌早期诊断的困难及重要意义 对于肝细胞癌的防治来说,早期诊断是关键。肝细胞癌的5年生存率约为5%~9%,而在早期诊断和接受了肝切除手术或肝移植术的患者中可增加到69%[27]。手术切除和原位肝移植是肝细胞癌最有效的治疗方法。但由于肝细胞癌早期症状多不明显,造成早期诊断难度大,而且受肿瘤位置、大小及潜在肝脏疾病的影响,导致只有5%~15%的患者可以接受手术切除。肝脏超声和甲胎蛋白(AFP)检测是目前临床上诊断和监控肝细胞癌最常用的方法。由于受操作者经验、肿瘤大小、检查频率的影响,肝脏超声很难辨别早期肝细胞癌与肝脏良性病变。AFP是肝细胞癌高危患者筛查和预测预后常用的血清肿瘤标志物。但在早期肝细胞癌患者中,AFP的假阴性率高达40%[28-29]。AFP的灵敏度只有39%~65%,特异度只有76%~94%,接近1/3的早期肝细胞癌患者不能通过AFP检测出来,这远不能满足肝细胞癌早期诊断的需要[30]。因此,我们迫切需要找到新型、灵敏度高、特异度高的肝细胞癌肿瘤标志物。近年来,越来越多的研究表明miRNAs参与肝细胞癌的发生发展过程,很有潜力成为新型、灵敏度高、特异度高的早期诊断肝细胞癌的标志物和治疗靶点。
Tab 1 Main abnormally expressed miRNAs in hepatocellular carcinoma and their target genes
3.2 miRNAs与肝细胞癌的诊断 关于肝细胞癌组织中miRNA表达谱的研究表明了肿瘤组织中异常表达的miRNAs具有诊断肝细胞癌的潜力。但要获取肿瘤组织的miRNA就要进行有创的穿刺或手术,因此组织miRNA在临床上并不适用于肝细胞癌的早期诊断和广泛筛查。现有研究表明血清或血浆中稳定存在着一定的miRNAs。血清或血浆中的miRNAs可通过与AGO2蛋白或高密度脂蛋白结合,或被包装进入分泌囊泡(包括凋亡小体和外泌体)来抵抗血清或血浆中内源性核糖核酸酶的水解作用。每种miRNA在正常个体血中的表达是始终一致的,血浆中表达增多的致癌miRNAs可能来源于肿瘤的坏死,凋亡和分泌囊泡(外泌体)的释放[31]。而且,温度变化、pH值高低、放置时间等因素对血清或血浆中的miRNAs无明显影响[32]。因此,血清或血浆中的miRNAs有潜力成为一种非侵入性、易获取的肿瘤标志物。为提高检测的灵敏性和特异性,在选择肿瘤标志物时,应优先选择在肿瘤中表达上调的血清或血浆中的miRNAs。
Fiorino等[32]系统性分析总结了有潜力作为诊断HBV相关肝细胞癌的肿瘤标志物的被报道超过3次的miRNAs:包括在肝细胞癌组织和血清中都表达上调的miR-221、miR-21、miR-222、miR-224、miR-18a。Okajima等[31]通过研究107例肝细胞癌患者和75例健康对照者的血浆样本,发现血浆miR-224的高表达与肝细胞癌的诊断、肿瘤大小、肿瘤分级和复发率密切相关(在有或无HBV、HCV感染或其他肝脏疾病中无明显差异),且在Ⅰ期肝细胞癌患者血浆中的表达就明显增加(AUC:0.899),而miR-151和miR-191在有HBV或HCV感染的肝细胞癌患者的血浆中表达明显增加。此外,使用血浆miR-224可提高对小于18mm的肝细胞癌检测的灵敏度(AUC:0.802,灵敏度:78.7%~90.7%),而血清AFP可检测的肝细胞癌大小最小值是26 mm(AUC:0.475,灵敏度:30.3~40.7%),强调了血浆miR-224在肝细胞癌早期诊断中的重要性。Li等[29]通过研究195例肝细胞癌临床前期患者和435例慢性乙肝病毒感染患者的血清标本,发现用血清miRNA组合(miR-193a-3p、miR-369-5p、miR-672、miR-429、let-7i*)对早期无症状肝细胞癌进行筛查可明显提高灵敏度(AUC:0.764,灵敏度:69.2%,特异度:80.0%),而AFP(AUC:0.603,灵敏度:36.9%,特异度:83.8%)。Li等还发现这个血清miRNA组合可诊断80.5%AFP阴性和81.5% AFP阳性的早期无症状肝细胞癌患者。在AFP水平低、无异常超声表现的时期,血清miRNA就可在慢性乙肝患者中筛查出早期无症状肝细胞癌患者,可比明确临床诊断提早12个月,说明血清miRNAs在肝细胞癌早期诊断的重要性。
miRNAs不仅可以作为肝细胞癌早期诊断的标志物,还可以作为肝细胞癌预后预测和术后复发的标志物。Zhu等[33]研究发现伴有血清miR-192-5p、miR-29a-3p高表达的肝细胞癌患者与低表达患者相比有更差的总生存期(overall survival,OS)和无进展生存时间(progression-free survival,PFS)。Zheng等[21]用qRT-PCR测定了163名肝细胞癌患者的血浆miR-101表达水平,测得所有具有远处转移的肝细胞癌患者的血浆miR-101表达明显降低,验证了miR-101表达降低与肝细胞癌晚期和预后不良密切相关。血浆miR-224可能是接受了局部治疗(如经皮消融治疗或TACE)的患者出现肿瘤残留的一个检测指标[31]。肝细胞癌组织中miR-19a、miR-126、miR-223、miR-24、miR-886-5p、miR-147表达的改变与原位肝移植术后复发有关[34]。
3.3 miRNAs与肝细胞癌的治疗 目前研究表明,miRNA治疗可成为肝细胞癌治疗的一个新方向。当靶miRNA为致癌基因时,通过使用miRNA功能沉默技术抑制靶miRNA的表达可达到治疗肝细胞癌的效果。Callegari等[13]在用DENA处理的过表达miR-221的肝癌小鼠的尾静脉中注射anti-miR-221 AMOs后,观察到与对照组相比,肿瘤的数量、大小明显减少,而且miR-221在肿瘤中的表达明显减少。说明miR-221可作为肝细胞癌治疗的靶基因,anti-miR-221可有效传递到肝组织中,抑制miR-221的表达,抑制肝细胞癌的生长,且无明显毒性。当靶miRNA为抑癌基因时,常通过病毒载体转染miRNA模拟物恢复靶miRNA的表达来治疗肝细胞癌。Zheng等[21]通过在原位接种了肝细胞癌的小鼠的尾静脉注射lenti-miR-101,发现与对照组相比,miR-101在肝、肺和肿瘤中的表达显著增加,肿瘤大小明显减小,肿瘤的微血管密度明显减少,肝内转移和肺转移都明显减少,生存时间延长。说明miR-101可作为肝细胞癌治疗的靶基因,增加miR-101的表达可有效抑制肝细胞癌的生长和转移。而实验使用的慢病毒表达载体lenti-miR-101的转染率超过90%,使miR-101在肝、肺和肿瘤组织中高表达,且无明显毒性。说明慢病毒载体是一种有效的转导miR-101的工具,有望成为一种治疗肝细胞癌的新方法。此外,用腺病毒携带miR-26a 基因转染MYC诱导的肝细胞癌小鼠模型,可明显抑制肿瘤的生长[13]。MRX34是首个进入I期临床试验的miRNA类似物,用于不可切除的原发性肝细胞癌或有肝转移性肿瘤的患者。MRX34是一种脂质体纳米颗粒包被的miR-34类似物,可通过下调miR-34的靶基因C-MET的表达,上调抑癌基因P53的表达,进而导致肝癌细胞周期循环停滞,诱导肝癌细胞凋亡[35]。
4 展望
肝细胞癌易复发、高侵袭转移的特点导致了肝细胞癌的5年生存率极低。因此,肝细胞癌已成为人类健康的一大威胁。近年来,对miRNAs在肝细胞癌形成过程中的分子机制研究发现miRNAs可作为致癌基因或抑癌基因调节肝细胞癌细胞的分化、增殖、肿瘤形成、血管生成、侵袭和转移。大量研究表明miRNAs可成为早期诊断肝细胞癌的灵敏的生物指标和有效的治疗靶点。但目前对miRNAs在诊断肝细胞癌方面的研究仍存在很大的局限性:大部分研究的样本数量太少且大部分是HBV相关肝细胞癌的样本。虽然miR-34的类似物MRX34已经进入I期临床试验,对miRNA在治疗肝细胞癌方面的研究已取得一定的进展,但仍需深入研究miRNA药物的药代动力学、安全性和稳定性等问题。未来对miRNAs在诊断和治疗肝细胞癌方面的研究会越来越深入,成为今后肝细胞癌诊断治疗研究的重要发展方向之一。
[1] Pascual S, Herrera I, Irurzun J.New advances in hepatocellular carcinoma[J].WorldJHepatol,2016,8(9): 421-38.
[2] 王晓钰,于 曦,王 燕,等.MicroRNAs:过敏性疾病的潜在新靶点[J].中国药理学通报, 2016,32(5): 616-9.
[2] Wang X Y, Yu X, Wang Y,et al. MicroRNAs:potential new targets for allergic diseases[J].ChinPharmacolBull, 2016,32(5): 616-9.
[3] Borel F, Konstantinova P, Jansen PL.Diagnostic and therapeutic potential of miRNA signatures in patients with hepatocellular carcinoma[J].JHepatol, 2012, 56(6): 1371-83.
[4] 毛玉娣,丁西平,王 华.微小RNA与胃癌关系的研究进展[J].中国药理学通报, 2016,32(6): 756-60.
[4] Mao Y D, Ding X P, Wang H. Research progress on relationship between microRNA and gastric cancer[J].ChinPharmacolBull, 2016,32(6): 756-60.
[5] Murakami Y, Kawada N.MicroRNAs in hepatic pathophysiology[J].HepatolRes, 2017,47(1):60-9.
[6] Calin G A, Sevignani C, Dumitru C D, et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].ProcNatlAcadSciUSA, 2004, 101(9): 2999-3004.
[7] Tsang F H, Au S L, Wei L, et al.Long non-coding RNA HOTTIP is frequently up-regulated in hepatocellular carcinoma and is targeted by tumour suppressive miR-125b[J].LiverInt, 2015, 35(5): 1597-606.
[8] Ge Y, Yan X, Jin Y, et al.fMiRNA-192 and miRNA-204 directly suppress incRNA HOTTIP and interrupt GLS1-Mediated glutaminolysis in hepatocellular carcinoma[J].PloSGenet, 2015, 11(12): e1005726.
[9] Zhang J, Fan D, Jian Z, et al.Cancer specific long noncoding RNAs show differential expression patterns and competing endogenous RNA potential in hepatocellular carcinoma[J].PloSOne, 2015, 10(10): e0141042.
[10]Murakami Y, Yasuda T, Saigo K, et al.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues[J].Oncogene, 2006, 25(17): 2537-45.
[11]Katayama Y, Maeda M, Miyaguchi K, et al.Identification of pathogenesis-related microRNAs in hepatocellular carcinoma by expression profiling[J].OncolLett, 2012, 4(4): 817-23.
[12]Saito Y, Suzuki H, Matsuura M, et al.MicroRNAs in hepatobiliary and pancreatic cancers[J].FrontGenet, 2011, 2:66.
[13]Callegari E, Elamin BK, Giannone F, et al.Liver tumorigenicity promoted by microRNA-221 in a mouse transgenic model[J].Hepatology, 2012, 56(3): 1025-33.
[14]Yang Y F, Wang F, Xiao J J, et al.MiR-222 overexpression promotes proliferation of human hepatocellular carcinoma HepG2 cells by downregulating p27[J].IntJClinExpMed, 2014, 7(4): 893-902.
[15]Xu G, Zhang Y, Wei J, et al.MicroRNA-21 promotes hepatocellular carcinoma HepG2 cell proliferation through repression of mitogen-activated protein kinase-kinase 3[J].BMCCancer, 2013, 13:469.
[16]Liao C G, Kong L M, Zhou P, et al.miR-10b is overexpressed in hepatocellular carcinoma and promotes cell proliferation, migration and invasion through RhoC, uPAR and MMPs[J].JTranslMed, 2014, 12:234.
[17]Yu L, Zhang J, Guo X, et al.MicroRNA-224 upregulation and AKT activation synergistically predict poor prognosis in patients with hepatocellular carcinoma[J].CancerEpidemiol, 2014, 38(4): 408-13.
[18]Lan S H, Wu S Y, Zuchini R, et al.Autophagy suppresses tumorigenesis of hepatitis B virus-associated hepatocellular carcinoma through degradation of microRNA-224[J].Hepatology, 2014, 59(2): 505-17.
[19]Nakao K, Miyaaki H, Ichikawa T.Antitumor function of microRNA-122 against hepatocellular carcinoma[J].JGastroenterol, 2014, 49(4): 589-93.
[20]Wang S C, Lin X L, Li J, et al.MicroRNA-122 triggers mesenchymal-epithelial transition and suppresses hepatocellular carcinoma cell motility and invasion by targeting RhoA[J].PloSOne, 2014, 9(7): e101330.
[21]Zheng F, Liao Y J, Cai M Y, et al.Systemic Delivery of MicroRNA-101 Potently Inhibits Hepatocellular Carcinoma In Vivo by Repressing Multiple Targets[J].PloSGenet, 2015, 11(2): e1004873.
[22]Cao K, Li J, Zhao Y, et al.miR-101 Inhibiting Cell Proliferation, Migration and Invasion in Hepatocellular Carcinoma through Downregulating Girdin[J].MolCells, 2016, 39(2): 96-102.
[23]Liu Z, Wang J, Mao Y, et al.MicroRNA-101 suppresses migration and invasion via targeting vascular endothelial growth factor-C in hepatocellular carcinoma cells[J].OncolLett, 2016, 11(1): 433-38.
[24]Xu Y, An Y, Wang Y, et al.miR-101 inhibits autophagy and enhances cisplatin-induced apoptosis in hepatocellular carcinoma cells[J].OncolRep, 2013, 29(5): 2019-24.
[25]Wu L, Wang Q, Yao J, et al.MicroRNA let-7g and let-7i inhibit hepatoma cell growth concurrently via downregulation of the anti-apoptotic protein B-cell lymphoma-extra large[J].OncolLett, 2015, 9(1): 213-18.
[26]Lu Y, Yue X, Cui Y, et al.MicroRNA-124 suppresses growth of human hepatocellular carcinoma by targeting STAT3[J].BiochemBiophysRescommun, 2013, 441(4): 873-79.
[27]Liu A M, Yao T J, Wang W, et al.Circulating miR-15b and miR-130b in serum as potential markers for detecting hepatocellular carcinoma: a retrospective cohort study[J].BMJOpen, 2012, 2(2): e000825.
[28]Zhang Y C, Xu Z, Zhang T F,et al. Circulating microRNAs as diagnostic and prognostic tools for hepatocellular carcinoma[J].WorldJGastroenterol, 2015, 21(34): 9853-62.
[29]Li L, Chen J, Chen X, et al.Serum miRNAs as predictive and preventive biomarker for pre-clinical hepatocellular carcinoma[J].CancerLett, 2016, 373(2): 234-40.
[30]Qi J, Wang J, Katayama H, et al.Circulating microRNAs (cmiRNAs) as novel potential biomarkers for hepatocellular carcinoma[J].Neoplasma, 2013, 60(2): 135-42.
[31]Okajima W, Komatsu S, Ichikawa D, et al.Circulating microRNA profiles in plasma: identification of miR-224 as a novel diagnostic biomarker in hepatocellular carcinoma independent of hepatic function[J].Oncotarget, 2016, 7(33): 53820-36.
[32]Fiorino S, Bacchi-Reggiani ML, Visani M, et al.MicroRNAs as possible biomarkers for diagnosis and prognosis of hepatitis B-and C-related-hepatocellular-carcinoma[J].WorldJGastroenterol, 2016, 22(15): 3907-36.
[33]Zhu H T, Hasan A M, Liu R B, et al.Serum microRNA profiles as prognostic biomarkers for HBV-positive hepatocellular carcinoma[J].Oncotarget, 2016,7(29):45637-48.
[34]Han Z B, Zhong L, Teng M J, et al.Identification of recurrence-related microRNAs in hepatocellular carcinoma following liver transplantation[J].MolOncol, 2012, 6(4): 445-57.
[35]Bouchie A.First microRNA mimic enters clinic[J].NatBiotechnol, 2013, 31(7): 577.
Research progress of relevance between miRNAs and hepatocellular carcinoma
SUN Jia-ling1, WEN Bin2,SUN Hai-tao1,CHEN Guan-xin1,HE Song-qi1
(1.CollegeofTraditionalChineseMedicine,SouthernMedicalUniversity,Guangzhou510515,China;2.DeptofTCM, 458HospitalofPLA,Guangzhou510602,China)
Hepatocellular carcinoma(HCC)is one of the most common malignancies worldwide. Due to the difficulty of diagnosis in the early stage of HCC, most HCCs are diagnosed in intermediate-advanced stage. Moreover, the high invasion, metastasis and recurrence rate of HCC result in the high mortality of HCC. MicroRNAs(miRNAs) are a class of highly conserved, endogenous, small, non-coding ,single stranded RNA with the length of 22 nucleotides. There are plentiful of miRNAs in liver. MiRNAs not only can regulate the growth and development of liver, but also are closely related to the formation of HCC. In the process of HCC formation, miRNAs could function as oncogenes or tumor suppressor genes to regulate multiple biological processes related to HCC, including cell differentiation,proliferation,tumorigenesis,angiogenesis,invasion,and metastasis. With the intensive study of molecular mechanisms of miRNAs in the process of HCC formation, increasingly studies have revealed that miRNAs could become sensitive biomarkers and effective therapeutic targets for HCC.
miRNAs;hepatocellular carcinoma;oncogenes;tumor suppressor genes;diagnosis;therapy
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.002.html
2016-10-26,
2016-12-07
国家自然科学基金资助项目(No 81573808);广东省中医药局资助项目(No 20151038)
孙嘉玲(1992-),女,硕士生,研究方向:中西医结合肝病,E-mail:1329043035@qq.com; 贺松其(1968-),男,医学博士,教授,主任医师,博士导师,研究方向:中西医结合肝病证的临床与实验,通讯作者,Tel:020-61648247,E-mail:hesongqijz@126.com
10.3969/j.issn.1001-1978.2017.04.001
A
1001-1978(2017)04-0445-05
R-05;R322.47;R342.2;R735.702.2;R735.704;R735.705