醇提香荚兰过程中理化指标和风味物质分析
2017-04-13金惠玉张彦军
李 娜,金惠玉,徐 飞,初 众,*,张彦军
(1.中国热带农业科学院香料饮料研究所,海南万宁 571533; 2.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨 150066; 3.国家重要热带作物工程技术研究中心,海南万宁 571533; 4.农业部香辛饮料作物遗传资源利用重点实验室,海南万宁 571533)
醇提香荚兰过程中理化指标和风味物质分析
李 娜1,2,金惠玉2,徐 飞1,3,4,初 众1,3,4,*,张彦军1,3,4
(1.中国热带农业科学院香料饮料研究所,海南万宁 571533; 2.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨 150066; 3.国家重要热带作物工程技术研究中心,海南万宁 571533; 4.农业部香辛饮料作物遗传资源利用重点实验室,海南万宁 571533)
为探索香荚兰浸提过程中理化指标及风味物质变化,采用乙醇常温浸提香荚兰,对不同浸提时间下浸提液的感官特性、理化指标、主要风味物质变化进行分析。结果表明:浸提液的综合感官评分由高到低为40 d>20 d>30 d>10 d>50 d。色泽随浸提时间延长逐渐加深,其中L*值呈现降低的趋势,a*、b*、c*值呈现增加的趋势。折光指数、相对密度和可溶性固形物含量随浸提时间延长整体呈上升趋势。香荚兰中4种主要风味物质(香草醛、香草酸、4-羟基苯甲醛和4-羟基苯甲酸)含量在浸提40 d时最高,分别为1.732%、0.2820%、0.1176%和0.0623%。香荚兰浸提过程中挥发性香气成分共检测出36种,其中浸提10、20、30、40、50 d的浸提液分别检测出15、27、15、23和20种。综合理化指标与风味物质检出结果得到乙醇常温浸提最佳时间为40 d,为香荚兰酊剂工业化生产提供理论依据。
香荚兰,浸提时间,香草醛,风味物质,理化指标

表1 感官指标评分表Table 1 The sensory index score table
香荚兰(VanillaplanifoliaAndrews)又名香草兰、香子兰、华妮拉,是热带香料植物,素有“食品香料之王”的美誉[1-2]。香荚兰鲜豆荚没有香味,但经发酵后含有250多种挥发性成分,其中香草醛被认为是最重要的香气成分,其相对含量占总挥发性成分的1/3左右[3]。香荚兰的乙醇浸提物称为酊剂,乙醇蒸干浓缩后称为浸膏,工业上一般以酊剂和浸膏的形式应用于高级食品、医药、化妆品、保健品等领域[4-6]。
目前,国内外对香荚兰的研究主要围绕萃取技术研究、主要风味成分研究等。其中Dong[7-8]比较了溶剂浸泡、超声提取、加压、微波提取技术下香草醛得率和提取物抗氧化性,结果显示微波法获得的香草醛时间最短、得率最高。同时检测了海南香荚兰豆荚中挥发性成分达105种,其中芳香族相对含量高达92.53%。李智[9]对溶剂浸提香荚兰进行优化,结果表明优化条件为:温度61.24 ℃、时间13.00 h、料液比4.50 g/100 mL,乙醇浓度81.15%,香草醛理论得率为4.14%。姜欣[10]对索氏抽提香荚兰进行优化,结果显示:温度100 ℃、时间20 h、乙醇浓度75%,香草醛理论得率为1.63%。赵建平[11]等对超临界CO2技术萃取香荚兰进行优化,结果表明:在压力41.10 MPa、时间180 min、提取温度50 ℃、夹带剂乙醇体积5.0 mL,20 g香荚兰获得香草醛理论产量177.21 mg。从研究结果显示,微波提取技术能加快从物料内部分离进入溶剂,但微波条件下热敏性挥发性物质损失较快[12]。而索氏抽提、超声提取、加压、超临界CO2等提取技术均具有物质溶出速度快,提取效率高等特点,但由于能耗较大,一直未能工业化应用[13-15]。
溶剂浸提法耗时较长,消耗溶剂量大,但其成本较低,工业操作简单,因此溶剂浸提仍是工业生产的主流技术[16]。且尚未见不同时间乙醇常温浸提下香荚兰理化特性及主要风味物质变化的研究报道。因此,本实验以发酵生香后的香荚兰豆荚为原材料,采用乙醇常温浸提技术。对不同浸提时间下感官特性、理化指标、风味物质变化进行分析,为香荚兰酊剂工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
香荚兰发酵豆荚 采用单元式热空气技术发酵生香制备,由中国热带农业科学院香料饮料研究所提供;香草醛、香草酸、4-羟基苯甲醛、4-羟基苯甲酸标准品 美国Sigma公司;色谱甲醇 默克股份两合公司;乙醇 食用级;冰乙酸 分析级;纯净水 深圳娃哈哈荣泰实业有限公司。
DMA4100密度计 奥地利安东帕有限公司;WF32-16MM颜色测定仪 威福光电科技有限公司;手持折光仪,手持糖度计 ATAGO公司;1260高效液相色谱仪、气相色谱-质谱仪 7890A-5975C 美国Agilent公司。
1.2 实验方法
1.2.1 香荚兰浸提液制备 参照李智[9]方法略做修改,准确称取4.50 g香荚兰粉末(过20目筛)于250 mL锥形瓶中,加入100 mL浓度为80%(v/v)乙醇充分混匀,室温密封浸提,定时摇匀,过滤取样。浸提时间分别为10、20、30、40和50 d后待测。
1.2.2 香荚兰浸提液感官评价方法 利用加权评分法进行人为感官评定,邀请10位从事香荚兰研究专业人员,利用闻香纸评定不同浸提时间下的浸提液,各因素权重分数与样品对应因素感官分数相乘后的和作为产品的综合得分。具体感官分析方法参照GB/T 14454.2-2008和文献[17]的方法进行,感官评分表如表1。
1.2.3 可溶性固形物含量分析 在20 ℃的温度条件下,准确移取0.3 mL浸提液滴于手持糖度计镜面上读数,每个样品平行测定5次。
1.2.4 折光指数分析 在20 ℃的温度条件下,准确移取0.3 mL浸提液滴于手持折光仪镜面上读数,每个样品平行测定5次。
1.2.5 相对密度测定 通过相对密度计(Anton Paar DMA4100)进行测定,吸取2 mL待测液,待温度达到20 ℃,开始测量,每个样品平行测定5次。
1.2.6 色泽的测定 用色差仪(WF32-16MM)进行测定,将10 mL待测样装入测量杯中。在颜色空间:CIE1976LAB、含光方式:SCI,颜色空间:D50(印刷),色差公式:△EHunter的条件下进行测定,每个样品平行测定5次。色泽主要参数有L*(亮度值)、a*(红绿值)、b*(黄蓝值)、c*(饱和度)、Hue(色调)、ΔE*(总色差)。ΔE*(总色差)是指香荚兰浸提液在浸提过程中色泽变化差异的重要指标,ΔE*越大表明色泽差异越大[18]。计算公式如下:ΔE*=(ΔL*2+Δa*2+Δb*2)1/2
1.2.7 主要风味物质含量分析 HPLC检测条件:根据卢少芳[19]的方法略作修改,色谱柱为ZORBAX XDB-C18柱(4.6 mm×150 mm,5 μm);进样量5 μL;流速1 mL/min;检测波长280 nm;柱温26 ℃;流动相:甲醇∶0.2%冰乙酸(v/v)=20∶80;外标法峰面积定量。
1.2.8 挥发性成分测定 样品制备:参照袁竹连[20]方法略做修改,取香荚兰浸提物10 mL于50 mL旋蒸瓶内,55 ℃下减压浓缩至干[21],分别用2 mL二氯甲烷复溶3次,无水硫酸钠脱水,过4.5 μm滤膜供GC-MS分析。
色谱条件:色谱柱为DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:起始温度50 ℃,以5 ℃/min的速率升温到100 ℃,然后以10 ℃/min的速率升温到150 ℃,再以5 ℃/min的速率升温到180 ℃,最后以1.5 ℃/min的速率升温到240 ℃并保持5 min;载气为高纯度He;流速1 mL/min;进样方式为不分流。

表3 不同浸提时间下样品香气、色泽、杂质度评定结果Table 3 The aroma,colour and impurities evaluation result of the the samples with different extraction time
质谱条件:电子轰击(EI)离子源;离子源温度230 ℃;四极杆温度150 ℃;接口温度280 ℃;扫描范围30~300 m/z。
定性定量分析:各组分按照GC-MS谱库(NIST 14,Mainlib,Replib)进行检索再与文献报道的DB-5 柱的保留指数(retention index,RI)值比对进行定性分析,采用峰面积归一化法对各组分进行定量分析。
保留指数计算公式:I=100z+100[TR(x)-TR(z)]/[TR(z+1)-TR(z)]
式中:I为保留指数(物质在柱上的保留指数可用两种紧靠它作为标准物的正构烷烃来表示),设其中一个碳数为z,另一个为z+1用TR(z)、TR(z+1)和TR(x)分别表示碳数z、z+1和待测组分x的保留时间,并使TR(x)正好处于TR(z)和TR(z+1)之间。
1.2.9 数据统计与分析 数据采用SPSS 20.0软件分析处理,采用Origin 8.5软件作图。
2 结果与分析
2.1 香荚兰浸提过程中感官特性分析
2.1.1 权重的确定 所谓权重是指该因素在整体评价中的影响,根据相对重要性对各个因素进行重要性比较[22],得到每个评委对各个因素所打的分数见表2。
2.1.2 加权评分 10位评委对不同浸提时间5种样品的香气、色泽及杂质度进行评分,评分标准参照表1。样品得分为各因素对应权重比重乘以得分的和相加,即10位评委评分和相加,满分100分,评分结果见表3。
样品评分结果为:浸提40 d(82.6)>20 d(81.8)>30 d(78.1)>10 d(76.3)>50 d(73.8)。可见从香气、色泽、杂质度三个因素综合评价最高分数为浸提40 d的浸提液。

表2 权重打分结果Table 2 The weighted score results
2.2 香荚兰浸提过程中理化指标分析
2.2.1 香荚兰浸提过程中色泽分析 表4是香荚兰在浸提过程中色度值(L*、a*、b*、c*、Hue)和总色差ΔE变化的参数,表中浸提液的亮度值L*、色调Hue随浸提时间的延长而降低,说明随着浸提时间的延长,浸提液浓度增加,大部分有效成分和色素类物质的萃取量也逐渐加大,使浸提液亮度变暗,颜色变深[23]。而a*、b*、c*呈现增长的趋势,说明浸提时间越长,颜色偏红光、偏黄光、饱和度增加。总体呈现棕褐色与赵建平[24]对豆酊色泽报道一致。ΔE*(总色差)是指香荚兰浸提液在浸提过程中色泽变化差异的重要指标,ΔE*越大表明色泽差异越大。从表4中看出随着浸提时间的延长,浸提液颜色差异较大,逐渐呈现变深,变暗的趋势。结果与感官评定较为一致。

表4 不同浸提时间样品色泽分析Table 4 The color analysis of the sample with different extraction time
注:表中同一色泽参数相同字母代表在p>0.05水平无显著性差异。表5同。
2.2.2 香荚兰浸提过程中相对密度、折光指数和固形物含量分析 折光指数、相对密度、可溶性固形物含量是检测浸提液的重要理化指标,王庆煌[25]等报道香荚兰豆酊折光指数与相对密度范围分别是1.3500~1.3800、0.8600~0.9380。表5所示,随着浸提时间的延长,浸提液的相对密度、折光指数、可溶性固形物都略有增加,相对密度和折光指数在浸提10~40 d时略有增加,表明溶液浓度在逐渐增大,当浸提时间到40 d时达到最大值,表明浸提液浓度达到最大值,40 d到50 d基本稳定不变,表明浸提液达到饱和状态且理化指标均在文献报道范围内。可溶性固形物含量整体呈上升趋势,由于可溶性固形物含量与折光指数成正相关,这也进一步验证了数据的可靠性。
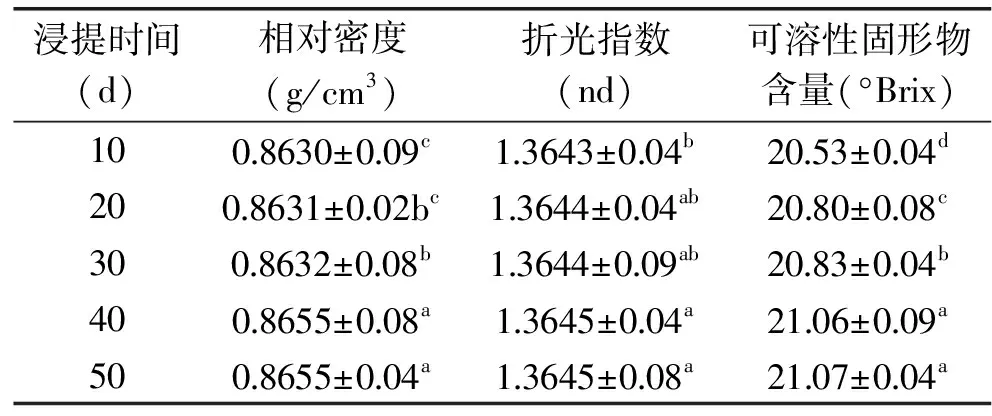
表5 不同浸提时间样品理化指标分析Table 5 The physical-chemical indexes analysis of sample at different extraction time
2.3 香荚兰浸提过程中风味物质变化分析
2.3.1 主要风味物质含量分析 传统冷浸提由于浸提时间长,陈化效应形成了多种复杂香气,香气饱满度高,操作简单,成本低廉故更适合工业化生产。香荚兰豆荚中主要风味物质是香草醛、香草酸、4-羟基苯甲醛、4-羟基苯甲酸,对香荚兰浸提液的整体香气起着重要的作用。香草醛是香荚兰中最主要的风味物质,对整体香气有高达1/3贡献率,在一定含水量条件下,香草醛含量通常为1.0%~5.0%[26]。图1所示香荚兰在浸提过程中四种主要风味物质含量变化,香草醛含量在浸提10~40 d时逐渐升高并在40 d时达到最大值为1.732%,在浸提50 d时含量略有下降,表明浸提时间越长浸提液中香草醛相对含量越高,而达到一定浸提时间后香草醛含量将不再增加,但提取时间过长,非但不能提高提取率,反而会增加提取液中杂质的含量。
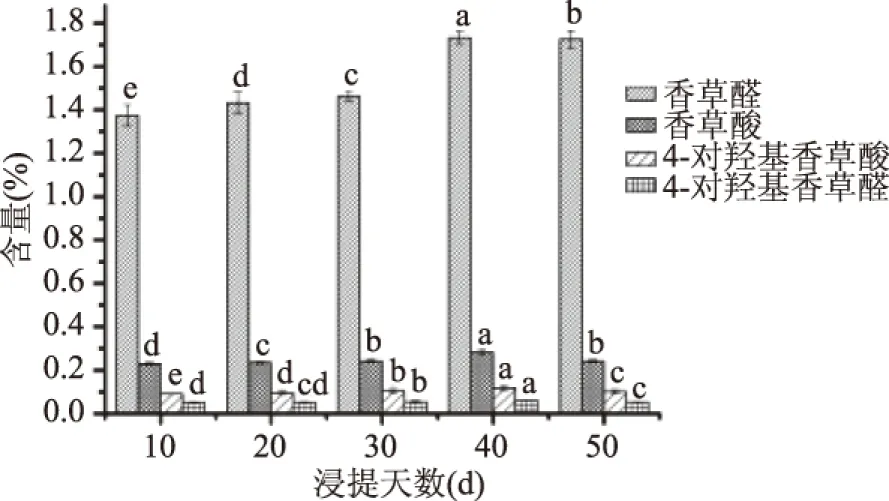
图1 香荚兰浸提液中4种主要风味物质的相对含量Fig.1 The contents of four main flavor substances in vanilla extraction注:图中同一物质含量相同字母代表在p<0.05水平无显著性差异。
香草酸、4-羟基苯甲醛、4-羟基苯甲酸含量均呈现先升高后下降的趋势,可能是由于浸提时间过长导致微量挥发性香气物质有部分损失,但均在浸提40 d时达到最大值其含量分别为0.2820%、0.1176%、0.0623%,比浸提10 d含量分别增加0.0518%、0.0276%、0.0117%,表明浸提效果显著。四种物质含量总和在浸提10、20、30、40、50 d分别为1.7460%、1.8155%、1.8642%、2.1944%、2.1213%。结果表明在浸提40 d时四种主要风味物质含量总和达到最大值。
2.3.2 挥发性成分分析 GC-MS色谱与质谱联用,既能高效分离化合物又能对其进行定性。张辉[27]等检测香荚兰浸提液中挥发性成分为19种。通过GC-MS对香荚兰不同浸提时间的浸提液中挥发性成分进行分析,共检测出36种挥发性成分(表6),其中浸提10、20、30、40、50 d的浸提液分别检测出15、27、15、23和20种。利用面积归一法进行定量分析,含量较高的物质有香草醛、亚油酸、4-乙氧基苯酚、对甲氧基苯甲醛、4-(乙氧基甲基)-2-甲氧基苯酚、十六酸、顺式-十八碳烯酸、十八酸、(z)-油酸酰胺,其中含量最多的为香草醛。香荚兰中除了高含量物质外,微量挥发性成分也同样影响整体香气,如愈创木酚(特殊芳香味)、5-羟甲基糠醛(甘菊花甜香气味)、三乙酸甘油酯(果味和肉甜香味)等挥发性成分也对香荚兰浸提液的整体香气起着重要的作用[28-29]。这些挥发性成分含量较少,但在浸提40 d的浸提液中均能检测到,表明其整体香气较好。

表6 香荚兰浸提液挥发性成分Table 6 5 Aroma volatile compounds of different levels vanilla pods
注:*.RI参考值通过数据库(www.odour.org.uk数据库)和文献报道来确定[30-32];-.未检测到。

表7 各类化合物的种类及相对含量Table 7 Relative contents and species of different types of compounds
对不同浸提时间的浸提液检测出挥发性成分进行分类总结如表7所示,浸提10 d的浸提液中检测出芳香族3种、醛类2种、酮类1种、酸类5种、醇类0种、杂环1种、烷烃0种和酯类3种;20 d浸提液依次为4种、3种、1种、9种、3种、1种、2种、4种;30 d浸提液依次为2种、2种、1种、5种、0种、1种、0种、4种;40 d浸提液依次为3种、3种、1种、7种、2种、1种、0种、6种;50 d浸提液依次为2种、2种、1种、8种、1种、1种、0种、7种。醛类化合物在香料香味中占有重要地位,具有令人愉快的香气(如香草醛、对甲氧基苯甲醛、5-羟甲基糠醛等),醛类化合物在相对含量方面有明显优势,在10、20、30、40、50 d的浸提液中相对含量分别是74.00%、75.95%、65.95%、63.56%、51.06%。香荚兰中某些小分子酸、酮、醇类物质呈现出黄油味或植物味(如香草酸、对羟基苯甲醇、6,10,14-三甲基-2-十五烷酮等)。酯类则主要来源于香荚兰浸提过程中酸与醇的相互作用,酯类化合物含量越高香荚兰浸提液整体风味越好。烷烃类化合物主要是大分子类物质,不易挥发,因而对香草兰香气贡献不大。综合分析,浸提40 d的浸提液挥发性呈香(醛、醇、酯)类化合物较多而不挥发性的大分子(烷烃)化合物较少。
综上所述,不同浸提时间的香荚兰浸提液中挥发性物质有所不同,这主要是当浸提时间过短浸提不完全,只能浸提出部分挥发性物质;当浸提时间过长时,部分微量挥发性物质容易损失。
3 结论
对香荚兰浸提过程中感官特性、理化指标、主要风味物质及挥发性成分变化进行分析。结果表明:
浸提液感官评定得出样品得分由高到低:浸提40 d>20 d>30 d>10 d>50 d。色泽随浸提时间的延长总体颜色变暗,颜色偏红光、偏黄光、呈现棕褐色,不同浸提时间下颜色差异较大。浸提液折光指数、相对密度、可溶性固形物含量随浸提时间的延长整体呈上升的趋势。
对香荚兰中4种主要物质含量进行分析,均得到在浸提40 d时香草醛、香草酸、4-羟基苯甲醛和4-羟基苯甲酸含量较高分别为1.732%、0.2820%、0.1176%和0.0623%。
GC-MS分析浸提液中挥发性成分,结果显示浸提10、20、30、40、50 d中分别检出15、27、15、23种和20种挥发性物质,其中醛类化合物相对含量较高,分别为74.00%、75.95%、65.95%、63.56%和51.06%。
综上分析,在实验范围内,香荚兰浸提液在感官评定、理化指标、主要风味分析均显示在浸提40 d时效果较好,主要风味物质相对含量较高、挥发性物质种类较多。
[1]Bernd Schwarz,Thomas Hofmann. Identification of Novel Orosensory Active Molecules in Cured Vanilla Beans(Vanilla planifolia)[J].Journal of Agricultural and Food Chemistry,2009,57(9):3729-3737.
[2]陈庆文,郭运青. 海南香草兰产业发展概况[J]. 热带农业科学,2010,30(7):61-64.
[3]董智哲. 香草兰挥发性成分鉴定及提取研究[D]. 武汉:华中农业大学,2014.
[4]Duran S,Karran P. Vanillins:A novel family of DNA-PK inhibitors[J]. Nucleic Acids Research,2003,31(19):5501-5512.
[5]Fenglin G,XU F,Tan LH,et al. Optimization of enzymatic process for vanillin extraction using response surface methodology[J]. Molecules,2012,17(8):8753-8761.
[6]宋应辉,王庆煌,赵建平,等. 香草兰产业化综合技术研究[J].热带农业科学,2006,26(6):43-46.
[7]董智哲,谷风林,徐飞,等. 固相微萃取和同时蒸馏萃取法分析海南香草兰挥发性成分[J]. 食品科学,2014,35(2):158-163.
[8]Dong Z,Gu F,Xu F,et al. Comparison of four kinds of extraction techniques and kinetics of microwave-assisted extraction of vanillin from Vanilla planifoliaAndrews[J]. Food Chemistry,2014,149(15):54-61.
[9]李智. 海南香草兰豆挥发性成分分析及溶剂提取研究[D]. 哈尔滨:黑龙江东方学院,2015.
[10]姜欣.香草兰浸膏制备及酶促生香研究[D].海口:海南大学,2010.
[11]赵建平,谭乐和,宋应辉,等. 均匀设计优化香草兰中香兰素的超临界萃取工艺[J]. 热带农业学报,2009,30(6):878-882.
[12]Xie J H,Xie M Y,Shen M Y,et al. Optimization of microwave-assisted extraction of polysaccharides fromCyclocaryapaliurus(Batal.)lljinskaja using response surface methodology[J]. Journal of the Science of Food and Agriculture,2010,90(8):1353-1360.
[13]尹凤交,赵改菊,王成运,等. 国内超临界 CO2萃取技术工业化现状及存在问题[J]. 干燥技术与设备,2014,12(4):32-34.
[14]Chen W,Huang Y,Qi J,et al. Optimization of ultrasound-assisted extraction of phenolic compounds from areca husk[J]. Journal of Food Processing and Preservation,2014,38(1):90-96.
[15]Jadeja G C,Naik S N,Maheshwari R C. Pressurized liquid extraction of natural flavour fromvanilla planifoliaandrews. 10th International Symposium on Supercritical Fluids San Francisco,CA,USA,2012.
[16]Jadhav D,Rekha B N,Gogate P R,et al. Extraction of vanillin from vanilla pods:A comparison study of conventional soxhlet and ultrasound assisted extraction[J]. Journal of Food Engineering,2009,93(4):421-426.
[17]陈建华,张晓峰,翁少伟,等.香荚兰豆酊热提工艺、原料产地研究及成分分析[J]. 香精香料化妆品,2015,12(1):17-21.
[18]CHOI M H,KIM G H,LEE H S. Effects of ascorbic acid retention on juice color and pigment stability in blood orange(Citrus sinensis)juice during refrigerated storage[J]. Journal of Food Research International,2002,35(8):753-759.
[19]卢少芳,初众,赵建平. 反相高效液相色谱法检测香草兰豆酊、浸膏中香兰素[J].热带作物学报,2009,30(10):543-1545.
[20]袁竹连,张贞发. 巴马神酒香气成分的GC-MS分析[J]. 南方农业学报,2013(5):833-837.
[21]吴立军. 天然药物化学实验指导[Z]. 人民卫生出版社,2011.
[22]初众,李智,张彦军,等. 香草兰豆挥发性香气成分比较研究与电子感官图谱绘制[J]. 热带作物学报,2015,36(11):2099-2107.
[23]黎春怡,温娴,黄卓烈. 洋紫苏红色素的提取和理化性质研究[J]. 广东农业科学,2015,42(9):88-92.
[24]赵建平,王庆煌,宋应辉,等. 香草兰产业开发与应用配套技术研究成果[J]. 热带农业科学,2006,26(6):38-42.
[25]王庆煌. 热带作物产品加工原理与技术[M]. 科学出版社,2013.
[26]Gu F,Chen Y,Fang Y,et al. Contribution of Bacillus Isolates to the Flavor Profiles of Vanilla Beans Assessed through Aroma Analysis and Chemometrics.[J]. Molecules,2015,20(10):18422-18436.
[27]张辉,熊国玺,喻世涛,等. 不同提取方法对香荚兰挥发性成分的影响[J]. 香料香精化妆品,2014(2):12-16.
[28]Brunschwig C,Senger-Emonmot P,Aubanel M L,et al. Odor-active compounds of Tahitian vanilla flavor[J]. Food Research International,2012,46(1):148-157.
[29]Dignum M J W,Kerler J,Verpoorte R. Vanilla curing under laboratory conditions[J]. Food Chemistry,2002,79(2):165-171.
[30]Marisa S,Laura V,Antonio M. Volatile composition and descriptive sensory analysis of Italian vanilla torrone[J]. International Journal of Food Science and Technology,2010,45(8):1586-1593.
[31]Takahashi M,Inai Y,Miyazawa N,et al. Identification of the Key Odorants in Tahitian Cured Vanilla Beans(Vanilla tahitensis)by GC-MS and an Aroma Extract Dilution Analysis[J]. Bioscience,biotechnology,and biochemistry,2013,77(3):601-605.
[32]李智,初众,姚晶,等. 海南产不同等级香草兰豆挥发性成分分析[J]. 食品科学,2015,36(18):97-102.
Analysis of physico-chemical indicator and flavor substances in vanilla extraction process by ethanol
LI Na1,2,JIN Hui-yu2,XU Fei1,3,4,CHU Zhong1,3,4,*,ZHANG Yan-jun1,3,4
(1.Spice and Beverage Research Institute,Chinese Academy of Tropical Agricultural Sciences,Wanning 571533,China; 2.Department of Food and Environmental Engineering,East University of Heilongjiang,Harbin 150066,China; 3.National Center of Important Tropical Crops Engineering and Technology Research,Wanning 571533,China; 4.Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture,Wanning 571533,China)
In order to explore the physical and chemical indicators and flavor changes in vanilla extraction,the sensory characteristics,physico-chemical indexes and the main flavor substances of vanilla extraction were analyzed under different time and room temperature. The results showed that the comprehensive sensory scores of the extract were 40 d>20 d>30 d>10 d>50 d,successively. The color was gradually deepened when extraction time was extended. TheL*value was gradually reduced,a*,b*,c*value tended to be increased with prolonged extraction time. Refractive index,density and soluble solids content showed overall upward trend of vanilla extraction with prolonged extraction time. The four main flavor substance of vanilla extraction reached maximum when extracted time reached to 40 days,and(Vanillin,Vanillic acid,4-hydroxy benzaldehyde,4-hydroxybenzoic acid)the content were 1.732%,0.2820%,0.1176% and 0.0623%,respectively. 36 kinds of volatile aroma components were detected in extraction process. 15,27,15,23 and 20 compounds were detected in extraction time of 10d,20d,30d,40d and 50d,respectively. The best ethanol extraction time was 40 days at room temperature according to comprehensive physico-chemical index and flavor compounds detection results. The results provided theoretical basis for vanilla extraction industrialized production.
vanilla;extraction time;vanillin;flavor substances;physico-chemical indexes
2016-10-19
李娜(1993-),女,硕士研究生,研究方向:食品工程,E-mail:744652538@qq.com。
*通讯作者:初众(1981-),男,硕士,副研究员,研究方向:食品工程,E-mail:cz809@163.com。
中国热带农业科学院院本级基本科研业务费专项(1630142016001,1630142016002)。
TS255.1
A
1002-0306(2017)07-0299-07
10.13386/j.issn1002-0306.2017.07.050
