罗勒精油的微波辅助提取工艺及其抑菌效果研究
2017-04-13刘经伦李晓娇
艾 薇,刘经伦,李晓娇
(保山学院 资源环境学院,云南保山 678000)
罗勒精油的微波辅助提取工艺及其抑菌效果研究
艾 薇,刘经伦,李晓娇
(保山学院 资源环境学院,云南保山 678000)
采用微波辅助提取罗勒精油,优化了实验条件对精油得率的影响。在单因素实验的基础上,通过正交实验对提取工艺进行优化。将所得精油作为抑菌剂,结合滤纸片法和二倍稀释法,确定了罗勒精油的抑菌活性和最低抑菌浓度(MIC)、最低杀菌浓度(MBC)。结果表明:选用粗粉碎干料罗勒,在料液比1∶16 g/mL,NaCl浓度4%,浸泡时间6 h,微波功率567 W,微波时间120 s的条件下,罗勒精油的最佳得率为0.3758%(n=3)。罗勒精油对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌均有抑制作用,最低抑菌浓度分别为31.25、62.5、125 μg/mL,最低杀菌浓度分别为31.25、125、500 μg/mL,表明抑菌作用大小为:大肠杆菌(E.coli)>枯草芽孢杆菌(B.subtilis)>金黄色葡萄球菌(S.auTeus)。该研究为罗勒的综合利用与开发提供了理论依据。
罗勒,精油,微波辅助提取,抑菌效果
罗勒(OcimumbasilicumLinn)为唇形科罗勒属一年生芳香草本植物,又名甜罗勒、九层塔、丁香等[1]。罗勒分布于热带和温带地区[2],因其药食兼用的特性,被广泛的用于各少数民族食物烹制和药材使用。在云南,罗勒别名转转香、帕友新(傣语),是傣族、景颇族不可缺少的一种调味料,在傣味食材中用于熟食或作凉拌。在维药和中医理论中,罗勒也用于疏风解表、化湿和中、行气活血、解毒消肿等[3-4]。近几年关于罗勒药理研究表明罗勒提取物具有抗炎杀菌、抗病毒、抗血栓形成、抗肿瘤转移、抗氧化、降血糖、降血脂等作用[2-3,5],以鲜嫩花叶最佳,味辛,性温。
经查阅文献,对罗勒的研究集中在引种栽培[6]、化学成分[7]、药理[3,5]、黄酮提取[4,8]、多糖提取[9]及肿瘤治疗[10]等几个方面,而在罗勒精油提取方面的研究报道很少。张文成等[11]研究表明,分别采用水蒸气蒸馏法和SFC-CO2萃取,罗勒挥发油的出油率和主要成分差异都较大。任吉君等[12]探索出SFC-CO2萃取罗勒芳香油的最优条件为阴干与萃取压力15 MPa。曹维金等[13]研究表明,3种罗勒子油提取法:溶剂浸出法、索氏抽提法和氯仿-甲醇法中,氯仿-甲醇法提取率最高、提取时间最短。国外学者对采自伊朗的两种人工种植的罗勒挥发油进行分析,结果显示含量最高的皆为甲基胡椒酚[14];也有国外学者报道罗勒中含有菊苣酸、迷迭香酸、咖啡酸[15]。Jamal等[16]研究表明,花和叶的组织中酚酸主要为迷迭香酸。近年来植物精油具有良好的抑菌抗炎活性,且较化学抑菌剂具有副作用和残留毒性小的优势,进而使其在抑菌研究方面得到了广泛的关注,而用微波辅助提取罗勒精油并研究其抑菌活性却没有报道。本文采用微波辅助的方法提取罗勒枝叶干料中的精油,且以精油得率为指标,采用L9(34)正交表进行实验,确定最佳工艺参数,并在此基础上对其抑菌效果进行研究,旨在为精油的深加工及药理作用提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
罗勒 原料购于保山市农贸市场,经洗净放阴凉处风干,用粉碎机粉碎,再用密封袋密封保存备用;二甲亚砜、无水乙醇、蛋白胨、氯化钠、乙醚、硫酸镁 分析纯,国药集团化学试剂有限公司;大肠埃希氏菌Escherichiacoli标准菌株ATCC25922,金黄色葡萄球菌Staphylococcusaureus标准菌株ATCC259226538,枯草芽孢杆菌Bacillussubtilis标准菌株ATCC6633 广东微生物菌种保藏中心。
Q/OANN 10-2008电子天平 奥豪斯仪器上海有限公司;G70F20N2L-DG(SO)微波炉 格兰仕微波炉电器有限公司;LDZX-75KB立式压力蒸汽灭菌器 上海申安医疗器械厂;HZQ-X100A恒温培养箱、HZQ-F160A高低温恒温振荡培养箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 精油得率的计算 根据杨艳等[17]采用微波辅助水蒸气蒸馏法提取孜然精油工艺的研究,本研究采用类似的工艺流程,略作改动。称取罗勒枝叶粉末20 g,料液比1∶20(m∶v,g/mL,下同)浸泡在4% NaCl溶液中2 h,微波功率为567 W,辅助加热120 s,水蒸气蒸馏法提取罗勒精油,用乙醚萃取。罗勒精油的得率参考何君等[18]的计算方法,即:
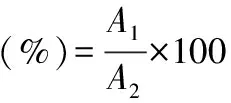
式中:A1-提取精油的质量,g;A2-罗勒枝叶粉末的质量,g。
1.2.2 单因素实验 称取罗勒枝叶粉末20 g,以罗勒精油得率为考察指标,固定料液比为1∶20 g/mL,NaCl浓度为4%,浸泡时间为2 h,微波功率为567 W辅助加热120 s,依次对其进行不同水平的NaCl浓度(2%、3%、4%、5%、6%)、浸泡时间(2、4、6、8、10 h)、料液比(1∶16、1∶18、1∶20、1∶22、1∶24 g/mL)、微波功率(126、252、406、567、700 W)、微波时间(60、90、120、150、180 s)的单因素实验,测定方法同 1.2.1。
1.2.3 最优工艺条件的选择 通过单因素实验的结果分析,筛选了浸泡时间、料液比、微波功率、微波时间等因素进行优化(正交实验的各因素及其水平见表1),建立L9(34)的正交实验,确定罗勒精油提取的最优工艺条件参数。
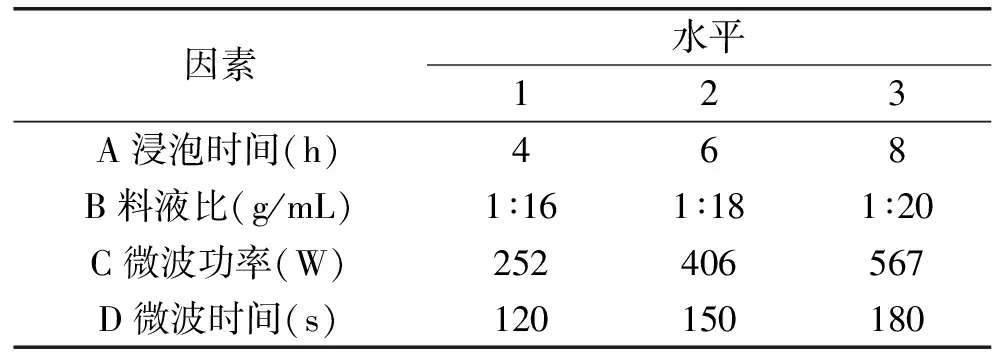
表1 正交实验因素及水平Table 1 Factor and levels of orthogonal experiment
1.2.4 精油抑菌实验
1.2.4.1 菌种活化及菌悬液的制备 用接种环挑取适量的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌于LB液体培养基中进行活化,37 ℃培养24 h。挑取一环已活化的菌苔放入100 mL无菌生理盐水中,摇匀菌悬液,150 r/min振荡培养,37 ℃培养24 h。
1.2.4.2 不同浓度罗勒精油的制备 用二倍稀释法[19]配制不同浓度罗勒精油。称取2000 μg罗勒精油,用二甲亚砜制备1000 μg/mL的精油溶液,采用二倍稀释法稀释为以下几个浓度:1000、500、250、125、62.5、31.25、15.625 μg/mL。放置冰箱中冷冻保存,备用。
1.2.4.3 不同罗勒精油浓度对3种细菌抑制活性实验 滤纸片法[20]测定抑菌活性,每皿设计四片滤纸片。纸片法判定标准[21]:极敏:抑菌圈直径>20 mm;高敏:抑菌圈直径15~19 mm;中敏:抑菌圈直径10~15 mm;低敏:抑菌圈直径<10 mm。具体方法如下:用无菌的移液枪吸取0.1 mL菌悬液至已冷却的LB固体培养基中,用无菌涂布器均匀涂布,晾干后,将3片浸入不同浓度的罗勒精油,直径为6 mm的圆形无菌滤纸片,等距离放置于培养基中,以二甲亚砜作空白对照组。细菌的培养条件参照1.2.4.1,如有抑菌圈说明对供试菌具有抑菌作用,无抑菌圈则说明对供试菌无抑菌作用。
1.2.4.4 最低抑菌浓度(MIC)测定和最低杀菌浓度(MBC)测定 将制备好的罗勒精油浓度1000、500、250、125、62.5、31.25、15.625 μg/mL的溶液用滤纸片法测定精油的最低抑菌浓度和最低杀菌浓度,具体方法参照1.2.4.3,重复三次,取平均值。细菌置于37 ℃下培养24 h,以完全没有菌生长的最低浓度作为该精油的最低抑菌浓度(MIC)[22]。把上述没有长菌的培养皿继续培养48 h后观察,以完全无菌生长的浓度为最低杀菌浓度(MBC)[22]。
2 结果与分析
2.1 罗勒精油的单因素实验
2.1.1 NaCl浓度对罗勒精油得率的影响 如图1所示,随着NaCl浓度的增加,罗勒精油得率也相对增加,但是当NaCl浓度超过4%,精油得率就开始减少。加入NaCl溶液能够增大植物细胞内外渗透压差,使精油能够容易溶出,也可能对精油挥发性及溶解性有一定的影响[18],所以NaCl浓度控制在4%左右较合适。

图1 NaCl浓度对罗勒精油得率的影响Fig.1 Effect of concentration of NaCl on extraction yield of essential oil注:标注不同字母表示数据有显著差异(p<0.05),图2~图5同。
2.1.2 浸泡时间对罗勒精油得率的影响 如图2所示,在一定浸泡时间内,精油得率有所增加,浸泡时间为8 h时达到最大值0.39%,当浸泡时间超过这个时间段,精油得率反而减少。这是由于精油具有挥发性,长期暴露在空气中易挥发。因此,浸泡时间在4~8 h左右精油得率较高。
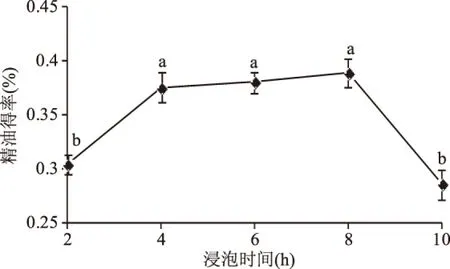
图2 浸泡时间对罗勒精油得率的影响Fig.2 Effects of soaking time on extraction yield of essential oil
2.1.3 料液比对罗勒精油得率的影响 如图3所示,在其他因素不变的情况下,料液比在1∶16~1∶20之间精油得率增加缓慢;当料液比增大到1∶20后,得率急剧减少;在料液比为1∶20时,罗勒精油得率为0.30%,达到最大值。随着料液比的增大,精油得率逐渐增大,由于渗入细胞内的水分迅速升温,使细胞内压急剧增大,导致细胞破裂,使水蒸汽更容易将精油带出;但随着料液比进一步增加,得率下降,同时增加能耗和时间,液面厚度可能一定程度上影响了微波的吸收[17]。因此罗勒精油提取的料液比控制在1∶20。
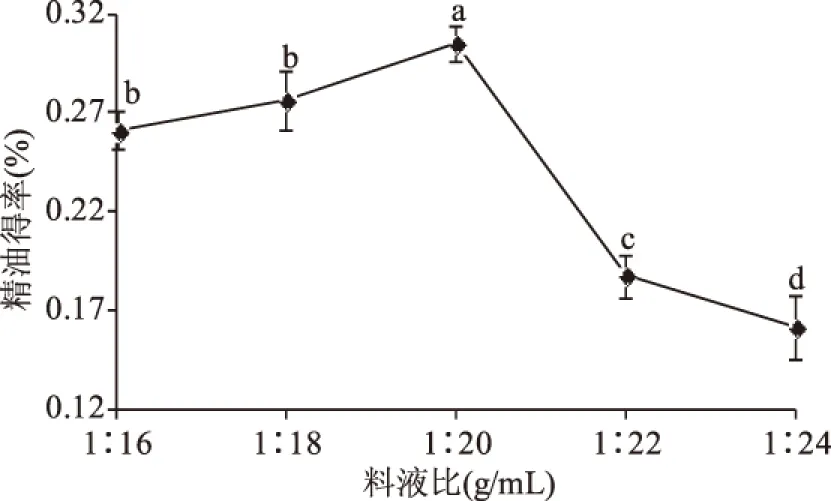
图3 料液比对罗勒精油得率的影响Fig.3 Effects of solid-liquid ratio on extraction yield of essential oil
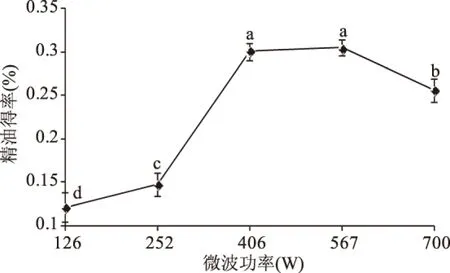
图4 微波功率对罗勒精油得率的影响Fig.4 Effects of microwave power on extraction yield of essential oil
2.1.4 微波功率对罗勒精油得率的影响 如图4所示,微波功率为126~252 W时无明显变化,当微波功率增大到406 W时急剧增大,在567 W时达到最大值,超过567 W提取率又开始降低。这是因为外加电场作用增强,微波引起的极性分子如水的极化作用增强,此时,分子热运动动能增大,可以在较短的时间内得到精油;但随着功率继续增大,得率下降,溶液中物质也可能容易发生氧化分解[17]。因此,微波功率在567 W时精油得率最佳。
2.1.5 微波时间对罗勒精油得率的影响 如图5所示,随着微波时间的增长(60~120 s),精油得率开始增加,达到120 s时罗勒精油的得率到达最高点,继续延长微波时间,精油得率又开始逐渐下降。这可能是由于微波对罗勒细胞具有破膜作用,处理时间长,罗勒细胞破膜速度增大,罗勒精油得率增加,当微波处理时间超过120 s时,罗勒细胞被破坏强烈,导致精油乳化现象严重,且由于细胞膜的破坏,导致杂质进入到精油中,因此得率下降[23]。因此,微波时间在120 s时用微波辅助水蒸汽蒸馏法提取罗勒精油的得率最佳。
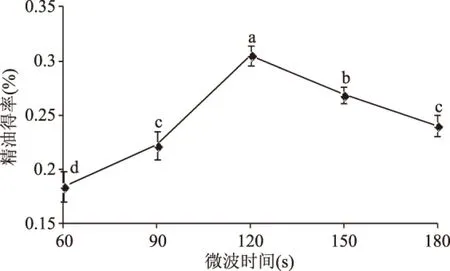
图5 微波时间对罗勒精油得率的影响Fig.5 Effects of microwave time on extraction yield of essential oil
2.2 正交实验优化罗勒精油提取工艺
由表2可得,从罗勒精油提取得率的直观分析结果看,最佳工艺为5号实验A2B2C3D1,但从极差分析可知罗勒精油提取的最优工艺方案为:A2B1C3D1。为此,在相同条件下,对A2B2C3D1和A2B1C3D1分别进行3次重复性验证实验,实验结果表明,罗勒精油的平均出油率分别为0.3698%和0.3758%,由此可得微波辅助蒸馏法提取罗勒精油最优工艺组合A2B1C3D1,即浸泡时间6 h,料液比1∶16,微波功率567 W,微波时间120 s。在此提取条件下,罗勒精油得率达到最大值。
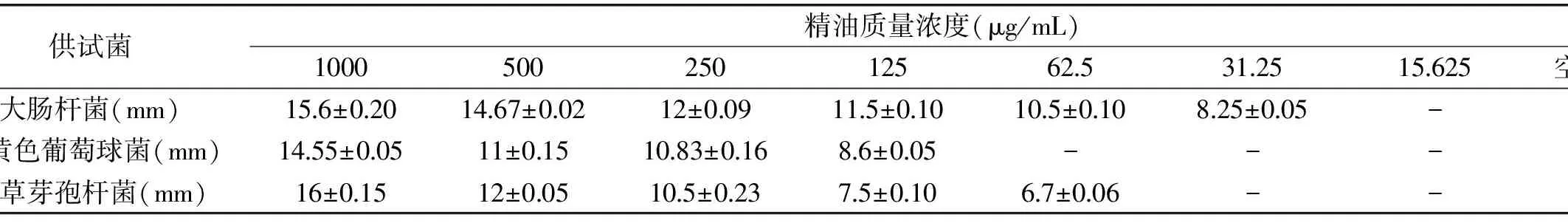
表4 不同浓度罗勒精油的抑菌活性Table 4 The antimicrobial activity of essential oil
注:“-”表示无抑菌作用。

表5 罗勒精油对细菌的最低抑菌浓度(MIC)Table 5 The minimum inhibitory concentration(MIC)of essential oil
注:+表示有抑菌作用,有抑菌圈;-表示无抑菌作用,表6同。
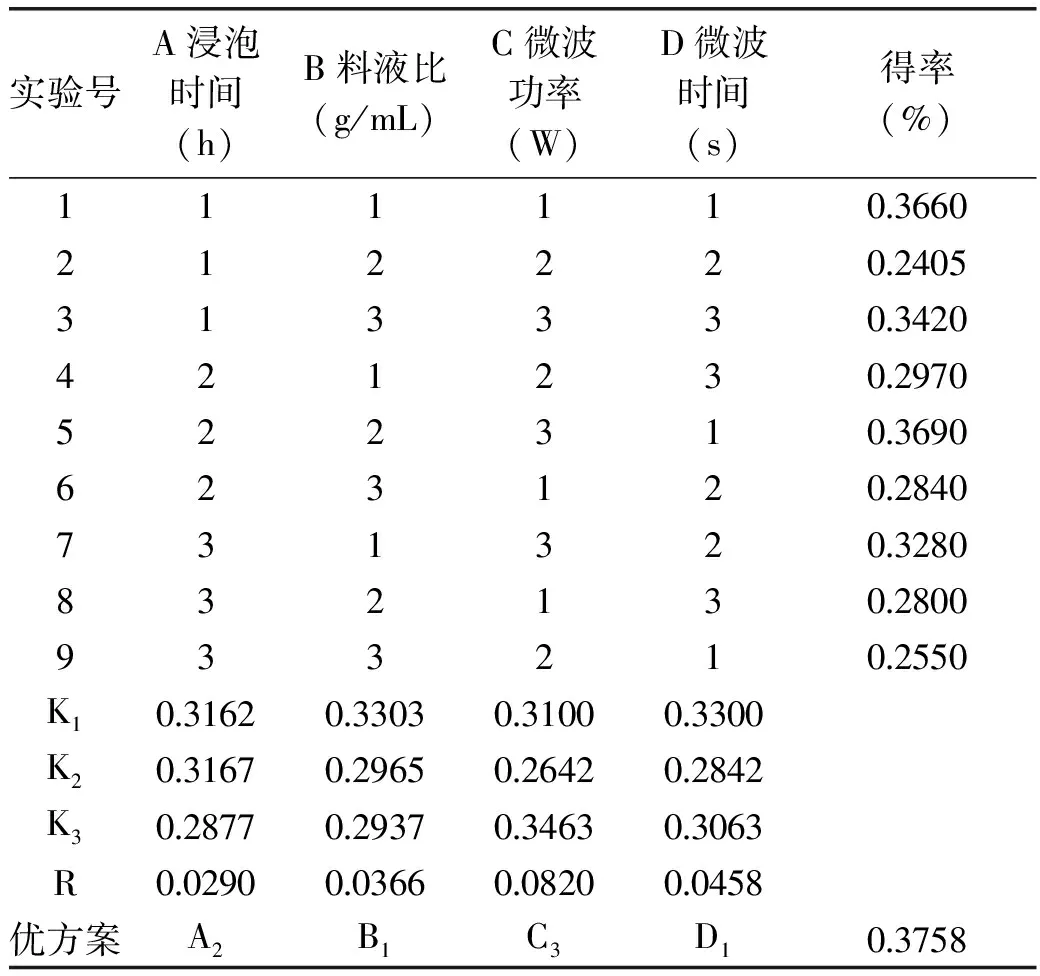
表2 正交实验及结果分析表Table 2 Results and analysis of orthogonal experiment
注:K1,K2,K3分别是同一水平罗勒精油得率平均值,R极差为同一水平因素的最小值与最大值之间的差。
2.3 正交实验方差分析
由表3可见,以精油得率为考察指标,经方差分析可得,FA、FB、FC、FD均小于F0.05=4.460,说明浸泡时间、料液比、微波功率和微波时间对精油得率的影响不显著,其中综合评价极差大小结果显示影响罗勒精油得率的因素顺序为C>D>B>A,即微波功率>微波时间>料液比>浸泡时间。
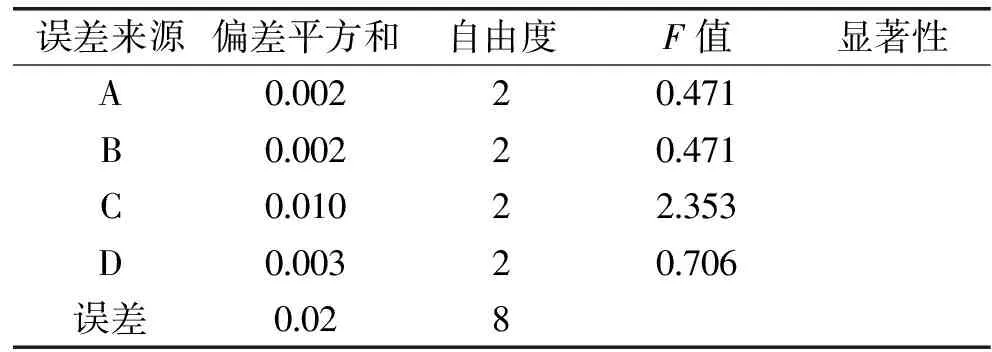
表3 正交实验结果方差分析Table 3 Variance analysis of orthogonal array design
2.4 罗勒精油抑菌实验结果
2.4.1 罗勒精油对3种不同细菌的抑菌活性测定结果 不同浓度的罗勒精油对3种细菌均出现了大小不等的抑菌圈。由表4可知,对于大肠杆菌,罗勒精油浓度为1000 μg/mL时为高敏,精油浓度为500~62.5 μg/mL时为中敏,精油浓度为31.25 μg/mL为低敏;对于金黄色葡萄球菌,精油浓度为1000~250 μg/mL时为中敏,精油浓度为125 μg/mL为低敏;对于枯草芽孢杆菌,精油浓度为1000 μg/mL时为高敏,精油浓度为500~250 μg/mL时为中敏,浓度为125~62.5 μg/mL时为低敏。测定结果表明,罗勒精油对大肠杆菌的抑菌效果最好,其次是枯草芽孢杆菌和金黄色葡萄球菌。
2.4.2 最低抑菌浓度的测定(MIC) 由表5可知,罗勒精油对金黄色葡萄球菌,枯草芽孢杆菌和大肠杆菌都有一定的抑菌作用,最低抑菌浓度分别为125,62.5,31.25 μg/mL。
2.4.3 最低杀菌浓度的测定(MBC) 表6列出了三种供试菌在不同精油浓度下生长状况和MBC值。从表6中可以看出,罗勒精油对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌都表现出一定的杀菌能力,尤其对大肠杆菌表现出了强烈的杀菌能力,MBC值为31.25 μg/mL。

表6 罗勒精油对细菌的最低杀菌浓度(MBC)Table 6 The minimum bactericidal concentration(MBC)of essential oil
3 结论
本实验采用微波辅助水蒸气蒸馏法提取罗勒精油,通过单因素实验及正交实验的验证,最终确定了微波辅助水蒸气蒸馏法提取罗勒精油的最优工艺是:浸泡时间6 h,料液比1∶16,微波功率567 W,微波时间120 s,选用干料粗粉碎罗勒,在促溶剂4% NaCl溶液浸泡的条件下,进行重复性实验并整理计算得出精油平均得率为0.3758%(n=3)。由罗勒精油抑菌活性测定实验得出,罗勒精油对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌都有一定的抑制作用,抑菌效果从大到小的顺序为:大肠杆菌(E.coli)>枯草芽孢杆菌(B.subtilis)>金黄色葡萄球菌(S.auTeus),不同浓度的罗勒精油对三种细菌的抑制作用不同,并与浓度成正比。该抑菌实验结果与丁华等对罗勒精油抑菌实验的结果相同,罗勒精油对大肠杆菌与金黄色葡萄球菌均具有强效抑菌作用[22]。陆占国等在对黑龙江培育的白花罗勒花精油抑菌活性的研究上也得到了类似的结论,罗勒花精油抑制细菌的生长活性大小顺序为:大肠杆菌>白色葡萄球菌>枯草芽孢杆菌[24]。近年来,精油的抗菌性被很多学者所研究,越来越得到人们的重视与关注,在云南罗勒作为少数民族不可缺少的调味品,是傣味中的重要食材,具有独特的发展前景。
[1]中国科学院中国植物志编委会,中国植物志[M]. 北京:科学出版社,1977,66:561-564.
[2]官玲亮,吴丽芬,庞玉新,等. 芳香植物罗勒的研究进展[J].热带农业科学,2013,33(8):42-46.
[3]杨志杰,李秀丽. 中药罗勒的研究进展[J].世界中医药,2013,8(8):976-978.
[4]米娜瓦尔·哈帕尔,艾尼瓦尔·吾买尔,阿孜古丽·吐尔逊,等. 维药罗勒提取物中总黄酮含量及其抗氧化活性研究[J].新疆医科大学学报,2012,35(6):736-739.
[5]董泽科,徐先祥,吴雅清,等. 罗勒的化学成分和药理作用研究进展[J]. 中国民族民间医药,2013,22(9):46-48.
[6]王文翠,但忠,木万福,等. 罗勒的适应性研究及开发价值[J]. 香料香精化妆品,2012(1):21-24.
[7]尹锋,胡立宏,楼凤昌. 罗勒化学成分的研究[J].中国天然药物,2004,2(1):20-24.
[8]杨建,付玲,何倩. 超声法提取维吾尔药罗勒叶中总黄酮的研究[J].安徽农业科学,2011,39(26):15907-15908.
[9]孙林芳,冯兵,朱亚珍,等. 罗勒多糖含量测定方法研究[J]. 山东中医药大学学报,2015,39(5):464-467.
[10]赵庆华,赵豫. 罗勒多糖抗肿瘤转移作用的机制研究[J]. 肿瘤药学,2013,3(5):344-347.
[11]张文成,潘见,谢慧明. 罗勒挥发油的中试开发工艺研究[J]. 工艺技术,2004,25(6):101-104.
[12]任吉君,王艳,周荣,等. 干燥方法与萃取压力对罗勒芳香油萃取的影响[J]. 北方园艺,2011(4):39-41.
[13]曹维金,陈娜. 罗勒子油脂提取工艺的比较研究及其脂肪酸组成的气相色谱分析[J]. 技术·油脂工程,2011(6):47-50.
[14]Seyed E S. Analysis of the essential oils of two cultivated Basil(Ocimum basilicum L.)from Iran[J]. Daru Volume,2006,14(3):128-129.
[15]Jungmin Lee a,Carolyn F,Scagel. Chicoric acid found in basil(Ocimum basilicum L.)leaves[J]. Food Chemistry,2009(115):650-656.
[16]Jamal J,Khalighi A,Kashi A,et al. Chemical Characterization of Basil(Ocimum basilicum L.)Found in Local Accessions and Used in Traditional Medicines in Iran[J]. Food Chem,2002(50):5878-5883.
[17]杨艳,吴素玲,张卫明,等. 微波辅助水蒸汽蒸馏法和无溶剂微波萃取法提取孜然精油工艺的研究[J]. 食品科学,2009,30(8):42-46.
[18]何君,姚晓玲,冯桂仁,等. 胡柚精油提取工艺优化与理化特性研究[J]. 食品工业,2015,36(3):976-979.
[19]朱深海.山莓提取物体外抑菌效果及抑制兔离体肠管运动的研究[D]. 长沙:湖南农业大学,2004.
[20]刘慧. 现代食品微生物学实验技术[M]. 北京:中国轻工业出版社,2006.
[21]陈丽萍,陈岩,董艳.大承气汤对大肠杆菌体外抑制作用的研究[J]. 世界中医药,2013,8(10):1225-1227.
[22]丁华,王建青,王玉峰,等. 罗勒精油和Nisin复配抑菌剂抑菌效果的研究[J]. 中国调味品,2016,41(7):20-25.
[23]纪鹏,周建平,刘向宇. 微波辅助水代法提取油茶籽油条件研究[J]. 现代食品科技,2010,26(5):486-489.
[24]陆占国,李伟,孟大威,等. 黑龙江栽培白花罗勒花精油成分及其抗菌活性[J]. 食品科学,2012,33(21):117-120.
Microwave-assisted extraction and antibacterial effect of essential oil fromOcimumbasilicumLinn
AI Wei,LIU Jing-lun,LI Xiao-jiao
(Resources and Environmental Sciences,Baoshan University,Baoshan 678000,China)
In this study,microwave-assisted extraction was applied to extract the essential oil fromOcimumbasilicumLinn with petroleum ether. By using orthogonal methodology,the effects of concentration of NaCl,soaking time,solid-liquid ratio,microwave power and extraction time were investigated. It was found that when soaking time was 6 h,solid-liquid ratio was 1∶16,microwave power was 567 W and microwave time was 120 s,the optimal oil yield was 0.3758%(n=3). Then,essential oil’s antibacterial effect was determined by using paper discassay and fold dilution plate method. The results indicated that the minimum inhibitory concentration(MIC)forEscherichiacoli,BacillussubtilisandStaphylococcusaureuswere 31.25,62.5,125 μg/mL,respectively,and the minimum bactericidal concentration(MBC)for these were 31.25,125,500 μg/mL,respectively. The antibacterial order was:Escherichiacoli>Bacillussubtilis>Staphylococcusaureus. The research provides the theoretical basis for development and comprehensive utilization ofOcimumbasilicumLinn.
OcimumbasilicumLinn;essential oil;microwave-assisted extraction;antibacterial effect
2016-08-26
艾薇(1979-),女,硕士,副教授,从事食品科学的研究及教学工作,E-mail:fwaiwei@aliyun.com。
保山学院食品科学重点学科建设项目;云南省教育厅科学研究基金资助性项目(2016ZZX221)。
TS201.2
B
1002-0306(2017)07-0240-05
10.13386/j.issn1002-0306.2017.07.039
