甲鱼抗氧化肽的超滤分离研究
2017-04-13朱静静沈佳盈郑星霞金巧燕
朱静静,王 楠,沈佳盈,郑星霞,金巧燕,张 慧
(浙江树人大学生物与环境工程学院,浙江杭州 310015)
甲鱼抗氧化肽的超滤分离研究
朱静静,王 楠*,沈佳盈,郑星霞,金巧燕,张 慧
(浙江树人大学生物与环境工程学院,浙江杭州 310015)
以甲鱼为原料,利用中性蛋白酶制备甲鱼蛋白酶解肽,以膜通量为评价指标,分别研究操作压力、操作温度、料液浓度对超滤效果的影响。确定了较适宜的超滤条件为:操作压力30 psi,操作温度25 ℃,料液浓度15 g/L。采用分子质量为 5 ku超滤膜分离甲鱼蛋白酶解肽能够显著提高其DPPH·清除率、还原力、总抗氧化活性,并且其抗氧化活性呈现一定的量效关系。结论:分子量<5 ku的甲鱼蛋白肽段具有较高的抗氧化活性。
甲鱼蛋白酶解肽,超滤,DPPH·清除率,还原力,总抗氧化活性
生物活性肽(Bioactive Peptides)是具有生理功能的特殊蛋白片段[1]。1960年,Marcuse[2]首先在《Nature》上报道了食源氨基酸的抗氧化活性。食源性抗氧化肽(Antioxidative Peptides)由于其分子量小、成本低、活性强、易吸收、稳定性强,具有抑制、延缓脂质氧化,保护人体组织器官免受自由基侵害的作用,已成为一种健康、安全的抗氧化剂[3],也将会成为控制人体机体内各种氧化过程的潜在能源。已有研究[3-5]从大豆、羊栖菜、鹰嘴豆、玉米、酪蛋白、乳清、蛋、贻贝、鱼、泥鳅和虾等多种动植物蛋白中制备抗氧化肽。近年来,抗氧化肽已成为国内外研究最多的生物活性肽之一。
甲鱼又称鳖、团鱼、脚鱼、水鱼,动物界,脊索动物门,脊椎动物亚门,爬行纲,龟鳖目,鳖科,鳖属,是一种水生经济动物[6]。甲鱼蛋白含量较高,甲鱼为冷血动物,经过规范化和标准化养殖,其蛋白的安全性较高,可以作为制备高品质活性肽的优质原料[7]。前期研究表明,甲鱼蛋白酶解液中具有潜在的抗氧化生物活性肽段[6],但是在利用蛋白酶水解制备活性肽过程中,酶解液中常存在一些未水解和未水解完全的大分子蛋白质和酶,采用分离纯化的手段可以提高其生物活性。超滤分离是按照膜截留的相对分子质量对物料进行分离[8],以压差为推动力,利用高分子薄膜凭借各组分在膜中传质的选择性差异对多肽进行分离和浓缩[9]。因此,本研究采用超滤可以实现甲鱼抗氧化肽的分离和浓缩,有效提高甲鱼蛋白酶解肽的抗氧化活性,从而有利于实现抗氧化肽产品的产业化。
膜通量是膜分离过程的一个重要工艺运行参数,是指单位时间内通过单位膜面积上的流体量。本实验以膜通量为评价指标,优化了超滤过程中操作压力、操作温度、料液浓度等超滤条件,并比较了超滤对甲鱼蛋白肽的抗氧化作用的影响,从而为甲鱼抗氧化肽制备的产业化提供数据支持。
1 材料与方法
1.1 材料与仪器
甲鱼 浙江市售;中性蛋白酶(100 U/mg)上海源叶生物科技有限公司;L-酪氨酸 上海康捷生物科技发展有限公司;DPPH试剂盒 南京建成生物工程研究所;其它试剂均为分析纯。
Millipore-Labscale超滤设备 Millipore杯式超滤器,5 ku膜包 美国Millipore公司;PHS-3C pH计 杭州奥立龙仪器有限公司;HH-4型数显恒温水浴锅 金坛市江南仪器厂;UV-124型紫外-可见分光光度计 岛津有限公司;PL303型电子分析天平 梅特勒-托利多仪器(上海)有限公司;FD-1D-50型冷冻干燥机 北京医康实验仪器有限公司;Biofuge Prino R型台式高速冷冻离心机 德国贺利氏公司;Waters 2695-2996 高效液相色谱仪等。
1.2 实验方法
1.2.1 甲鱼肽的制备 甲鱼宰杀→去脂→脱壳→打浆→冻干→蛋白酶酶解8 h,连续搅拌,每30 min用0.5 mol/L的NaOH 或0.5 mol/L 的HCl调节一次pH使其保持在7.0→灭酶(煮沸10~15 min)→离心抽滤(4000 r/min,10 min)→取上清液→冷冻干燥→保存备用[6]。
1.2.2 甲鱼抗氧化肽的超滤分级分离 在 0.25 MPa压力下超滤,依次用透过分子质量为5,3 ku的超滤膜超滤分别得到分子质量为>5,3~5,<3 ku 的甲鱼蛋白酶解肽滤出液,冻干后称重。
1.2.3 甲鱼抗氧化肽的超滤分离条件优化 配制不同浓度的甲鱼蛋白酶解液,首先采用0.45 μm的中空纤维膜对甲鱼蛋白酶解液进行微滤。微滤所得滤液用5 ku的超滤膜进行超滤分离,在超滤过程中,以膜通量为主要评价指标,分别考察操作压力(10、20、30 psi)、样品浓度(5、10、15、20 g/L)和操作温度(15、20、25、30、35 ℃)等超滤条件对超滤分离的影响。
1.3 分析方法
1.3.1 膜通量的计算 超滤过程中的特性指标主要是膜通量,即单位时间内通过单位膜面积的透过液的量来表示[10-11]。膜通量的计算:
式(1)
式(1)中:J:膜通量,(L/m2h);V:透过液的体积,(L);A:膜的面积,(m2);T:超滤所用的时间,(min)。
1.3.2 抗氧化活性的评价
1.3.2.1 DPPH·清除能力的测定 取0.1 mL蛋白酶解液,加入1×10-4mol/L DPPH·无水乙醇溶液2.8 mL,混匀后在室温下避光反应30 min,并在4000 r/min下离心10 min,取上清液用分光光度计在517 nm下测定其吸光度Ai,空白组以等体积无水乙醇溶液代替DPPH·溶液,并以等体积蒸馏水和无水乙醇混合液空白调零[12-13]。清除率按下式计算:
式(2)
式(2)中:Ai:样品组吸光度;A:空白组吸光度。
1.3.2.2 还原力测定 参考Kaur等的方法[14],取1.0 mL(0.25、0.50、0.75、1.00 mg/mL)酶解液与(0.2 mol/L,pH为6.6)的磷酸缓冲液和2.5 mL的1%铁氰化钾均匀混合,置于50 ℃孵化20 min,然后加入2.5 mL 10%三氯乙酸,3000 r/min离心力,离心10 min取上清液2.5 mL,加2.5 mL蒸馏水和0.5 mL(0.1%)的氯化铁。在700 nm下测定吸光度,增加的吸光度表示增加还原能力。BHT(二叔丁基对甲酚)作为阳性对照。吸光值越大表示还原能力越强[15]。
1.3.2.3 总抗氧化活性 参考高燕等的方法[16],取0.1 mL的酶解液(0.25、0.50、0.75、1.0 mg/mL)加入到1 mL EP管中加入1 mL溶解试剂(0.6 mmol/L硫酸、28 mmol/L磷酸钠、4 mmol/L钼酸铵)。EP管在90 ℃孵化90 min,冷却后在695 nm下测定吸光度。对照组1 mL溶解试剂(0.6 mmol/L硫酸、28 mmol/L磷酸钠、4 mmol/L钼酸铵)加0.1 mL蒸馏水。
1.4 数据处理

2 结果与分析
2.1 超滤后各级组分含量的比较
由表1可看出,甲鱼蛋白酶解肽分级超滤后称重,<3 ku的甲鱼蛋白酶解肽仅仅占16%,3~5 ku甲鱼蛋白酶解肽占55%。考虑样品得率因素,本实验采用5 ku的超滤膜进行超滤分离研究。

表1 甲鱼蛋白酶解肽超滤后各级组分含量的比较Table 1 Comparison of content of Turtle protein hydrolysis peptides various component by ultrafiltration
2.2 超滤工艺参数对膜通量的影响
2.2.1 操作压力对膜通量的影响 利用超滤分离蛋白肽时,操作压力对超滤效率的影响主要在于膜污染,即物料中的微粒、胶体离子或溶质大分子在膜表面或膜孔内吸附、沉积造成膜孔径变小或堵塞,使膜通量及膜的分离特性产生不可逆变化[17]。当样品浓度(15 g/L)和超滤温度(25 ℃)在一定的条件下,优化合适的操作压力,以避免膜污染,有效保证超滤效率,从而延长超滤膜的使用周期。
由图1可以看出,在同一操作压力的条件下,膜通量随着超滤时间的延长而下降。最初,膜通量随着时间的延长而迅速下降,但随着超滤时间的延长,膜通量的变化逐渐变缓。超滤压力在10 psi到30 psi范围内,初始膜通量随着操作压力的增加而迅速提高,在膜过滤10 min时,超滤压力为10、20、30 psi的膜通量分别为12.02、21.69、28.7 L/m2h。主要是由于超滤压力越大,膜两侧的压力差则越大,膜通量也越大。在同一操作压力处理条件下,前40 min内,膜通量随着时间的延长而显著下降,40 min后,膜通量的变化趋于平稳。主要是由于随着超滤时间的延长膜表面会产生凝胶层,而增大传质阻力,导致较低的操作效率。综合考虑以上各个因素,本研究后续实验选择的操作压力为30 psi。

图1 操作压力对膜通量的影响Fig.1 Effect of operating pressure on membrane flux
2.2.2 操作温度对膜通量的影响 在其它超滤条件不变的情况下,探究超滤操作温度对甲鱼肽分离膜通量的影响。结果如图2所示。
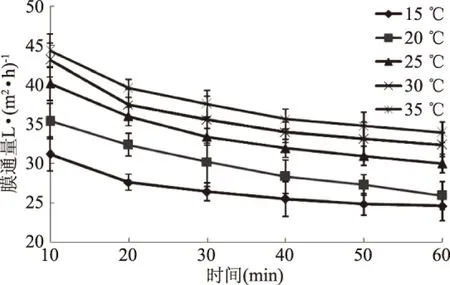
图2 操作温度对膜通量的影响Fig.2 Effect of operating temperature on membrane flux
由图2可以看出,在超滤过程中,随着操作温度的升高,膜通量逐渐增加。在超滤处理10 min时,操作温度为15、20、25、30、35 ℃样品的膜通量分别为31.20、35.41、40.20、43.20、44.40 L/m2h,结果表明,操作温度为15~25 ℃时,膜通量上升幅度较大,分别为4.21、4.79 L/m2h,但随着操作温度进一步上升,膜通量上升的幅度逐渐减小,操作温度在25~35 ℃范围内,膜通量上升幅度分别为3.00、1.20 L/m2h。主要是由于随着操作温度的升高,料液黏度下降,扩散系数增加,进而减少了浓差极化的影响[18]。在同一操作温度处理条件下,前40 min内,膜通量随着时间的推移明显下降,40 min之后,膜通量的变化趋于平稳。然而,随温度升高蛋白质大分子在膜表面的吸附会增加,且容易被微生物污染,从而降低膜通量的增幅。在实际操作过程中,综合考虑超滤效率、防止微生物生长所致的膜污染及节省能源等因素,选择25 ℃较为适宜。
2.2.3 料液浓度对膜通量的影响 在其它超滤条件不变的情况下,研究料液浓度对甲鱼肽超滤分离的影响。结果见图3。

图3 料液浓度对膜通量的影响Fig.3 Effect of liquor concentration on membrane flux
由图3可知,在其它超滤条件相同的情况下,料液浓度越低,膜通量越大。随着分离时间的延长,膜通量显著下降,但随着时间进一步延长,膜通量没有显著的变化。分别对料液浓度为5、10、15、20 g/L的样品进行超滤,在10 min时,膜通量分别为43.2、35.64、31.2、26.4 L/m2h。这是由于在较低的料液浓度时,液体在膜管内的流动趋于湍流状态,且大分子溶质不易堆积,可以保持较高的膜通量[11]。但料液比为5、10 g/L时,由于浓度过低,仅仅是溶剂(水)通量的提高,而溶质(小肽及其他小分子物质)通量反而下降,使膜效能下降[19]。适当的提高料液浓度,有利于提高超滤效率,充分发挥超滤膜的作用。综合膜通量和超滤效率两方面考虑,采用15 g/L的甲鱼蛋白酶解液料液浓度进行分离。
2.3 超滤前后所得样品的抗氧化活性比较
2.3.1 超滤前后所得样品的DPPH·清除率的比较 DPPH·是一个相对稳定的自由基,被广泛用作抗氧化成分的体外抗氧化性评价有物质。分别对5 ku超滤膜处理前后的肽样品的DPPH·清除率进行测定,结果如图4所示。
由图4可知,肽浓度为0.25、0.50、0.75、1.00 mg/mL时,随着肽浓度的增加,超滤前后所得样品的DPPH·清除率都呈上升趋势,但是超滤后的样品递增趋势比超滤前样品的递增趋势更大。当肽浓度为1 mg/mL时,超滤前后样品的DPPH·清除率分别为24.48%和32.94%。结果表明,分子量低于5 ku的甲鱼蛋白酶解肽样品的DPPH·清除率更好,超滤可以显著提高甲鱼肽的DPPH·清除率。

图4 超滤前后所得样品的DPPH·清除率比较Fig.4 The comparison of DPPH· radical scavenging capabilities of samples注:不同字母代表同一浓度下,超滤前后所得样品的DPPH·清除率的差异显著性(p<0.05),图5、图6同。
2.3.2 超滤前后所得样品的还原力的比较 研究表明,生物活性物的抗氧化活性与其还原力具有直接关系,还原力可以用来评价抗氧化物提供氢原子或者提供电子的能力[20-21],根据1.4.2.2所述还原力的测定方法,分别对5 ku超滤膜分离得到的超滤前后样品的还原力进行测定,结果如图5所示。
由图5可知,随着肽浓度的增加,超滤前后样品的还原力均呈上升趋势,超滤后样品的递增趋势比超滤前样品的递增趋势更大。在肽浓度分别为0.25 mg/mL时,超滤前后样品的还原力没有显著差异,随着肽浓度的增加,超滤后样品的还原力显著高于超滤前的样品,说明超滤后样品的还原力高于超滤前样品的还原力。结果表明超滤后可以显著提高甲鱼肽的还原力。
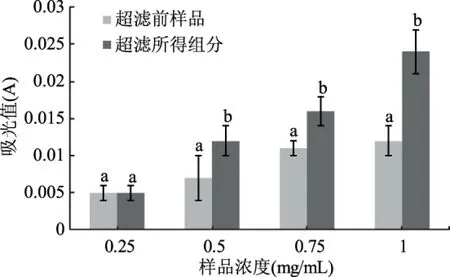
图5 超滤前后所得样品的还原力的比较Fig.5 The comparison of reducing power of samples
2.3.3 超滤前后所得样品的总抗氧化活性的比较 根据1.4.2.3所述的总抗氧化活性测定方法,分别对5 ku超滤膜分离得到的超滤前后样品的总抗氧化活性进行测定,结果如图6所示。
由图6可知,在肽浓度为0.25~1 mg/mL范围内,随着肽浓度的增加,超滤前后样品的总抗氧化活性均呈上升趋势,超滤后样品的递增趋势比超滤前样品的递增趋势更大。结果说明,超滤后可以显著提高甲鱼肽的总抗氧化活性。

图6 超滤前后所得样品的总抗氧化活性的比较Fig.6 The comparison of the total antioxidant activities of samples
据报道,小于20个氨基酸残基的抗氧化肽,分子越低其穿过肠道屏障发挥生物效应的机率越高[22]。有研究表明,活性肽的生物活性与分子量相关[23-24]。林慧敏[25]等研究表明,利用3 ku的超滤膜分离带鱼蛋白亚铁螯合肽,可以显著提高其抗氧化活性。彭维兵[26]等研究发现,分子量在1 ku以下的花生肽,对卵黄脂蛋白脂质过氧化具有较好的抑制作用,呈现剂量依赖性的抗氧化活性。李桂峰[27]利用木瓜蛋白酶酶解双孢菇蛋白制备了抗氧化肽,其相对分子质量主要分布在 600~2600 ku。本研究超滤前后所得样品的抗氧化活性比较研究表明,分子量低于5 ku的甲鱼蛋白酶解肽的抗氧化活性较高,这些结果表明5 ku超滤膜分离可有效提高甲鱼蛋白酶解肽的抗氧化活性,高活性抗氧化肽主要分布在<5 ku的分子量肽段,说明低分子量肽产物的抗氧化活性较高。
3 结论
本研究确定了采用5 ku膜超滤分离甲鱼蛋白酶解肽的最佳条件为:操作压力为30 psi,操作温度为25 ℃,料液浓度为15 g/L。结果表明,采用5 ku超滤膜分离可有效提高甲鱼蛋白酶解肽的DPPH·清除率、还原力、总抗氧化活性抗氧化活性,并呈现一定的量效关系,分子量<5 ku的甲鱼蛋白酶解肽段具有较高的抗氧化活性。
[1]Korhonen H,Pihlanto A.Food-derived bioactive peptides-opportunities for designing future foods[J].Current Pharmaceutical Design,2003,9(16):1297-1308.
[2]Marcuse R.Antioxidative effect of amino-acids[J].Nature,1960,186(6):886-887.
[3]Sarmadi B H,Ismail A.Antioxidative peptides from food proteins:A review[J].Peptides,2010,31(10):1949-1956.
[4]György P,Murata K,Ikehata H.Antioxidatives isolated from fermented soybeans(Tempeh)[J].Nature,1964,203(8):870-872.
[5]张晖,唐文婷,王立,等.抗氧化肽的构效关系研究进展[J].食品与生物技术学报,2013,32(7):673-679.
[6]王楠,王伟,周虹,等. 甲鱼蛋白抗氧化肽的中性蛋白酶酶解条件优化[J].浙江农业学报,2014,26(2):303-308.
[7]王楠,王伟,刘彩琴,等.甲鱼蛋白质各组分的营养价值分析[J].食品工业科技,2015,36(8):343-347.
[8]穆利霞,鲁珍,廖森泰,等.膜超滤对蚕蛹蛋白酶解液风味的影响[J].食品科学,2013,34(23):108-112.
[9]张艳梅,唐浩国,焦润玲,等.超滤分离茅岩莓黄酮工艺优化及其抑菌作用[J].食品科学,2016,37(6):89-94.
[10]时钧,袁权.膜技术分离手册[M].北京:化学工业出版社,2001.
[11]刘茉娥.膜分离技术[M].北京:化学工业出版社,1998.
[12]Teo C C,Chong W P K,Ho Y S.Development and application of microwave-assisted extraction technique in biological sample preparation for small molecule analysis[J]. Metabolomics,2013,09(5):1109-1112.
[13]孙丽萍,王大仟,张智武.11种天然植物提取物对DPPH的清除作用[J].食品科学,2009,30(1):45-47.
[14]Kaur R,Arora S,Singh B.Antioxidant activity of the phenol rich fractions of leaves of Chukrasia tabularis A.JuSS[J]. Bioresource Technology,2008,99(16):7692-7698.
[15]Dorman H J D,Kosar M,Kahlos K,Holm Y.Antioxidant properties and composition of aqueous extracts from Menthaspecies,hybrids,varieties,and cultivars[J]. Journal of Agricultural and Food Chemistry,2003,51(16):4563-4569.
[16]彭维兵,陈维云,王雪,等.花生肽的体外抗氧化活性研究[J].山东科学,2013,26(12):29-30.
[17]刘忠洲,续曙光,李锁定.微滤、超滤过程中的膜污染与清洗[J].水处理技术,1997,23(4):187-193.
[18]张艳萍,戴志远,张虹. 紫贻贝酶解物中降血压肽的超滤分离[J].食品与发酵工业,2010,36(9):46-51.
[19]龙晓丽.红三鱼蛋白水解物的制备及分离技术的研究[D].广州:华南理工大学,2004.
[20]郭利娜,朱玉,刁明明,等.赵海珍枯草芽孢杆菌发酵小米糠对其抗氧化肽含量与抗氧化活性的影响[J].食品科学,2015,36(13):196-201.
[21]Thana P,Machmudah S,Goto M,et al.Response surface methodology to supercritical carbon dioxide extraction of astaxanthin fromHaematococcuspluvialis[J].Bioresource Technology,2008,99(8):3110-3115.
[22]Roberts P R,Burney J D,Black K W,Zaloga G P.Effect of chain length on absorption of biologically active peptides from the gastrointestinal tract[J].Digestion,1999,60(4):332-337.
[23]Kim E K,Kim Y S,Hwang J W,et al.Purification and characterization of a novel anticancer peptide derived from Ruditapes philippinarum[J].Process Biochemistry,2013,48(7):1086-1090.
[24]Kitts D D,Weiler K. Bioactive proteins and peptides from food sources. Applications of bioprocesses used in isolation and recovery[J].Current Pharmaceutical Design,2003,9(16):1309-1323.
[25]林慧敏,邓尚贵,庞杰,张宾.超滤法制备高抗菌抗氧化活性带鱼蛋白亚铁螯合肽(Fe-HPH)的工艺研究[J].中国食品学报,2012,12(6):16-21.
[26]高燕,陈计峦.野生薄荷精油的抗氧化活性研究[J].农产品加工,2014,11(11):20-23.
[27]李桂峰,王向东,赵国建,等.酶解双孢菇蛋白制备抗氧化肽的研究[J].中国食品学报,2011,11(8):37-43.
Study on the separation of antioxidant peptides from Turtle using ultrafiltration
ZHU Jing-jing,WANG Nan*,SHEN Jia-ying,ZHENG Xing-xia,JIN Qiao-yan,ZHANG Hui
(College of Biology and Environmental Engineering,Zhejiang Shuren University,Hangzhou 310015,China)
Turtle protein hydrolysis peptides were prepared using Turtle as raw material. Based on the membrane flux,the effects of pressure,temperature and concentration on ultrafiltration treatment efficacy were studied. The results showed that the optimum conditions of ultrafiltration treatment were pressure of 30 psi,temperature of 25 ℃,and concentration of 15 g/L. The permeate fractions of 5 ku membrane can significantly increase the Turtle protease peptide DPPH· clearance,reducing power,total antioxidant activity,and its antioxidant activity present concentration-response relationship. Conclusion:the molecular neight below 5 ku of turtle protein hydrolysis peptides with high antioxidant activities.
Turtle protein hydrolysis peptides;ultrafiltration;DPPH scavenging activity;reducing power;total antioxidant activity
2016-08-19
朱静静(1995-),女,本科,研究方向:食品科学,E-mail:578271240@qq.com。
*通讯作者:王楠(1981-),女,博士,副教授,研究方向:食品科学,E-mail:xiaofeiyu0708@163.com.
国家自然科学基金青年基金项目(31401500);浙江省自然科学基金(Y17C200037);浙江省自然科学基金青年基金项目(LQ13C200005);国家级大学生创新创业训练计划项目(201511842005);浙江树人大学中青年术团队项目资助。
TS201
A
1002-0306(2017)07-0101-05
10.13386/j.issn1002-0306.2017.07.011
