溶剂热合成氮化铁及其催化氯代硝基苯加氢反应的研究*
2017-04-13赵朝晖邹汉波
赵朝晖,邹汉波
广州大学 化学化工学院,广东 广州 510006
溶剂热合成氮化铁及其催化氯代硝基苯加氢反应的研究*
赵朝晖,邹汉波
广州大学 化学化工学院,广东 广州 510006
采用溶剂热法制备了氮化铁催化剂,并用于邻氯硝基苯加氢合成氯代苯胺反应,考察了合成温度、原料配比以及合成时间等制备条件对其催化性能的影响.通过XRD、TG-DTG、BET等方法对催化剂的结构和性质进行表征.结果表明:在合成温度400 ℃、m(NaN3)∶m(FeCl2)=4∶1以及反应时间为30 h的条件下制备的氮化铁催化剂,在邻氯硝基苯加氢反应中,邻氯代硝基苯转化率为58.41%,邻氯苯胺选择性为100%.所制备的氮化铁催化剂具有较好的热稳定性;除了有介孔结构外,还有大孔结构的颗粒.提高合成温度,有利于提高所制备的氮化铁催化剂的结晶度和纯度.
氮化铁;溶剂热;邻氯硝基苯;加氢
被誉为“准铂催化剂”的过渡金属氮化物,在加氢精制反应中表现出优良的催化性能,在选择性上也比传统的加氢精制催化剂更好,且耗氢量少,展示出这类催化新材料潜在的应用前景[1-3].金属氮化物的合成方法有多种,如高温合成法[4]、程序升温法[5]、化学气相沉积法[6]等.其中程序升温法是制备高比表面积过渡金属氮化物最有效的方法.采用程序升温氮化法制备过渡金属氮化物,虽然通过严格控制反应条件,可以得到高比表面的氮化物,但该法需要缓慢升温和高空速的氮化气体,氮化温度需要650 ℃以上,合成条件相对苛刻,不适合规模化生产[7-10].因此,有必要对氮化物的合成方法做进一步探索,以便在相对温和的条件下,能大规模制备出性能优异的负载型多组分金属氮化物催化剂.
溶剂热法是在水热法的基础上发展起来的,许多金属氮化物可以用溶剂热法制备[11-13].本文介绍的是以氯化亚铁(FeCl2·4H2O)为铁源,氯化铵(NH4Cl)和叠氮化钠(NaN3)为混合氮源,采用溶剂热法制备纳米氮化铁催化剂,考察了合成温度、原料配比以及合成时间等制备条件对其催化性能的影响,并对其结构进行了表征.
1 实验部分
1.1 样品制备
实验中所用的化学试剂均为分析纯级.
将FeCl2·4H2O,NaN3和NH4Cl依次加入15 mL不锈钢高温釜中,再加入6 mL二甲苯溶液及0.2 g切碎的金属钠,然后将高温反应釜封紧后放置在坩埚电阻炉中.在400 ℃反应12 h后,冷却至室温,取出反应产物.用无水乙醇对产物洗涤数次,然后置于真空干燥箱中在50 ℃下干燥4 h,再用乙二醇洗涤2~3次,无水乙醇洗3~4次,最后置于50 ℃真空干燥箱中干燥4 h,即可获得所合成的氮化铁催化剂.
1.2 催化剂的活性评价
氯代硝基苯的选择性加氢反应是在70 mL带有玻璃内衬及磁力搅拌的不锈钢高压反应釜内进行.每次加氢反应都是将10 mg催化剂和10 mL的0.04 g/mL邻氯硝基苯乙醇溶液投入高压釜,密封后用H2吹扫4~5次以除去釜中的空气,反应温度为100 ℃,反应压力为1.0 MPa.将反应釜放入水浴中加热,待温度稳定后开始搅拌,达到指定时间后,停止搅拌并取出反应釜降温,然后将反应液离心获得产物.采用GC-979气相色谱仪分析对所制得的产物进行分析,色谱条件为:FID检测器,SD-30色谱柱(30m×0.32mm)的0型,柱温473K,气化室493 K,检测器533 K,除去溶剂峰后,用面积归一法对产物进行离线分析.
1.3 催化剂的表征
采用荷兰帕纳科公司的PW3040/60X型射线衍射仪对所制备的氮化铁催化剂进行XRD表征.测试条件为:Cu靶激发的Ka辐射为射线源,波长0.15406 nm,管压40 kV,电流100 mA,扫描范围(2θ)10°~90°,扫描速度率5°/min.
采用美国贝克曼库尔特公司的SA3100吸附仪,在吸附温度-250 ℃时通过氮气吸附测定所制备的氮化铁催化剂的比表面积、孔容和孔径分布.在吸附氮气前,将样品在250 ℃进行抽真空处理.比表面积是通过BET方程由氮气吸附等温线求得;总孔容是吸附等温线相对压力为1时吸附量对应的体积,中孔孔容是依据氮气脱附曲线用BJH法求出.平均孔径可根据Langumir吸附方程求得.
采用美国铂金埃尔默仪器有限公司的TGA4000型热分析仪进行催化剂的热重分析.先称取7 mg样品置于坩埚中,然后放入微量电子天平中,在氮气气氛中以10 ℃/min从室温升温到300 ℃.
2 实验结果与讨论
2.1 氮化铁催化剂催化邻氯硝基苯加氢反应
2.1.1 合成温度对催化剂催化性能的影响
在原料配比m(NaN3)∶m(FeCl2)为4∶1,合成时间为20 h的条件下,不同合成温度下所制备的氮化铁催化剂对邻氯硝基苯加氢反应催化活性和选择性的影响列于表1.由表1可知,当温度从250 ℃升至400 ℃,邻氯硝基苯的转化率不断提高;在400 ℃时,邻氯硝基苯的转化率最高,转化率达到了50.46%.说明催化剂的合成温度越高,越有利于氮化铁催化剂的合成,氮化铁催化剂的活性就越好.而催化剂的合成温度对邻氯硝基苯加氢反应的选择性影响不大,在各温度下的选择性均达100%.
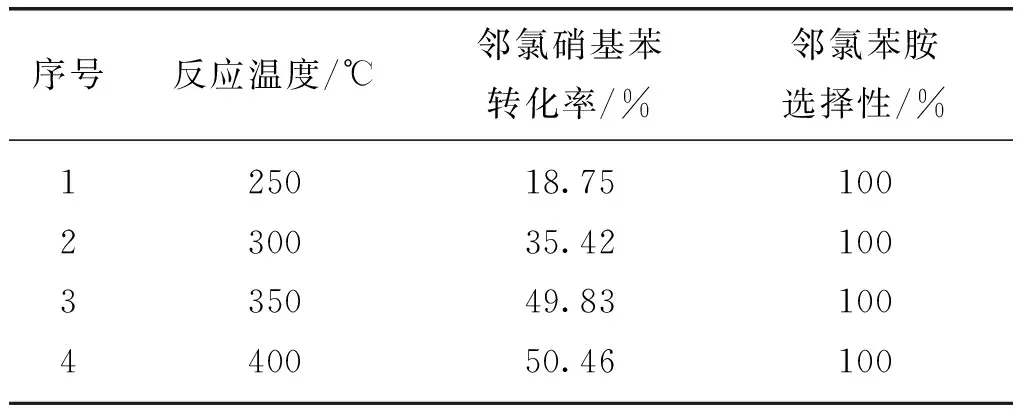
表1 合成温度对氮化铁催化邻氯硝基苯加氢反应的影响Table 1 Effects of reaction temperature on chloronitrobenzenes hydrogenation over FexN catalysts
2.1.2 原料配比对催化剂催化性能的影响
在合成时间为30 h,合成温度为400 ℃的条件下,原料配比不同时所制备的氮化铁催化剂对邻氯硝基苯加氢反应催化活性和选择性的影响列于表2.由表2可知,当原料配比m(NaN3)∶m(FeCl2)从3∶1增加到4∶1时,邻氯硝基苯的转化率从44.53%提升到54.46%,继续增加原料配比,邻氯硝基苯的转化率反而下降.故选择合适的原料配比m(NaN3)∶m(FeCl2)为4∶1.
表2 原料配比对氮化铁催化邻氯硝基苯加氢反应的影响
Table 2 Effects of raw material ratio on chloronitrobenzenes hydrogenation over FexN catalysts

序号m(NaN3)∶m(FeCl2)邻氯硝基苯转化率/%邻氯苯胺选择性/%12343∶14∶15∶110∶144.5354.4650.4632.58100100100100
2.1.3 合成时间对催化剂催化性能的影响
在原料配比m(NaN3)∶m(FeCl2)为4∶1,合成温度为400 ℃的条件下,不同合成时间所制备的氮化铁催化剂对邻氯硝基苯加氢反应催化活性和选择性的影响列于表3.由表3可知,当反应时间从10 h增加到30 h时,邻氯硝基苯的转化率从45.74%增至58.41%;当反应时间由30 h增至40 h时,邻氯硝基苯的转化率没有明显的增加.这说明随着反应时间的增加,有利于提高催化剂的催化效果.但是当反应达到一定程度后,再增加催化剂的合成时间,对催化剂活性的影响不明显.
表3 合成时间对氮化铁催化邻氯硝基苯加氢反应的影响
Table 3 Effects of reaction time on chloronitrobenzenes hydrogenation over FexN catalysts
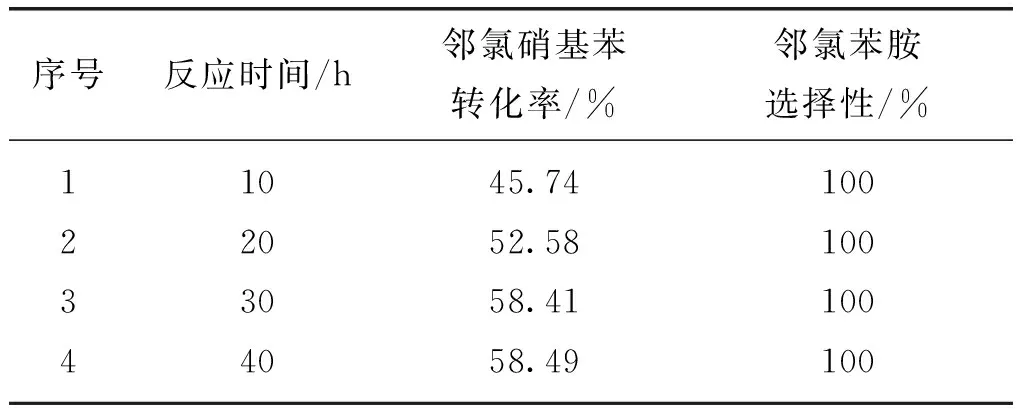
序号反应时间/h邻氯硝基苯转化率/%邻氯苯胺选择性/%12341020304045.7452.5858.4158.49100100100100
2.2 氮化铁催化剂的XRD分析
在m(NaN3)∶m(FeCl2)=4∶1,反应时间为20 h的条件下,不同温度下所制备的氮化铁催化剂样品的XRD谱图如图1所示.由图1可知,各样品在2θ为35.2°和56.27°时出现Fe4N的衍射峰,在42.7°出现FeN的衍射峰,在50.1°左右出现Fe2N的衍射峰,在62.1°出现Fe3N的衍射峰,与文献报道基本一致.随着反应温度的增加,衍射峰的强度呈增加的趋势.说明提高合成温度,有利于提高氮化铁催化剂的结晶度和纯度.

图1 不同合成温度下制备的氮化铁催化剂样品的XRD谱图 Fig.1 XRD patterns of FexN catalysts prepared under different reaction temperature
2.3 氮化铁催化剂的BET多孔分析
在合成温度为400 ℃、m(NaN3)∶m(FeCl2)=4∶1、反应时间为30 h的条件下制备的氮化铁催化剂,其N2吸附-脱附曲线如图2所示.由图2可看出,氮化铁呈明显的Ⅳ型吸附等温线,符合介孔分子筛的特征吸附曲线.当压力比接近1时,等温线急剧上升,吸附曲线斜率再次剧增,出现拐点,且在中间段出现吸附回滞环.这是因为催化剂样品是介孔结构,经过水热处理后的样品常出现这种现象.同时,等温线没有出现明显的饱和吸附平台,表明样品除了有介孔结构外,还有大孔结构的颗粒.
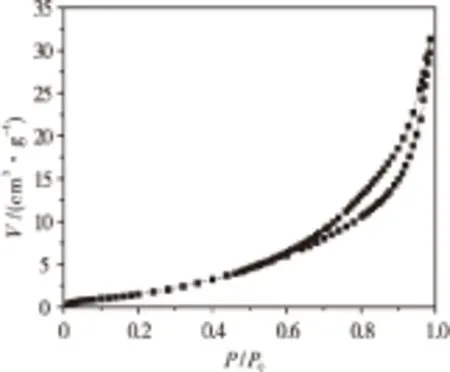
图2 样品N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherm of FexN catalysts
2.4 氮化铁催化剂的热重分析(TG-DSC)
在合成温度为400 ℃、m(NaN3)∶m(FeCl2)=4∶1、反应时间为30 h的条件下制备的氮化铁催化剂,其TG-DTG曲线如图3所示.由图3可看出,在78~102 ℃的温度区间内出现了一个明显的DTG峰,失重量约为0.4%.这部分的失重量是试样中水和醇等低沸点物质的含量.随着温度继续升高,氮化铁催化剂并没有明显的失重现象,说明氮化铁催化剂热稳定性较好.
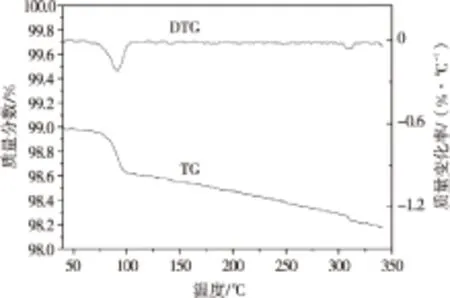
图3 氮化铁催化剂的TG-DTG曲线Fig.3 TG-DTG curves of FexN catalysts
3 结 论
采用溶剂热法,在合成温度400 ℃、m(NaN3)∶m(FeCl2)=4∶1、反应时间30 h的条件下制备的氮化铁催化剂活性最好,其中邻氯代硝基苯转化率为58.41%,邻氯苯胺选择性为100%.通过TG-DSC,BET,XRD分析表明,所制备的氮化铁催化剂具有较好的热稳定性;除了有介孔结构外,还有大孔结构的颗粒.提高合成温度,有利于提高所制备的氮化铁催化剂的结晶度和纯度.
[1] 祝国强.过渡金属氮化物的合成与表征[D].秦皇岛:燕山大学,2012.
[2] 沈强,卢春山,马磊,等,过渡金属氮化物的制备及其在催化中的应用[J].化学生产与技术,2004,11(1):33-38.
[3] BLEVY R,BOUDART M.Platinum-like behavior of tungsten carbide in surface catalysis[J].Science,1973,181(4099):547-549.
[4] IWAMA S,HAYAKAWA K,ARIZUMI T, et al. Growth of ultrafine particles of transition metal nitrides by the reactive gas evaporation technique with electron beam heating[J].Journal of Crystal Growth,1984,66(1): 189-194.
[5] KOJIMA R,AIKA K.Molybdenum nitride and carbide catalysts for ammonia synthesis[J]. Applied Catalysis A: General, 2001, 219: 141-147.
[6] NAGAI M,SUDA T,OSHIKAWA K,et al.CVD synthesis of alumina-supported tungsten nitride and its activity for thiophene hydrodesulfurization[J].Catalysis Today,1999,50: 29-37.
[7] DESMOULINS-KRAWIEC S, AYMONIER C,LOPPINET-SERANI A, etal. Synthesis of nanostructured materials in supercritical ammonia: nitrides,metals and oxides[J].J Mater Chem,2004,14(2): 228-232.
[8] OYAMA S T.The chemistry of transition metal carbides and nitrides[M].New York:Blackie, 1996:491-494.
[9] OGINO Y,YAMASAKI T,ATZUMI N,et al.Nitriding of transition metal powders by ball milling in nitrogen gas[J].Materials Transactions:JIM,1993,34(12):1212-1216.
[10] 郑明远.程序升温反应法制备氮化铁及催化肼分解研究[D].北京:中国科学院研究生院(大连化学物理研究所),2005:10-13.
[11] 刘淑玲,仝建波.氮化铁晶体的溶剂热合成[J].无机材料学报,2009,24(5):989-992.
[12] 刘小华,孙荣林.水热与溶剂热合成技术在无极合成中的应用[J].盐湖研究,2008,16(2):60-61.
[13] ZHU L P,OHASHI M,YAMANAKA S. Novel synthesis of TiN fine powders by nitridation with ammonium chloride[J]. Materials Research Bulletin,2002,37:475-476.
Solvothermal synthesis of FexN catalysts and catalytic hydrogenation of chloronitrobenzene
ZHAO Zhaohui,ZOU Hanbo
SchoolofChemistryandChemicalEngineering,GuangzhouUniversity,Guangzhou510006,China
AseriesofFexNcatalystswerepreparedbythesolventthermalmethod.ThephysicochemicalpropertiesofthecatalystswerecharacterizedbyX-raydiffraction(XRD),thermalgravimetricanalysis(TG-DTG),pupilanalysis(BET).Theresultsshowsthatthechloronitrobenzeneconversionwas58.41%,andtheselectivityreached100%whenthereactiontemperaturewassetat400 ℃,NaN3∶FeCl2was4∶1andreactiontimewas30h.Thesecatalystshavegoodthermalstability.Inadditiontothemesoporousstructure,therearelargeporestructureofparticles.ThecrystallinityandpurityofFexNcatalystwereimprovedwithincreasingthesynthesistemperature.
ironnitride;solvothermalmethod;o-chloronitrobenzene;catalytichydrogenation
2016-08-25
广州市属高校科研项目(1201420673,1201420847)
赵朝晖(1976-),女,湖南武冈人,博士,高级实验师.
1673-9981(2017)01-0039-04
TQ 032.41
A
