一株枯草芽孢杆菌的鉴定及液体发酵工艺优化
2017-04-13胡红伟段明房闫凌鹏邢俊德麻啸涛李自茹陈茹茹杨京娥
胡红伟, 段明房, 闫凌鹏, 邢俊德, 麻啸涛, 李自茹, 陈茹茹, 杨京娥
(1.山西大禹生物工程股份有限公司,山西芮城 044600;2.太原理工大学化学工程学院,山西太原 030024)
一株枯草芽孢杆菌的鉴定及液体发酵工艺优化
胡红伟1*, 段明房1, 闫凌鹏1, 邢俊德2, 麻啸涛1, 李自茹1, 陈茹茹1, 杨京娥1
(1.山西大禹生物工程股份有限公司,山西芮城 044600;2.太原理工大学化学工程学院,山西太原 030024)
从鸡肠道筛选出一株菌,命名为DY032,经16S rDNA分子鉴定和系统发育分析,该菌种为枯草芽孢杆菌。在摇瓶发酵条件下,采用单因素试验,对菌株DY032的培养基配方进行优化,确定了影响发酵液菌体数和芽孢数的5个因素,分别为淀粉、鱼粉、豆饼粉、MnSO4·H2O和CaCO3,其适宜浓度分别为20、10、10、0.05、0.05 g/L,进一步通过L16(45)正交试验确定以上5因素的最佳配比。为放大培养,在最优培养基基础上,利用10 L发酵罐,采用L9(34)正交试验设计,以芽孢数为指标,对菌株DY032的培养温度、pH值、搅拌转速、通气量4个条件进行优化。结果表明:菌株DY032培养基最优配方为:淀粉16 g/L,鱼粉10 g/L,豆饼粉10 g/L,MnSO4·H2O 0.05 g/L,CaCO30.03 g/L。最优发酵罐培养条件为:培养温度37℃,pH值6.5,转速200 r/min,通气量5 L/min,最终芽孢数可达51.95×108cfu/mL。
菌株DY032;16S rDNA;优化
枯草芽孢杆菌是我国农业部允许作为饲料添加剂的益生菌之一,相对其他益生菌,是较早应用到饲料中的微生态制剂,其可有效调节动物肠道微生态平衡。枯草芽孢杆菌为需氧菌,其产酶能力较强,能产生蛋白酶、纤维素酶、脂肪酶等,同时可降解饲料中的抗营养因子,提高动物的消化吸收率,从而促进动物生长。
芽孢是一种休眠体,是其产生菌在生长过程中对不良环境的一种自我保护,并非细菌生长周期的一个必要阶段,芽孢的形成受营养与环境的双重调控 (Prabhat等,2015;Eugénie等,2012;Barak等,2005)。微生态制剂中芽孢体的产率是影响微生态应用效果的关键因素。因此,系统研究微生态制剂菌种的生理生化特性,找出其生长的最佳条件,同时优化其培养基成分,能够实现高密度的培养,可以有效地降低生产成本,为微生态制剂的推广利用奠定基础。
本研究以本实验室筛选的DY032为出发菌株,对其进行16S rDNA分子鉴定,然后进行培养基优化,最后利用10 L全自动发酵罐从培养温度、pH、转速和通气量4个因素进行优化,为该菌株工业化生产提供了条件。
1 材料与方法
1.1 试验菌株 本实验室从鸡肠道筛选并保藏的菌株DY032。
1.2 培养基 种子培养基(MRS培养基):蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L,葡萄糖20 g/L,吐温80 1 mL/L,碳酸钙3 g,磷酸氢二钾2 g/L,无水乙酸钠 2 g/L,柠檬酸二铵2 g/L,七水硫酸镁0.2 g/L,一水硫酸锰0.05 g/L,pH 6.8。
牛奶强化培养基:脱脂奶粉12 g/L。
基础发酵培养基:葡萄糖 20 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 6.8。
1.3 菌株的分子鉴定与系统发育分析
1.3.1 基因组总DNA的提取 菌株DY032总DNA提取,采用上海生工Ezup柱式细菌基因组DNA抽提试剂盒进行提取。
1.3.2 PCR扩增及序列分析 以DY032基因组DNA作为模板进行PCR扩增,用于菌株16S rDNA扩增的PCR反应的引物为一对细菌通用引物(7F:5’-AGAGTTTGATCCTGGCTCAG-3’,1540R:5-CTACGGCTACCTTGTTACGA,由上海生工合成)。
25 μL PCR反应体系:Template(基因组DNA 20~50 ng/μL)0.5 μL;10×Buffer(with Mg2+)2.5 μL;dNTP(各2.5 mM)1μL;Taq DNA聚合酶0.2 μL;16S(7F)(10 μM)0.5 μL;16S(1540 R)(10 μM)0.5 μL;加ddH2O至25 μL。
PCR反应条件:94℃预变性5 min,94℃变性45 s,53℃退火1 min,72℃延伸1 min;循环30次;72℃总延伸10 min。
PCR产物进行2%的琼脂糖凝胶电泳,采用上海生工SK8131胶回收试剂盒回收16S rDNA序列,序列由上海生工进行测序。将测定的序列用blast软件与Genbank中已有序列进行同源性比较,采用Mega 4.0软件菌株进行系统发育分析,利用Neighbor-Joining法构建系统发育树。
1.4 菌种培养
1.4.1 菌种活化 将冷冻干燥保存的菌种接入液体种子试管,37℃、160 r/min培养24 h,然后挑取菌液,MRS固体平板划线,37℃静置培养48 h,待单菌落长出后,挑选菌落小,透明圈较大菌落。
1.4.2 菌种强化 将挑选到的菌落接种到牛奶试管强化液体培养基中,37℃、160 r/min培养24~ 48 h,待牛奶凝固后测定牛奶酸度,待牛奶酸度大于2.0时,挑取菌液划线培养,否则继续强化。
1.4.3 斜面种子制备 取MRS固体斜面数支,挑取强化好的菌种划斜面,37℃静置培养24 h,作为种子。
1.4.4 种子液的制备 从斜面上挑取一环接种到100 mL三角瓶中,装液量40 mL,37℃、160 r/min,振荡培养24 h备用。
1.4.5 三角瓶培养 将上述种子液,按照1%的接种量接种到碳氮源基础培养基中,250 mL三角瓶装液量100 mL,于37℃、160 r/min条件下摇瓶培养48 h。
1.4.6 菌数及芽孢数检测方法 菌体数:活菌计数采用平板计数法。芽孢数:培养后菌液于80℃水浴15 min后稀释涂平板。
芽孢率/%=(芽孢数/活菌数)×100。
1.4.7 发酵罐培养方法 使用火焰接种法,接种量1%,将摇瓶培养24 h的种子接入发酵罐。
1.5 菌种培养基优化单因素试验 配制不同的培养基,分别探讨碳源、氮源和无机盐3个单因素对发酵的影响。
1.5.1 碳源优化试验 在基础发酵培养基的基础上,分别选择葡萄糖、糖蜜、麸皮、淀粉、玉米粉为碳源(替代基础发酵培养基中的葡萄糖),每种原料浓度设置低、中、高3个水平,浓度梯度水平见表1,每个水平设2个重复,细菌及芽孢数量取平均值,根据结果筛选出最优的碳源及其适宜浓度。

表1 不同碳源及其浓度 g/L
1.5.2 氮源优化试验 在基础发酵培养基的基础上,分别选择蛋白胨 、酵母粉、鱼粉、鱼粉+豆饼粉、豆饼粉、硫酸铵为氮源,每种原料设置低、中、高3个水平,浓度梯度水平见表2,每个水平设2个重复,细菌及芽孢数量取平均值,根据结果筛选出最优氮源及其适宜浓度。
1.5.3 无机盐优化试验 在基础发酵培养基的基础上,分别选择无机盐MgSO4·7H2O、MnSO4·H2O、CuSO4·5H2O、CaCl2、FeSO4·7H2O、NaCl,每种原料设置低、中、高3个水平,浓度梯度水平见表3,每个水平设2个重复,细菌及芽孢数量取平均值,根据结果筛选出最优无机盐及其适宜浓度。
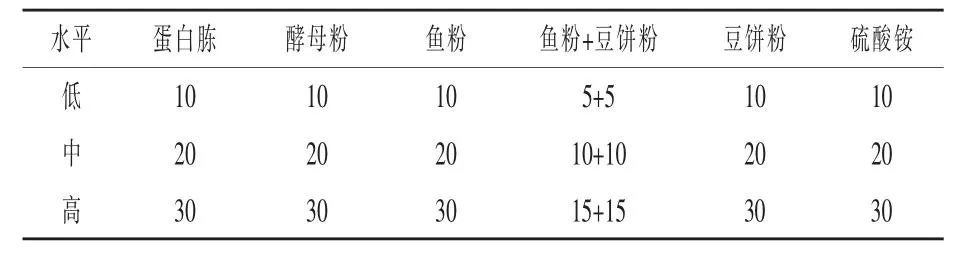
表2 不同氮源及其浓度 g/L

表3 不同无机盐及其浓度 g/L
1.6 正交试验 将筛选出的最佳碳源、氮源和无机盐进行正交试验,进一步确定各培养基成分的最适添加量。
1.7 菌株DY032发酵罐培养条件优化 在选出的最优培养基基础上,对菌株DY032进行发酵罐小试培养条件的探索,选取培养温度、转速、通气量、pH值4个因素,根据前期摇瓶培养的研究结果,分别设定3个水平进行L9(34)正交试验,发酵罐装液系数60%,培养时间48 h,以芽孢数为指标确定最佳培养条件组合,并进行验证试验,因素水平见表4。

表4 正交试验因素与水平
1.8 数据统计与分析 采用Microsoft Excel软件对数据进行整理,采用SAS 9.0软件中的anova进行方差分析,并用邓肯新复极差法进行显著性多重比较。
2 结果与分析
2.1 菌种鉴定结果 琼脂糖凝胶电泳检测结果如图1所示。扩增的片段为单一的谱带,无明显特异扩增现象,大小约为1.5 kb。

图1 PCR电泳结果
胶回收16S rDNA序列,由上海生工测序结果表明,菌株DY032序列长度为1426 bp,序列比对结果见表5,可见菌株DY032与Bacillus subtilis subsp.inaquosorum 16S rDNA相似度达100%。

表5 菌株DY032 16S核糖体DNA序列比对结果
2.2 菌株DY032系统进化分析 利用NCBI中的blast软件在线分析菌株DY032 16S rDNA序列,并与Genbank数据库中不同菌株的16S rDNA序列进行同源性比较,用Maga 4.0软件绘制N-J系统进化树。如图 2所示,DY032与 Bacillus subtilis subsp.Inaquosorum亲缘关系最近,说明菌株DY032为枯草芽孢杆菌。
2.3 菌种培养基单因素优化试验结果
2.3.1 碳源对发酵的影响 不同碳源对菌株DY032发酵水平的影响结果见表6。五种碳源活菌数大小依次为:葡萄糖、淀粉、糖蜜、玉米粉和麸皮,碳源为葡萄糖时,活菌数最高,其中葡萄糖浓度为30 g/L时,活菌数数最高,达到28.22×108cfu/mL,但与20 g/L葡萄糖组差异不显著(P>0.05)。淀粉浓度为20 g/L和30 g/L时,芽孢数显著高于其他各组(P<0.05),但两组之间芽孢数差异不显著(P>0.05),分别为13.50×108cfu/mL和14.50×108cfu/mL,芽孢率可达55.6%和56.2%;以糖蜜为碳源时菌体数较高,但芽孢率较低,可能与糖蜜中某些成分抑制芽孢的形成有关;麸皮为碳源时,菌体数最低,显著低于其他各组(P<0.05),菌体数分别为6.33×108、6.52×108、7.262×108cfu/mL,但芽孢率仍可达到40%以上,可能由于麸皮的营养组成不利于菌体的生长但利于芽孢的产生。综合考虑菌体数和芽孢数,选择20 g/L的淀粉为发酵培养基最佳碳源。

图2 DY032的系统发育树

表6 不同碳源及其浓度对菌株DY032菌数及芽孢率的影响
2.3.2 氮源对发酵的影响 不同氮源对菌株DY032发酵水平的影响结果见表7。以鱼粉、鱼粉+豆饼粉、豆饼粉等为氮源时,菌株DY032活菌数和芽孢数均较高,其中鱼粉+豆饼粉组中,鱼粉与豆饼粉浓度分别为10 g/L时,芽孢数最高(P<0.05),达到26.61×108cfu/mL,芽孢率达到66.1%。以硫酸铵为氮源时,活菌数最低(P<0.05),可见,不同氮源对菌株DY032的活菌数和芽孢数有较大影响,考虑到原料活菌数、芽孢数及成本,选取鱼粉+豆饼粉为最优氮源。

表7 不同氮源及其浓度对菌株DY032菌数及芽孢率的影响
2.3.3 不同无机盐对发酵的影响 不同无机盐对菌株DY032发酵水平的影响结果见表8。以Ca-CO3、MnSO4·H2O、NaCl和MgSO4·7H2O为无机盐时,随着浓度的增加对菌株DY032芽孢率有不同程度的促进作用,当MnSO4·H2O浓度为0.05 g/L时,菌体数和芽孢数均显著高于其他各组 (P<0.05),菌体数为25.82×108cfu/mL,芽孢数为17.64× 108cfu/mL,芽孢率可达68.3%。以浓度为0.05 g/L CaCO3为无机盐时,芽孢数达到17.91×108cfu/mL,芽孢率达到75.8%,与0.05 g/L MnSO4·H2O作为无机盐时,芽孢数差异不显著 (P>0.05)。而随着CuSO4·5H2O浓度的增加,芽孢产率显著下降。因此,选取芽孢产率较高的CaCO3和MnSO4·H2O作为培养基无机盐,并且浓度选择为0.05 g/L。

表8 不同无机盐及其浓度对菌株DY032菌数及芽孢率的影响

表9 正交试验因素与水平 g/L

表10 培养基正交试验结果与分析

表11 正交试验方差分析结果
2.4 菌株DY032培养基正交优化试验 基于上述单因素试验的结果,培养基配方碳源选取淀粉,氮源选取鱼粉+豆饼粉,无机盐选取MnSO4·H2O和CaCO3,由于培养基各组分之间相互影响,设计出5因素4水平L16(45)正交试验表,以芽孢数为指标通过正交试验来寻求培养基各组分之间的最佳配比。表9为正交试验因素水平表,表10为芽孢数的优化结果,芽孢数的极差分析结果表明,RA>RC>RE>RD>RB,可见,对芽孢数影响因素顺序依次是淀粉、豆饼粉、CaCO3、MnSO4·H2O和鱼粉,由正交试验方差分析结果(表11)可知,淀粉、豆饼粉、CaCO3和MnSO4·H2O各水平间差异极显著(P<0.01),鱼粉各水平间差异显著(P<0.05),通过Duncan’s多重比较(表12),进一步确定各因素各水平间的差异显著性,得出最佳水平组合为A2B3C3D3E2,所对应的培养基配方为:淀粉16 g/L,鱼粉10 g/L,豆饼粉10 g/L,MnSO4·H2O 0.05 g/L,CaCO30.03 g/L,以这一组最优培养基组合为配方进行培养48 h后,芽孢数可达45.43×108cfu/mL。
2.5 菌株DY032发酵罐小试培养条件优化试验菌株DY032培养条件极差分析结果 (表13)表明,RA>RD>RC>RB,可见对菌种芽孢数影响最大的因素是温度,其次是通气量,然后是转速和pH值,正交试验方差分析结果(表14)显示,除pH值外,其余各因素各水平差异极显著(P<0.01),通过Duncan’s多重比较进一步对各因素各水平间进行差异显著性分析(表15),得出最优培养条件组合为A2B2C2D2,即培养温度为37℃,pH值为7.0,转速为200 r/min,通气量为4 L/min。由于培养条件最优组合不对应正交试验表格中设计的试验,将分析后的这一最优组合进行验证,得到芽孢数为49.23×108cfu/mL,结果小于芽孢数最高的试验组合4,所以将菌株DY032的最优培养条件定为试验组合4,即培养温度为37℃,pH值为6.5,转速为200 r/min,通气量为5 L/min。

表12 菌株DY032培养基各水平Duncan’s多重比较结果

表13 菌株DY032培养条件正交试验结果与分析

表14 菌株DY032培养条件正交试验方差分析结果
3 讨论
本研究结果表明,影响芽孢产生的因素包括两方面:一是培养基各成分及其浓度;二是菌种培养条件。
从单因素试验结果上看,不同碳源对菌体数和芽孢数的影响差异较大,以葡萄糖为碳源时,菌体数最高 (P<0.05),但芽孢率最高只有42.0%,葡萄糖浓度为30g/L时,芽孢率只有30%,可能是因为葡萄糖为速效碳源,在菌体生长过程中能够被快速利用,但前期产生了分解代谢阻遏物(葡萄糖效应),菌种不能进一步利用葡萄糖,导致后期培养液浓度过高而抑制了芽孢的产生。这与杨立华等(2010)与郭夏丽等(2012)的研究结果一致。
以麸皮与玉米粉为碳源时,菌体数较低,但芽孢率较高,可能是麸皮与玉米粉的营养较匮乏,不利于菌体的生长,但有利于芽孢的生成。淀粉作为碳源时,芽孢率与菌体数均较高(活菌数最 高 为 25.81×108cfu/mL, 芽 孢 率 最 高 为56.2%),可能是菌株DY032在以淀粉为碳源时产生的淀粉酶,缓慢将淀粉水解为葡萄糖,菌体能利用缓慢产生的葡萄糖进行增殖,而芽孢在生长后期大量产生。
在氮源单因素优化的试验中,以蛋白胨、酵母膏、鱼粉、鱼粉+豆饼粉和豆饼粉为氮源时活菌数较高,而以硫酸铵为氮源时活菌数较低,可能与该菌对有机氮源的利用较好,不能产生能利用无机氮源的酶系有关。在有机氮源组合中,以鱼粉+豆饼粉组,活菌数和芽孢率最高,因为鱼粉为动物蛋白,豆饼粉为植物蛋白,两种蛋白相结合,氨基酸配比更加均衡,更利于菌株DY032的生长需要。
无机盐具有调节细胞膜的通透性,维持正常渗透压和酸碱平衡,参与构成酶、激素和维生素等多种生理功能。研究表明,一些金属离子对某些菌株芽孢的形成具有显著的影响,适宜浓度的金属离子能有效提高芽孢的产率(Oomes等,2004;Kong等,1998)。CaCO3和MnSO4·H2O对菌株DY032芽孢的形成具有显著促进作用 (Stefan等,2000;Hara等,1990;Busta等,1964)。Raeymaekers等(2002)指出,枯草芽孢杆菌在形成芽孢时需要一种P型Ca2+-transport ATPase的参与,这种酶作用的动力需要细胞基质内高浓度的Ca2+。Richard(1972)等通过试验证实,Ca2+是巨大芽孢杆菌芽孢形成过程中的重要离子之一,在一定浓度范围内,随着Ca2+浓度的升高,菌种所产芽孢数量越多。本试验中添加了CaCO3,还能够中和菌株DY032培养过程中产生的乳酸,起到稳定芽孢的作用。Mn2+是微生物代谢过程中产生超氧化物歧化酶、L-阿拉伯糖异构酶等多种酶的辅助因子,能促进芽孢的产生(陈秋红等,2009;郭小华等,2006;王天云等,2001)。姚露燕等(2008)研究了金属离子浓度对枯草芽孢杆菌芽孢率的影响,结果发现,随着Mn2+浓度的升高,芽孢杆菌的活菌数、芽孢数和芽孢率均逐渐升高。在本研究中,随CuSO4·5H2O浓度的增加,菌株DY032的活菌数及芽孢数明显下降,可能是Cu2+对菌株DY032菌体生长与芽孢产生中某些酶有抑制作用,Rodriguez等(2010)研究Cu2+对Clostridium tyrobutyricum芽孢的形成、萌发以及生长进行了系统研究,发现该菌芽孢形成与萌发对Cu2+高度敏感,培养基中的Cu2+浓度为15 ppm时能完全抑制菌体及芽孢的生长。

表15 菌株DY032培养条件Duncan’s多重比较结果
极差分析结果显示,除pH值外,温度、通气量和转速对芽孢数的影响差异极显著 (P<0.01)并且温度对菌株DY032芽孢数的影响最大,温度通过改变酶促反应的速率来影响菌体的生长,酶高效性的发挥需要适宜的温度,在一定温度范围内,酶促反应随着温度的升高而升高,温度过高或过低,酶的效率下降,芽孢杆菌生长代谢缓慢,菌体衰老加快,芽孢产率降低。
通气量和转速为影响菌株DY032芽孢数的第二和第三大因素,通气量和转速影响发酵液中的溶氧,菌株DY032为好氧菌,其芽孢的产生需要氧气的参与,Mohamed等(1993)通过对球形芽孢杆菌的产芽孢率与发酵液中溶氧进行研究,证实芽孢杆菌芽孢的产生与溶氧有正相关关系,培养基中氧气浓度越高,芽孢产量越高。
4 结论
通过16S rDNA序列测定和系统发育分析,菌株DY032鉴定为枯草芽孢杆菌,该菌株的最佳培养基配方为:淀粉16 g/L,鱼粉10 g/L,豆饼粉10 g/L,MnSO4·H2O 0.05 g/L,CaCO30.03 g/L;最优发酵罐培养条件为:培养温度37℃,pH值6.5,转速200 r/min,通气量5 L/min,按照最优培养条件及培养基对枯草芽孢杆菌DY032进行培养,最终芽孢数达到51.95×108cfu/mL。
[1]陈秋红,孙梅,匡群.培养条件对凝结芽孢杆菌芽孢形成的影响[J],生物术,2009,19(1):77~81.
[2]郭夏丽,狄源宁,王岩.枯草芽孢杆菌产孢条件的优化[J].中国土壤与肥料,2012,3:99~103.
[3]郭小华,陆文清.益生枯草芽孢杆菌MA139增殖培养基的优化[J].中国农业大学学报2006,11(3):41~46.
[4]王天云,陈振风,王福源.一种促使乳酸芽孢杆菌大量生成芽孢的方法[J].工业微生物,2001,3(3):13~18.
[5]杨立华.凝结芽孢杆菌产孢条件的研究:[硕士学位论文][D].湖北武汉:华中农业大学,2010,6.
[6]姚露燕,张水华,曹昱等.金属离子浓度对枯草芽孢杆菌芽孢率的影响[J].现代食品科技,2008,24(8):770~772.
[7]Barak I,Ricca E.Cutting S M.From fundamental stuadies of sporulation to applied spore research[J].Mol Microbiol,2005,55(2):330~338.
[8]Busta F F,John O Z.Use of calcium dipicolinate for enumeration of totao viable endospore populations without heat activation[J].Applied Microbiology,1964,12(2):106~110.
[9]Eugénie B,Louis C,Olivier C,etal.Sporulation boundaries and spore formation kinetics of Bacillus spp.as a function of temperature,pH and aw[J]. Food Microbiology,2012,32(1):79~86.
[10]Hara M B,Hageman J H.Energy and calcium ion dependence of proteolysis during Sporulation of Bacillus subtilis cells[J].Journal of Bacteriology,1990,172(8):4161~4170.
[11]Kong I C.Metal Toxicity on the dechlorination of monochloro pH enols in fresh and accilimated anaerobic sediment slurries[J].Wat Sci Tech,1998,38(7):143~150.
[12]Mohamed I,smail A K et al.The effect of oxygen on the sporulation and toxicity of Bacillus sphericus 2362[J].Biotechnollett,993,15(1):34~43.
[13]Oomes S J C M,Brul S B.The effect of metal ions commonly present in food on gene expression of sporulating Bacillus subtilis cells in relation to spore wet heat resistance [J].Innovative Food Science and Emerging Technologies,2004,5:307~316.
[14]Prabhat K T,Valeria O A,Maryam A,et al.Updates on the sporulation process in Clostridium species[J].Research in Microbiology,2015,166:225~235.
[15]Raeymaekers L,Wuytack E Y.Willems I.Expression of a P-type Ca2+-transport ATPase in Bacillus subtilis during sporulation [J].Cell Calcium,2002,32(2),93~103.
[16]Rodriguez L M,Alatossava T.Effects of copper on germination,growth and sporulation of Clostridium tyrobutyricum[J].Food Microbiology,2010,27:434~437.
[17]Richard A G,Ralph A S.Minimal requirement for commitment to sporulation in Bacillus megaterium[J].Journal of Bactruiology,1972,111(2):557~565.
[18]Stefan R,Sigid E,Helmut S.Calcium and malate are sporulation-promoting factors of Physarum polycephalum [J].Journal of Bacteriology,2000,182(24):6900~6905.■
A bacterium named DY032 screened from gut of chicken,designated strain DY032,throngh the 16S rDNA sequence molecular identificaton and phylogenetic analysis,which was indicated Bacillus subtillis.Single factor test was used to optimize the fermentated medium of strain DY032.Based on the results of single factor test,five important factors that influence the viable count and spore were determined.Appropriate concentration of starch,fishmeal,soybean cake powder,MnSO4·H2O and CaCO3were 20,10,10,0.05,0.05 g/L,respectively.To determine the best proportion of the above 5 factors,L16(45)orthogonal test were used.Based on the the optimum medium,the culture temperature,pH,stirring speed and air flow rate during fermentation were optimized by the L9(34)orthogonal test in 10 L bioreactor,spores were considered as index.The results showed that the optimum medium was as follows:starch 16 g/L,fishmeal 10 g/L,soybean cake powder 10 g/L,MnSO4·H2O 0.05 g/L,CaCO30.03 g/L.The optimal culture conditions were culture temperature of 37℃,pH of 6.5,stirring speed of 200 r/min,and air flow rate of 5 L/min.Under these optimization conditions,the number of spore was up to 51.95×108cfu/mL。
strain DY032;16S rDNA;optimization
S816.3
A
1004-3314(2017)05-0013-07
10.15906/j.cnki.cn11-2975/s.20170503
山西省重点研发计划(201603D221026-3)
*通讯作者
