河口区淡水与微咸水潮汐湿地CH4和CO2的产生速率
2017-04-12任洪昌胡敏杰汪旭明
任 鹏, 任洪昌, 胡敏杰, 汪旭明, 仝 川
(福建师范大学地理科学学院/湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007)
河口区淡水与微咸水潮汐湿地CH4和CO2的产生速率
任 鹏, 任洪昌, 胡敏杰, 汪旭明, 仝 川
(福建师范大学地理科学学院/湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007)
通过室内培养试验研究盐度差异对闽江河口短叶茳芏潮汐湿地CH4和CO2的产生速率以及土壤理化性质的影响.结果显示,淡水湿地和微咸水湿地土壤CH4的产生速率分别为0.03~0.76 μg·g-1·d-1和0.01~0.22 μg·g-1·d-1,平均值分别为(0.27±0.06) μg·g-1·d-1和(0.10±0.03) μg·g-1·d-1.土壤CO2产生速率分别为0.44~6.68 μg·g-1·d-1和0.64~6.77 μg·g-1·d-1,平均值分别为(3.03±0.42) μg·g-1·d-1和(3.47±0.41) μg·g-1·d-1.淡水湿地土壤CH4的产生速率显著高于微咸水湿地(P<0.05),而2个潮汐湿地土壤CO2的产生速率并无显著差异.微咸水湿地的电导率、pH、总碳(TC)、总磷(TP)均极显著高于淡水湿地(P<0.01),总氮(TN)含量显著高于淡水湿地(P<0.05).相关分析显示,土壤CH4和CO2产生速率主要受温度、电导率、pH、TC、TN、TP的影响.
产生速率; CH4和CO2; 淡水与微咸水; 潮汐湿地; 闽江河口
CO2和CH4是大气中重要的温室气体,自1750年以来,其含量分别提高了40%和105%,达到3.91×10-4和1.803×10-6[1],对其排放通量的研究一直是全球气候变化研究的焦点[2,3].其中CH4是仅次于CO2的第二大温室气体,其全球增温潜势(GWPs)是CO2的25倍,对全球变暖的贡献率可达20%左右[4].湿地是陆地生态系统中重要的有机碳库,特别在CH4和CO2等含碳温室气体的固定和释放中起着重要的开关作用,被称为“转换器”[5].河口潮汐湿地处于陆海交互作用的集中带,受河流径流和海洋潮汐的共同作用,形成过程复杂多变,生态敏感脆弱,是融多种生态系统于一体的复杂系统[6,7].由于气候变暖,海平面上升以及极端天气事件的增多,河口潮汐湿地遭受盐水入侵的现象日益严重.
盐度是影响河口潮汐湿地碳循环的一个重要环境因子.早在上世纪80年代,Delaune et al[8]通过对河口自然盐度梯度下湿地CH4排放通量原位的测定,发现CH4排放与盐度之间存在显著负相关.张子川等[9]通过采集闽江河口区淡水和微咸水短叶茳芏潮汐湿地土样,添加不同盐度的人造海水、NaCl溶液以及盐度为0的去离子水,进行室内泥浆厌氧培养实验,发现盐度对淡水和微咸水潮汐沼泽湿地CH4产生均有显著的抑制作用.然而,也有部分学者研究发现,少量的盐分输入会对湿地CH4的产生与排放有一定的促进作用,如 Bartlett et al[10,11]对美国弗吉尼亚湾河口湿地进行了原位测定,发现随着盐度的升高CH4排放呈先增加后减少的趋势,CH4排放通量最高值出现在盐度居中的地段.Weston et al[12]采集新泽西州Delaware河口潮汐湿地原状土,通过室内模拟试验发现,盐水入侵显著促进了湿地CH4的排放.研究表明盐度对湿地CH4的产生与排放无显著影响.Krauss et al[13]对美国Savannah河口潮汐湿地温室气体排放的研究发现,盐度差异为0.2~4.7 g·L-1时对CH4排放无影响.

福建省闽江河口区地处中亚热带和南亚热带过渡区,是中国东南沿海典型的开放型河口之一.由于受盐水入侵上溯的影响,形成了较长的感潮河段,分布许多不同类型的河口湿地.在海平面上升和极端天气事件增多的背景下,开展闽江河口区不同盐度湿地温室气体产生速率的研究具有重要意义.
1 研究区概况
选择闽江河口面积最大的鳝鱼滩湿地(26°01′48.0″N,119°37′35.3″E)和该河口中游段的道庆洲湿地(25°57′21.4″N,119°24′25.6″E)作为样地,具体地理位置见图1.其中鳝鱼滩湿地潮水盐度变化范围为0.941‰~8.100‰,属于微咸水湿地,主要优势植被群落有土著种的短叶茳芏(Cyperusmalaccensis)、芦苇(Phragmitesaustralis)以及外来入侵种互花米草(Spartinaalterniflora).土壤粒径组成中粘粒占8.49%±1.72%,粉砂粒占53.50%±3.94%,砂粒含量为38.01%±4.92%.道庆洲湿地潮水盐度范围为0.160‰~0.311‰,属于淡水湿地,优势植被主要为短叶茳芏(Cyperusmalaccensis),土壤粒径组成中粘粒占9.39%±3.70%,粉砂粒占62.33%±5.69%,砂粒占28.28%±8.77%.
2 材料与方法
2.1 样品采集与处理
在2013年11月、2014年2、5、8月的一个小潮日(分别代表一年内秋、冬、春、夏4个季节),利用土壤采样器采集短叶茳芏(Cyperusmalaccensis)植被带下0~5 cm、5~10 cm、10~15 cm 3个不同深度的原状土柱,每个采样地设置4个重复,共24个土柱.将采集土样装入圆筒状培养瓶(PVC材质,底部密封,顶部加塞,高度12 cm,内径5 cm),运回实验室培养.并采用同样方法另采集一份土样,4个重复,用于土壤理化性质测定.此外,与土样采集同步,将原位采集的潮水运回实验室进行厌氧培养.
2.2 土壤理化指标的测定
原位土样经自然风干后,剔除根系和沙石,过0.149 mm网筛.采用碳氮元素分析仪(德国艾力蒙塔公司提供)测定土壤总碳(TC)、总氮(TN)含量;土壤总磷(TP)在浸提后采用流动注射分析仪(荷兰斯卡拉仪器公司提供)测定.土壤电导率及pH采用便携式电导计(美国光谱技术公司提供)和便携式pH计(美国奥豪斯公司提供)测定.土壤粒径采用Mastersizer 2000激光衍射粒度分析仪测定,粒径分级采用国际制土粒分级方法,即黏粒粒径<2 μm,粉砂粒粒径2~20 μm,砂粒粒径>20 μm.

图1 研究样点位置示意图
2.3 室内培养与气体含量的测定
2.3.1室内培养 将采集的原位潮水注入上述培养瓶内(淹没土壤表层1 cm).在培养试验开始前,将培养瓶在培养温度下预培养1 d;预培养结束后,将培养瓶用硅橡胶塞密封,并提前在硅橡胶塞中间打2个孔,往其中1个孔插入1根长玻璃管,长度以接近泥浆表层为宜(不要插入泥浆),作为氮气(N2)进口;另1根玻璃管较短,稍稍插入培养瓶即可,作为气体出口和取样口.然后用纯N2(含量99.99%)通过上述N2进口玻璃管对培养瓶进行冲洗(8~10 min),直至达到厌氧状态[13],测定培养瓶内气体浓度,以此作为初始浓度.然后,根据闽江河口气象观测站提供的温度数据,将培养温度设置为采样时所在季节平均气温(春季17.45 ℃,夏季27.45 ℃,秋季21.36 ℃,冬季11.01 ℃),每天同一时间用气密针从培养瓶顶部抽取气样,每次抽取3 mL,测定CH4和CO2气体的含量.每次抽气完成后注入同等体积N2以保持培养瓶内的气压平衡.为了尽可能反映河口湿地土壤CH4和CO2的实际产生速率,培养分为2个阶段,每4 d为一个阶段,最终的产生速率为2个阶段的平均值.当第1个培养阶段结束后,用纯N2对培养瓶重新进行清洗(约8~10 min),并开始下一阶段的培养与气体含量测定,计算前后2个阶段产生速率的平均值,以此作为产生速率.
2.3.2 CH4和CO2产生速率的测定 分别用GC-2010和GC-2014气相色谱仪测定CH4和CO2气体含量.CH4含量测定:进样口温度、柱箱温度和检测器温度分别为100、45和280 ℃,N2流量、H2流量和空气流量分别为30、47和400 mL·min-1.CO2含量的测定:进样口温度、柱箱温度和检测器温度分别为100、45和280 ℃,N2流量、H2流量和空气流量分别为30、40和400 mL·min-1.检测器均为FID(氢火焰离子化)检测器,N2(纯度≥99.999%)为载气,氢气(纯度≥99.99%)为燃气,空气作为助燃气.土壤CH4和CO2产生速率的计算公式[16]表示如下:
式中:P为CH4或CO2的产生速率/(μg·g-1·d-1);dc/dt为培养瓶内CH4或CO2气体含量单位时间的变化/(μL·L-1·d-1);VH为培养瓶内部空间体积/L;WS为干土重/g;MW为CH4或CO2的摩尔质量/(g·mol-1);MV为标准状态下1 mol气体的体积(22.4 L·mol-1);TST为标准温度(273 K);T为培养温度/℃.
2.4 数据处理与分析
运用SPSS 19.0统计分析软件对数据进行统计分析,使用Excel 2007软件作图.首先检验试验数据是否符合方差齐性和正态分布,若数据检验不通过,需对原始数据进行对数转化,直到检验通过后再进行数据分析.采用SPSS 19.0统计分析软件中的单因素方差分析法分别对同一样地不同季节、同一样地不同土层的CH4和CO2的产生速率进行差异性分析.采用独立样本T检验对不同样地CH4和CO2产生速率进行差异性分析.采用Pearson相关分析方法分析CH4和CO2产生速率与环境因子之间的相关性.本文中所有误差均为标准误差.
3 结果与分析
3.1 环境因子时空特征
闽江河口湿地土壤环境因子动态特征如图2所示(数值为3个深度的平均值±标准误差,n=12).淡水和微咸水湿地电导率分别为0.16~0.31 mS·cm-1和1.14~3.14 mS·cm-1,平均值分别为0.24和2.16 mS·cm-1,微咸水湿地电导率极显著高于淡水(P<0.01).淡水和微咸水湿地pH分别为4.85~5.07和6.54~6.89,平均值分别为4.78和6.71,表明微咸水湿地pH极显著高于淡水湿地(P<0.01).淡水和微咸水湿地TC含量分别为18.88~21.48 g·kg-1和17.61~19.03 g·kg-1,平均值分别为20.28和18.40 g·kg-1,淡水湿地TC含量极显著高于微咸水湿地(P<0.01).淡水和微咸水TN含量分别为1.71~1.96 g·kg-1和1.83~2.08 g·kg-1,平均值分别为1.84和1.94 g·kg-1,表明微咸水湿地TN含量显著高于淡水湿地(P<0.05).淡水和微咸水湿地TP含量分别为0.73~0.84 mg·g-1和0.81~0.90 mg·g-1,平均值分别为0.78和0.85 mg·g-1,表明微咸水湿地TP含量极显著高于淡水湿地(P<0.01).综上所述,微咸水湿地电导率极显著高于淡水湿地,二者盐度存在显著差异.微咸水湿地TN和TP含量均显著高于淡水湿地,而TC含量显著低于淡水湿地.

图2 淡水和微咸水湿地土壤环境因子时空动态特征
3.2 CH4产生速率
淡水与半咸水湿地0~15 cm土壤CH4产生速率的季节变化如图3所示.总体上看,淡水湿地土壤CH4产生速率高于微咸水湿地,平均值分别为0.27和0.10 μg·g-1·d-1.其中淡水湿地土壤CH4产生速率最高值和最低值分别出现在夏季和冬季,平均值分别为0.76和0.03 μg·g-1·d-1,各季节土壤CH4产生速率总体表现为夏季>秋季>春季>冬季.微咸水湿地土壤CH4产生速率最高值和最低值分别出现在夏季和冬季,平均值分别为0.22和0.01 μg·g-1·d-1,各季节土壤CH4产生速率总体表现为夏季>春季>秋季>冬季.统计分析显示,淡水湿地土壤CH4产生速率总体上显著高于微咸水湿地(P<0.05),其中秋季淡水湿地土壤CH4产生速率极显著高于微咸水湿地(P<0.01),夏季淡水湿地土壤CH4产生速率显著高于微咸水湿地(P<0.05),冬、春季两样地之间无显著差异(P>0.05).淡水湿地夏季土壤CH4产生速率显著高于其他三季(P<0.05),而冬季土壤CH4产生速率显著低于其他三季(P<0.05).微咸水湿地春季和夏季土壤CH4产生速率分别显著高于秋、冬季节(P<0.05).
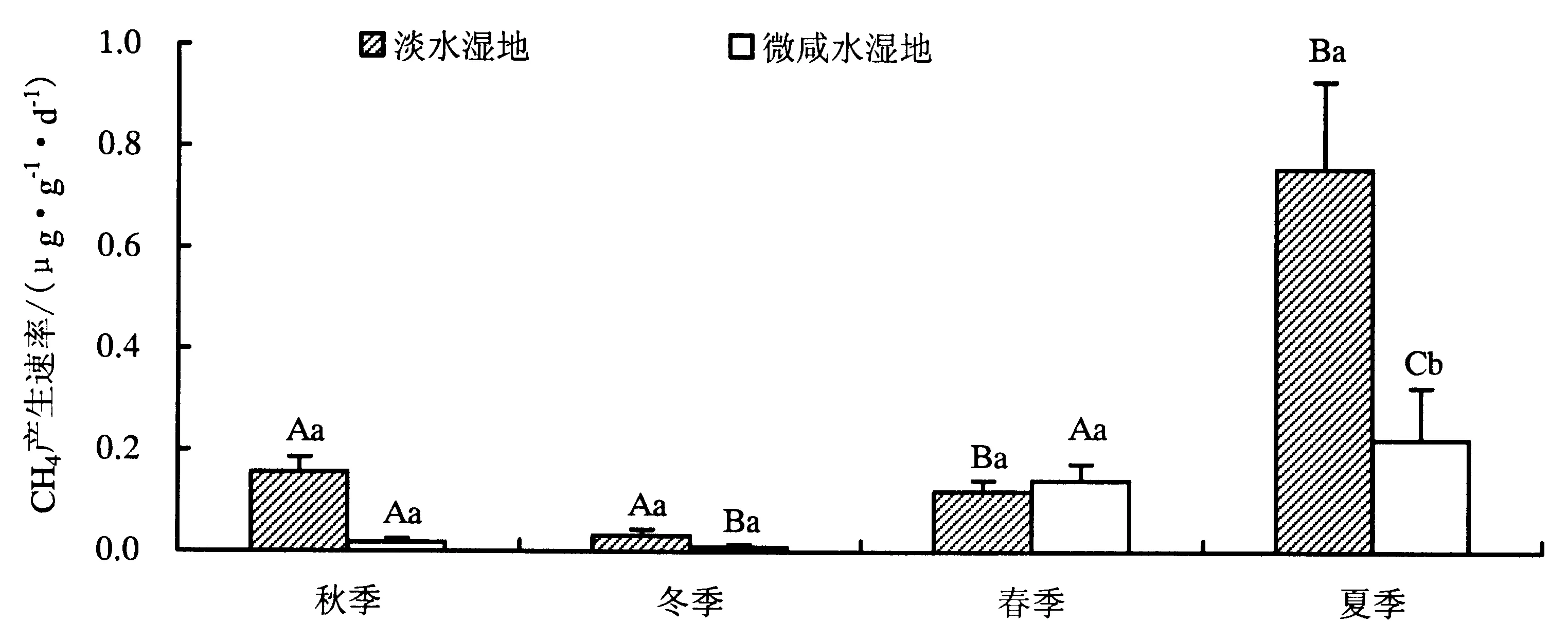
不同大写字母代表同一样地不同季节差异显著,不同小写字母代表同一季节不同样地之间差异显著.
从图4可知:淡水湿地0~5 cm土层夏季CH4产生速率显著高于春、秋、冬3个季节(P<0.05),5~10 cm和10~15 cm土层冬季CH4产生速率显著低于其他3个季节(P<0.05);同一季节不同土层之间CH4产生速率均无显著差异(P>0.05).微咸水湿地0~5 cm土层春季和夏季土壤CH4产生速率分别显著高于秋、冬季节(P<0.05),5~10 cm土层各季节间均无显著差异(P>0.05),10~15 cm土层夏季CH4产生速率显著高于秋、冬季节(P<0.05),同一季节不同土层之间CH4产生速率均无显著差异(P>0.05).
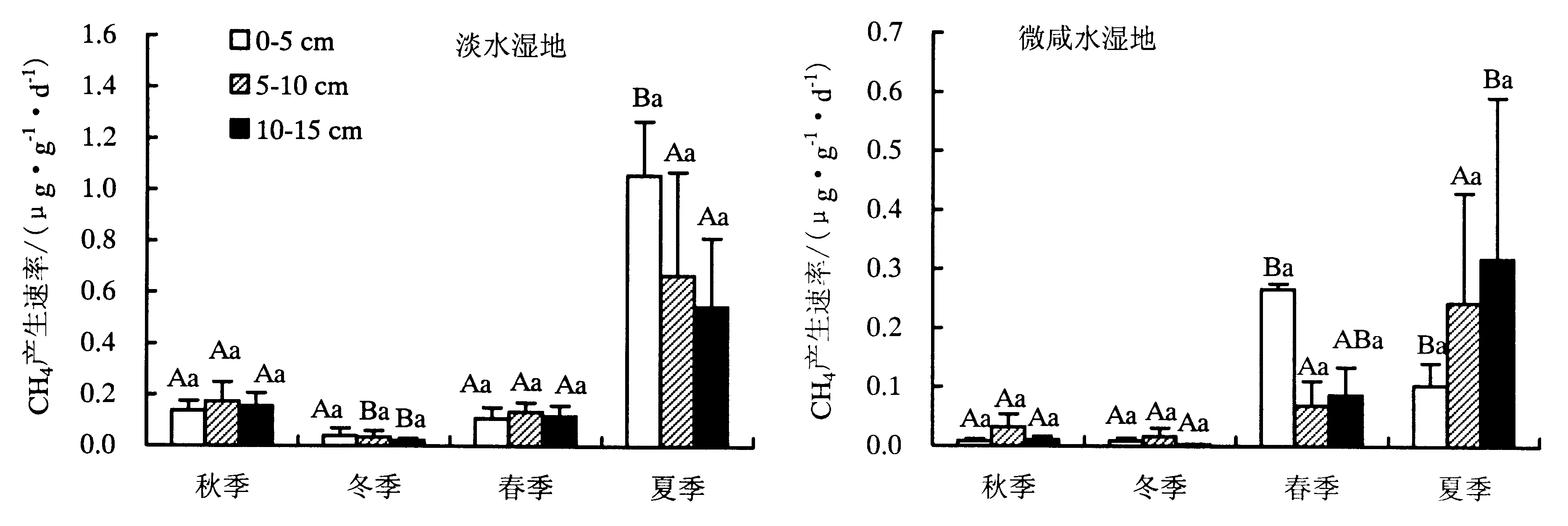
不同大写字母代表同一样地同一土层不同季节差异显著,不同小写字母代表同一样地在同一季节下不同土层之间差异显著.
3.3 CO2产生速率
从图5可知,微咸水湿地土壤CH4产生速率高于淡水湿地,平均值分别为3.47和3.03 μg·g-1·d-1.其中淡水湿地土壤CO2产生速率最高值和最低值分别出现在夏季和秋季,平均值分别为6.68和0.44 μg·g-1·d-1,各季节土壤CO2产生速率总体表现为夏季>春季>冬季>秋季.微咸水湿地土壤CO2产生速率最高值和最低值分别出现在夏季和秋季,平均值分别为6.77和0.64 μg·g-1·d-1,季节动态表现为夏季>春季>冬季>秋季.统计分析显示,淡水湿地土壤CO2产生速率与微咸水湿地之间总体上无显著差异(P>0.05),但冬季微咸水湿地土壤CO2产生速率极显著高于淡水湿地(P<0.01),春季微咸水湿地土壤CO2产生速率显著高于淡水湿地(P<0.05),夏秋季两样地之间无显著差异(P>0.05).淡水和微咸水湿地土壤CO2产生速率在夏季均显著高于其他三季(P<0.05),春季均显著高于秋冬季节(P<0.05),而秋季均显著低于其他3个季节(P<0.05).
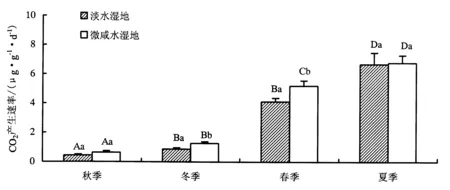
图5 淡水和微咸水湿地0~15 cm深度土壤CO2产生速率季节动态
从图6可知,淡水湿地0~5 cm土层夏季CO2产生速率显著高于春、秋、冬季节(P<0.05),春季CO2产生速率显著高于秋、冬季节(P<0.05);5~10 cm土层春季和夏季CO2产生速率均显著高于秋、冬季节(P<0.05),冬季CO2产生速率显著高于秋季(P<0.05);10~15 cm土层春季和夏季CO2产生速率均显著高于秋、冬两季(P<0.05);而冬季0~5 cm土层冬季CO2产生速率显著高于10~15 cm土层(P<0.05),其余各季节不同土层之间CO2产生速率无显著差异(P>0.05).微咸水湿地0~5 cm土层夏季CO2的产生速率显著高于秋、冬季节(P<0.05),春季CO2产生速率与其余三季均无显著差异(P>0.05);5~10 cm土层春季和夏季CO2产生速率均显著高于秋、冬季节(P<0.05),冬季CO2产生速率显著高于秋季(P<0.05);10~15 cm土层春季和夏季CO2产生速率均显著高于秋冬两季(P<0.05);各季节不同土层之间CO2产生速率无显著性差异(P>0.05).
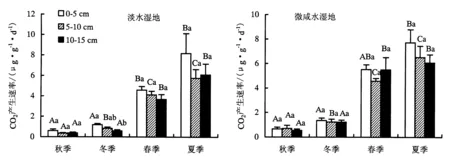
不同大写字母表示同一样地同一土层不同季节差异显著,不同小写字母表示同一样地在同一季节下不同土层之间差异显著.
3.4 CH4和CO2产生速率与环境因子的相关性
从表1可知,淡水湿地土壤CH4产生速率与培养温度和TP含量均呈极显著正相关(n=48,P<0.01),而与电导率呈极显著负相关(n=48,P<0.01).微咸水湿地土壤CH4产生速率与土壤TN呈极显著正相关(n=48,P<0.01),与培养温度和TC含量呈显著正相关(n=48,P<0.05).
淡水湿地土壤CO2产生速率与培养温度、TN和TP含量呈极显著正相关(n=48,P<0.01).微咸水湿地土壤CO2产生速率与培养温度、TN和TP含量呈极显著正相关(n=48,P<0.01),与pH值呈显著正相关(n=48,P<0.05),而与电导率呈极显著负相关(n=48,P<0.01).
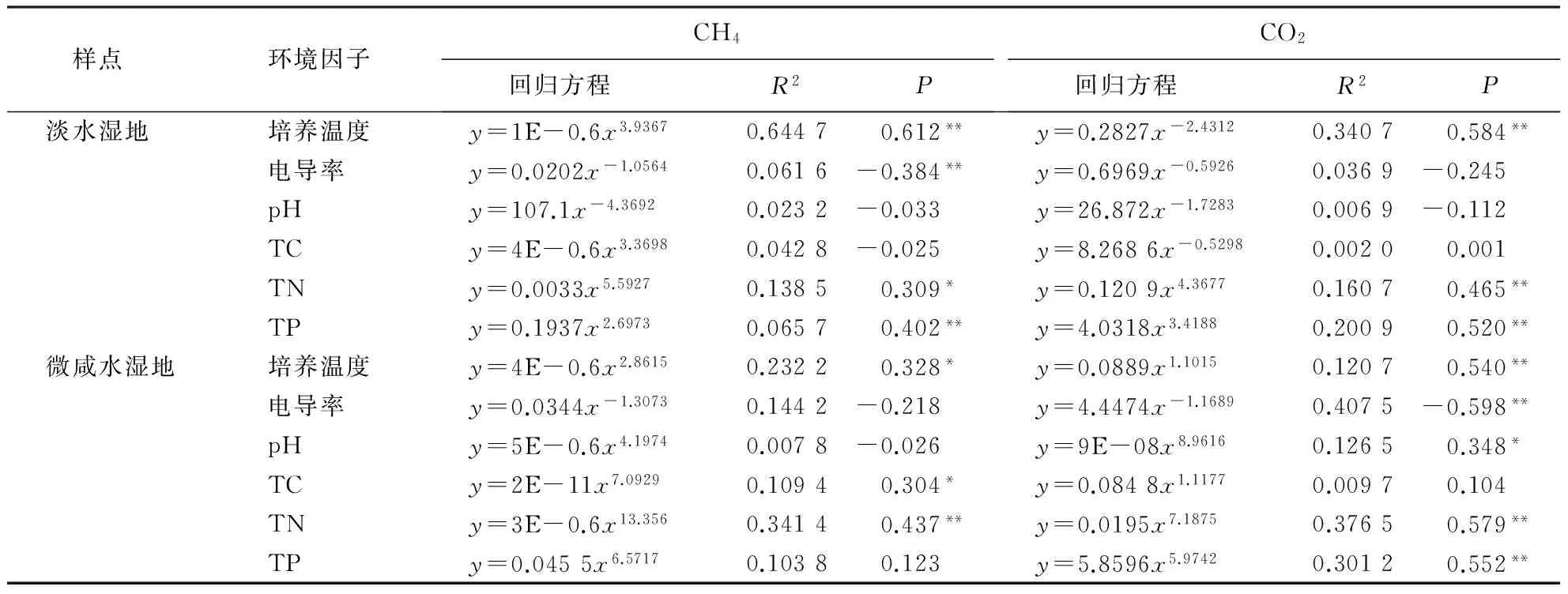
表1 淡水和微咸水湿地CH4和CO2产生速率与环境因子的相关性(n=48)1)
1)*表示差异显著;**表示差异极显著.
4 讨论
闽江口淡水和微咸水湿地土壤CH4产生速率最高值均出现在夏季,最低值均出现在冬季,温度是影响湿地碳循环的重要环境因子之一.一般认为,温度升高会增强土壤微生物活性,加速有机质分解,为产甲烷菌提供大量底物,从而加快土壤CH4和CO2的产生与排放[17,18].此外,温度升高也会对土壤产甲烷菌的群落结构和优势菌种类产生影响,改变产甲烷代谢途径,影响土壤甲烷菌产甲烷能力的发挥[19,20].丁维新等[21]研究表明,在低温条件下,土壤产甲烷菌中的优势菌为只能利用乙酸的甲烷毛菌(Methanosaetaceae),产甲烷能力相对较弱;而高温条件下,土壤产甲烷菌中的优势菌以乙酸和CO2/H2均可利用的甲烷八叠球菌(Methanosarcinaceae)为主,产甲烷能力相对较强.Avery et al[22]对美国北卡罗莱纳州White Oak河流沉积物甲烷产生速率的研究发现,随着培养温度的升高,土壤甲烷产生总速率、乙酸发酵产甲烷速率以及CO2还原途径产甲烷速率均表现为指数增长趋势.本研究发现,淡水和微咸水沼泽土壤CH4和CO2产生速率均与各季节培养温度存在显著正相关关系,CH4和CO2产生速率最高值均出现在培养温度最高的夏季,表明培养温度是影响土壤CH4和CO2产生速率的重要环境因子.

湿地土壤CH4产生与产甲烷菌可利用底物的丰富度密切相关,同时底物也是土壤碳矿化的基础,底物充足在一定程度上可以促进土壤碳矿化.研究表明在适宜条件下,土壤和外源有机碳在产甲烷过程中起重要作用,有学者研究发现湿地甲烷排放与土壤有机碳含量之间存在较强的相关性[31,32].本研究发现TC含量较高的淡水湿地土壤CH4产生速率高于TC含量较低的微咸水,且微咸水湿地土壤CH4产生与TC含量呈显著正相关,这可能是因为TC中的有机碳为产甲烷菌提供了丰富的底物,提高了土壤CH4产生速率.此外,本研究发现淡水和微咸水湿地土壤CH4和CO2的产生速率均与TN和TP含量存在显著或极显著正相关.通常认为氮是湿地生态系统的限制元素,研究[33]表明土壤中氮素增加会加速土壤有机碳矿化,为产甲烷菌提供底物,从而促进土壤CH4产生.此外,土壤中氮素增加可以提高土壤酶活性,加速土壤有机质分解速率,降低土壤C/N,促进土壤CO2产生[34].一般认为,湿地生态系统不存在磷素限制作用,然而磷增加却可以提高碳矿化速率,促进湿地土壤CH4和CO2产生[35].
[1] IPCC. Climate change 2013: the physical science basis[R]. Cambridge, UK, and New York: Cambridge University Press, 2013.
[2] TONG C, WANG C, HUANG J F, et al. Ecosystem respiration does not differ before and after tidal inundation in brackish marshes of the Min River estuary, Southeast China[J]. Wetlands, 2014,34(2):225-233.
[3] BATSON J, NOE G B, HUPP C R, et al. Soil greenhouse gas emissions and carbon budgeting in a short-hydroperiod floodplain wetland[J]. Journal of Geophysical Research, 2015,120(1):77-95.
[4] IPCC. Climate change 2007: the physical science basis[R]. Cambridge, UK, and New York: Cambridge University Press, 2007.
[5] 马安娜,陆健健.湿地生态系统碳通量研究进展[J].湿地科学,2008,6(2):116-123.
[6] 游巍斌,何东进,林立,等.闽东滨海湿地生态脆弱性动态评价[J].福建农林大学学报(自然科学版),2013,42(6):648-653.
[7] 黄桂林,何平,侯盟.中国河口湿地研究现状及展望[J].应用生态学报,2006,17(9):1 751-1 756.
[8] DELAUNE R D, SMITH C J, PATRICK W H. Methane release from Gulf coast wetlands[J]. Tellus B, 1983,35(1):8-15.
[9] 张子川,杨平,仝川.盐分对河口淡水、微咸水沼泽湿地土壤甲烷产生潜力的影响[J].生态学报,2015,35(24):8 075-8 084.
[10] BARTLETT K B, HARRISS R C, SEBACHER D I. Methane flux from coastal salt marshes[J]. Journal of Geophysical Research: Atmospheres, 1985,90(D3):5 710-5 720.
[11] BARTLETT K B, BARTLETT D S, HARRISS R C, et al. Methane emissions along a salt marsh salinity gradient[J]. Biogeochemistry, 1987,4(3):183-202.
[12] WESTON N B, VILE M A, NEUBAUER S C, et al. Accelerated microbial organic matter mineralization following salt-water intrusion into tidal freshwater marsh soils[J]. Biogeochemistry, 2011,102(1-3):135-151.
[13] KRAUSS K W, WHITBECK J L. Soil greenhouse gas fluxes during wetland forest retreat along the lower Savannah River, Georgia (USA)[J]. Wetlands, 2012,32(1):73-81.
[14] MARTON J M, HERBERT E R, CRAFT C B. Effects of salinity on denitrification and greenhouse gas production from laboratory-incubated tidal forest soils[J]. Wetlands, 2012,32(2):347-357.
[15] 聂明华,刘敏,侯立军,等.长江口潮滩土壤呼吸季节变化及其影响因素[J].环境科学学报,2011,31(4):824-831.
[16] WASSMANM R, NEUE H U, BUENO C, et al. Methane production capacities of different rice soils derived from inherent and exogenous substrates[J]. Plant and Soil, 1998,203(2):227-237.
[17] INGLETT K S, INGLETT P W, REDDY K R, et al. Temperature sensitivity of greenhouse gas production in wetland soils of different vegetation[J]. Biogeochemistry, 2012,108(1-3):77-90.
[18] 王洋,刘景双,窦晶鑫,等.温度升高对湿地系统温室气体排放的影响[J].安全与环境学报,2010,10(5):122-126.
[19] 吴美容,张瑞,周俊,等.温度对产甲烷菌代谢途径和优势菌群结构的影响[J].化工学报,2014,65(5):1 602-1 606.
[20] HØJ L, OLSEN R A, TORSVIK V L. Effects of temperature on the diversity and community structure of known methanogenic groups and other archaea in high Arctic peat[J]. The ISME Journal, 2008,2(1):37-48.
[21] 丁维新,蔡祖聪.温度对甲烷产生和氧化的影响[J].应用生态学报,2003,14(4):604-608.
[22] AVERY G B, SHANNON R D, WHITE J R, et al. Controls on methane production in a tidal freshwater estuary and a peatland: methane production via acetate fermentation and CO2reduction[J]. Biogeochemistry, 2003,62(1):19-37.
[23] 汪旭明,任洪昌,仝川.盐度对河口潮汐湿地温室气体产生和排放的影响研究进展[J].湿地科学,2014,12(6):814-820.
[24] CHAMBERS L G, OSBORNE T Z, REDDY K R. Effect of salinity-altering pulsing events on soil organic carbon loss along an intertidal wetland gradient: a laboratory experiment[J]. Biogeochemistry, 2013,115(1-3):363-383.
[25] 王维奇,曾从盛,仝川.控制湿地甲烷产生的主要电子受体研究进展[J].地理科学,2009,29(2):300-306.
[26] NEUBAUER S C. Ecosystem responses of a tidal freshwater marsh experiencing saltwater intrusion and altered hydrology[J]. Estuaries and Coasts, 2013,36(3):491-507.
[27] 卢昌义,叶勇,林鹏,等.海南海莲红树林土壤CH4的产生及其某些影响因素[J].海洋学报,1998,20(6):132-138.
[28] EDMONDS J W, WESTON N B, JOYE S B, et al. Microbial community response to seawater amendment in low-salinity tidal sediments[J]. Microbial Ecology, 2009,58(3):558-568.
[29] BALDWIN D S, REES G N, MITCHELL A M, et al. The short-term effects of salinization on anaerobic nutrient cycling and microbial community structure in sediment from a freshwater wetland[J]. Wetlands, 2006,26(2):455-464.
[30] 崔有为,王淑莹,宋学起,等.NaCl盐度对活性污泥处理系统的影响[J].环境工程,2004,22(1):19-21.
[31] CHANG T C, YANG S S. Methane emission from wetlands in Taiwan[J]. Atmospheric Environment, 2003,37(32):4 551-4 558.
[32] SINGH S N, KULSHRESHTHA K, AGNIHOTRI S. Seasonal dynamics of methane emission from wetlands[J]. Chemosphere-Global Change Science, 2000,2(1):39-46.
[33] LINDAU C W, DELAUNE R D, PARDUE J H. Inorganic nitrogen processing and assimilation in a forested wetland[J]. Hydrobiologia, 1994,277(3):171-178.
[34] SONG Y, SONG C, LI Y, et al. Short-term effect of nitrogen addition on litter and soil properties inCalamagrostisangustifoliafreshwater marshes of Northeast China[J]. Wetlands, 2013,33(3):505-513.
[35] 刘德燕,宋长春.磷输入对湿地土壤有机碳矿化及可溶性碳组分的影响[J].中国环境科学,2008,28(9):769-774.
(责任编辑:叶济蓉)
CH4and CO2production rates from freshwater and brackish marshes in the Min River estuary
REN Peng, REN Hongchang, HU Minjie, WANG Xuming, TONG Chuan
(College of Geographical Sciences/Key Laboratory of Humid Sub-tropical Eco-geographical Process of the Ministry of Education, Fujian Normal University, Fuzhou, Fujian 350007, China)
Using laboratory incubation experiment, the effects of salinity on CH4and CO2production rates fromCyperusmalaccensistidal wetlands in Min River estuary were measured. Then soil physical-chemical properties were examined to elucidate the dynamic characteristics. The results showed that under anaerobic conditions, CH4production rates from the freshwater and brackish marsh amounted to 0.03 -0.76 μg·g-1·d-1and 0.01- 0.22 μg·g-1·d-1, with (0.27±0.06) μg·g-1·d-1and (0.10±0.03) μg·g-1·d-1being the averages, respectively. CO2production rates from the freshwater and brackish marsh amounted to 0.44-6.68 μg·g-1·d-1and 0.64-6.77 μg·g-1·d-1, with (3.03±0.42) μg·g-1·d-1and (3.47±0.41) μg·g-1·d-1being the averages, respectively. CH4production rate was significantly higher from freshwater marsh than brackish marsh (P<0.05), while no statistical differences between CO2production rates from both marshes. Physical-chemical property analysis showed that EC, pH, total carbon (TC), total nitrogen (TN), total phosphorus (TP) were significantly higher at the freshwater marsh than brackish marsh (P<0.05 orP<0.01). Moreover, correlation analysis revealed that CH4and CO2production rates were mainly controlled by temperature, EC, pH, TC, TN and TP.
production rate; CH4and CO2; freshwater and brackish; tidal marsh; Min River estuary
2016-06-14
2016-10-12
国家自然科学基金资助项目(41371127);福建省科技厅重点资助项目(2014R1034-1).
任鹏(1992-),男,硕士研究生.研究方向:湿地生态与环境.Email:1426488002@qq.com.通讯作者仝川( 1964-),男,教授,博士生导师.研究方向:湿地生物地球化学循环.Email:tongch@fjnu.edu.cn.
X144
A
1671-5470(2017)02-0211-09
10.13323/j.cnki.j.fafu(nat.sci.).2017.02.015
