抗HTNV中和性鼠/人嵌合抗体基因向植物转化研究
2017-04-12谢伟强
谢伟强
摘 要:在由农杆菌介导的叶盘法转化烟草的研究中,将含有重组质粒的农杆菌过夜培养后按1∶100接种于新鲜的LB培养液中培养6h至OD600≈0.6时,取菌液经梯度稀释后分别对大小约0.5cm2的烟草叶片进行不同时间浸染。结果表明,用经20倍稀释后的菌液浸染的烟草叶片其转化率达97%以上,且不同时间浸染的处理间无显著差异,培养基中激素浓度以6-BA 1.5mg/L IAA 0.5mg/L为宜。
关键词:汉滩病毒;嵌合抗体;转基因植物;烟草
中图分类号 R392 文献标识码 A 文章编号 1007-7731(2016)23-0046-05
Transformation of Full-length Gene of Mouse/human Chimeric Antibody against HTNV into Plants
Xie Weiqiang
(Yangling Institute of Quality and Technology Inspection,Yangling 712100,China)
Abstract:In this thesis Agrobacterium-mediated transformation of tobacco leaf discs with Agrobacterium tumefaciens containing mouse/human chimeric antibody gene against Hantaan virus was studied.Overnight cultured Agrobacterium tumefaciens containing recombinant plasmid was inoculated in fresh LB culture medium by the Ratio of 1∶100 and incubated till OD600 was about 0.6.Then the pellet of Agrobacterium tumefaciens was diluted gradiently and used to immerse the tobacco leaf discs about 0.5cm2 for different length of time.The results showed that the highest transformation efficiency was obtained with the tobacco leaves immersed by the Agrobacterium tumefaciens which had been diluted 20 times,that no less than 97% leaf discs callused.There were no significant differences among treatments for different immersing time.In addition,it was appropriate for callusing of tobacco leaf discs when the concentrations of 6-BA being 1.5mg / L and IAA being 0.5mg / L.
Key words:Hantaan virus;Chimeric antibody;Transgenic plant;Tobacco
1 引言
1.1 腎综合征出血热(HFRS)的研究意义及其进展 肾综合征出血热(HFRS)是一类以发热、出血和肾脏损害为主要临床特征的疾病。全世界90%以上的HFRS病例发生在我国,疫情非常严重,年发病人数超过10万,且以青壮年居多,死亡率约5%~10%。HFRS已成为目前我国死亡人数最多的急性病毒性传染病之一。汉滩病毒(HTNV)隶属于布尼亚病毒科汉滩病毒属,在我国发生的HFRS主要由该病毒引起,因此对HTNV的研究具有十分重要的意义。
对HFRS的治疗,迄今还没有特异有效的治疗药物,临床上主要是采取血液透析等方法进行对症处理,费用昂贵。目前,对该病治疗制剂研究最多的是抗HTNV鼠源性单克隆抗体(mAb),但由于其在人体内应用易导致人抗鼠抗体的产生,不仅影响其治疗效果,而且还存在一定的安全性问题。而人源性mAb由于存在制备困难,产量低的问题,也难以广泛应用。基因工程抗体主要是在原核及真核系统中表达,原核表达系统虽然表达产量高,但由于其加工修饰功能限制,会影响表达产物的生物学特性;而真核表达又存在表达产量低的难题[1]。运用合适的植物表达系统表达抗体不仅表达产量高,而且由于植物表达系统表达的抗体是以双体形式存在,因此表达产物的亲和力也较高。采用新兴的植物表达技术,高效表达鼠/人嵌合植物抗体,不仅可以克服上述鼠源性mAb的缺点,而且具有高表达量、低成本等优点。
1.2 植物转化的影响因素 自20世纪80年代首次获得转基因烟草植株以来,转基因技术日益成熟和集中,针对不同植物也建立了切实可行的转化方法。目前,转基因植物开发主要采用农杆菌介导法和基因枪介导法。其中,农杆菌介导的遗传转化早期主要应用于双子叶植物,近些年来在单子叶植物上也已取得突破。利用农杆菌介导法已向植物中导入了多个功能基因,获得了大量转基因植株,培育了一些转基因新品种。利用农杆菌介导法可以获得多种可稳定遗传的植株,但其转化条件因转化对象的不同而有所差异。
1.2.1 菌液浓度和浸染时间对植物转化的影响 农杆菌悬浮液浓度及浸染时间是影响遗传转化最重要的2个因素。砀山酥梨离体叶片的外植体经过不同浓度的菌液浸染不同的时间处理,再进行选择培养,结果表明:当OD600=0.5,浸染时间为5min时,再生频率最高[1]。在农杆菌介导的小麦遗传转化试验中,当OD600=0.5时,Alondra's中的gus基因瞬时表达频率最高,而扬麦15则在OD600=1时表现最高的gus基因瞬时表达频率。当浸染时间为10min时,扬麦15和Alondra's都表现最高的gus基因表达率。而降低或延长浸染时间都会使表达率降低[3]。根癌农杆菌浸染金边狗牙根遗传转化表明,用根癌农杆菌浸染10min,GUS瞬间表达效果最好[4]。不同浓度的农杆菌菌液对草地早熟禾浸染表明,农杆菌菌液浓度OD600=0.6时草地早熟禾的转化率最高。而当农杆菌浓度OD600大于0.6转化率则下降[5]。
1.2.2 共培养对植物转化的影响 有研究表明在微孔滤膜上进行共培养转化效率显著高于在玻璃纸上进行共培养的转化效率。共培养温度为20℃时转化效率最高[5]。砀山酥梨离体叶片外植体用OD600=0.5的农杆菌浸染5min,然后共培养,结果表明,共培养48h时的再生频率较高[2]。小麦愈伤组织经农杆菌浸染后,在相同条件下共培养1~3d后进行gus染色,结果表明当共培养1d时,扬麦15中的gus基因瞬时表达率最高;而Alondra's中gus基因表达率共培养2d时达到最高。对辣椒的研究表明,若共培养3d,比较有利于提高转化率[5]。此外有报道称共培养时光照时间对表达率有一定影响。在全天光照条件下,金边狗牙根愈伤组织GUS瞬间表达率最高,但与每天16h光照处理差异不明显。这2种条件下GUS瞬间表达率均明显高于暗培养[5]。Kenjirou Ozawa等用富含N6和DKN的湿润滤纸培养基代替固体培养基,将水稻愈伤组织和农杆菌进行共培养,在水稻上成功的获得了高效率的转化体系[7]。
1.2.3 乙酰丁香酮(AS)对植物转化的影响 乙酰丁香酮可以诱导活化Vir区基因,使农杆菌T-DNA更易进入植物基因组并与其整合。因此,乙酰丁香酮也是影响遗传转化的重要因素之一[8]。砀山酥梨离体叶片外植体经农杆菌浸染后添加不同浓度的AS,其再生频率显著提高;而当AS浓度为100μmol/L时,再生频率最高。对于小麦的研究表明,AS的浓度以100μmol/L为宜[2]。对辣椒进行实验表明,在浸染液中加不同浓度的AS可以不同程度地提高转化效率,当AS浓度在100μmol/L时达到较好的转化效果[9]。
1.2.4 预培养对植物转化的影响 预培养有利于农杆菌更好地将外源基因整合到植物基因组内,是影响植物遗传转化的又一重要因素。外植体预培养可以促进细胞分裂,分裂状态的细胞更容易与外源DNA整合,因而可以提高转化效率[10-11]。预培养也可以在一定程度上减少伤害胁迫而有利于农杆菌的侵[11]。子叶叶盘在接种农杆菌前,在预培养2d后,芽诱导分化率高,达到77.6%。预培养1~7d的栗子香胚性悬浮细胞的转化结果表明,预培养2d的胚性悬浮细胞,GUS瞬时表达率最高,达71.13%[9]。
1.2.5 其他影响因素 除了研究共培养、菌液浓度和浸染时间、乙酰丁香酮(AS)、预培养对植物转化的影响外,一些学者考察了诸如负压强度、超声波处理时间、悬浮培养天数、抗生素选择压等因素对植物转化的影响。子叶叶盘转化结果表明,预培养3d的胚性悬浮细胞,GUS瞬时表达率最高[12]。对金边狗牙根进行不同负压处理表明,给予一定的负压处理有利于提高转化率,但负压过大则会对植物细胞本身产生较大的伤害甚至导致细胞死亡[5]。农杆菌对苦豆子子叶和下胚轴的转化率随超声波处理时间的延长逐渐递增,当超声波处理25min时GUS瞬时表达率最高,再延长处理时间转化率下降[13]。王欣等在对甘薯声波辅助的农杆菌遗传转化方法(SAAT)条件的优化的研究中对悬浮培养不同天数的胚性悬浮细胞进行遗传转化。GUS瞬时表达率检测结果表明,培养105d的愈伤GUS瞬时表达率最高。在各培养阶段不同浓度的羧苄青霉素(Carb)均不影响未浸染农杆菌的胚性愈伤生长及植株再生,浓度为100mg/L反而对细胞的生长有明显的促进作用。不同培养阶段的胚性愈伤在含Kan0~50mg/L的培养基上培养结果表明,14d内Kan对愈伤无明显影响,28d后影响则逐渐明显[12]。
1.3 拟开展研究的内容及方法 农杆菌介导的转化技术已成功运用到植物的遗传转化中。农杆菌介导的外源基因转化是农杆菌菌株与植物细胞之间相互作用的结果,凡是能够影响植物细胞转化应答能力和农杆菌侵染能力以及转化体再生能力的各种因素都会对其转化效果产生影响。因此,农杆菌转化频率的提高依赖于对各种影响因子的优化和转化条件的改善。就菌悬液浓度及浸染时间对转化率影响方面来看,大多数植物在OD600=0.6浸染10min时能达到较高的转化率。但考虑到种属特异性,我们有必要在现有条件下对菌悬浮液浓度及浸染时间作进一步研究。
本研究将改造过的抗HTNV鼠/人嵌合抗体基因导入农杆菌进而通过叶盘法转化烟草,通过抗生素对转基因植株进行初步筛选,获得抗性植株,并初步检测外源基因在烟草中的表达。继而,建立适合本实验室的烟草转化与再生系统,确定本实验室烟草的最优转化条件,获得可稳定表达抗HTNV中和性鼠/人嵌合抗的抗性植株。本实验着重对菌液浓度及浸染时间进行了研究。待含有重组质粒的农杆菌培养至0.6时,取菌液梯度稀释后分别用于对烟草叶片进行不同时间的浸染。运用组织培养技术,将浸染后的烟草叶片经共培养、选择培养后统计其在不同条件下的转化率。另外,本实验对部分叶片采用不同的共培养时间探究了共培养时间对烟草转化的影响。
2 材料与方法
2.1 实验材料
2.1.1 植物材料 无菌烟草苗CV品种。
2.1.2 菌种 农杆菌EHA105,由本实验室保存。
2.1.3 质粒 抗汉滩病毒鼠/人嵌合抗体植物表达载体3G1MH-pCAMBIA2301,由第四軍医大学微生物学教研室构建。
2.2 实验仪器 台式高速离心机(Eppendorf),数显振荡培养箱(苏坤),超低温冰箱(中科美菱),电泳仪(北京鼎国1100型),PCR仪(MJ),光照培养箱,超净工作台,数码凝胶成像系统(Wealtech公司)。
2.3 实验试剂
2.3.1 质粒提取试剂 质粒小量提取试剂盒,购自博大泰克公司。
2.3.2 抗生素:利福霉素(rif) 工作浓度50mg/L;卡那霉素(kan):工作浓度50mg/L;羧苄青霉素(carb):工作浓度50mg/L 均为Sigma产品。
2.3.3 转化液 MS+AS(200μM/L)+二巯基乙醇(0.003%)。
2.3.4 培养基 (1)LB液体培养基:胰蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,pH≈7.0。(2)LB固体培养基:胰蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,琼脂粉0.7%,pH≈7.0。(3)MS培养基:大量元素+微量元素+铁盐+有机元素+蔗糖(3%)+琼脂(0.7%),pH≈5.8。(4)共培养培养基:MS+AS(40μM/L)+6-BA+IAA。(5)选择培养基:MS+Kan(100mg/L)+carb(200mg/L)+6-BA+IAA。
2.4 实验方法
2.4.1 制备农杆菌转化子及鉴定
2.4.1.1 农杆菌EHA105的培养 取-70℃保存的农杆菌EHA105菌株划线接种于含rif 50mg/L的LB平板上,28℃培养36~48h后挑取单菌落,接种于6ml含rif 50mg/L的LB液体培养基中,28℃ 200r振荡培养24h后,按1∶100转接于新鲜LB液体培养基中继续培养6h(OD600≈0.6)。
2.4.1.2 农杆菌感受态细胞的制备 取新鲜转接的培养菌液1.5mL,10 000r离心1min,弃上清;用100μL的TSS重悬菌体沉淀,制备的感受态细胞置于冰上现用或-70℃冻存。
2.4.1.3 重组质粒向农杆菌感受态细胞的转化(冻融法) 向农杆菌感受态细胞(100μL)中加入10μL重组质粒3G1MH-pCAMBIA2301,混和均匀,置于液氮中速冻3min,立即28℃水浴5min,28℃200r振荡培养5h后,涂布于含rif 50mg/L、kan 50mg/L的LB平板上,培养48~72h[14]。
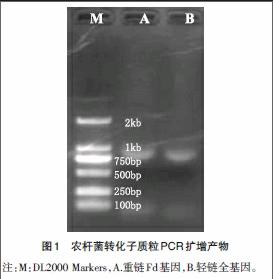
2.4.1.4 农杆菌转化子的鉴定 从平板上挑取已转化的农杆菌单菌落,接种于10mL的含rif 50mg/L、kan 50mg/L的LB液体培养基中,28℃振荡培养过夜,留取甘油菌备用,并提取质粒。提出的质粒进行PCR扩增。PCR扩增产物经电泳鉴定。
(1)重链Fd基因的扩增:
引物:
P1:5′-ATTCTAGAGCCATGGCCGAGGCGCAGCTG-3′
P2:5′-TCACTAGTTCATTTGTCACAAGATTTGGC-3′
反应体系(50μL):
①H2O 35.0μL;②10×PCR Buffer 5.0μL ③Mgcl2 3.0μL;④dNTP 2.0μL;⑤P1 2.0μL,P2 2.0μL;⑥质粒DNA 0.5μL;⑦TaqDNAPolymerase 0.5μL。
PCR扩增条件:
预变性:95℃10min;循环扩增:94℃ 1min,50℃ 1min,72℃1min,30个循环;延伸:72℃ 10min。
(2)轻链全基因的扩增:
引物:
PⅠ:5′-GCGCCATGGACATTGTGATGACGCAG-3′
PⅡ:5′-TCCACTAGTTTAACACTCTCCCCTGTT-3′
反应体系(50μL):
①H2O 35μL;②10×PCR Buffer 5.0μL③Mgcl2 3.0μL;④dNTP 2.0μL;⑤PⅠ 2.0μL,PⅡ 2.0μL;⑥质粒DNA 0.5μL;⑦TaqDNAPolymerase 0.5μL。
PCR扩增条件 预变性:95℃10min;循环扩增:94℃1min,55℃1min,72℃1min,30个循环;延伸:72℃10min。
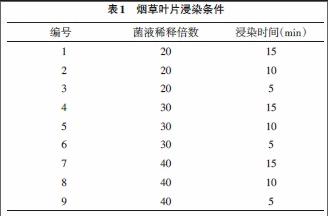
2.4.2 农杆菌介导的叶盘法转化 (1)将含有重组质粒的农杆菌EHA105培养24h后按1:100接种于新鲜的LB培养液中培养6h至OD600≈0.6,分别取2mL离心,用2mL转化液重悬菌体,取菌液经梯度稀释后分别对大小约0.5cm2的烟草叶片进行不同时间浸染。具体处理如表1所示。
(2)用无菌滤纸吸干烟草叶片表面的菌液。
(3)共培养:将浸染过的烟草叶片接种于共培养基上,22℃黑暗培养。
(4)选择培养:将经共培养数天的烟草叶片转入含有Kan和carb的诱导愈伤组织及芽的选择培养基上进行培养(温度:22℃光周期:暗8h;光16h)。
3 实验结果
3.1 农杆菌的转化提取及鉴定 利用TSS冻融法将3G1MH-pCAMBIA2301质粒转入农杆菌EHA105中,提取质粒,插入序列经PCR扩增鉴定,结果如图1所示,分别扩增出大小为750bp左右的片段。与预期相符,说明重组质粒3G1MH-pCAMBIA2301已成功转入农杆菌。
3.2 农杆菌介导的烟草叶片转化 将烟草叶片接种到诱导愈伤组织培养基上,培养3d后,部分叶片的边缘开始膨胀,再继续培养,切块膨大成圆拱形,并开始出现有绿色半透明的愈伤组织。愈伤组织生长迅速,根据色泽、质地,可分为以下2种类型:第一类,开始透明状后转为褐色、质地疏松的愈伤组织;第二类,开始为黄绿色后转为绿色致密愈伤组织。
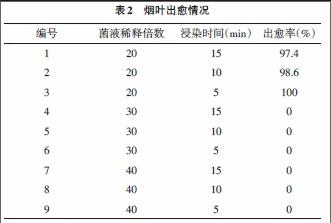
3.2.1 菌悬浮液浓度及浸染时間对出愈率的影响 取OD600≈0.6的含有重组质粒的农杆菌EHA105菌液经梯度稀释后,分别对大小约0.5cm2的烟草叶片进行不同时间浸染。叶片共培养3d后转入选择培养基培养,其出愈率如表2所示,方差分析结果如表3所示。
3.2.2 共培养时间对出愈率的影响 对经30倍稀释菌液浸染的烟草叶片分别进行不同时间的共培养后转入选择培养基培养。观察发现不同的处理间叶片被包埋的程度不同,随着浸染时间的缩短,农杆菌长势呈下降趋势。
3.2.3 激素浓度对出愈的影响 将浸染过的烟草叶片共培养后转入激素浓度为:6-BA 2.0mg/L、IAA 0.5 mg/L 的选择培养基培养,结果叶片均未出现愈伤组织。将激素浓度调整为:6-BA 1.5mg/L、IAA 0.5mg/L后部分叶片产生愈伤组织。
4 讨论
在农杆菌介导的植物遗传转化过程中,由于受体组织是直接浸染在农杆菌悬浮液之中,因此,菌液浓度以与遗传转化效率有着最为直接的关系。当菌液浓度过低时,会由于单位体积农杆菌细胞数过少而达不到浸染效果,以至于遗传转化效率较低;过高则会由于农杆菌细胞的过度生长而影响受体细胞的正常生长及分化,也达不到较高的遗传转化效率。与菌液浓度最为密切的是浸染时间,因此,需要将2个因素综合考虑,当菌液浓度过大时,可以适当减少受体组织浸染的时间;当菌液浓度过小时,可以适当延长浸染时间。
本研究中,将含有重组质粒的农杆菌过夜培养后按1∶100接种于新鲜的LB培养液中培养6h至OD600≈0.6时取菌液经梯度稀释后分别对大小约0.5cm2的烟草叶片进行不同时间浸染。结果用经20倍稀释后的菌液浸染的烟草叶片其转化率达97%以上,且不同时间浸染的处理间无显著差异。农杆菌悬浮液浓度及浸染时间是影响遗传转化最重要的2个因素,但相比之下菌悬浮液浓度对转化的影响更为明显。
将含重组质粒的菌体振荡培养过夜,取菌液2mL离心后用转化液重悬菌体,并进行20~40倍的稀释,黑暗处22℃共培养3d,叶片常会被农杆菌包埋,而导致实验失败。分析原因:其一,可能是菌液浓度过大,导致经其浸染的叶片上菌浓度过高,从而快速生长将组织叶片包埋;其二,可能是共培养的时间过长,应适当缩短共培养的时间,当共培养至肉眼可见的微小菌落出现时,立即转入选择培养基中;其三,在选择培养的过程中,可能是抗生素的浓度较小,而无法将农杆菌抑制,可将抗生素的浓度加大或是采用另一种更有效的广谱抗生素。
虽然有文献称烟草转化再生系统中激素浓度以6-BA 2.0mg/L+IAA 0.5mg/L时再生率最高[15]。但本研究中烟草转化后按其再生条件进行再生,再生率为0%,然将激素浓度调整为6-BA 1.5mg/L+IAA 0.5mg/L时再生情况良好。出现以上情况可能是因为加入抗生素后使再生条件发生变化进而影响了烟草的再生。
参考文献
[1]白雪帆,黄长形.进一步加强肾综合征出血热的研究[J].中华传染病杂志,2002,820(4):197-198.
[2]孟颢光,张朝红,王跃进.抗病基因VpPR10转化‘砀山酥梨及转化条件的优化[J].园艺学报,2010,37(10):1567-1574.
[3]李明浩,陈炜,邢莉萍,等.农杆菌介导小麦遗传转化条件的优化[J].分子植物育种.2010,8(2):388-392.
[4]胡繁荣.根癌农杆菌介导的金边狗牙根遗传转化条件的优化[J].植物资源与环境学报,2005,14(2):15-18.
[5]王娟.农杆菌介导草地早熟禾转化条件的优化[J].安徽农业科学,2010,38(1):58-59,62.
[6]张娇,谷守芹,李青为,等.根癌农杆菌介导的玉米大斑病菌转化条件的优化[J].河北农业大学学报.2010,33(4):85-88.
[7]Kenjirou Ozawa.Establishment of a high efficiency Agrobacterium-mediated Transformation system of rice(Oryza sativa L.)[J].Plant Science,176 (2009):522-527.
[8]武小霞,李静,王志坤,等.乙酰丁香酮濃度和共培养pH对大豆再生频率的影响[J].东北农业大学学报.2010,41(5):1-4.
[9]罗齐军,朱昌叁,曾富华.农杆菌介导的基因转化辣椒条件的优化[J].江西农业学报,2008,20(5):14-16.
[10]王关林,方宏筠.植物基因工程原理与技术(第二版)[M].北京:科学出版社,2002.
[11]MchughenA,JordanM,FeistG.Aprecultureperiodpriorto Agrobacteriuminoculationincreaseproductionoftransgenicplants[J]. J. PlantPhysio.l,1989,135:245~248.
[12]王欣,周忠,李强,等.甘薯SAAT法遗传转化条件的优化[J].江苏农业学报,2006,22(1):14-18.
[13]赵东利,陈红波,聂秀苑,等.超声波辅助处理对发根农杆菌介导的苦豆子遗传转化的影响[J].西北植物学报,2003,23(3):468-472.
[14]罗雯,刘阳.根癌农杆菌转化条件优化的研究[J].生物技术,2006,16(1):41-42.
[15]王荔,杨艳琼,杨德,等.不同激素浓度及培养基对烟草愈伤组织分化的影响[J].云南农业大学学报,1999,14(4):371-375.
(责编:张宏民)
