亚急性瘤胃酸中毒对奶山羊血浆异常代谢产物及生化指标的影响
2017-04-11孙燕勇胡红莲宋利文
孙燕勇 胡红莲 高 民 徐 明 宋利文*
(1.内蒙古农业大学动物科学学院,呼和浩特010018;2.内蒙古农牧业科学院动物营养与饲料研究所,呼和浩特010031)
亚急性瘤胃酸中毒对奶山羊血浆异常代谢产物及生化指标的影响
孙燕勇1胡红莲2*高 民2徐 明1宋利文2**
(1.内蒙古农业大学动物科学学院,呼和浩特010018;2.内蒙古农牧业科学院动物营养与饲料研究所,呼和浩特010031)
本试验通过递增饲粮非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)方式诱导奶山羊发生亚急性瘤胃酸中毒(SARA),旨在探讨SARA诱导过程中奶山羊血浆组胺(HIS)、脂多糖(LPS)含量及生化指标的变化。选取4只体况良好、体重接近的泌乳期萨能奶山羊,依次饲喂NFC/NDF为1.40、1.79、2.31、3.23的4种饲粮,每种饲粮饲喂15 d(为1组),前12 d为适应期,后3 d为采样期。酶联免疫吸附测定(ELISA)法检测血浆中HIS、LPS的含量,生化分析仪测定血浆生化指标。结果表明:1)当饲粮NFC/NDF由1.40递增至3.23时,成功诱导奶山羊处于SARA状态。2)在诱导SARA发生过程中,随着饲粮NFC/NDF增加,血浆HIS和LPS含量增加,NFC/NDF为3.23时显著高于NFC/NDF为1.40时(P<0.05)。3)随着饲粮NFC/NDF增加,血浆免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)含量无显著变化(P>0.05);血浆肌酐(CREA)、D-乳酸(LD)含量及肌酸激酶(CK)、谷草转氨酶(AST)、二胺氧化酶(DAO)活性无显著变化(P>0.05);血浆γ-谷氨酰转移酶(γ-GT)活性呈升高趋势,NFC/NDF为3.23时显著高于其他各组(P<0.05);血浆尿素氮(UN)含量降低,NFC/NDF为1.40时显著高于其他各组(P<0.05);血浆碱性磷酸酶(ALP)活性升高,NFC/NDF为3.23时极显著高于其他3组(P<0.01);血浆游离脂肪酸(FFA)含量先升高后降低,且在NFC/NDF为2.31时极显著高于其他各组(P<0.01);血浆β-羟丁酸(β-HB)含量降低,NFC/NDF为1.40时呈极显著高于其他各组(P<0.01)。结果提示,随着饲粮NFC/NDF递增,血浆中HIS和LPS含量显著增加,引发了机体炎症反应,加重了瘤胃上皮的损伤和SARA病情,激发奶山羊免疫活化状态;诱导SARA发生过程中,血浆生化指标有不同程度的变化,提示SARA期间奶山羊处于应激状态,引发了肝功能损伤。
亚急性瘤胃酸中毒;生化指标;奶山羊;非纤维性碳水化合物与中性洗涤纤维比;组胺;脂多糖
亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)又名慢性或者亚临床性瘤胃酸中毒,是现代反刍动物生产中最常见的一种营养代谢疾病,尤其在牛羊快速育肥和高产奶牛生产中较为常见,严重影响了动物的长期健康和高效生产[1],因而一直以来备受关注。据调查,美国有多达19%的泌乳早期奶牛和26%的泌乳中期奶牛患有SARA[2-3]。并有研究报道,在诱导山羊发生SARA时,瘤胃内产生大量的脂多糖(lipopolysaccharide,LPS),转运进入血液[4-6]。血液中的LPS则诱发体内产生细胞因子和急性期蛋白。目前国内外学者还未形成统一标准来界定SARA,但多数采用瘤胃液pH来进行界定[7],Ghorbani等[8]表示一般以pH≤5.5为衡量标准,SARA对动物的损坏是个持续的过程,产生各种有毒有害物质。郭鹏等[9]的研究表明,发生SARA时血浆LPS含量逐渐递增,引发了全身炎症反应,血液中组胺(histamine,HIS)含量在非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)为1.63时最高,为22.28 ng/mL。也有报道说当奶牛发生SARA时,瘤胃液pH降低到4.5,HIS含量达3~70 mg/L[10]。Lachmann等[11]研究表明,SARA发生期间血液指标没有显著变化。章森[12]研究了不同饲粮模式对血浆LPS含量及血浆代谢产物的影响规律,结果表明,血浆中的LPS含量主要受饲粮精粗比影响,而血浆代谢产物与奶牛免疫变化、生长性能变化密切相关。但是关于反刍动物发生SARA后血浆代谢产物的含量变化,生化指标对机体影响的研究还不够深入。本试验采用递增饲粮NFC/NDF来逐步诱导奶山羊发生SARA,符合动物采食模式[13],并用pH连续动态监测系统测定瘤胃液pH,当24 h内瘤胃液低于5.6的时间超过3 h,即判断发生SARA[14]。鉴于此,本试验检测不同饲粮NFC/NDF下奶山羊的血浆HIS和LPS含量及生化指标,探究其与SARA发生发展的内在关系,为揭示SARA对奶山羊血浆中LPS和HIS含量及生化指标的影响提供理论依据。
1 材料与方法
1.1 试验动物与饲养管理
选取4只体况良好,体重(43.58±2.77) kg,安装永久性瘤胃瘘管,年龄2~3岁并处于泌乳期的萨能奶山羊,于2015年9月至2016年1月饲养于内蒙古农牧业科学院动物试验基地。试验动物单笼饲养,先饲喂粗料后饲喂精料,每天06:00、18:00等量饲喂,自由饮水。
1.2 试验饲粮
试验饲粮参照NRC(1989)[15]奶山羊营养需要,并结合金公亮[16]推荐的《奶山羊饲养标准》配制,主要以玉米、豆粕、麦麸、苜蓿、青干草为原料设计NFC/NDF分别为1.40、1.79、2.31和3.23的4种饲粮,试验饲粮组成及营养水平见表1。

表1 试验饲粮组成及营养水平(干物质基础)

续表1项目Items饲粮NFC/NDFDietaryNFC/NDF1.401.792.313.23钙Ca0.540.550.550.57磷P0.320.330.330.34钙磷比Ca∶P1.681.681.681.68精粗比Concentrate∶roughage51∶4960∶4068∶3279∶21
1)每千克预混料含有 One kilogram of premix contained the following:FeSO4·7H2O 6 240 mg,CuSO4·5H2O 300 mg,MnSO4·5H2O 1 560 mg,ZnSO4·7H2O 3 500 mg,Co2Cl·6H2O 206 mg,KI 17 mg,NaSeO3130 mg,VA 1 620 000 IU,VD3324 000 IU,VE 540 IU,VK3150 mg,VB120.9 mg,VB5 450 mg,泛酸钙calcium pantothenate 750 mg,叶酸folic acid 15 mg。
2)粗蛋白质、中性洗涤纤维、酸性洗涤纤维、钙、磷为实测值,其余为计算值。非纤维性碳水化合物=1-中性洗涤纤维-粗蛋白质-粗脂肪-粗灰分。CP, NDF, ADF, Ca and P were measured values, while the others were calculated values. NFC=1-NDF-CP-EE-ash.
1.3 试验设计
采用自身对照试验设计,通过逐步递增饲粮NFC/NDF例的方式诱导奶山羊发生SARA,共分为4期,每期15 d,分别饲喂NFC/NDF为1.40(Ⅰ期)、1.79(Ⅱ期)、2.31(Ⅲ期)、3.23(Ⅳ期)的4种饲粮,每期作为1组,其中每期前12 d为预试期,后3 d为采样期。采用动态pH连续监测记录系统对瘤胃液pH进行24 h连续监测,以判断SARA是否成功诱导,根据Ramanzin等[17]和Penner等[18]的报道,当24 h内瘤胃液pH在5.5~5.2持续时间达3 h以上即视为SARA模型成功建立。
1.4 主要仪器
酶标仪(美国Awareness公司)、半自动生化分析仪(A6,北京松上技术有限公司)、pH电极(S651CD,美国Sensorex公司)、变送器(692,美国Jenco公司)、无纸记录仪(R4100,浙大中控仪表有限公司)、全自动生化分析仪(BS-420,深圳迈瑞生物医疗电子股份有限公司)。
1.5 试验方法
1.5.1 瘤胃液pH连续监测
本试验用动态pH连续检测记录系统对采样期瘤胃液pH进行动态监测。本试验动态pH连续监测记录系统主要由pH电极(插在反刍动物的瘤胃)、pH变送器和无纸记录仪组成,无纸记录仪设定每5 s显示1次数据并且每10 min记录1次数据,最终将数据上传至电脑,对瘤胃液pH平均值、最大值、最小值、pH<5.5持续的时间及其曲线面积的数据进行分析,曲线面积是pH阈值与低于阈值偏差的绝对值累加的总和与时间间隔的乘积。
1.5.2 血浆的采集和处理方法
采样期每天于晨饲前颈静脉采血20 mL,3 500 r/min离心10 min,取血浆,分装到2 mL离心管中,-20 ℃保存。
1.5.3 血浆LPS和HIS含量及生化指标的测定
HIS试剂盒购自美国DiaSource公司,含量测定参照说明书中的方法进行。LPS试剂盒购自南京建成生物科技有限公司,含量测定方法参照说明书进行。采用半自动生化分析仪测定肌酐(CREA)、D-乳酸(LD)、β-羟丁酸(β-HB)、游离脂肪酸(FFA)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)含量及二胺氧化酶(DAO)活性;采用全自动生化分析仪测定谷草转氨酶(AST)、γ-谷氨酰转移酶(γ-GT)、肌酸激酶(CK)、碱性磷酸酶(ALP)活性及尿素氮(UN)含量。
1.6 数据统计
所有数据先通过Excel整理后,采用SAS 9.0软件中的ANOVE过程进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较检验差异显著性,结果以平均值±标准差的形式表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 不同NFC/NDF饲粮对瘤胃液pH的影响
由表2可以看出,在诱导奶山羊发生SARA的过程中,瘤胃液pH发生了很大变化,NFC/NDF为1.79和2.31时pH平均值和最小值显著低于NFC/NDF为1.40时(P<0.05),显著高于NFC/NDF为3.23时(P<0.05);NFC/NDF为1.40时,pH最大值显著低于另外3组(P<0.05)。总体来说,随着NFC/NDF的增加,瘤胃液pH最大值、最小值和平均值都呈下降趋势,pH<5.5和pH<5.8的曲线面积呈上升趋势。由此可见,在诱导奶山羊发生SARA的过程中,奶山羊瘤胃液pH有很大变化。

表2 奶山羊在诱导SARA的过程中瘤胃液pH的变化
同行数据肩标相同或无小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with the same or no small letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.2 不同NFC/NDF饲粮对血浆LPS和HIS含量的影响
由表3可以看出,诱导SARA发生的过程中,随着饲粮NFC/NDF的递增,血浆中LPS和HIS含量递增,LPS和HIS含量在NFC/NDF为3.23时最高;LPS含量在NFC/NDF为2.31和3.23时显著高于NFC/NDF为1.40时(P<0.05),高于NFC/NDF为1.79时,但差异不显著(P>0.05);HIS含量在NFC/NDF为3.23时显著高于其他3组(P<0.05),其他各组间差异不显著(P>0.05)。

表3 不同NFC/NDF饲粮对奶山羊血浆LPS和HIS含量的影响
2.3 不同NFC/NDF饲粮对血浆生化指标的影响
由表4可以看出,不同NFC/NDF饲粮对奶山羊血浆生化指标均有不同程度的影响。IgA含量,NFC/NDF为2.31时大于其他各组,但差异不显著(P>0.05);IgG含量,NFC/NDF为3.23时大于其他各组,但差异不显著(P>0.05),NFC/NDF为1.40时大于NFC/NDF为1.79和2.31时,但差异不显著(P>0.05);IgM含量,NFC/NDF为2.31时大于其他各组,但差异不显著(P>0.05),NFC/NDF为1.40时大于NFC/NDF为1.79和3.23时,但差异不显著(P>0.05)。
由表5可以看出,AST活性,各组之间差异不显著(P>0.05);γ-GT活性,NFC/NDF为3.23时显著高于其他各组(P<0.05);GREA含量,各组之间差异不显著(P>0.05);UN含量,NFC/NDF为1.40时显著高于其他各组(P<0.05),NFC/NDF为1.79和2.31时与NFC/NDF为3.23时之间差异不显著(P>0.05);CK活性,各组之间差异不显著(P>0.05);ALP活性,NFC/NDF为3.23时极显著高于其他3组(P<0.01),其他3组之间差异不显著(P>0.05);LD含量,各组之间差异不显著(P>0.05);FFA含量,NFC/NDF为2.31时极显著高于其他3组(P<0.01),其他3组之间差异不显著(P>0.05);DAO活性,各组之间差异不显著(P>0.05);β-HB含量,NFC/NDF为1.40时极显著高于其他3组(P<0.01),其他3组之间差异不显著(P>0.05)。
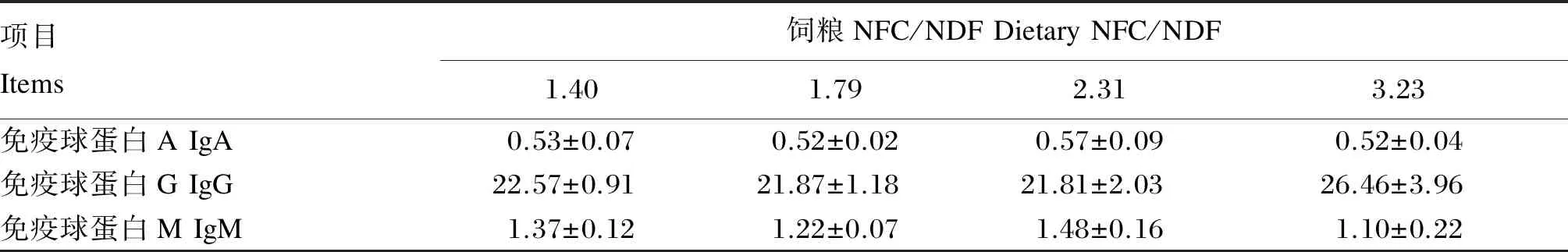
表4 不同NFC/NDF饲粮对奶山羊血浆免疫球蛋白含量的影响

表5 不同NFC/NDF水平对奶山羊血浆生化指标的影响
3 讨 论
3.1 不同NFC/NDF饲粮对血浆异常代谢产物的影响
LPS是革兰氏阴性菌的细胞壁的组成成分,具有渗透性屏障功能[19]。当机体发生SARA时,瘤胃内革兰氏阴性菌释放大量的细菌LPS,破坏瘤胃屏障功能,损伤瘤胃上皮细胞[20],随后通过瘤胃屏障迁移进入血液[21],使血液中的LPS含量增加,引起全身性炎症反应,并活化机体免疫状态[22]。LPS积累到一定量后将引起内毒素血症。前人报道,当增加饲粮NFC/NDF后,血浆LPS含量升高,并引发奶山羊内毒素血症[19,23]。也有资料显示,高谷物诱导反刍动物发生SARA时往往伴随血浆LPS含量的增多[24]。本试验中,随着NFC/NDF由1.40增加到3.23,血浆当中LPS的含量也逐渐增加,由15.76×103EU/mL显著增加到85.55×103EU/mL,与前人报道相符。结果表明,饲粮不同NFC/NDF对奶山羊机体免疫活化状态有一定影响,并持续引发动物机体炎症反应。
HIS是重要的生物活性物质之一,也是Ⅰ型变态反应的重要介质,参与变态反应、过敏反应、血管收缩和舒张;同时也是炎症反应和免疫损伤的重要介质。当发生SARA时,瘤胃内环境发生紊乱,瘤胃长期处于低pH状态,组氨酸脱羧形成HIS,异常代谢产物HIS等增多[25],造成瘤胃黏膜损伤,降低了瘤胃屏障功能。异常代谢产物HIS很容易通过破损的瘤胃黏膜进入血液引起炎症反应[26]。本试验结果发现,血浆中的HIS含量随着NFC/NDF增加也呈递增趋势,并在NFC/NDF为3.23时达到最高,为1.04 ng/mL,与郭鹏等[9]的研究结果相一致。Aschenbach等[27]调查显示,HIS诱导细胞凋亡,或增加细胞脱落,或干涉细胞核分裂和细胞成熟,这几个过程可能意味着HIS能干扰SARA时上皮细胞的再生,进而造成细胞损伤,引发炎症反应。同时,也有报道说当奶牛发生SARA时,pH降低到4.5,HIS含量在3×10-3~70×10-3ng/mL[9]。本试验检测血浆HIS含量变化,发现递增NFC/NDF下诱导SARA后,血浆HIS含量呈增加趋势。这表明HIS通过瘤胃上皮吸收进入血液,使血液中HIS含量增加[28]。由于检测方法和试验条件不同,本试验所得测定值偏低,但变化趋势与前人研究的相近。Nagaraja等[29]指出,SARA导致瘤胃上皮细胞角质化不全,瘤胃上皮细胞发炎。因此,奶山羊血浆中HIS含量升高与机体的病理改变明显相关,所引发的炎症反应也可能是导致SARA发生的重要因素之一,具有加重病情发展的作用。
3.2 不同NFC/NDF饲粮对血浆免疫球蛋白含量的影响
机体接受刺激后发生免疫反应,产生免疫球蛋白,适当的刺激有助于机体增强免疫机能,但过强的刺激却会增加能量消耗,影响动物生产性能。动物血液中的蛋白质有稳恒能力,IgA、IgG、IgM是动物机体内主要的免疫球蛋白,环境刺激可能会促使机体发生不同程度的免疫反应。本试验中各种免疫球蛋白在饲粮NFC/NDF为2.31与3.23时有所增加但变化不显著,可能是由于SARA的逐渐形成对机体产生了刺激效应,机体在接受刺激后产生稳恒效应,代偿性地减少了蛋白质的重分配量,降低了机体免疫激活状态[30]。
3.3 不同NFC/NDF饲粮对血浆生化指标的影响
正常血浆中ALP主要来自骨骼,骨细胞产生并经肝胆系统进行排泄。血液钙代谢与ALP密切相关,血液钙含量降低则预示着ALP活性的升高。本试验中NFC/NDF为3.23时ALP活性显著高于其他3组,可能是因为饲粮NFC/NDF增高后,提供给动物机体的能量增高,较高的产奶量增加了钙的动员与周转,提示SARA发病过程中机体处于缺钙状态,同时也影响了肝胆系统。AST是转氨酶中比较重要的一种,它是医学临床上肝功能检查的指标,用来判断肝脏是否受到损伤,当肝脏发生严重损伤时,AST活性就会显著升高[31]。正常成年奶牛血浆中AST活性范围在12.9~104.0 U/L[32]。本试验中,饲粮NFC/NDF为3.23时超出正常范围,其他3种饲粮下的AST活性都在正常范围内稍偏高,提示饲粮NFC/NDF不断增加肝脏的损伤程度增加。血浆γ-GT主要来自肝脏,它活性的升高预示着肝功能有活动性损伤。从本试验数据看出,随着饲粮NFC/NDF增加,NFC/NDF为3.23时血浆γ-GT活性显著高于NFC/NDF为1.79与2.31时,提示SARA引起了肝功能的严重损伤。反刍动物血液中CREA和UN等指标可以作为蛋白质代谢和肾功能的评价指标。血液UN含量主要受瘤胃发酵能力、饲粮氨基酸成分、肝肾功能、瘤胃酵解碳水化合物总量和蛋白质的摄入等因素的影响[33],能反映肾小球的滤过机能和体内蛋白质代谢状况,也可反映机体的水盐平衡。血液中CREA可以作为肾脏功能的指标之一,CREA由肌酸脱水形成,进入血液后随尿排出。因CREA分子质量小,因而可通过肾小球滤过,在肾小管很少被吸收。正常情况下,CREA会被机体代谢随尿排出。但当肾功能异常后,使得CREA不能排出,在体内而蓄积,并形成有毒物质。本试验结果显示,随着饲粮NFC/NDF增加,瘤胃内pH降低,并发生SARA,可使血浆CREA含量增加,UN含量反而由8.16 mmol/L显著降低到5.72 mmol/L。这与王婷婷等[34]检测牛发生SARA血液中UN含量显著升高的结果不相一致。本试验结果提示,发生SARA时,可能存在脱水或一定程度的肾脏功能损伤,这或许与蛋白质的代谢有关。机体本身蛋白质分解就会增加肝脏内氨基酸的代谢,转化成尿素,进而形成UN。
本试验在NFC/NDF为2.31和3.23时UN含量显著低于NFC/NDF为1.40时,表明奶山羊自身蛋白质分解周转量较低。可以看出,饲粮NFC/NDF的增加,肝脏功能受到严重影响。β-HB是酮体的主要成分,通常作为判断奶牛是否发生酮病的指标。李小杉等[35]在临床上证实,发生亚临床酮病时,血液β-HB含量为1.2 mmol/L。本试验中,血浆β-HB含量都在正常范围内,可以初步判断SARA发生时试验动物无酮病隐患。FFA是组成乳脂的主要成分之一[36],乳腺可以从血液当中选择性摄入乳成分前体物(包括FFA),而乳成分前体物的含量之间的作用影响乳脂的合成,从而影响乳品质[37]。本试验随着饲粮NFC/NDF的增加,饲料的精粗比递增后,血浆FFA含量在NFC/NDF为2.31时极显著高于其他组,表明在NFC/NDF为2.31时,FFA合成最多,乳脂含量增高。这与张树坤[38]研究不同精粗比饲粮条件下,泌乳期山羊血浆中乳脂合成前体物甘油和FFA均发生了变化,且高精料饲喂血液中甘油和FFA含量均显著高于低精料组的结果一致。DAO是存在于哺乳动物小肠黏膜上层的绒毛上皮细胞胞浆中的细胞内酶,正常血浆中DAO活性很低,因此DAO可以比较准确地反映肠黏膜结构功能,当肠黏膜受到损伤,屏障功能被破坏,大量的DAO从肠黏膜绒毛上皮细胞释放并很快进入血液,增加了血液当中的DAO含量[39]。本试验发现,在NFC/NDF逐渐增加的过程当中,血浆中DAO含量呈递增趋势,表明瘤胃上皮逐渐受到损伤与破坏。CK是相当敏感的应激指标,主要参与ATP的合成代谢,从而提供给机体能量。当动物机体受到刺激时CK活性会增加[40]。LD也是抗应激指标,主要存在动物机体肝脏、心脏和肌肉中的,这些器官受损后LD含量升高,LD是胃肠道中固有细菌的代谢终产物,而哺乳动物既不能自身合成,也缺乏相关代谢酶,所以当胃肠道通透性增加时,LD进入血液引起血液的LD含量升高[41-42]。Simaraks等[43]发现在相同应激条件下,血液当中LD与抗应激能力成负相关。CK活性也是肝功能的重要指标之一[40],本试验中,血浆LD含量在NFC/NDF为2.31时高于其他组,但差异不显著;而DAO活性在NFC/NDF为3.23时高于其他组,但差异不显著,CK活性除在NFC/NDF为2.31时略低以外,其他各组都较高,但差异不显著,表明在不同NFC/NDF逐渐增加过程中,奶山羊在NFC/NDF为2.31时抗应激能力最弱,黏膜损伤,通透性增加。王婷婷[44]通过检测正常健康育肥牛和SARA病牛血清中生化指标发现,SARA病牛的生化指标与正常健康牛相比显著升高,存在不同程度的炎性反应。以上结果共同说明了,在饲粮NFC/NDF逐渐递增的过程当中,山羊瘤胃上皮逐渐受到破坏,肝肾功能降低,受到不同程度的影响。
4 结 论
① 随着饲粮NFC/NDF递增,血液中LPS和HIS含量显著增加,引发了机体炎症反应,加重了瘤胃上皮的损伤和SARA病情,激发了奶山羊免疫活化状态。
② 通过递增饲粮NFC/NDF来诱导奶山羊SARA过程中,血浆生化指标有不同程度的变化,提示SARA期间奶山羊处于应激状态,引发了肝功能损伤。
[1] 贾媛媛.亚急性瘤胃酸中毒对山羊血液皮质醇浓度和肝脏脂代谢的影响及其机制研究[D].硕士学位论文.南京:南京农业大学,2013:1-4.
[2] KLEEN J L,HOOIJER G A,REHAGE J,et al.Subacute ruminal acidosis in Dutch dairy herds[J].The Veterinary Record,2009,164(22):681-683.
[3] KLEEN J L,CANNIZZO C.Incidence,prevalence and impact of SARA in dairy herds[J].Animal Feed Science and Technology,2012,172(1/2):4-8.
[4] 胡红莲,刘大程,卢德勋,等.日粮不同非纤维性碳水化合物与中性洗涤纤维的比值对奶山羊瘤胃液和血液中内毒素、组织胺含量的影响[J].中国畜牧兽医,2012,39(3):104-109.
[5] 贾媛媛,王绍庆,常广军,等.高精料诱导的SARA对泌乳期山羊血液和瘤胃液中皮质醇的影响[J].草业学报,2012,21(4):259-266.
[6] 胡红莲,谢天宇,杨淑青,等.亚急性瘤胃酸中毒对奶山羊血浆细胞因子和激素含量的影响[J].动物营养学报,2015,27(2):418-425.
[7] STEELE M A,ALZAHAL O,HOOK S E,et al.Ruminal acidosis and the rapid onset of ruminal parakeratosis in a mature dairy cow:a case report[J].Acta Veterinaria Scandinavica,2009,51:39.
[8] GHORBANI G R,MORGAVI D P,BEAUCHEMIN K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and the microbial populations of feedlot cattle[J].Journal of Animal Science,2002,80(7):1977-1985.
[9] 郭鹏,刘大程,赵培厅,等.不同NFC/NDF比日粮对奶山羊瘤胃细菌及瘤胃和血浆中内毒素及组胺含量的影响[J].畜牧兽医学报,2015,46(1):96-103.
[10] SUBER R L,HENTGES J F,GUDAT J C,et al.Blood and ruminal fluid profiles in carbohydrate-foundered cattle[J].American Journal of Veterinary Research,1979,40(7):1005-1008.
[11] LACHMANN G,SIEBERT H.Bestimmung des saure-basen-status in den erythrocytten and inm lebergewebe beim rind[J].Monatshefte Fur Vetennarmedizin,1980,35:384-388.
[12] 章森.不同日粮模式对奶牛血浆内毒素、代谢产物和激素含量的影响[D].硕士学位论文.重庆:西南大学,2013:7-13.
[13] MUTSVANGWA J,WRIGHT T.奶牛亚急性瘤胃酸中毒(SARA)[J].张树金,译.中国动物保健,2004(8):23-24.
[14] NOCEK J E.Bovine acidosis:implications on laminitis[J].Journal of Dairy Science,1997,80(5):1005-1028.
[15] NRC.Nutrient requirements of goats:angora,dairy,and meat goats in temperate and tropical countries[S].Washington,D.C.:National Academy Press,1981.
[16] 金公亮.奶山羊饲养标准[J].畜牧兽医杂志,1989,8(2):7-12.
[17] RAMANZIN M,BAILONI L,SCHIAVON S,Effect of forage to concentrate ratio on comparative digestion in sheep,goats and fallow deer[J].Animal Science,1997,64(1):163-170.
[18] PENNER G B,OBA M,GBEL G,et al.A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term[J].Journal of Dairy Science,2010,93(10):4838-4845.
[19] PLAIZIER J C,KHAFIPOUR E,LI S,et al.Subacute ruminal acidosis (SARA),endotoxins and health consequences[J].Animal Feed Science and Technology,2012,172(1/2):9-21.
[20] ENEMARK J M D,JØRGENSEN R J,ENEMARK P S.Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidosis:a review[J].Veterinarija Ir Zootechnika,2002,20(42):16-29.
[21] EMMANUEL D G V,MADSEN K L,CHURCHILL T A,et al.Acidosis and lipopolysaccharide fromEscherichiacoliB∶055 cause hyperpermeability of rumen and colon tissues[J].Journal of Dairy Science,2007,90(12):5552-5557.
[22] 周俊.不同日粮模式对奶牛瘤胃内毒素释放和乳腺免疫活化状态的影响[D].硕士学位论文.重庆:西南大学,2013.
[23] 赵培厅.日粮不同NFC/NDF比对奶山羊瘤胃发酵功能和微生物区系变化的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011.
[24] GOZHO G N,KRAUSE D O,PLAIZIER J C.Ruminal lipopolysaccharide concentration and inflammatory response during grain-induced subacute ruminal acidosis in dairy cows[J].Journal of Dairy Science,2007,90(2):856-866.
[25] 胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2008:43-52.
[26] KHAFIPOUR E,KRAURE D O,PLAIZIER J C.A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].Journal of Dairy Science,2009,92(3):1060-1070.
[27] ASCHENBACH J R,FURLL B,GBEL G.Histamine affects growth of sheep ruminal epithelial cells kept in primary culture[J].Zentralblatt Fur Veterinarmedizin.Reihe A,1998,45(6/7):411-416.
[28] 汪恩强,黄会岭,李占雷.奶山羊瘤胃酸中毒主要特性的试验研究[J].河北农业大学学报,2000,23(3):83-85.
[29] NAGARAJA T G,CHENGAPPA M M.Liver abscesses in feedlot cattle:a review[J].Journal of Animal Science,1998,76(1):287-298.
[30] 王林枫,杨树,杨改青,等.不同饲养模式对奶牛血液生化指标及激素含量的影响[J].中国畜牧兽医,2014,41(9)110-115.
[31] 张庆茹,李建国,倪耀娣,等.暑热宁对热应激奶牛血液生化指标的影响[J].中国兽医杂志,2008,44(12):50-52.
[32] 李新萍,陶岳,张孝恩,等.新疆石河子地区奶牛血液生化指标正常参考值范围的建立[J].中国奶牛,2011(18):47-50.
[33] GODDEN S M,LISSEMORE K D,KELTON D F,et al.Factors associated with milk urea concentrations in Ontario dairy cows[J].Journal of Dairy Science,2001,84(1):107-114.
[34] 王婷婷,郭立辉,赵晨旭,等.组胺对体外培养犊牛原代瘤胃上皮细胞炎性因子的影响[J].吉林农业大学学报,2016,36(2):275-280.
[35] 李小杉,杨丰利,杜玉兰,等.奶牛酮病及其预防措施[J].动物医学进展,2010,31(1):108-111.
[36] 阳毅,蒙炜.肠道屏障功能障碍:治疗急性Stanford A型主动脉夹层全身炎性反应的新靶点[J].成都医学院学报,2016,11(1):1-4.
[37] BAUMAN D E,MATHER I H,WAU R J,et al.Major advances associated with the biosynthesis of milk[J].Journal of Dairy Science,2006,89(4):1235-1243.
[38] 张树坤.不同精粗比日粮对泌乳奶山羊乳脂肪/乳蛋白的影响及其机制[D].硕士学位论文.南京:南京农业大学,2012.
[39] 史成和,吴成林,张达矜,等.紫芪方对失血性休克大鼠肠道通透性的影响[J].转化医学杂志,2016,5(2):87-91.
[40] 叶平生.高精料日粮饲喂对奶山羊肝脏中游离氨基酸重分配及乳产量/乳蛋白的影响与相关机制[D].硕士学位论文.南京:南京农业大学,2014.
[41] EWASCHUK J B,NAYLOR J M,ZELLO G A.D-lactate in human and ruminant metabolism[J].The Journal of Nutrition,2005,135(7):1619-1625.
[42] ASSADIAN A,ASSADIAN O,SENEKOWITSCH C,et al.PlasmaD-lactate as a potential early marker for colon ischaemia after open aortic reconstruction[J].European Journal of Vascular & Endovascular Surgery:the Official Journal of the European Society for Vascular Surgery,2006,31(5):470-474.
[43] SIMARAKS S,CHINRASRI O,AENGWANICH S.Hematological,electrolyte and serum biochemical values of the Thai indigenous chickens (Gallusdomesticus) in northeastern,Thailand[J].Songklanakarin Journal of Science and Technology,2004,26(3):425-430.
[44] 王婷婷.亚急性瘤胃酸中毒病牛瘤胃组胺对瘤胃上皮细胞炎性通路的影响[D].硕士学位论文.长春:吉林大学,2015:26-28.
*Corresponding author, professor, E-mail: honglianhu2010@163.com
**Contributed equally
(责任编辑 王智航)
Effects of Subacute Ruminal Acidosis on Plasma Abnormal Metabolites and Biochemical Indexes of Dairy Goats
SUN Yanyong1HU Honglian2*GAO Min2XU Ming1SONG Liwen2**
(1.CollegeofAnimalScienceandTechnology,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.ResearchInstituteofAnimalNutrition,InnerMongoliaAcademyofAnimalSciences,Hohhot010030,China)
Using the method of increasing dietary non-fiber carbohydrate/neutral detergent fiber (NFC/NDF) to induce subacute ruminal acidosis (SARA) of dairy goats for the purpose of investigating the changes of lipopolysaccharide (LPS) and histamine (HIS) contents, and biochemical indexes in plasma. Four healthySanengdairy goats with similar body weight were selected. Goats were fed 4 diets with different NFC/NDF (1.40, 1.79, 2.31 and 3.23, respectively) in order. Each diet was fed for 15 days as 1 group, the first 12 days were for adjustment period, and the last 3 days were for sampling period. Plasma LPS and HIS contents were detected with the method of enzyme linked immunosorbent assay; plasma biochemical indexes were detected with biochemical analyzer. The results showed as follows: 1) SARA was successfully inducted when NFC/NDF reached the level of 3.23 since 1.40. 2) The contents of HIS and LPS in plasma were both increased with the gradual increase of dietary NFC/NDF during SARA induction, and 3.23 NFC/NDF group was significantly higher than 1.40 NFC/NDF group (P<0.05). 3) With the increase of dietary NFC/NDF, the contents of immunoglobulin M (IgM), immunoglobulin A (IgA) and immunoglobulin G (IgG) in plasma were not significantly changed (P>0.05); the contents of creatinine (CREA) andD-lactic acid (LD) and the activities of creatine kinase (CK), aspartate aminotransferase (AST) and diamine oxidase (DAO) were not significantly changed (P>0.05); plasma γ-glutamyl transpeptidase (γ-GT) activity tended to be increased, and 3.23 NFC/NDF group was significantly higher than other groups (P<0.05); plasma urea nitrogen (UN) content was decreased, and 1.40 NFC/NDF group was significantly higher than other groups (P<0.05); plasma alkaline phosphatase (ALP) activity was increased, and 3.23 NFC/NDF group was significantly higher than other groups (P<0.01); plasma free fatty acid (FFA) content was firstly increased and then decreased, 2.31 NFC/NDF group was significantly higher than other groups (P<0.01); plasma β-hydroxybutyric acid (β-HB) content was decreased, and 1.40 NFC/NDF group was significantly higher than other groups (P<0.01). The results indicate that the contents of HIS and LPS in plasma are both significantly increased with the gradual increase of dietary NFC/NDF, which lead to inflammatory reaction in dairy goats, aggravate illness of SARA, and active immune reaction; different changes of biochemical indexes in plasma are observed, which suggests that dairy goats is in a state of stress during SARA period, and liver damage is caused.[ChineseJournalofAnimalNutrition, 2017, 29(3):1046-1055]
subacute ruminal acidosis; biochemical indexes; dairy goats; non-fiber carbohydrate/neutral detergent fiber; lipopolysaccharide; histamine
10.3969/j.issn.1006-267x.2017.03.039
2016-09-06
国家自然科学基金(31472124);内蒙古自然科学基金(2015MS0380);现代农业(奶牛)产业技术体系建设专项资金(CARS-37)
孙燕勇(1988—),女,河北张家口人,硕士研究生,从事反刍动物营养研究。E-mail: 840353512@qq.com
*通信作者:胡红莲,研究员,E-mail: honglianhu2010@163.com
S826
A
1006-267X(2017)03-1046-10
**同等贡献作者
