饲粮添加酵母寡聚糖对高密度养殖条件下蛋鸡生产性能、蛋品质、血清生化指标和肠道健康的影响
2017-04-11李恩凯孟彦淼丁祥文杨家昶胡希怡宋志刚
王 玉 李恩凯* 孟彦淼 丁祥文 杨家昶 胡希怡 张 博 宋志刚**
(1.山东农业大学动物科技学院,泰安271018;2.河北省辛集市畜牧局,辛集052360;3.菲利欧-乐斯福动物营养与健康事业部,上海200235)
饲粮添加酵母寡聚糖对高密度养殖条件下蛋鸡生产性能、蛋品质、血清生化指标和肠道健康的影响
王 玉1李恩凯1*孟彦淼2丁祥文1杨家昶1胡希怡1张 博3宋志刚1**
(1.山东农业大学动物科技学院,泰安271018;2.河北省辛集市畜牧局,辛集052360;3.菲利欧-乐斯福动物营养与健康事业部,上海200235)
本试验旨在研究饲粮中添加酵母寡聚糖(YOS)对高密度养殖条件下蛋鸡生产性能、蛋品质、肠道黏膜形态结构及微生物区系分布、血清生化指标和肠道功能相关基因表达的影响。选取864只12周龄海兰褐蛋鸡,随机分为6个组,每组12个重复,每重复3个笼子,每个笼子3只(低密度)或5只(高密度)。对照组饲喂基础饲粮,试验组饲喂在基础饲粮中分别添加250和500 g/t YOS的饲粮,试验期18周。结果表明:1)饲粮添加YOS能显著提高蛋壳颜色的均匀度(P<0.05)。2)饲粮添加YOS增加了蛋鸡肠道绒毛高度/隐窝深度值(P=0.059),其中250 g/t YOS组显著高于对照组(P<0.05)。3)饲粮添加YOS使得蛋鸡空肠乳酸杆菌数量显著增加(P<0.05),大肠杆菌数量显著减少(P<0.05),其中250 g/t YOS组菌群变化较为明显。4)饲粮添加YOS显著降低了蛋鸡血清中内毒素含量(P<0.05),提高了免疫球蛋白A含量(P=0.090),且250 g/t YOS组较对照组显著提高(P<0.05)。由此可见,饲粮中添加YOS能够改善高密度养殖条件下蛋鸡肠道功能,添加剂量以250 g/t的综合效果较佳。
酵母寡聚糖;蛋鸡;生产性能;蛋品质;血清生化指标;肠道健康
应激是指动物对外界环境刺激所产生的非特异性反应。在养禽业中许多因素都可以成为应激源,在现代家禽业高度集约化的养殖模式下,饲养密度成为家禽养殖中最普遍的应激因素[1]。高密度养殖条件所带来的应激,不仅影响家禽生产性能,对肠道健康也有重要影响[2]。肠道是畜禽消化、吸收的主要场所,肠道健康是动物良好生产性能和免疫功能健全的保障。实践证明抗生素对保持动物健康、促进动物生长、提高饲料利用率有明显效果,但是会破坏肠道微生态平衡,影响肠道健康。因此,抗生素作为生长促进剂的应用应当逐渐受到限制直至禁止,在功效上全面替代抗生素、无任何毒副作用的新型添加剂的使用成为必然趋势。大量的研究表明,作为一种新型的微生态添加剂——酵母寡聚糖(yeast oligosaccharide,YOS)可以促进有益菌的增殖,抑制有害菌,促进和完善肠道的吸收功能及完整性,促进动物生长,提高饲料利用率[3-5]。本试验从YOS对高密度养殖条件下蛋鸡生产性能、蛋品质、肠道黏膜形态结构及微生物区系分布、血清生化指标和肠道功能相关基因表达的影响着手,探讨YOS对蛋鸡高密度养殖条件下应激的防治效果和机制,为YOS在蛋鸡上的合理使用提供理论依据。
1 材料与方法
1.1 试验材料
YOS为法国菲利欧-乐斯福生产(YOS含量为21%)。
1.2 试验设计
选取864只12周龄海兰褐蛋鸡,随机分为6个组,每组12个重复,每个重复3个笼子,每笼3只(低密度)或5只(高密度)。对照组饲喂基础饲粮,试验组饲喂在基础饲粮中分别添加250和500 g/t YOS的试验饲粮,试验期为18周。基础饲粮参考《鸡饲养标准》(NY/T 33—2004)配制,基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1)每千克预混料含有 One kilogram premix contained the following:VA 160 000~200 000 IU,VD370 000~100 000 IU,VE 500 mg,VK360~100 mg,VB150 mg,VB2120 mg,VB665 mg,VB120.3 mg,Cu 0.16~0.40 g,Fe 0.9~5.0 g,Mn 1~3 g,Zn 1~3 g,Se 3.6~10.0 mg,I 10~20 mg,生物素 biotin 3.5 mg,叶酸 folic acid 16 mg,烟酸niacin acid 700 mg,泛酸钙 calcium pantothenate 260 mg。
2)营养水平均为计算值。Nutrient levels were all calculated values.
1.3 饲养管理
试验鸡饲养于半开放式鸡舍,采用3层立体笼养,白天自然光照,早晚补光以保证光照时间为16 h/d,光照强度为20 lx。鸡舍相对湿度为50%~90%,采用自然通风和横向负压通风相结合的通风方式。饲喂干粉料,每天布料3次,匀料4次,乳头式饮水器自由饮水。鸡舍由专人管理,每日按重复捡蛋2次,每周带鸡消毒1次,每天清粪2次。
1.4 指标检测
1.4.1 生产性能和蛋品质
试验第18周末,以重复为单位统计采食量和产蛋率;每组取24枚蛋测定蛋重和蛋品质(包括蛋形指数、蛋壳厚度和硬度、蛋黄颜色、哈夫单位和蛋壳颜色);计算料蛋比。
1.4.2 血清生化指标
试验第18周末,每组选取12只鸡,翅静脉采血,分离血清,-20 ℃保存,采用全自动生化分析仪(7170A,日本HITACHI公司)检测血清中葡萄糖(GLU)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)含量,利用酶联免疫吸附试验测定免疫球蛋白A(IgA)和内毒素的含量,所需试剂盒购于南京建成生物工程研究所。
1.4.3 肠道黏膜形态结构
取空肠组织切片样,测量绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度值。
1.4.4 肠道菌群数量
取空肠内容物,测定乳酸菌和大肠杆菌的数量,方法参考文献[3-4]操作。
1.4.5 肠道功能相关基因表达
用RNA提取试剂盒(购于康为试剂生物有限公司,CW0584)提取空肠样品总RNA,琼脂糖凝胶电泳检测RNA的完整性,使用Transcriptor First Strand cDNA Synthesis Kit试剂盒(Roche公司,4897030001)将总RNA反转录为cDNA,根据FastStart Universal SYBR Green Master试剂盒(Roche公司,4913914001)进行实时荧光定量PCR,采用-2△△Ct法对Toll样受体4(TLR4)、营养物质转运体——葡萄糖转运载体2(GLUT2)和脂肪酸结合蛋白1(FABP1) mRNA表达量进行分析。
1.5 数据统计与分析
采用SAS 9.13的ANOVA过程进行方差分析,并采用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准,P<0.10表示具有显著趋势,结果用平均值±标准误表示。
2 结果与分析
2.1 饲粮添加YOS对高密度养殖条件下蛋鸡生产性能的影响
由表2可知,高密度养殖条件极显著降低了蛋鸡采食量和料蛋比(P<0.01),对产蛋率没有显著影响(P>0.05);饲粮添加YOS对蛋鸡生产性能没有显著影响(P>0.05);饲粮添加YOS和高养殖密度对蛋鸡采食量存在交互作用(P<0.01),对料蛋比和产蛋率没有交互作用(P>0.05)。

表2 饲粮添加YOS对高密度养殖条件下蛋鸡生产性能的影响
同行或同列平均值肩标不同字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。P1代表密度,P2代表YOS,P3代表互作。下表同。
Means within the same row or column with different letter superscripts were significantly different (P<0.05), while within no letter or the same letter superscripts were not significantly different (P>0.05).P1mean density,P2mean YOS, andP3mean interaction. The same as below.
2.2 饲粮添加YOS对高密度养殖条件下蛋鸡蛋品质的影响
由表3可知,饲粮添加YOS和高养殖密度对蛋重、蛋形指数、蛋壳厚度、哈夫单位均没有产生显著影响(P>0.05),高密度组的蛋黄颜色值显著大于低密度组(P<0.05)、蛋壳硬度显著低于低密度组(P<0.05)。250 g/t YOS组的蛋壳颜色值显著小于对照组(P<0.05)。饲粮添加YOS和高养殖密度对蛋壳厚度、蛋黄颜色值和蛋壳颜色值有交互作用(P<0.05),对蛋品质其他指标没有交互作用(P>0.05)。
2.3 饲粮添加YOS对高密度养殖条件下蛋鸡空肠黏膜形态结构的影响
由表4可知,高养殖密度对蛋鸡空肠黏膜形态结构没有显著影响(P>0.05)。与对照组相比,250 g/t YOS组显著降低了空肠隐窝深度(P<0.05),显著增加了绒毛高度/隐窝深度值(P<0.05);500 g/t YOS组显著增加了绒毛高度(P<0.05)。饲粮添加YOS和高养殖密度对绒毛高度/隐窝深度值有交互作用(P<0.05),说明YOS的添加改善了高养殖密度对绒毛高度/隐窝深度的影响。

表3 饲粮添加YOS对高密度养殖条件下蛋鸡蛋品质的影响

表4 饲粮添加YOS对高密度养殖条件下蛋鸡空肠黏膜形态结构的影响
2.4 饲粮添加YOS对高密度养殖条件下蛋鸡空肠菌群数量的影响
由表5可知,饲粮添加YOS显著增加了高密度养殖条件下蛋鸡空肠中乳酸杆菌数量(P<0.05),显著降低了空肠中大肠杆菌数量(P<0.05)。高养殖密度和YOS的添加对蛋鸡空肠菌群数量没有交互作用(P>0.05)。
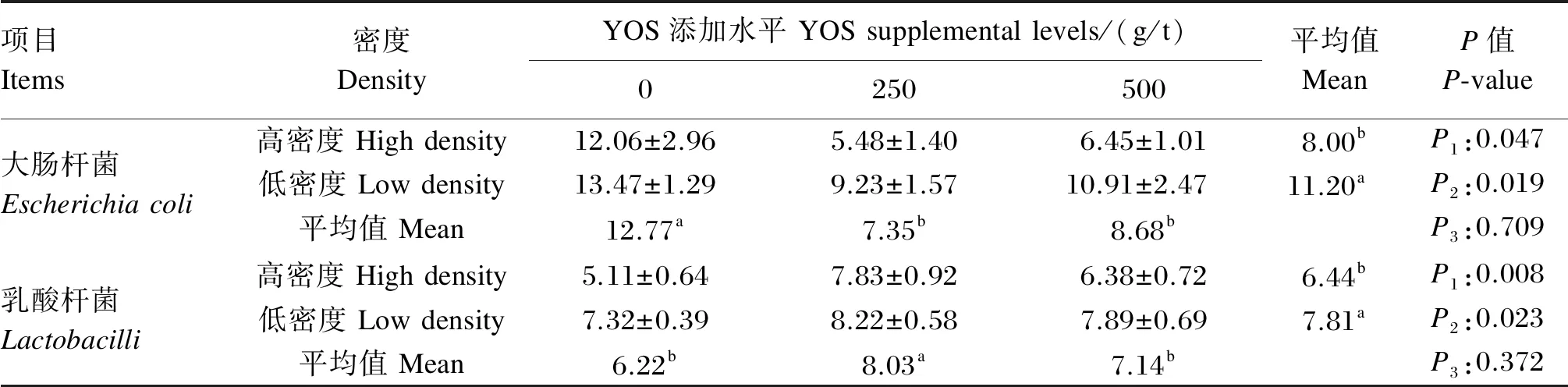
表5 饲粮添加YOS对高密度养殖条件下蛋鸡空肠菌群数量的影响
2.5 饲粮添加YOS对高密度养殖条件下蛋鸡血清生化指标的影响
由表6可知,高密度养殖条件对蛋鸡血清生化指标未产生显著影响(P>0.05)。饲粮添加YOS显著降低蛋鸡血清中内毒素含量(P<0.05),添加250 g/t YOS显著增加血清中IgA含量(P<0.05)。饲粮添加YOS和高养殖密度对蛋鸡的血清生化指标没有交互作用(P>0.05)。

表6 饲粮添加YOS对高密度养殖条件下蛋鸡血清生化指标的影响
2.6 饲粮添加YOS对高密度养殖条件下蛋鸡肠道功能相关基因表达的影响
由表7可知,饲粮添加YOS显著降低了空肠TLR4 mRNA的表达量(P<0.05);与对照组相比,250 g/t YOS组GLUT2和FABP1 mRNA表达量有所提高,但差异不显著(P>0.05)。饲粮添加YOS和高养殖密度对FABP1 mRNA的表达量有交互作用(P<0.05)。

表7 饲粮添加YOS对高密度养殖条件下蛋鸡肠道功能相关基因表达的影响
3 讨 论
3.1 饲粮添加YOS对高密度养殖条件下蛋鸡生产性能的影响
研究表明,增加鸡群饲养密度会减少鸡群采食量并降低产蛋率[6],饲养密度增加,鸡体活动空间减少使其处于应激状态,从而采食量下降,产蛋率和饲料转化率降低[7-8]。本试验中高密度组的采食量、料蛋比显著低于低密度组的结果与之相一致。饲粮中添加甘露寡聚糖可以显著提高产蛋鸡的饲料报酬[9],也有试验表明,饲粮中添加YOS会增加采食量[5]。本试验中添加YOS可以提高蛋鸡的采食量,产蛋率的降低可能与外界环境温度有关,蛋鸡受到高温应激,产蛋率会明显下降。
3.2 饲粮添加YOS对高密度养殖条件下蛋鸡蛋品质的影响
在高密度应激下,大部分采食的饲粮用来抵御应激给自身带来的压力,导致蛋重减小。有研究表明高笼养密度使鹌鹑采食量减少,鹌鹑蛋重量降低[10]。本试验中,高密度组的蛋重比低密度组蛋重减少0.93 g,这说明高密度养殖在一定程度上会减小蛋重。有报道指出,鹌鹑饲粮中添加甘露寡聚糖只会显著减小蛋黄直径[11],母鸡饲粮中添加甘露寡聚糖会降低蛋重[12],饲粮添加甘露寡聚糖会提高蛋壳比率[13-14]。在本试验中,添加YOS显著降低蛋壳颜色,对蛋品质其他指标影响不显著,说明饲粮中添加YOS对蛋品质影响不大。
3.3 饲粮添加YOS对高密度养殖条件下蛋鸡肠道微生态的影响
研究显示添加甘露寡聚糖可以调节肠道微生物菌群的生长,附着于肠壁的乳酸菌可以通过增加黏蛋白的表达稳定黏膜屏障以阻止有害菌的过度生长[5],防止病原菌附着于肠壁上,提高肠道的完整性[4]。本试验证明,饲粮中添加YOS显著降低了空肠内大肠杆菌数量,添加250 g/t YOS显著增加了空肠中乳酸杆菌数量,这与前人的研究结果[15]相一致。高密度养殖显著降低了空肠内大肠杆菌和乳酸杆菌的数量,说明高密度养殖会破坏肠道菌群平衡,而饲粮中添加250 g/t YOS对肠道菌群具有良好的调节作用。
3.4 饲粮添加YOS对高密度养殖条件下蛋鸡肠道黏膜形态结构的影响
小肠绒毛是小肠吸收营养物质的主要部位,饲粮中添加甘露寡聚糖可以显著增加肥育兔回肠绒毛高度[3];甘露寡聚糖可增加小肠绒毛高度,不影响隐窝深度[16];也有研究显示添加甘露寡聚糖小肠绒毛的长度没有变化,而隐窝深度显著降低[5]。以上结果均表明添加甘露寡聚糖使得小肠绒毛高度与隐窝深度的比值增大,小肠吸收面积增大。本试验中,与对照组相比,250和500 g/t YOS组的绒毛高度分别增加3.00%、10.21%,隐窝深度分别降低12.67%、7.93%,绒毛高度/隐窝深度值分别增加15.4%、13.2%,说明YOS对肠道的作用效果非常明显,能有效地提高肠道绒毛吸收面积,完善肠道吸收功能。饲粮添加YOS和高养殖密度对绒毛高度/隐窝深度值有交互作用,说明YOS的添加改善了高养殖密度对肠道吸收功能的影响。
3.5 饲粮添加YOS对高密度养殖条件下蛋鸡血清生化指标的影响
本试验中,血清GLU含量的变化与采食量的变化相一致,添加YOS能够提高血清中GLU含量,可在一定程度上减少高养殖密度应激引起的血糖降低。甘露寡聚糖能够促进乳酸杆菌和双歧杆菌等有益菌的生长,这些有益菌可以同化胆固醇,降低血清中胆固醇含量[17]。本试验中,与对照组相比,500 g/t YOS组血清TC含量降低了10.06%。HDL和LDL具有运输胆固醇的作用,LDL是将肝脏合成的内源性胆固醇运送到肝外组织,保证细胞对胆固醇需求,HDL是将肝外组织中胆固醇转运到肝内进行代谢[18]。本试验中,饲粮添加YOS使得血清中HDL含量升高,LDL含量降低,进一步证实添加YOS可以调节血清TC含量。
甘露寡聚糖具有一定的免疫原性,可通过与肠绒毛上特异性受体结合,刺激机体免疫应答,增强细胞和体液免疫[19]。本试验中,与对照组相比,250 g/t YOS组蛋鸡血清中IgA含量显著升高,这与饲喂甘露寡聚糖火鸡胆汁IgA及血浆免疫球蛋白G的含量增加的结果[20]一致。甘露寡聚糖可以降低肠道pH,酸性环境可以抑制腐败菌的异常发酵,减少内毒素的产生。本试验证明,饲粮添加YOS显著降低了血清中内毒素的含量,说明YOS对提高蛋鸡的免疫水平有一定作用。
3.6 饲粮添加YOS对高密度养殖条件下蛋鸡肠道功能相关基因表达的影响
Toll样受体(TLRs)是启动家禽肠道天然免疫应答的关键模式识别受体,TLRs通过识别微生物表面脂多糖,激活与适应性免疫有关的基因,释放免疫效应因子来引发免疫反应。研究证实TLR4表达的提高与胃肠道屏障功能的改善密切相关,由此提高肠道对病原菌入侵和感染的抵抗力[21]。Lu等[22]发现肉鸡在感染产气荚膜杆菌后,TLR4的表达提高。本试验中,饲粮添加YOS显著降低了空肠TLR4的表达量,说明YOS可以抑制肠道有害菌增殖,从而降低TLR4的表达。
GLUT2是肠上皮细胞葡萄糖转运的基本载体,其表达量会随着胰岛素分泌的增加而提高,在本试验中GLUT2的表达量变化和血清中GLU含量的变化高度一致。近年来的研究表明,FABP1能够促进脂肪酸的转运和代谢,能参与机体的炎症免疫应答,提高机体抵御疾病的能力[23-24]。本试验中,饲粮添加YOS提高了空肠FABP1 mRNA的表达量,但差异不显著,这与试验组血清TC含量变化相一致。
4 结 论
高密度养殖带来的应激会降低蛋鸡采食量和蛋壳硬度、减少肠道菌群数量,饲粮中添加YOS可以增加肠道绒毛吸收面积,调节肠道微生态,提高蛋鸡免疫水平,从而缓解高密度养殖给蛋鸡带来的应激。
[2] HUME M E,HERNANDEZ C A,BARBOSA N A,et al.Molecular identification and characterization of ileal and cecal fungus communities in broilers given probiotics,specific essential oil blends,and under mixedEimeriainfection[J].Foodborne Pathogens and Disease,2012,9(9):853-860.
[4] YANG Y,IJI P A,KOCHER A,et al.Effects of mannanoligosaccharide in broiler chicken diets on growth performance,energy utilisation,nutrient digestibility and intestinal microflora[J].British Poultry Science,2008,49(2):186-194.
[5] YANG Y,IJI P A,KOCHER A,et al.Effects of dietary mannanoligosaccharide on growth performance,nutrient digestibility and gut development of broilers given different cereal-based diets[J].Journal of Animal Physiology and Animal Nutrition,2008,92(6):650-659.
[6] MTILENI B J,NEPHAWE K A,NESAMVUNI A E,et al.The influence of stocking density on body weight,egg weight,and feed intake of adult broiler breeder hens[J].Poultry Science,2007,86(8):1615-1619.
[7] NAHASHON S N,ADEFOPE N A,AMENYENU A,et al.Laying performance of pearl gray guinea fowl hens as affected by caging density[J].Poultry Science,2006,85(9):1682-1689.
[8] HESTER P Y,WILSON E K.Performance of White Leghorn hens in response to cage density and the introduction of cage mates[J].Poultry Science,1986,65(11):2029-2033.
[9] HASSAN H A,RAGAB M S.Single and combined effects of mannan oligosaccharide (MOS) and dietary protein on the performance and immunity response of laying hens[J].Egyptian Poultry Science,2007,27:969-987.
[10] EL-TARABANY M S,ABDEL-HAMID T M,MOHAMMED H H.Effects of cage stocking density on egg quality traits in Japanese quails[J].Kafkas Universitesi Veteriner Fakültesi Dergisi,2015,21(1):13-18.
[11] BONOS E,CHRISTAKI E,FLOROU-PANERI P.Effects of dietary mannan oligosaccharides and calcium formate on performance and egg quality of Japanese quail (Coturnixjaponica)[J].Journal of Food Science and Engineering,2011,1(4):289-296.
[12] ZAGHINI A,MARTELLI G,RONCADA P,et al.Mannanoligosaccharides and aflatoxin B1in feed for laying hens:effects on egg quality,aflatoxins B1and M1residues in eggs,and aflatoxin B1levels in liver[J].Poultry Science,2005,84(6):825-832.
[13] RADU-RUSU C G,POP I M.Improvement of laying hen performances by dietary mannanoligosaccharides supplementation[J].Lucrăritiinifice-Universitatea detiine Agricolei Medicină Veterinară,Seria Zootehnie,2009,52:144-148.
[14] BOZKURT M,TOKUOGLU Ö,KÜÇÜKYILMAZ K,et al.Effects of dietary mannan oligosaccharide and herbal essential oil blend supplementation on performance and oxidative stability of eggs and liver in laying hens[J].Italian Journal of Animal Science,2012,11(2):e41223.
[15] 邵良平,周伦江,李国平,等.不同剂量甘露寡聚糖对鸡细胞免疫和肠道微生态的影响[J].福建农业大学学报,1999,28(1):86-89.
[16] LEE B D,ZHANG A W,SUNG C K,et al.Effects of dietary yeast (Saccharomycescerevisiae) components on growth performance,ileal morphology and serum cholesterol in male broiler chickens[J].Korean Journal of Poultry Science,2005,32(1):49-54.
[17] GILLILAND S E,NELSON C R,MAXWELL C.Assimilation of cholesterol byLactobacillusacidophilus[J].Applied and Environmental Microbiology,1985,49(2):377-381.
[18] CRAIG I H,PHILLIPS P J,LLOYD J V,et al.Effects of modified fat diets on LDL/HDL ratio[J].The Lancet,1980,216(8198):799.
[19] GRIESHOP C M,FLICKINGER E A,BRUCE K J,et al.Gastrointestinal and immunological responses of senior dogs to chicory and mannan-oligosaccharides[J].Archives of Animal Nutrition,2004,58(6):483-494.
[20] SAVAGE T F,COTTER P F,ZAKRZEWSKA E I.The effect of feeding mannanoligosaccharide on immunoglobulins,plasma IgG and bile IgA of Wrolstad MW male turkeys[J].Poultry Science,1996,75(Suppl.1):143.
[21] RAKOFF-NAHOUM S,PAGLINO J,ESLAMI-VARZANEH F,et al.Recognition of commensal microflora by Toll-like receptors is required for intestinal homeostasis[J].Cell,2004,118(2):229-241.
[22] LU Y,SARSON A J,GONG J,et al.Expression profiles of genes in Toll-like receptor-mediated signaling of broilers infected withClostridiumperfringens[J].Clinical and Vaccine Immunology,2009,16(11):1639-1647.
[23] 郑云峰,高玉鹏,杨烨.脂肪酸结合蛋白及其对动物脂肪代谢的作用[J].动物科学与动物医学,2004,21(12):23-25.
[24] WANG G,BONKOVSKY H L,DE L A,et al.Recent insights into the biological functions of liver fatty acid binding protein 1[J].Journal of Lipid Research,2015,56(12):2238-2247.
*Contributed equally
**Corresponding author, professor, E-mail: naposong@qq.com
(责任编辑 田艳明)
Effects of Dietary Yeast Oligosaccharides Supplementation on Performance, Egg Quality, Serum Biochemical Indices and Intestine Health of Laying Hens under High Density Cultivation
WANG Yu1LI Enkai1*MENG Yanmiao2DING Xiangwen1YANG Jiachang1HU Xiyi1ZHANG Bo3SONG Zhigang1**
(1.CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271018,China; 2.AnimalHusbandryBureauofXinji,Xinji052360,China; 3.Phileo-LesaffreAnimalNutritionandHealthDivision,Shanghai200235,China)
This trial was conducted to investigate the effects of dietary yeast oligosaccharides (YOS) supplementation on performance, egg quality, intestinal mucosal morphology and microflora distribution, serum biochemical indices and intestinal function related gene expression of laying hens under high density cultivation. A total of 864 twelve-week-old Hy-Line Brown hens were randomly allocated to 6 groups with 12 replicates per group, and each replicate with 3 cages and 3 (low density) or 5 (high density) birds per cage. Hens in control group were fed a basal diet, while in the other two experimental groups were fed the same basal diet supplemented with 250 and 500 g/t YOS, respectively. The experiment lasted for 18 weeks. The results showed as follows: 1) dietary YOS supplementation significantly enhanced the uniformity of eggshell color (P<0.05). 2) Dietary YOS supplementation increased the ratio of villus height to crypt depth of intestinal mucosal of hens (P=0.059), which in 250 g/t YOS group was significantly higher than that in control group (P<0.05). 3)Lactobacilluspopulation in jejunum of hens was significantly increased (P<0.05), whereasEscherichiacolipopulation was significantly decreased (P<0.05) by dietary YOS supplementation and 250 g/t level got a better effect. 4) Dietary YOS supplementation significantly decreased serum endotoxin content (P<0.05), increased serum immunoglobulin A content (P=0.090) especially in 250 g/t YOS group, which was significantly higher than that in control group (P<0.05). The results indicate that dietary YOS supplementation, more particularly the 250 g/t dosage, can increase the intestinal function of laying hens subjected to high-density.[ChineseJournalofAnimalNutrition, 2017, 29(3):1030-1038]
yeast oligosaccharides; laying hens; performance; egg quality; serum biochemical indices; intestinal health
10.3969/j.issn.1006-267x.2017.03.037
2016-09-02
山东省现代农业产业技术体系家禽创新团队项目(STAIT-13-011-08)
王 玉(1990—),女,山东枣庄人,硕士研究生,动物营养与饲料科学专业。E-mail: 1161190127@qq.com
S816.7
A
1006-267X(2017)03-1030-09
*同等贡献作者
**通信作者:宋志刚,教授,博士生导师,E-mail: naposong@qq.com
