大鼠肝硬化模型中门静脉压力无创评估的初步探讨
2017-04-11李锦伟王晓航李建奇谢渭芬
李锦伟 王 剑 曾 欣 王晓航 李建奇 谢渭芬*
第二军医大学附属长征医院消化内科1(200003) 上海交通大学医学院附属同仁医院老年科2上海市磁共振重点实验室 华东师范大学物理系3
大鼠肝硬化模型中门静脉压力无创评估的初步探讨
李锦伟1,2王 剑1曾 欣1王晓航1李建奇3谢渭芬1*
第二军医大学附属长征医院消化内科1(200003) 上海交通大学医学院附属同仁医院老年科2上海市磁共振重点实验室 华东师范大学物理系3
肝硬化; 门静脉压; 无创评估; 模型,动物
各种慢性肝病进展至肝硬化后常发生门静脉高压,门静脉高压可进一步导致腹水、脾功能亢进、食管胃底静脉曲张、肝性脑病等一系列并发症,严重影响患者预后。其中,食管胃底静脉曲张破裂出血是导致肝硬化患者死亡的重要原因[1]。因此,门静脉压力的测定对了解肝硬化患者的病情变化、判断预后以及评估治疗效果具有重要意义[2]。目前,肝静脉压力梯度(HVPG)是评价门静脉压力的金标准[3-5]。但由于技术难度大、存在一定创伤性等问题,HVPG难以在临床中大规模应用[6]。近年越来越多的研究聚焦于门静脉压力的无创评估领域。
已有研究发现血清学指标可用来预测门静脉高压的存在,联合使用不同的血清学指标建立数学模型甚至可直接评估门静脉压力的大小[7-8]。但由于血清学指标经常受到全身炎症反应、其他系统疾病等因素的影响,其检测门静脉压力的准确性尚存在疑问。多项研究[9-12]表明,肝脾体积、门静脉系统管径、肝脏纤维化程度等参数可反映门静脉压力。本研究通过制备大鼠肝硬化模型,并分析与门静脉压力密切相关的参数,旨在为临床无创诊断门静脉高压提供依据。
材料与方法
一、实验动物、主要试剂
6周龄雄性Sprague-Dawley(SD)大鼠20只,体质量约180~200 g,购自上海斯莱克实验动物有限公司,饲养于第二军医大学实验动物中心(清洁级)。
硫代乙酰胺购自国药集团化学试剂有限公司,羟脯氨酸试剂盒购自南京建成生物工程研究所。
二、研究方法
1. 肝硬化动物模型制备:将大鼠随机分成对照组和模型组,每组各10只。模型组大鼠予以硫代乙酰胺0.2 g/kg腹腔注射,每周注射3~4次,隔天注射。对照组大鼠给予腹腔注射0.9% NaCl溶液。连续注射20周完成模型制备。
2. 门静脉横径(PVD)测量:成功制备模型后麻醉大鼠,使用动物线圈行MRI(Magnetom Trio Tim; Siemens Medical Solutions)TOF序列扫描[13]。扫描结束后利用后处理软件测量大鼠门静脉左右分支处的最大横径长度。TOF序列成像参数:重复时间11 ms,回波时间4.2 ms,翻转角度18°,平面分辨率0.4 mm×0.3 mm,层厚0.7 mm,层数30层。
在此之前,收敛了昂扬姿态的王树林在看电视。他在等辛娜的出浴。眼睃着屏幕,耳朵一直在浴室的响动中。他的手里拿着手机若有所思。很快浴室的水声停止了,他收起手机,快步来到浴室门外。略一迟疑,伸手拧开了浴室的门,一股香波味儿扑鼻弥香,淡薄的水汽里辛娜正抬腿擦拭,晶莹的水珠在光洁丰腴的后腰闪耀着诱人的光点。不假思索,王树林躬身抱起了出水芙蓉,惊得辛娜哎呀一声一下子揽住了王树林的脖子。两条修长白皙的大腿不停在半空踢踏,别有一番情调。
3. 直接穿刺测压法测定门静脉压力[14]:打开测压包,将玻璃管两端分别与头皮针、橡皮管连接,检查装置气密性后,将玻璃管内注满0.9% NaCl溶液,排除气泡,血管钳夹闭橡皮管。大鼠麻醉后,打开腹腔,穿刺并插管至门静脉主干,松开血管钳,待玻璃管内水柱稳定后读数。测量3次,取均值。
4. 一般情况和组织学检查:大鼠处死后称取体质量,打开腹腔分离肝脏和脾脏并称重和测量体积。取肝组织,部分组织以中性甲醛溶液固定,石蜡包埋,制备石蜡切片,行HE染色。其余肝脏标本-80 ℃冰箱冻存备用。
5. 碱水解法测定组织羟脯氨酸含量[15]:精确称量肝组织,加入水解液混匀,调整pH值。将空白管、标准管和待测管依次加入0.5 mL试剂1、试剂2、试剂3混匀,60 ℃水浴15 min,冷却后离心,取上清于550 nm波长处检测各管吸光度值,计算样品羟脯氨酸含量。
6. 天狼星红染色和胶原面积比例计算:石蜡切片脱蜡至水,天狼星红-苦味酸染色1 h后。1%乙酸溶液分化2 s,脱水、透明、封片。每张切片随机选取4个低倍视野,用图像分析系统测量染色后的胶原面积并自动计算与总面积的百分比,取均值。
三、统计学分析
结 果
一、 肝脏组织学
大体观察示模型组大鼠肝脏表面呈结节样增生;对照组大鼠肝脏表明光滑,色泽饱满,未见结节样增生。HE染色可见模型组大鼠肝脏实质纤维组织增生、假小叶形成;对照组肝脏实质为正常小叶、门管区和小叶间隔。天狼星红染色示模型组大鼠大量胶原沉积,对照组仅在正常小叶间隔和门管区有胶原沉积(图1)。
二、 各参数检测结果
模型组大鼠门静脉压力为11.3~19.0 cm H2O(1 cm H2O=0.098 kPa),对照组为8.4~14.0 cm H2O。与对照组相比,模型组大鼠门静脉压力显著升高(P<0.001),体质量显著下降(P<0.001),肝脏重量、肝脏体积、脾脏重量、PVD、肝脏体积与体质量比(LV/BW)、脾脏体积与体质量比(SV/BW)、羟脯氨酸含量以及胶原面积比例均显著升高(P<0.05)(表1)。
三、不同参数与门静脉压力的相关性分析
门静脉压力与LV/BW和肝脏胶原面积比例成正相关(r=0.649,P=0.042;r=0.699,P=0.026)(图2),而与其余参数无明显相关性。

图2 LV/BW、胶原面积比例与门静脉压力关系的散点图

图1 大鼠肝脏组织HE染色和天狼星红染色结果(×50)
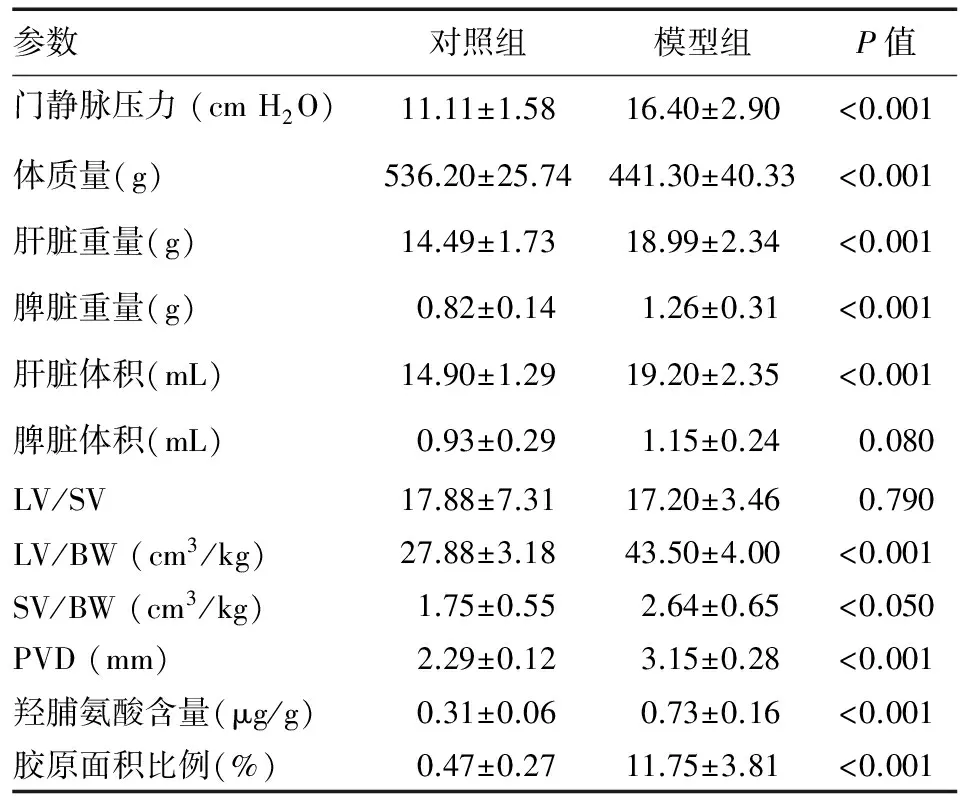
参数对照组模型组P值门静脉压力(cmH2O)11.11±1.5816.40±2.90<0.001体质量(g)536.20±25.74441.30±40.33<0.001肝脏重量(g)14.49±1.7318.99±2.34<0.001脾脏重量(g)0.82±0.141.26±0.31<0.001肝脏体积(mL)14.90±1.2919.20±2.35<0.001脾脏体积(mL)0.93±0.291.15±0.240.080LV/SV17.88±7.3117.20±3.460.790LV/BW(cm3/kg)27.88±3.1843.50±4.00<0.001SV/BW(cm3/kg)1.75±0.552.64±0.65<0.050PVD(mm)2.29±0.123.15±0.28<0.001羟脯氨酸含量(μg/g)0.31±0.060.73±0.16<0.001胶原面积比例(%)0.47±0.2711.75±3.81<0.001
讨 论
无创诊断门静脉高压是慢性肝病研究领域的热点问题[16]。联合不同血清学指标建立数学模型可评估门静脉压力。由天冬氨酸氨基转移酶(AST)和血小板计数(PLT)构成的APRI指数与门静脉压力显著相关[17]。Berzigotti等[18]通过回顾性分析发现联合使用白蛋白、ALT、INR三个指标可用于诊断有临床意义的门静脉高压症。但血清学检查波动较大,容易受其他系统疾病的影响,因此用于无创诊断门静脉高压存在较大局限性。近年随着影像学技术的迅速发展,利用影像学参数评估肝硬化程度和门静脉压力不断受到重视。Hayashi等[9]发现利用CT测量脾脏体积是诊断门静脉高压的较敏感指标。瞬时弹性成像测定的肝脏硬度与HVPG之间具有极好的相关性,当肝脏硬度值>8.74 kPa,诊断门静脉高压的敏感性和特异性可分别达 90.0%和81.0%[10]。此外,Colecchia等[19]的研究发现,利用MRE测量脾脏硬度值可评估和监测门静脉高压,甚至还可预测食管静脉曲张的发生。Iranmanesh等[20]的一项研究发现,利用CT扫描获取肝脾体积等指标建立的数学诊断模型可较为准确地反映HVPG。但目前建立的无创预测模型尚不成熟,不同的门静脉压力预测公式所使用的参数不尽相同。因此,利用大鼠肝硬化模型进行门静脉压力相关参数分析将对临床探索无创诊断门静脉高压以及为现有预测公式的修正提供重要参考。
本研究发现,在大鼠肝硬化模型中,LV/BW和肝脏组织胶原面积比例与门静脉压力成线性正相关。在临床中,肝脏体积的测量简单易行,可通过CT、MRI等影像学手段以及后处理技术获取。肝脏组织胶原面积比例与门静脉压力成线性正相关更佐证了肝脏组织变化能反映门静脉压力水平。脾脏肿大是门静脉高压引起的常见并发症之一,多项研究发现脾脏体积可间接反映门静脉压力。但本研究中脾脏体积与门静脉压力无明显相关性。其原因可能与大鼠脾脏体积较小、实验中测量方法误差较大有关,故关于此项参数在评估门静脉压力中的意义尚需行进一步实验探讨。
综上所述,本研究利用动物模型对肝硬化条件下能反映门静脉压力变化情况的相关因素进行了初步分析,有望为临床探索无创诊断门静脉高压提供重要依据。
1 Tsochatzis EA, Bosch J, Burroughs AK. Liver cirrhosis[J]. Lancet, 2014, 383 (9930): 1749-1761.
2 de Franchis R; Baveno Ⅴ Faculty. Revising consensus in portal hypertension: report of the Baveno Ⅴ consensus workshop on methodology of diagnosis and therapy in portal hypertension[J]. J Hepatol, 2010, 53 (4): 762-768.
3 Groszmann R, Vorobioff JD, Gao H. Measurement of portal pressure: when, how, and why to do it[J]. Clin Liver Dis, 2006, 10 (3): 499-512, viii.
4 Merkel C, Montagnese S. Hepatic venous pressure gradient measurement in clinical hepatology[J]. Dig Liver Dis, 2011, 43 (10): 762-767.
5 Groszmann RJ, Wongcharatrawee S. The hepatic venous pressure gradient: anything worth doing should be done right[J]. Hepatology, 2004, 39 (2): 280-282.
6 Berzigotti A, Seijo S, Reverter E, et al. Assessing portal hypertension in liver diseases[J]. Expert Rev Gastroenterol Hepatol, 2013, 7 (2): 141-155.
7 Buck M, Garcia-Tsao G, Groszmann RJ, et al. Novel inflammatory biomarkers of portal pressure in compensated cirrhosis patients[J]. Hepatology, 2014, 59 (3): 1052-1059.
8 Sharma S, Khalili K, Nguyen GC. Non-invasive diagnosis of advanced fibrosis and cirrhosis[J]. World J Gastroenterol, 2014, 20 (45): 16820-16830.
9 Hayashi H, Beppu T, Okabe H, et al. Combined measurements of serum bile acid level and splenic volume may be useful to noninvasively assess portal venous pressure[J]. J Gastroenterol, 2012, 47 (12): 1336-1341.
10 Carrión JA, Navasa M, Bosch J, et al. Transient elastography for diagnosis of advanced fibrosis and portal hypertension in patients with hepatitis C recurrence after liver transplantation[J]. Liver Transpl, 2006, 12 (12): 1791-1798.
11 Vizzutti F, Arena U, Romanelli RG, et al. Liver stiffness measurement predicts severe portal hypertension in patients with HCV-related cirrhosis[J]. Hepatology, 2007, 45 (5): 1290-1297.
12 Choi SY, Jeong WK, Kim Y, et al. Shear-wave elastography: a noninvasive tool for monitoring changing hepatic venous pressure gradients in patients with cirrhosis[J]. Radiology, 2014, 273 (3): 917-926.
13 Willmann JK, Göpfert K, Lutz AM, et al. Prospective intraindividual comparison between respiratory-triggered balanced steady-state free precession and breath-hold gradient-echo and time-of-flight magnetic resonance imaging for assessment of portal and hepatic veins[J]. Eur Radiol, 2007, 17 (1): 229-240.
14 Chen X, Zhai J, Cai X, et al. Severity of portal hypertension and prediction of postoperative liver failure after liver resection in patients with Child-Pugh grade A cirrhosis[J]. Br J Surg, 2012, 99 (12): 1701-1710.
15 Lin Y, Xie WF, Chen YX, et al. Treatment of experimental hepatic fibrosis by combinational delivery of urokinase-type plasminogen activator and hepatocyte growth factor genes[J]. Liver Int, 2005, 25 (4): 796-807.
16 Kim MY, Jeong WK, Baik SK. Invasive and non-invasive diagnosis of cirrhosis and portal hypertension[J]. World J Gastroenterol, 2014, 20 (15): 4300-4315.
17 Jin W, Lin Z, Xin Y, et al. Diagnostic accuracy of the aspartate aminotransferase-to-platelet ratio index for the prediction of hepatitis B-related fibrosis: a leading meta-analysis[J]. BMC Gastroenterol, 2012, 12: 14.
18 Berzigotti A, Gilabert R, Abraldes JG, et al. Noninvasive prediction of clinically significant portal hypertension and esophageal varices in patients with compensated liver cirrhosis[J]. Am J Gastroenterol, 2008, 103 (5): 1159-1167.
19 Colecchia A, Montrone L, Scaioli E, et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis[J]. Gastroenterology, 2012, 143 (3): 646-654.
20 Iranmanesh P, Vazquez O, Terraz S, et al. Accurate computed tomography-based portal pressure assessment in patients with hepatocellular carcinoma[J]. J Hepatol, 2014, 60 (5): 969-974.
(2016-12-12收稿;2016-12-24修回)
Primary Study on Non-invasive Evaluation of Portal Vein Pressure in Model of Liver Cirrhosis in Rats
LIJinwei1,2,WANGJian1,ZENGXin1,WANGXiaohang1,LIJianqi3,XIEWeifen1.
1DepartmentofGastroenterology,ChangzhengHospital,SecondMilitaryMedicalUniversity,Shanghai(200003);2DepartmentofGeratology,TongRenHosipital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai;3ShanghaiKeyLaboratoryofMagneticResonanceandDepartmentofPhysics,EastChinaNormalUniversity,Shanghai
XIE Weifen, Email: weifenxie@medmail.com.cn
Liver Cirrhosis; Portal Pressure; Non-Invasive Evaluation; Models, Animal
10.3969/j.issn.1008-7125.2017.03.004
*本文通信作者,Email: weifenxie@medmail.com.cn
Background: The measurement of portal vein pressure (PVP) is important for the evaluation of therapeutic efficacy and prognosis in patients with liver cirrhosis. Aims: To investigate a non-invasive method for evaluating PVP in model of liver cirrhosis in rats. Methods: Liver cirrhosis model in rats was induced by intraperitoneal injection with thioacetamide. Magnetic resonance imaging with TOF sequence was used to measure portal vein diameter (PVD). PVP was detected directly by transvenous catheterization of portal vein. Body weight, liver weight, spleen weight, liver volume and spleen volume were determined. The hydroxyproline content in liver was determined by alkaline hydrolysis assay, proportion of collagen area in liver was detected by Sirius red staining. Results: Liver cirrhosis model in rats was successfully established after intraperitoneal injection for 20 weeks. Compared with control group, mean PVP, liver weight, liver volume, spleen weight, PVD, liver volume/body weight (LV/BW) ratio, spleen volume/body weight (SV/BW) ratio, hydroxyproline content and proportion of collagen area were significantly increased in model group (P<0.05), and body weight was significantly decreased (P<0.001). PVP was positively correlated with LV/BW ratio and proportion of collagen area (P<0.05). Conclusions: LV/BW and proportion of collagen area can indirectly reflect the PVP, and may provide a non-invasive approach for evaluation of portal hypertension.
