气相条件对ANAMMOX菌种短期保藏效果的影响
2017-04-11马金元左陆珅李华宇马金贵徐雅茹于海琴北京交通大学土木建筑工程学院北京00044东北林业大学工程技术学院哈尔滨50040中日友好环境中心北京0009
马金元,左陆珅,李华宇,马金贵,徐雅茹,姚 宏*,于海琴,山 丹(.北京交通大学土木建筑工程学院,北京 00044;.东北林业大学工程技术学院,哈尔滨 50040;3.中日友好环境中心,北京 0009)
气相条件对ANAMMOX菌种短期保藏效果的影响
马金元1,左陆珅1,李华宇1,马金贵2,徐雅茹1,姚 宏1*,于海琴1,山 丹3*(1.北京交通大学土木建筑工程学院,北京 100044;2.东北林业大学工程技术学院,哈尔滨 150040;3.中日友好环境中心,北京 100029)
研究了气相保藏条件对厌氧氨氧化菌种短期保藏效果的影响,分别在常温(14±0.5)℃和低温(4±0.5)℃条件下,将厌氧氨氧化菌种在气相条件分别为13393mg/m3的NO、1339mg/m3的NO、氮气和空气的环境中密封保存28d,考察了保藏前后菌种的脱氮性能、颜色、沉降性能和生物量的变化,并对常温条件下保藏的菌种做了活性恢复研究,结果发现:在浓度为1339mg/m3的NO中和氮气中保藏的菌种活性都高于相应温度下在空气中保藏的菌种活性,其中常温条件下4种保藏方式活性保留率依次为23.40%,86.22%,61.54%和46.47%,低温条件下4种保藏方式活性保留率分别为36.53%,47.12%,53.53%和42.95%;在无氧环境中保藏能保持菌种的颜色和沉降性能,在高浓度NO中保藏能降低保藏过程中生物量的损失;不同保藏方式下菌种恢复过程中各阶段的分布存在差异,空气中保藏的菌种适应期为6个周期,而在氮气中保藏的菌种其适应期只有2个周期.
厌氧氨氧化(ANAMMOX);短期保藏;一氧化氮(NO);联氨
厌氧氨氧化是一种新型生物脱氮工艺,能够在厌氧条件下以亚硝酸盐为电子受体将氨氮氧化为氮气,实现 2种氮素污染物的同时脱除[1-2].然而,厌氧氨氧化菌生长缓慢,对氧气、pH值、温度、生长基质等环境条件异常敏感[3-5],导致厌氧氨氧化工艺不易启动,容易失稳,失稳后难以恢复有关研究表明,部分或全部接种厌氧氨氧化污泥能快速启动厌氧氨氧化工艺[6],同时,采取厌氧氨氧化污泥流加方式能够显著减小低温、有机物和有毒物质等对厌氧氨氧化工艺运行的干扰[7-8].但是厌氧氨氧化菌倍增时间长达11~19d,细胞产率仅有 0.11gVSS/gNH4+-N[9-10],培养过程中污泥易流失,因而短期内很难获得大量菌种,此外,在实际运行中,某些工业废水来源的季节性可能导致厌氧氨氧化工艺暂停运作,因此,如何高效保藏现有的厌氧氨氧化菌种成了研究的热点.
菌种在保藏过程中活性降低的主要原因是内部细胞水解,蛋白质水解和內源呼吸[11],现有的保藏方法主要通过降低温度和改变与菌体直接接触的液相条件来避免或降低水解和內源呼吸对菌体造成的危害[12-13],研究发现:厌氧氨氧化菌的生长温度为30~40℃[14],37℃时活性最高,温度降到 11℃时,厌氧氨氧化活性只有 37℃时活性的 24%[15],在保藏厌氧氨氧化菌混培物时,以(NH4)2SO4作为基质对厌氧氨氧化菌活性产生的影响小[16],在相同温度和保藏时间的情况下,添加甘油时微生物群落反硝化活性是不加甘油时的1.5倍左右[17].然而,厌氧氨氧化菌是化能自养型缺氧菌,其对气相条件也很敏感,通常以CO2为唯一碳源[18],通过乙酰-CoA 途径还原CO2的过程需要一定的H2分压才能顺利合成细胞物质[19],当氧浓度达到0.5%~2.0%空气饱和度时,厌氧氨氧化活性即被完全抑制,充氩气除氧后活性可恢复,但当氧浓度超过 18%时,抑制作用则不可恢复[20-21],此外,NO作为厌氧氨氧化菌的中间产物
[22],厌氧氨氧化菌可以直接利用气态形式的NO[23],但NO浓度过高会对厌氧氨氧化菌的活性产生抑制[24].关于厌氧氨氧化菌种保藏的研究主要集中在保藏温度以及基质和保护剂等液相保藏条件的对保藏效果的影响,但对保藏过程中气相条件的对菌种保藏效果的还未见报道.
本文通过改变ANAMMOX混培污泥保藏过程中氧分压和 NO浓度,研究气相保藏条件对厌氧氨氧化菌混合培养物短期保藏效果的影响,以便为大量厌氧氨氧化菌种高效保藏提供参考.
1 材料与方法
1.1 材料
厌氧氨氧化菌种取自本实验室SBR反应器(反应器有效体积 8L),该反应器采用模拟废水运行,容积负荷达 0.97kg/(m3·d),进水 NH4+-N和NO2
--N浓度分别为 80,100mg/L,水力停留时间(HRT)为4h,排水比为50%,VSS/SS在90%左右,使用恒温装置控制系统温度为(32±1),pH℃ 值控制在 7.5~8.0,模拟废水组成:0.01g/L的KH2PO4, 0.0056g/L 的 CaCl2·2H2O1.25g/L 的 KHCO3, 0.3g/L的 MgSO4·7H2O,微量元素Ⅰ和Ⅱ各1.25mL/L.其中微量元素成分详见文献[25],氮气和 NO采用大连大特气体有限公司生产的标准气体(平衡气体为氮气).
1.2 活性检测及菌种保藏
活性检测: 活性测定所用的模拟废水成分同上,pH值为7.7~7.8,在600mL的具塞玻璃瓶中加入泥水混合物200mL,再用氮气置换其中的空气15min.密封后置于(32±1)℃,135r/min恒温摇床中培养,每隔1.5h取样测定NO2--N和NH4+-N浓度,每个样品检测3次.

表1 不同保藏条件Table 1 Different Preservation Conditions
菌种保藏: 8L的反应器(母反应器)用32℃的不加基质的模拟废水洗涤 5次后,加入基质(NH4HCO3和 NO2Na)使反应内的 NH4+-N和NO2
--N浓度分别为60,80mg/L,先在11个600mL的具塞玻璃瓶(1,2,3,R1、R2、R3、R4、R5、R6、R7、R8)内分别加入混匀后的母反应器泥水混合物200mL,接着再分别向11个瓶中加入NH4+-N和NO2--N浓度分别为60,80mg/L的模拟废水至充满,用 99.99%的氮气吹 15min,调节 pH值为7.7~7.8,等待沉降后向R1~R8中充入相应的气体(表 1),利用排水法(不排污泥)使各瓶内剩余泥水体积为 200mL,密封后将 R1~R4在常温(14± 0.5)℃下保藏,R5~R8在低温(4±0.5)℃下保藏,具体保藏方式如表1所示.1,2,3立刻做活性测定.
1.3 活性恢复实验
先将保藏后的污泥用(15±1)℃的不加基质的模拟废水冲洗3次,用氮气吹15min,排水至泥水混合物体积为 200mL,充入氮气密封后,在(20±1)℃条件下静置 12h,接着以同样的方式添加NH4+-N和NO2--N分别为80,100mg/l的模拟废水后,在(32±1)℃条件下静置 12h之后,测定R1~R8活性.活性测定后开始对R1~R4进行恢复实验,同样采用模拟废水,NH4+-N浓度为80mg/l, NO2
--N浓度为100mg/L.R1中除了添加上述的模拟废水外,还会投加1.0mmol/L的N2H4·2HCl,调节pH值至7.7~7.8,用氮气置换顶部空气后密封置于(32±1)℃、135r/min恒温摇床中培养,每隔3h取样测定NO2--N和NH4+-N浓度,每个样品检测3次,每个周期运行6h.
1.4 分析项目与方法
NH4+-N和NO2--N测定方法分别为纳氏试剂法和 N-(1-萘胺)-乙二胺光度法;混合液污泥浓度(MLSS)采用滤纸称重法;挥发性污泥质量浓度(MLVSS)采用马弗炉灼烧重量法测定;污泥容积指数(SVI)采用30min沉降法,以上方法均参照《水和废水监测分析方法》[26],沉降速度采用重力沉降法[27],厌氧氨氧化活性(SAA)的测定步骤详见Yang等[28]的方法.
胞外多聚物:分光光度法.取经10mmol/L、pH 7.5的磷酸缓冲液冲洗3次的湿厌氧氨氧化菌混培物2g进行碾磨,将碾磨后的泥浆与蒸馏水以1:9的体积混合,并置于 80℃恒温水浴中粗提 45min,冷却后于4℃ ,20000r/min 高速离心机中离心 25min,最后取上清液测定多糖和蛋白含量,多糖采用硫酸-苯酚法,蛋白采用考马斯亮蓝-250G法[16].
2 结果与讨论
2.1 气相条件对厌氧氨氧化菌脱氮性能的影响
由图1可以看出,相同温度不同气相条件下保藏的菌种剩余活性存在明显差异,相同气相条件不同温度下保藏的菌种剩余活性也存在一定的差异,经过28d的保存,R1~R8的厌氧氨氧化活性(SAA)分别为 0.073,0.269,0.192,0.145,0.114, 0.147,0.167,0.134(g/gVSS·d),活性保留率分别23.40%,86.22%,61.54%,46.47%,36.53%,47.12%,5 3.53%,42.95%.对比发现,在浓度为1339mg/m3的NO中保藏的R2、R6和在氮气中保藏的R3、R7的 SAA都高于相应温度下在空气中保藏的R4、R8的 SAA,同时,在浓度为 13393mg/m3的NO保藏的R1和R5的SAA都小于相应温度下在空气中保存的R4、R8的SAA.在常温条件下, R2保存效果最好,其SAA是R4的2.01倍,是R8的1.86倍,其次是R3;在低温条件下,R7的保藏效果最好,其SAA是R4的1.15倍,是R8的1.25倍,其次是 R6.由此可以看出,无氧条件更有利于厌氧氨氧化活性污泥脱氮活性的保存,低浓度的NO可以降低保藏过程中厌氧氨氧化菌的脱氮活性损失,但高浓度NO使污泥保藏过程中的活性损失更大.这主要是由于NO作为厌氧氨氧化过程中的中间产物[22],厌氧氨氧化菌可以直接利用气态形式的 NO[23],但 NO浓度过高会对厌氧氨氧化菌的活性产生抑制,Schmidt等[24]研究表明,当NO浓度达到803mg/m3时(NO负荷约为1mgNO/d)就会对Candidatus Brocadia属的厌氧氨氧化菌的活性产生抑制,Mark等[23]研究发现在浓度为4017mg/m3的NO作用下,厌氧氨氧化菌不但没有被抑制,反而能促进氨氮的降解, Courtens等[29]发现,NO优先抑制以亚硝酸盐为电子受体的脱氮菌(例如NOB).因此,从基质供应的角度出发,无氧条件本身会使一些好氧菌对氨氮和亚硝的竞争处于劣势[30-31],NO 又进一步抑制这类菌种的活性,使其它与厌氧氨氧化菌存在基质竞争关系的好氧菌和以亚硝为电子受体的菌种在体系中处于劣势[32],另外,对厌氧氨氨氧化菌而言,一方面NO可以为厌氧氨氧化菌持续提供少量的基质,另一方面 NO本身对ANAMMO菌的抑制作用,也会使菌对基质的消耗速率降低,避免了菌体更早的处于饥饿状态.
2.2 气相条件对厌氧氨氧化菌混合培养物生化性状的影响

图1 不同保藏条件下剩余SAAFig.1 The Remaining SAA under different Preservation Conditions

图2 保藏前后污泥颜色变化Fig.2 Change of sludge color before and after preservationa.保藏前 b.氮气中保藏 c.空气中保藏 d.1339mg/m3的NO中保藏
2.2.1 对菌种颜色的影响 不同保藏方式下,厌氧氨氧化菌混培物颜色存在明显的差异.从图 2可知,保存前的厌氧氨氧化菌混培物因富含血红素而呈砖红色(图 2a),常温条件下在氮气中保藏的厌氧氨氧化菌混培物的颜色(图 2b)和在浓度为1339mg/m3的NO(以氮气平衡气体)中保藏的厌氧氨氧化菌混培物的颜色(图 2d)相近,均变成了暗红色,在空气保存的厌氧氨氧化菌混培物大部分变成了黑色(图 2c).在有氧气存在的条件下,好氧菌会利用一部分基质,使厌氧氨氧化菌过早的处于饥饿状态,微生物在没有营养基质的情况下利用自身体内的物质维持生命活动,最终导致细菌逐步解体,颜色变黑.实验结果表明,在无氧状态下保藏厌氧氨氧化菌种,能更好的保持菌种原有的颜色.
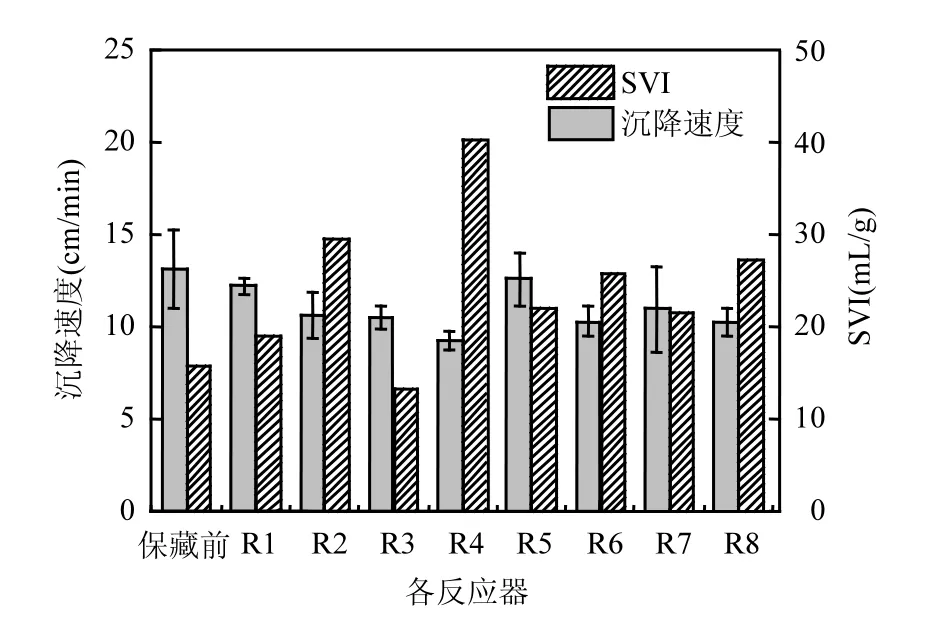
图3 不同保藏条件下沉降性能Fig.3 Sedimentation performance under different storage conditions
2.2.2 对沉降性能的影响 经过不同保藏方式保存28d后,厌氧氨氧化菌混培沉降性能也存在明显的差异,随着NO浓度的降低,沉降性能逐渐变差,R1和R5有更好的沉降性能(高的沉降速度和低的 SVI)[2].由图 3可以看出,在浓度为13393mg/m3的NO中保存的R1和R5,它们沉降速度分别为(12.56±0.69),(12.20±0.83)cm/min,SVI分别为22.14,19.05mL/g,与保存前的相差不大,在氮气中保存的R3和R7也有较好的沉降性能,相较而言,在空气中保存的R4和R8菌体沉降性能恶化程度更加严重,其 SVI分别达到 40.31, 27.45mL/g.由此可以看出,在无氧环境中能更好的保存污泥的沉降性能,在高浓度NO保存更有利于保持污泥原有的沉降性能.由图4可以看出,保藏前菌种 EPS中的多糖(PS)和蛋白质(PN)分别为 41.44,58.91mg/L,不同保藏条件下菌种的EPS剩余量存在明显变化,其中R1~R8的PS依次为:33.04,36.2,25.2,15.2,40.7,38.7,33.2,23.6mg/ L, PN依次为:53.93,40.6,32.2,20.8,47.6,45.9,40.3, 31.0mg/L.显然,在4种保藏方式下菌种的PS和PN含量均降低,且随NO浓度的降低其含量降低的越明显.这主要有两方面的作用,一方面高浓度的NO对厌氧氨氨氧化菌的活性产生抑制,菌种的生命活动速率降低,而低浓度的NO可以持续为菌种提供基质,缓解了菌种在对储能物质的消耗,另一方面在无氧环境中好氧微生物对基质的竞争性降低,对储能物质的消耗量降低,而有氧环境加剧了好氧微生物对储能物质的消耗.由此可以看出,菌体保藏前后沉降性能的差异主要是因为R1和R5中含有高浓度的 NO,抑制了菌种的生命活动速度,菌体中EPS的消耗量减少,保护了菌体结构的完整性,菌体的密度更大.而在空气中保存的R4和R8菌体沉降性能恶化程度最严重,主要是没有可供菌种持续利用的 NO,同时,因为有氧气的存在,好氧菌加剧了体系中EPS的消耗量,破坏了菌体结构,菌体密度降低,沉降性能变差.
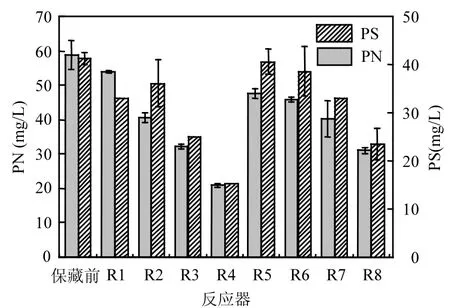
图4 不同保藏条件下EPSFig.4 EPS under different storage conditions

图5 不同保藏条件下MLVSS/MLSS值Fig.5 The ratio of MLVSS/MLSS under different storage conditions
2.2.3 对MLVSS/MLSS值的影响 保藏过程中,厌氧氨氧化菌混培物MLVSS/MLSS值存在明显的差异,随着NO浓度降低,MLVSS/MLSS的值也逐渐降低.保藏前菌种其值为89.23%.由图5可以看出,保藏 28d后,常温和低温条件下,MLVSS/ MLSS都随保存气体中NO浓度降低呈现出下降趋势.R1和R5的MLVSS/MLSS值分别为77.30%和82.53%,而R3和R7的MLVSS/MLSS分别降到了 72.56%和 67.72%,降幅比较明显,由此可以看出高浓度NO条件下保存,能更好的保存菌种的生物性能.
2.3 气相条件对厌氧氨氧化菌混合培养物活性恢复性能的影响
由图6可以看出,R1~R4的初始脱氮负荷分别为:0.262,0.544,0.502,0.264kgN/(m3·d),运行 15个周期后,R1~R4脱氮负荷分别为 0.620,0.672, 0.631,0.471kgN/(m3·d),其活性分别恢复到保藏前的91.99%,99.7%,93.62%和69.88%.可以看出,R2率先恢复活性,R4恢复的最慢,虽然R1的保藏方式(13393mg/m3的 NO下保存)使厌氧氨氧化活性损失较大,但在其恢复过程中投加一定量(1.0mmol/L)的联氨,实现菌种活性快速恢复.
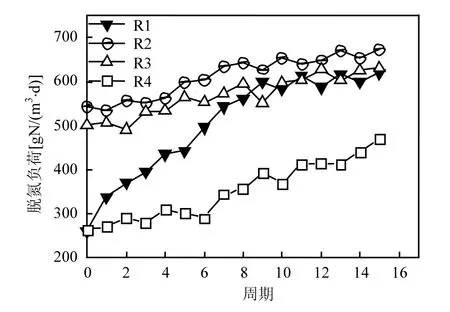
图6 不同条件保藏下的菌种活性恢复过程Fig.6 The recovery process under different storage conditions
比较R1~R4各自的活性恢复过程可以可以看出,菌种活性恢复的过程可以划分为3个阶段:适应期、恢复期和稳定期.适应期是菌种在经过保藏后,活性恢复缓慢的一段时期;恢复期是经过适应期缓慢的活性恢复后菌种活性快速恢复的一段时期;稳定期是经过恢复期活性快速恢复接近保藏前的活性时,菌种活性恢复又逐渐趋于稳定一段时期.R1从第1个周期开始就进入恢复期,到第11个周期,其活性已经由初始的0.261kgN/ (m3·d)恢复至 0.613kgN/(m3·d),此后活性恢复减慢,至第 15个周期结束后,活性已经恢复到0.620kgN/(m3·d).R2前4个周期为适应期,从第5个周期开始,活性快速提高,在运行至 9个周期,活性已经达到 0.643kgN/(m3·d),基本接近恢复前的活性,此后活性恢复速度减慢,至第 15个周期,活性已经达到 0.672kgN/(m3·d),已经很接近保藏前的0.674kgN/(m3·d);R3从第3个周期开始,活性恢复速度加快,运行至第 12个周期活性达到0.596kgN/(m3·d),此后活性恢复速度减慢,至第15个周期,活性已经达到 0.631kgN/(m3·d).R4的适应期长达6个周期,在这6个周期中,其活性由初始的0.264kgN/(m3·d)增长到0.289kgN/(m3·d),从第7个周期开始,进入恢复期,至第15周期结束,活性已经恢复到0.471kgN/(m3·d).
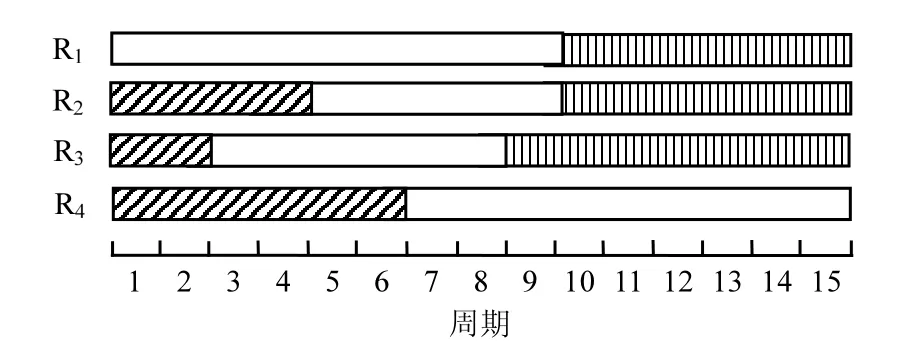
图7 恢复过程不同阶段的分布情况Fig.7 The distribution of the different stages of the recovery process

气象条件对菌种整体活性恢复性能不会产生太大影响,但对恢复过程各阶段的到达时间和持续时间有一定的影响.在空气中保藏的菌种适应期最长,在1339mg/m3的NO下保藏的菌种次之,在氮气中保藏的菌种其适应期最短,通过投加一定量的联氨,可以消除在13393mg/m3的NO中保藏的菌种适应期,延长其活性恢复期,使菌体活性快速恢复.
分析原因可能是联氨作为厌氧氨氧化菌的中间产物,体系中的联氨在联氨脱氢酶(HDH)的作用下自行降解[22],其降解过程中产生的一部分电子供含有细胞色素c(CytC)和细胞色素d1的亚硝酸还原酶(NiR)将亚硝还原成一氧化氮(NO2-+2H++ e-→NO+H2O),在亚硝供应充足的条件下,联氨降解产生的这部分电子刺激亚硝还原酶快速的恢复活性,加快亚硝酸盐的降解,亚硝酸盐的降解又会进一步产生更多的NO,NO的产量增加,在氨氮和NO都供应充足条件下,联氨降解产生的另一部分电子又进一步刺激了联氨合成酶(HZS)快速将 NH3和NO转化为联氨(NO+ NH3+3H++ 3e-→N2H4+H2O),氨氮的降解速度也逐渐加快,投加一定量的联氨,相当为整个体系提供了一定量的电子,能促使整个反应加快,脱氮负荷快速恢复.
3 结论
3.1 无论常温还是低温条件下,在浓度为1339mg/m3的NO中和氮气中保藏的菌种活性都高于相应温度下在空气中保藏的菌种活性.其中常温条件下 4种保藏方式(气相条件分别为13393mg/m3的NO、1339mg/m3的NO、氮气和空气)活性保留率依次为 23.40%,86.22%,61.54%和46.47%,低温条件下4种保藏方式活性保留率分别为36.53%,47.12%,53.53%和42.95%.
3.2 气相条件对保藏污泥的生化性状有一定的影响.在无氧环境中保藏能保持菌种的颜色和沉降性能,主要因为这种条件下降低了菌种对 EPS的消耗,更好的保存了菌体结构的完整性.
3.3 气相条件对菌种整体活性恢复性能不会产生太大影响,但对恢复过程中适应期和恢复期的持续时间有一定的影响.经过15个周期的恢复实验,在三种气相条件(1339mg/m3的 NO、氮气和空气)保藏的菌种活性恢复率依次为 91.99%, 99.7%,93.62%,适应期依次为 2,4,6个周期,恢复期为5,6,9个周期,恢复初期添加1mmol/L的联氨可以消除菌种的适应期,使其活性快速恢复.
[1] Kartal B, de Almeida N M, Maalcke W J, et al. How to make a living from anaerobic ammonium oxidation. [J]. FEMS Microbiology Reviews, 2013,37(3):428–461.
[2] Kuenen J G. Anammox bacteria: from discovery to application [J]. Nature Reviews Microbiology, 2008,6(4):320-326.
[3] Hu Z Y, Lotti T, van Loosdrecht M, et al. Nitrogen removal with the anaerobic ammonium oxidation process [J]. Biotechnol. Lett., 2013,35(8):1145-1154.
[4] Lotti T, Wr V D S, Kleerebezem R, et al. The effect of nitrite inhibition on the anammox process. [J]. Water Research,2012,46(8):2559-2569.
[5] Lotti T, Kleerebezem R, Van E T K C, et al. Anammox growth on pretreated municipal wastewater. [J]. Environmental Science & Technology, 2014,48(14):7874-7880.
[6] Tang C J, Zheng P, Chai L Y, et al. Characterization and quantification of anammox start-up in UASB reactors seeded with conventional activated sludge [J]. International Biodeterioration & Biodegradation, 2013,82(8):141-148.
[7] Jin R C, Ma C, Yu J J. Performance of an Anammox UASB reactor at high load and low ambient temperature [J]. Chemical Engineering Journal, 2013,232(10):17-25.
[8] 唐崇俭,郑 平,陈建伟.流加菌种对厌氧氨氧化工艺的影响 [J].生物工程学报, 2011,27(1):1-8.
[9] Kartal B, Loosdrecht M C M V. Sewage Treatment with Anammox [J]. Science, 2010,328(5979):702-703.
[10] 于英翠,高大文,陶 彧,等.利用序批式生物膜反应器启动厌氧氨氧化研究 [J]. 中国环境科学, 2012,32(5):843-849.
[11] Adav S S, Lee D J, Lai J Y. Proteolytic activity in stored aerobic granular sludge and structural integrity [J]. Bioresource Technology, 2008,100(1):68-73.
[12] Vlaeminck S E, De Clippeleir H, Verstraete W. Microbial resource management of one-stage partial nitritation/anammox [J]. Microbial Biotechnology, 2012,5(3):433-48.
[13] Lackner S, Gilbert E M, Vlaeminck S E, et al. Full-scale partial nitritation/anammox experiences--an application survey. [J]. Water Research, 2014,55(10):292-303.
[14] Thamdrup B, Dalsgaard T. Production of N2through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments [J]. Applied and Environmental Microbiology, 2002, 68(3):1312-1318.
[15] Xing B S, Guo Q, Jiang X Y, et al. Influence of preservation temperature on the characteristics of anaerobic ammonium oxidation (anammox) granular sludge. [J]. Applied Microbiology and Biotechnology, 2016,(10):1-13.
[16] 汪彩华,郑 平,蔡 靖,等.厌氧氨氧化菌混培物保藏方法的研究 [J]. 中国环境科学, 2013,33(8):1474-1482.
[17] Laurin V, Labbé N, Juteau P, et al. Long-term storage conditions for carriers with denitrifying biomass of the fluidized, methanolfed denitrification reactor of the Montreal Biodome, and the impact on denitrifying activity and bacterial population [J]. Water Research, 2006,40(9):1836-1840.
[18] BoranKartal, Niftrik L, JayneRattray, et al. Candidatus ‘Brocadia fulgida’: an autofluorescent anaerobic ammonium oxidizing bacterium [J]. FEMS Microbiology Ecology, 2008,63(1):46-55.
[19] Schouten S, Strous M, Kuypers M M M, et al. Stable Carbon Isotopic Fractionations Associated with Inorganic Carbon Fixation by Anaerobic Ammonium-Oxidizing Bacteria [J]. Applied & Environmental Microbiology, 2004,70(6):3785-3788.
[20] Strous M, van Gerven E, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic oxidizing (Anammox) sludge [J]. Applied and Environmental Microbiology, 1997,63(6):2446-2448.
[21] Van Dongen U, Jetten M S M, van Loosdrecht M C M. The Sharon-Anammox process for treatment of ammonium rich wastewater [J]. Water Science and Technology, 2001,44(1):153-160.
[22] Kartal B, Maalcke W J, de Almeida N M, et al. Molecular mechanism of anaerobic ammonium oxidation. [J]. Nature, 2011,479(7371):127-130.
[23] Kartal B, Tan N C, Van d B E, et al. Effect of nitric oxide on anammox bacteria. [J]. Applied & Environmental Microbiology, 2010,76(18):6304-6306.
[24] Schmidt I, Hermelink C, Pas-Schoonen K V D, et al. Anaerobic Ammonia Oxidation in the Presence of Nitrogen Oxides (NOx) by Two Different Lithotrophs [J]. Applied & Environmental Microbiology, 2002,68(11):5351-5357.
[25] vGraaf A A V D. Autotrophic growth of anaerobic ammonium oxidizing micro-organisms in a fluidized bed reactor [J]. Microbiology, 1996,142(8):2187-2196.
[26] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-281.
[27] Lu H F, Ji Q X, Ding S, et al. The morphological and settling properties of ANAMMOX granular sludge in high-rate reactors [J]. Bioresource Technology, 2013,143(17):592-597.
[28] Yang G F, Jin R C. Reactivation of effluent granular sludge from a high-rate Anammox reactor after storage. [J]. Biodegradation, 2013,24(1):13-32.
[29] Courtens E N P, Clippeleir H D, Vlaeminck S E, et al. Nitric oxide preferentially inhibits nitrite oxidizing communities with high affinity for nitrite [J]. Journal of Biotechnology, 2015,193:120-122.
[30] Walter J, Melzak S, Okello J, et al. Key physiology of anaerobic ammonium oxidation [J]. Journal of Neurosurgery, 1999,100(2): 332-334.
[31] Egli K, Fanger U, Alvarez P J, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate. [J]. Archives of Microbiology, 2001,175(3):198-207.
[32] Allain A V, Hoang V T, Lasker G F, et al. Role of nitric oxide in developmental biology in plants, bacteria, and man. [J]. Current Topics in Pharmacology, 2011,15(2):25-33.
致谢:本实验的部分内容是在课题组魏婷和孙斌帮助下完成的,在此表示感谢.
The effect of gas phase conditions on short-term preservation effect of AAMMOX bacteria.
MA Jin-yuan1, ZUO Lu-shen1, LI Hua-yu1, MA Jin-gui2, XU Ya-ru1, YAO Hong1*, YU Hai-qin1, SHAN Dan3*(1.School of Civil Engineering, Beijing Jiaotong University, Beijing 100044, China;2.College of Engineering and Technology, Northeast Forestry University, Harbin, 150040, China;3.Sino-Japanese Friendship Center for Environmental Protection, Beijing 100029, China). China Environmental Science, 2017,37(3):925~931
The effect of gas phase conditions on the performance of anaerobic ammonium oxidation (ANAMMOX) bacteria under short-term preservation was studied. Under the conditions of normal temperature (14±0.5)℃ and low temperature (4±0.5) ,℃ ANAMMOX bacteria were preserved in the four gas phase conditions (13393mg/m3NO, 1339mg/m3NO, nitrogen and air) for 28days and the recovery experiments of ANAMMOX bacteria preserved under normal temperature condition was studied. The results showed that the activities of the ANAMMOX bacteria preserved in 13393mg/m3NO and nitrogen conditions were higher than that of the bacteria preserved in the air at the corresponding temperature. The retention rates of ANAMMOX bacteria were 23.40%, 86.22%, 61.54% and 46.47%, respectively,under the four kinds of preservation (normal temperature condition), However, Under low temperature conditions, the retention rates were 36.53%, 47.12%, 53.53% and 42.95%, respectively; The results demonstrated that preservation in oxygen-free environment was beneficial to maintain color and settleability of bacteria while biomass decreased and in high concentrations of NO Can reduce the loss of biomass during preservation. The results of the recovery experiments showed that the distribution of each stage during the recovery process was various in different preservation mode. The adaptation period of bacteria preserved in air was 6cycles while in nitrogen was 2 cycles.
anaerobic ammonium oxidation (ANAMMOX);short-term preservation;nitric oxide;hydrazine
X703
A
1000-6923(2017)03-0925-07
马金元(1992-),男,甘肃天水人,北京交通大学硕士研究生,主要从事生物脱硝方面研究.
2016-07-19
北京市科委项目(Z151100002815011);国家自然科学基金面上项目(51578043);基本科研业务费(2016JBZ008)
* 责任作者, 姚宏, 教授, yaohongts@163.com; 山丹, 高级工程师, shandan1031 @126.com
