99mTc-HYNIC-TOC SPECT/CT显像探测结直肠神经内分泌肿瘤的临床价值
2017-04-11徐俊彦许晓平张建岗胡四龙潘禾戎程竞仪章英剑
李 毅,徐俊彦,3,4,许晓平,3,4,张建岗,3,马 光,胡四龙,3,4,潘禾戎,3,程竞仪,3,4,章英剑,3,4
1. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学生物医学影像研究中心,上海 200032;
3. 上海市质子重离子医院核医学科,上海 201315;
4. 上海分子影像探针工程技术研究中心,上海 200032
99mTc-HYNIC-TOC SPECT/CT显像探测结直肠神经内分泌肿瘤的临床价值
李 毅1,2,徐俊彦1,2,3,4,许晓平1,2,3,4,张建岗1,2,3,马 光1,2,胡四龙1,2,3,4,潘禾戎1,2,3,程竞仪1,2,3,4,章英剑1,2,3,4
1. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学生物医学影像研究中心,上海 200032;
3. 上海市质子重离子医院核医学科,上海 201315;
4. 上海分子影像探针工程技术研究中心,上海 200032

徐俊彦,2007年毕业于上海交通大学医学院临床医学专业,获得学士学位;同年7月开始就职于复旦大学附属肿瘤医院核医学科,后在职研读,师从章英剑教授,获得复旦大学影像医学与核医学硕士学位,现任主治医师。主要从事肿瘤SPECT/CT、PET/CT的影像诊断、临床研究,以及新型放射性分子影像探针在多种恶性肿瘤中的应用和分子生物学机制研究。曾作为主要研究者完成肿瘤标志物试剂盒的临床试验,并参与多项Ⅱ、Ⅲ期临床研究及基础实验研究。研究成果发表1篇SCI收录论文及多篇核心、权威杂志论文,并在国内外学术会议做口头及壁报交流。
目的:探讨99mTc标记肼基烟酰胺奥曲肽类似物(99mTc-hydrazinonicotinyl-Tyr3-octreotide,99mTc-HYNICTOC)显像探测结直肠神经内分泌肿瘤(neuroendocrine neoplasm,NEN)的价值。方法:对122例行99mTc-HYNIC-TOC显像的结直肠NEN患者进行回顾性分析,其中原发灶位于阑尾26例、直肠90例、乙状结肠3例、横结肠2例、降结肠1例。静脉注射370~555 MBq99mTc-HYNIC-TOC 2 h后,全身平面显像,随后行腹盆部SPECT/CT断层显像,对各个病灶进行图像分析,测量靶/非靶放射性计数比值(target/non-target,T/NT),病灶判断以临床治疗和随访结果为金标准。结果:99mTc-HYNICTOC对结直肠NEN的灵敏度、特异度和准确率分别为93.2%、97.4%和95.9%。病灶检出率为89.2%(199/223),阳性病灶T/ NT平均值为14.3±9.7(1.3~37.9,n=199),G1与G3、G2与G3级阳性率比较差异均有统计学意义(χ2=10.906,P=0.001;χ2=19.775,P<0.001)。此外,SPECT/CT断层配合全身平面显像可更加准确地发现病灶,对结直肠NEN患者术前评估及疗效评价均有较好的应用价值。结论:99mTc-HYNIC-TOC显像可准确、灵敏地探测结直肠NEN。
99mTc标记肼基烟酰胺奥曲肽类似物显像;神经内分泌肿瘤;结直肠
神经内分泌肿瘤( neuroendocrine neoplasm,NEN)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤[1]。根据世界卫生组织(World Health Organization,WHO)标准,可进一步分为高分化的神经内分泌瘤(neuroendocrine tumor,NET)及低分化的神经内分泌癌(neuroendocrine carcinoma,NEC)[2]。以往一直认为NEN为罕见疾病,但来自美国、日本、澳大利亚以及欧洲多个国家或地区的流行病学调查显示,NEN发病率呈逐年上升趋势[3-6]。传统的影像学检查(超声、CT或MRI )在胃肠道NEN定位和分期中的价值有限,检出率较低,尤其是术后复查的患者局部解剖结构紊乱,更难判定[7]。NET的葡萄糖代谢率较一般实体肿瘤低,常规18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18FDG)-PET/CT检查亦十分有限[8]。
99mTc-奥曲肽(octreotide,TOC)显像通过放射性核素标记生长抑素类似物(somatostatin analogue,SSA)与NEN细胞表面的生长抑素受体(somatostatin receptor,SSTR)特异性结合而使肿瘤显像。通常细胞表面分布的SSTR有5种亚型,99mTc-TOC与不同亚型的SSTR结合能力不同,主要与SSTR2及SSTR5有较高的亲和能力,而约80%的NEN细胞表面主要表达SSTR[9-10],
2因此99mTc-TOC可反映NEN SSTR分布及其表达水平。20世纪90年代初,111In-TOC已被批准用于诊断NEN和判断疗效,但111In需加速器生产,检查费用高,半衰期较长,限制了其临床广泛应用。99mTc半衰期短(约6 h),发射纯γ线,能量为140 keV,非常适合核医学显像。99mTc通过双功能螯合剂肼基烟酰胺(hydrazinonicotinamide,HYNIC)标记Tyr3-奥曲肽(99mTc-HYNIC-TOC)诊断NEN的灵敏度极高,已得到临床认可[11],是NEN的重要显像方法和可靠分期手段。
消化系统来源NEN中,小肠、直肠和胰腺NEN发病率居前3位[12],但SSTR显像在胃肠道NEN尤其是下消化道NEN中的应用价值国内外鲜有报道。本研究探讨99mTc-HYNIC-TOC SSTR显像在诊断和定位结直肠NEN原发灶、转移灶及复发灶中的临床价值。
1 资料和方法
1.1 临床资料
选取2012年10月—2016年10月于复旦大学附属肿瘤医院122例原发灶确诊为NET的患者,他们分别因治疗前分期、筛查复发或了解转移灶范围和数量而行99mTc-HYNIC-TOC显像。其中男性81例、女性41例;年龄15~78岁,平均(50.6±14.3)岁。原发灶来源于阑尾26例、直肠90例、乙状结肠3例、横结肠2例、降结肠1例。所有病灶均经组织病理学、免疫组织化学,或6个月以上的CT、B超和99mTc-HYNIC-TOC复查等临床随访证实。
WHO分级按细胞增殖标记Ki-67和核分裂象计数,将胃肠道NEN分为G1(Ki-67≤2%)、G2 (Ki-67>3%,且≤20%)和G3(Ki-67>20%)其3级,其中G1、G2级归为NET,G3级归为NEC[13-15]。本研究中,G1 67例、G2 37例、G3 18例。
1.2 检查方法
1.2.1 药物制备
99mTc-HYNIC-TOC由本科制备[16],现已药盒化使用,标志物放化纯度经纸层析法和放射薄层层析(radio-thin-layer chromatography,radio-TLC)检测>99%。
1.2.2 显像仪器
采用配CT的双探头单光子发射断层扫描仪(Discovery NM/CT 670,美国GE公司),配低能高分辨平行孔准直器。
1.2.3 显像方法
静脉注射370~555 MBq99mTc-HYNIC-TOC 2 h后,全身平面显像,随后行腹盆部SPECT/CT断层显像,两者轴向视野相同。经迭代重建后,用专用软件Entegra (GE Medical Systems)处理。
1.3 图像分析
所有图像由2名有经验的核医学科医师采用盲法读片。① 药物放射性分布分析:用相同大小的感兴趣区(region of interest,ROI),分别获得各主要器官正常区域放射性计数;② 病灶分析:同时分析核医学和同机CT图像。对病灶的选取遵循以下标准:核医学图像上任何灶性的放射性示踪剂浓集超过该部位正常组织的摄取量,不论相应部位CT有无异常密度改变,均将其视为阳性病灶;同机CT表现为低密度,相应部位未见放射性异常摄取,结合其他影像学检查排除囊肿、血管瘤等良性病变者亦视为阳性病灶。对每个病灶勾画ROI,以同层面正常肌肉组织为本底,行半定量分析,计算靶/非靶放射性计数比值(target/non-target,T/NT)。
1.4 统计学处理
数据用SPSS 20.0统计软件分析,组间率的比较用χ2检验,P<0.001为差异有统计学意义。
2 结 果
静脉注射2 h后,全身各器官放射性分布从高到低分别为膀胱、肾、脾、肝、胆囊、肠道、胃、胰腺、甲状腺、肌肉、肺、脑。
122例结直肠NEN患者中,41例为真阳性(图1),其中G1级11例、G2级17例、G3级13例。2例病灶摄取99mTc-HYNIC-TOC后经病理证实为假阳性(1例阑尾NET术后,术区1枚淋巴结,大小约0.8 cm×0.5 cm,T/NT为1.2;1例直肠NET术后,术区1枚淋巴结,大小约3.2 cm×3.1 cm,T/ NT为2.3。病理证实均为淋巴结炎性增生)。79例未摄取99mTc-HYNIC-TOC,其中76例为真阴性、3例为假阴性(直肠NET G1级息肉内镜下摘除后复发2例、横结肠NET G3级手术切除后复查1例,病灶最长径均<0.2 cm)。按病例计算,99mTc-HYNIC-TOC显像的灵敏度、特异度和准确率分别为93.2%、97.4%和95.9%。

图1 直肠NEN(G2)治疗前99mTc-HYNIC-TOC显像
99mTc-HYNIC-TOC显像诊断结直肠NEN病灶的阳性率为89.2% (199/223),T/NT平均值为14.3±9.7 (1.3~37.9,n=199),其中G1级T/NT平均值为14.4±9.0 (1.3~30.5,n=67),G2级T/NT平均值为15.5±10.6 (1.6~37.9,n=77),G3级T/NT平均值为12.4±9.1 (1.6~35.5,n=55)。不同分级结直肠NEN病灶的阳性率结果见表1,G1级与G3级、G2级与G3级比较差异均有统计学意义(χ2=10.906,P=0.001;χ2=19.775,P<0.001)。探测到的最小病灶约0.5 cm×0.4 cm,其T/NT为5.7(图2)。
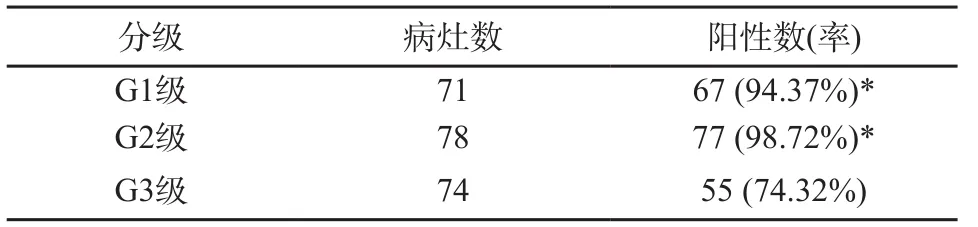
表1 结直肠NEN病理分级与99mTc-HYNIC-TOC显像结果比较
41例真阳性患者中,21例全身平面与断层显像均发现放射性浓聚灶;5例全身平面显像提示肝脏放射性分布不均匀,断层显像显示肝脏片状放射性摄取增高;15例平面未见病灶,但断层显像均表现为直肠肠壁增厚伴放射性摄取轻度增高。由此可见,SPECT/CT断层显像比全身平面显像能发现更多的SSTR阳性病灶,且能对病灶进行精准定位,极大提高了肿瘤早期诊断准确率。此外,与其他影像学方法相比,99mTc-HYNIC-TOC显像确诊了9例CT、MRI及B超无法确诊的转移灶(图3)。

图2 直肠NEN (G2)术后复查99mTc-HYNIC-TOC显像

图3 直肠NEN (G1)治疗前99mTc-HYNIC-TOC显像
3 讨 论
近年来NEN诊治受到广泛关注。由于大部分NEN缺乏典型的临床表现,早期常难发现,患者往往由于肿瘤引起的肠道出血、梗阻,或是肝脏转移引起黄疸、纳差等症状才来就诊[17-18]。此外,肿瘤的生物学特性、恶性程度、病理学特征及预后差异很大,国内外学者一度对NEN的治疗和预后缺乏统一认识[19]。
SSTR显像作为NEN的特异性显像方法已应用多年,不仅在NEN诊断、分期中体现出重要作用,还有助于指导SSA(如善龙、奥曲肽等)治疗,辅助临床评价手术或制订个体化治疗方案。近年来,利用放射性标记SSA奥曲肽的多肽-受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)已成为一个颇有前景的治疗策略,SSTR显像对其疗效预测具有重要价值[20]。目前,国际上的主流SSTR显像是由68Ga标记SSA的PET显像。然而,68Ga源发生器价格昂贵,显像需PET/CT。99mTc-HYNIC-TOC具有来源更方便、性价比更高等优势,且肿瘤探测阳性率及病灶T/NT均较高,既符合国情又能满足临床基本需要。
专注于结直肠NEN的SSTR显像报道国内外均较为罕见。本研究对122例结直肠NEN患者的99mTc-HYNIC-TOC显像进行回顾性分析,结果显示其诊断灵敏度、特异度和准确率分别为93.2%、97.4%和95.9%。以往研究显示胃肠道NEN的TOC显像灵敏度与肿瘤分化程度有关,一般认为分化程度较好的NEN灵敏度较高,部分胰腺NEN及胃肠NEN的SSTR表达率为80%~100%[21]。本研究中,G1级病灶阳性率为94.37%,G2级病灶阳性率为98.72%,均远高于G3级阳性率(74.32%)。G3级病灶放射性摄取多不均匀,T/NT较低。
本研究发现99mTc-HYNIC-TOC也存在假阳性,2例患者分别为NEN术后1、3个月,术区各见单一病灶(大小分别为0.8 cm×0.5 cm、3.2 cm×3.1 cm)放射性摄取略高(T/NT分别为1.2、2.3),再次手术证实为炎细胞浸润。这可能与炎症时淋巴细胞或巨噬细胞激活后SSTR表达明显增多有关[22-23]。因此,需对诊断阳性的T/NT阈值给予进一步分析、设定,或治疗后复查的间隔可能需延长。限于99mTc低能γ线的穿透率和SPECT设备本身的分辨率,本研究中3例假阴性病灶与病灶过小(2 mm)有关,此前亦有类似报道[24-25]。
综上所述,99mTc- HYNIC-TOC显像是一种灵敏度和特异度均很高的结直肠NEN检查方法,诊断和定位的性价比高。
参考文献
[1] MUN M J, LEE J C, LEE B J. A case of carotid body tumor concomitant with carcinoid tumor [J]. Auris Nasus Larynx, 2015, 42(1): 59-62.
[2] HAMILTON S R, BOSMAN F T, BOFFETTA P, et al. Carcinoma of the colon and rectum. In: Bosman FT, Carneim F, Hmban RH, et al. eds. WHO classification of tumours of the digestive system [M]. Lyon: IARC Press, 2010.
[3] YAO J C, HASSAN M, PHAN A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States [J]. J Clin Oncol, 2008, 26(18): 3063-3072.
[4] RINDI G, CAPELLA C, SOLCIA E. Cell biology, clinicopathological profile, and classification of gastroenteropancreatic endocrine tumors [J]. J Mol Med (Berl), 1998, 76(6): 413-420.
[5] LUKE C, PRICE T, TOWNSEND A, et al. Epidemiology of neuroendocrine cancers in an Australian population [J]. Cancer Causes Control, 2010, 21(6): 931-938.
[6] HAUSO O, GUSTAFSSON B I, KIDD M, et al. Neuroendocrine tumor epidemiology: contrasting Norway and North America [J]. Cancer, 2008, 113(10): 2655-2664.
[7] MODLIN I M, LATICH I, ZIKUSOKA M, et al. Gastrointestinal carcinoids: the evolution of diagnostic strategies [J]. J Clin Gastroenterol, 2006, 40(7): 572-582.
[8] ADAMS S, BAUM R, RINK T, et al. Limited value of fluorine-18 fluorodeoxyglucose positron emission tomography for the imaging of neuroendocrine tumours [J]. Eur J Nucl Med 1998, 25(1): 79-83.
[9] IOANNOU M, PAPAGELOPOULOS P J, PAPANASTASSIOU I, et al. Detection of somatostatin receptors in human osteosarcoma [J]. World J Surg Oncol, 2008, 6: 99.
[10] REUBI J C, KVOLS L, KRENNING E, et al. Distribution of somatostatin receptors in normal and tumor tissue [J]. Metabolism, 1990, 39(9 Suppl 2): 78-81.
[11] CHRAPKO B E, NOCUN A, GOLEBIEWSKA R, et al.99mTc-EDDA/HYNIC-TOC somatostatin receptor scintigraphy in daily clinical practice [J]. Med Sci Monit, 2010, 16(4): Mt35-44.
[12] 应红艳, 丛雪晶, 赵林, 等. 胃肠胰腺神经内分泌肿瘤分类和分期进展 [J]. 癌症进展, 2011, 15(5): 507-514.
[13] RINDI G, KLOPPEL G, ALHMAN H, et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system [J]. Virchows Arch, 2006, 449(4): 395-401.
[14] SHEN C, YIN Y, CHEN H, et al. Neuroendocrine tumors of colon and rectum: validation of clinical and prognostic values of the World Health Organization 2010 grading classifications and European Neuroendocrine Tumor Society staging systems [J]. Oncotarget, 2016. [Epub ahead of print].
[15] VINIK A I, WOLTERING E A, WARNER R R, et al. NANETS consensus guidelines for the diagnosis of neuroendocrine tumor [J]. Pancreas, 2010, 39(6): 713-734.
[16] 蒋津津, 许晓平, 张建平, 等.99mTc-HYNIC-TOC小动物SPECT/CT显像和人体内照射剂量估算 [J]. 肿瘤影像学, 2013, 22(3): 231-236.
[17] 陈璐璐. 胃肠胰神经内分泌肿瘤诊治进展 [J]. 中国实用内科杂志, 2006, 26(12): 1760-1762.
[18] KLOPPEL G, RINDI G, ANLAUF M, et al. Sitespecific biology and pathology of gastroenteropancreatic neuroendocrine tumors [J]. Virchows Arch, 2007, 451(Suppl 1): S9-S27.
[19] MODLIN I M, LYE K D, KIDD M. A 5-decade analysis of 13,715 carcinoid tumors [J]. Cancer, 2003, 97(4): 934-59.
[20] KWEKKEBOOM D J, KRENNING E P, LEBTAHI R, et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: peptide receptor radionuclide therapy with radiolabeled somatostatin analogs [J]. Neuroendocrinology, 2009, 90(2): 220-226.
[21] BARNETT P. Somatostatin and somatostatin receptor physiology [J]. Endocrine, 2003, 20(3): 255-264.
[22] CURTIS S B, CHEN J C, WINKELAAR G, et al. Effect of endothelial and adventitial injury on somatostatin receptor expression [J]. Surgery, 2000, 127(5): 577-583.
[23] BLAKER M, SCHMITZ M, GOCHT A, et al. Differential expression of somatostatin receptor subtypes in hepatocellular carcinomas [J]. J Hepatol, 2004, 41(1):112-118.
[24] BINDERUP T, KNIGGE U, LOFT A, et al. Functional imaging of neuroendocrine tumors: a head-to-head comparison of somatostatin receptor scintigraphy,123I-MIBG scintigraphy, and18F-FDG PET [J]. J Nucl Med, 2010, 51(5): 704-712.
[25] LIMOURIS G S, CHATZIIOANNOU A, KONTOGEORGAKOS D, et al. Selective hepatic arterial infusion of In-111-DTPA-Phe1-octreotide in neuroendocrine liver metastases [J]. Eur J Nucl Med Mol Imaging, 2008, 35(10): 1827-1837.
Evaluation of99mTc-hydrazinonicotinamide-Tyr3-octreotide SPECT/CT in detection of colorectal neuroendocrine
neoplasms
LI Yi1,2, XU Junyan1,2,3,4, XU Xiaoping1,2,3,4, ZHANG Jiangang1,2,3, MA Guang1,2, HU Silong1,2,3,4, PAN Herong1,2,3, CHENG Jingyi1,2,3,4, ZHANG Yingjian1,2,3,4
(1. Department of Nuclear Medicine, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Center for Biomedical Imaging, Fudan University, Shanghai 200032, China; 3. Shanghai Proton and Heavy Ion Center, Shanghai 201315, China; 4. Shanghai Engineering Research Center of Molecular Imaging Probes, Shanghai 200032, China)
XU Junyan E-mail: junyan233@aliyun.com
Objective: To evaluate the value of99mTc-hydrazinonicotinyl-Tyr3-octreotide (99mTc-HYNIC-TOC) in thedetection of colorectal neuroendocrine neoplasms. Methods:99mTc-HYNIC-TOC imaging data of 122 patients with colorectal neuroendocrine neoplasms were analyzed retrospectively, including 26 in appendix, 90 in rectum, 3 in sigmoid colon, 2 in transverse colon, 1 in descending colon. Whole-body imaging and SPECT/CT imaging were obtained 2 h after intravenous injection of 370-555 MBq99mTc-HYNIC-TOC. Results: The sensitivity, specificity, accuracy of99mTc-HYNIC-TOC SPECT/CT were 93.2%, 97.4%, 95.9%. The detection rate for all the lesions was 89.2% (199/223). The average target/non-target (T/NT) value of positive lesions was 14.3±9.7 (1.3-37.9,n=199). Poorly differentiated colorectal neuroendocrine neoplasm, G3, had lower imaging positive rate than G1 (χ2=10.906,P=0.001) and G2 (χ2=19.775,P<0.001). Besides, SPECT/CT scan could provide more correct information than planar imaging. Conclusion:99mTc-HYNIC-TOC SPECT/CT is an excellent method for detection of colorectal neuroendocrine neoplasms.
99mTc-hydrazinonicotinyl-Tyr3-octreotide imaging; Neuroendocrine neoplasm; Colorectal
R445.5
A
1008-617X(2017)01-0067-05
2017-02-01)
徐俊彦 E-mail:junyan233@aliyun.com
