使用交链孢霉建立小鼠过敏性哮喘模型
2017-04-11王静茹祝戎飞
李 杰,王静茹,陈 浩,杨 林,祝戎飞
(华中科技大学同济医学院附属同济医院过敏反应科, 武汉 430030)
ChinJAllergyClinImmunol,2017,11(4):344- 350
由真菌引起的支气管哮喘等过敏性疾病在临床上比较常见[1]。交链孢霉是一种重要的真菌过敏原,有研究显示交链孢霉在气传真菌过敏原中占比较高,为优势真菌[2- 5]。交链孢霉可破坏哮喘患者气道上皮屏障功能[6],与过敏性哮喘严重程度直接相关[7- 8]。由于在临床上直接对哮喘患者进行研究会受到患者依从性、取材等多方面的限制,还可能存在着医学伦理问题,很多研究均通过建立哮喘动物模型来实施。小鼠免疫遗传背景较为清楚,免疫系统认识已较全面深入,加上基因技术及生物测定技术的迅猛发展,小鼠在国内外已成为最主要的哮喘动物模型[9- 10]。本研究拟建立交链孢霉致敏的Balb/c小鼠过敏性哮喘模型,为后续研究提供基础。
材料与方法
动物与分组
由湖北省疾控中心提供的6周龄SPF级Balb/c雌鼠24只,体重(15±5)g Balb/c雌性小鼠随机分为2组,每组12只。对照组:以生理盐水致敏和激发小鼠;实验组:以交链孢霉提取物致敏和激发小鼠。
试剂与仪器
交链孢霉提取液(浓度100 μg/ml)购自北京新华联协和药业有限公司,小鼠白介素(interleukin,IL)- 4和IL- 10、干扰素(interferon,IFN)-γ、总IgE和特异性IgE的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自欣博盛生物科技有限公司,聚合酶链反应(polymerase chain reatcion,PCR)中的Trizol®试剂购自Invitrogen公司,DNase Ⅰ 购自Fermentas公司,小鼠肺功能仪购自SCIREQ公司。
模型建立
哮喘小鼠模型的建立参考文献[10- 12]进行,首先致敏:各组小鼠在第4、5、6天分别用交链孢霉提取液(25 μg/ml)滴鼻致敏,具体步骤如下:小鼠用乙醚麻醉后,移液器吸取50 μl交链孢霉提取液或生理盐水,缓慢滴入小鼠鼻腔中,待全部操作完成后,再次麻醉小鼠,吸取50 μl交链孢霉提取液或生理盐水滴入鼻腔;激发:第18、19、20天,实验组再次采用100 μl交链孢霉提取液(50 μg/ml)滴鼻激发,正常对照组采用100 μl 0.9%生理盐水进行滴鼻。
气道反应性测定
末次激发48 h内,用小鼠肺功能仪有创法测定小鼠的气道反应性。用1%戊巴比妥钠50 mg/kg麻醉小鼠后,行气管插管,连接呼吸机,测定小鼠气道阻力(airway resistance)和气道顺应性(airway compliance)的变化。并且经仪器加入50 μl乙酰甲胆碱(methacholine)6.25、12.5、25、50 μg/ml,分别观察气道反应性变化。
支气管肺泡灌洗液收集及细胞计数
取血后将小鼠置于仰卧位,固定头部及四肢,充分暴露气道,在光线充足情况下,用眼科剪剪开小鼠1/2的气管,将气管插管针插入小鼠气管内,固定后缓慢注入1 ml PBS缓冲液进行支气管肺泡灌洗,然后0.3 ml/次,抽吸3次后,将支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)进行回收,回收率>80%。BALF 4 000 r/min(离心半径13.5 cm),4 ℃离心10 min后,上清转移至另一EP管中,-20 ℃保存。准备用ELISA检测BALF中IL- 4、IL- 10以及IFN-γ水平。细胞沉淀则溶于100 μl PBS中重悬,取计数板计算细胞数量,图片固定后做苏木精-伊红(hematein eosin,HE)染色,连续计数200个细胞并进行分类计算各细胞比例。
血清总IgE和交链孢霉特异性IgE检测
激发结束后48 h,麻醉各组小鼠后,将各组小鼠行眼窝取血,收集于干净的EP管中,置于4 ℃冰箱中待血清析出,4 000 r/min(离心半径13.5 cm),4 ℃离心5 min,将血清转移至另一EP管中,ELISA检测血清总IgE和交链孢霉特异性IgE。
肺组织病理切片检查
打开小鼠胸腔,取出左侧肺组织(一般用左侧肺组织进行固定包埋切片,因为左肺只有一叶,结构很完整),将肺组织放置于4%的多聚甲醛溶液中,4 ℃过夜后,用梯度酒精溶液脱水、二甲苯溶液透明后用石蜡包埋,使用组织切片机切片,然后采用HE染色,采用光学显微镜观察鼻黏膜与肺组织的炎症浸润程度。
肺组织IL- 25 mRNA与IL- 33 mRNA水平测定
取肺组织匀浆,总RNA用TRIzol试剂提取,然后将总RNA逆转录成为cDNA,将反应体系加到荧光定量PCR反应孔中进行PCR扩增。
统计学处理
结 果
小鼠行为学观察
对照组和实验组分别有2只小鼠麻醉过程中窒息死亡,另实验组有3只小鼠在激发2 d后死亡。进行末次滴鼻激发后,实验组小鼠出现不同程度的烦躁不安或安静少动、口唇紫绀、喘息、行动改变,以出现烦躁呛咳、抓耳挠鼻、呼吸加快、口唇发绀、腹肌痉挛、点头呼吸、竖毛以及站立不稳等症状15~30 min后恢复平静,而对照组在麻醉苏醒5~10 min后就恢复正常。
气道高反应性
实验组与对照组相比气道阻力明显增大,气道顺应性明显降低(表1、2)。
BALF细胞分类计数
实验组BALF中细胞总数和Eos(%)较对照组明显增加,实验组 BALF Eos(%)高达 68%(表3)。
BALF中细胞因子
实验组IL- 4水平[(109.14±42.51)pg/ml]高于对照组[(31.32±12.42)pg/ml](P<0.05),而 IFN-γ水平[(93.42±51.26)pg/ml]低于对照组[(277.34±24.35)pg/ml](P<0.01),IL- 10水平实验组[(359.7±142.9)pg/ml]低于对照组[(627.4±119.1)pg/ml],但差异无统计学意义(P>0.05)(表4)。
表1小鼠气道阻力
Table1Airway resistance in experimental group and control group mice
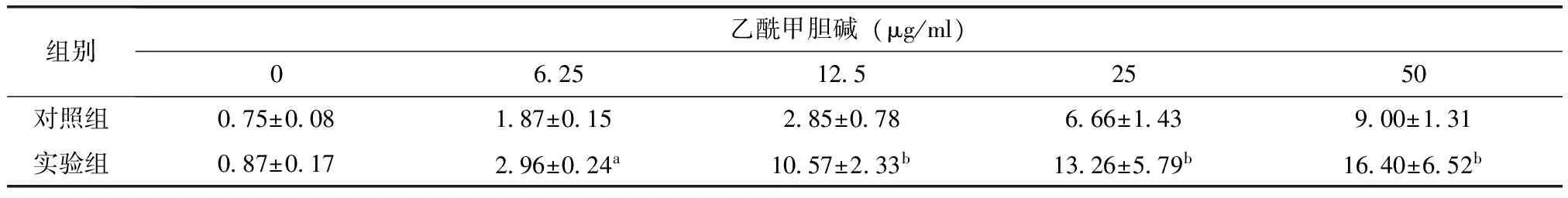
组别乙酰甲胆碱(μg/ml)06251252550对照组075±008 187±015285±078666±143900±131实验组087±017 296±024a1057±233b1326±579b1640±652b
与对照组相比,aP<0.05,bP<0.01
表2小鼠气道顺应性
Table2Airway compliance in experimental group and control group mice

组别乙酰甲胆碱(μg/ml)06251252550对照组0310±0110 0190±0067 0120±0037 0096±0071 0061±0013实验组0280±0160 0150±0092a 0053±0031b 0046±0022b 0037±0009b
与对照组相比,aP<0.05,bP<0.01

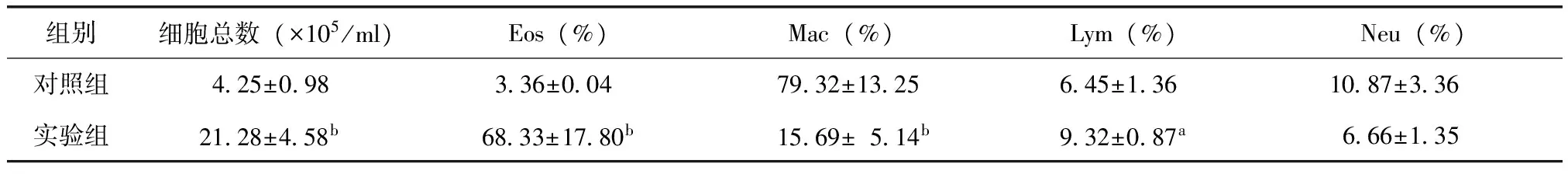
组别细胞总数(×105/ml)Eos(%)Mac(%)Lym(%)Neu(%)对照组425±098336±0047932±1325645±1361087±336实验组2128±458b6833±1780b1569±514b932±087a666±135
BALF:支气管肺泡灌洗液;Eos:嗜酸性粒细胞;Mac:巨噬细胞;Lym:淋巴细胞;Neu:中性粒细胞;与对照组相比,aP<0.05,bP<0.01


组别IL⁃4(pg/ml)IFN⁃γ(pg/ml)IL⁃10(pg/ml)TIgE(ng/ml)sIgE(ng/ml)IL⁃33mRNA对照组3132±1242 27734±2435 62741±11911 18501±67252341±874 066±031实验组 10914±4251a9342±5126b 35974±14293 88394±12233a 6576±1556a 221±058b
IL- 4:白介素- 4;IFN-γ:γ干扰素;IL- 10:白介素- 10;TIgE:总免疫球蛋白E;sIgE:特异性免疫球蛋白E;与对照组相比,aP<0.05,bP<0.01
血清中总IgE和特异性IgE水平
实验组血清总IgE和特异性IgE水平[分别为(883.94±122.33)ng/ml和(65.76±15.56)ng/ml]均明显高于对照组[分别为(185.01±67.25)ng/ml和(23.41±8.74)ng/ml](P<0.01)(表4)。
肺组织中IL- 25 mRNA与IL- 33 mRNA表达水平
IL- 25 mRNA两组均表达过低,未测出;IL- 33 mRNA表达水平实验组(2.21±0.58)高于对照组(0.66±0.31)(表4)。
肺组织病理学变化
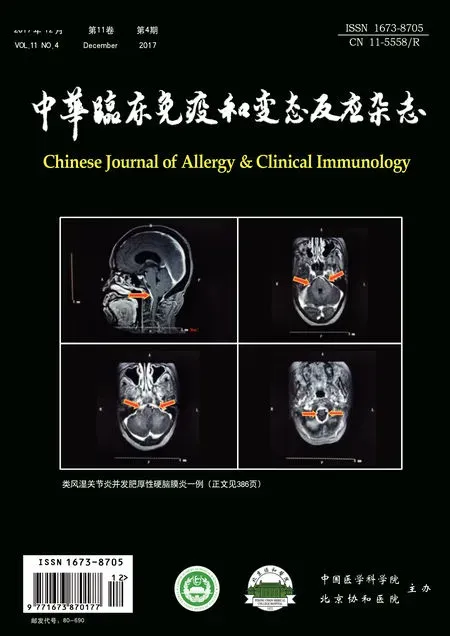
HE染色光镜下观察肺组织病理学改变,与对照组(图1,3,5)正常小鼠肺组织结构相比,实验组小鼠肺小血管壁增厚,黏膜下炎症细胞浸润,嗜酸性粒细胞增多(图2);管腔黏膜增厚,管腔变窄,黏液渗出增多,黏液栓形成,周围炎症细胞浸润(图4);肺泡间隔增厚,结构欠完整,大量炎症细胞浸润渗出(图6)。
讨 论
真菌尤其是交链孢霉对哮喘的影响巨大。Lyons等[2]调查914例哮喘儿童发现14%的儿童对真菌过敏,真菌过敏的哮喘儿童中又有46%对交链孢霉过敏。一项4 962例呼吸系统疾病患者的研究显示,19%的过敏患者对至少一种真菌提取物过敏,而这些真菌过敏患者中又有60%对交链孢霉过敏[3]。我国广州交链孢霉是主要气传真菌之一[4]。武汉地区气传真菌调查显示交链孢霉菌占13.87%,为优势真菌。

图1 对照组小血管HE染色Fig 1 Control group small vessel(HE)

图3 对照组细支气管HE染色Fig 3 Control group bronchiole(HE)
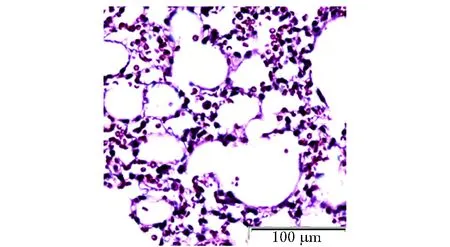
图5 对照组肺泡HE染色Fig 5 Control group alveolar(HE)

图2 实验组小血管HE染色Fig 2 Experience group small vessel(HE)

图4 实验组细支气管HE染色Fig 4 Experience group bronchiole(HE)
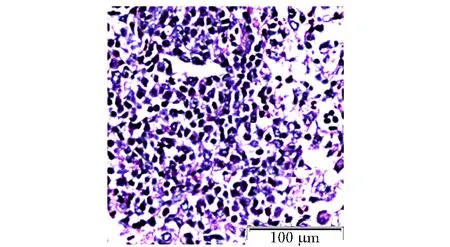
图6 实验组肺泡HE染色Fig 6 Experience group alveolar(HE)
有7.14%的哮喘患者和11.71%的过敏性鼻炎并发哮喘患者对交链孢霉提取物呈现皮肤试验阳性反应[5]。
动物模型是研究哮喘发病机制和新的治疗方法的重要工具。用作哮喘模型的实验动物先后有狗、兔、羊、豚鼠、大鼠等,直到最近小鼠以其便于饲养,繁殖能力强等优点成为模型制作最佳的备选动物而普遍使用,其中又以SPF级6~8周龄Balb/c小鼠最为多见,因Balb/c小鼠易产生针对卵白蛋白(ovalbumin,OVA)和花粉的高滴度IgE和气道高反应性,其实验结果相对稳定[10]。小鼠免疫遗传背景较为清楚,免疫系统认识已较全面深入,加上基因技术及生物测定技术的迅猛发展,小鼠在国内外已成为最主要的哮喘动物模型[10]。
尽管交链孢霉是重要的吸入性过敏原之一,但目前国内外对交链孢霉诱导的小鼠哮喘模型研究甚少[11],仅有极少数文章提及使用交链孢霉建立哮喘模型方法,且多是沿用OVA的致敏方法进行研究[13],但OVA并不是人体接触诱发哮喘的自然致敏原,不能完全模拟人体接触天然过敏原后的反应。有研究显示致敏过程中单独经鼻腔给予OVA不能诱发气道高反应性及肺部嗜酸性粒细胞浸润、Th2型细胞因子增加、气道黏液高分泌等哮喘特征[14]。然而作为天然变应原的交链孢霉是直接通过呼吸道途径进入人体致敏的,这点与OVA不同。本实验选择经鼻腔途径致敏小鼠,这也更符合哮喘发病的自然过程。而且有研究显示,相对于雾化吸入的方式,经鼻滴入方式可以引起肺部更加明显的炎症浸润及细胞因子表达,为哮喘研究提供更好的选择[15]。本实验选取交链孢霉提取液滴鼻诱导建立小鼠过敏性哮喘模型,操作简单,控制性高,可重复性强,能模拟临床上哮喘发展和过敏性哮喘的发作过程,其缺点是麻醉过程中小鼠容易窒息致死。
验证小鼠哮喘模型是否建立成功往往采用复合指标。小鼠过敏性哮喘的实质是由IgE介导的Ⅰ型超敏反应,其IgE水平是变态反应性炎症发生的重要决定因素。小鼠变态反应性炎症的重要特征指标是Th1细胞与Th2细胞比例失衡,相应的IL- 4等Th2型细胞因子增高,IFN-γ等Th1型细胞因子降低。此外小鼠出现呼吸困难的症状,肺泡灌洗液嗜酸性粒细胞增加,血清IgE升高,肺组织病理学检查也出现炎症细胞浸润等也作为小鼠哮喘模型成功的指标[10- 12]。本研究实验组小鼠相对于对照组小鼠,在行为学上有哮喘的症状出现,尤其是抓耳挠鼻,点头呼吸,呼吸加快明显,持续时间久,符合哮喘的表现;气道阻力增加,气道顺应性降低符合哮喘气道反应性特征;肺泡灌洗液中总细胞和嗜酸性粒细胞比例增加符合哮喘的变化;血清总IgE和特异性IgE水平明显升高,符合哮喘发生的基本机制;BALF中IL- 4水平明显升高,IFN-γ水平明显下降,亦符合哮喘发病机制中Th1/Th2失衡且Th2型细胞因子占优势的论断;肺组织病理学检查表现为支气管和血管黏膜下和周围肺组织有明显的炎症细胞浸润,管腔内黏液分泌增多,符合哮喘的病理变化。最近研究表明,IL- 25和IL- 33分别不同程度地影响了气道的功能和重塑[16- 19]。本实验还对肺组织的IL- 25和IL- 33 mRNA表达水平进行了检测。研究发现实验组和对照组IL- 25 mRNA均表达过低,而IL- 33 mRNA的升高,可能提示IL- 33参与过敏性哮喘的发生。研究结果还证实了交链孢霉可单独诱发过敏性哮喘的发生,提示其对人群哮喘的发生可能具有重要的影响。上述变化提示使用交链孢霉滴鼻激发致敏的Balb/c小鼠哮喘动物模型建立成功。但本实验亦存在不足之处:小鼠肺功能的检测采用的是国际上通用的有创检测方法[20],有创小鼠气道反应性测定法需通过气管插管和机械通气来完成,能准确地反映气道阻力变化[21],但无法对同一只小鼠进行重复检测来比较交链孢霉激发前后肺功能的改变,只能通过比较实验组和对照组过敏原激发后气道阻力的差异判断小鼠的气道反应性。检测小鼠气道反应性的其他方法包括离体气道平滑肌收缩力测定法和无创的整体体积描记法,由于离体方法不能反映由气道内黏液分泌、黏膜水肿以及小气道病变所引起的肺通气功能障碍,而无创的整体体积描记法不能直接反映气道阻力[21],因此本研究未采用后两种方法。
综上所述,采用交链孢霉滴鼻致敏、激发的方法能够成功诱导Balb/c小鼠产生过敏性哮喘反应的模型,为后续交链孢霉诱发的哮喘研究打下了基础。
[1]Prester L. Indoor exposure to mould allergens[J]. Arh Hig Rada Toksikol, 2011, 62: 371- 380.
[2]Lyons TW, Wakefield DB, Cloutier MM. Mold andAlternariaskin test reactivity and asthma in children in Connecticut[J]. Ann Allergy Asthma Immunol, 2011, 106: 301- 307.
[3]Mari A, Schneider P, Wally V, et al. Sensitization to fungi: epidemiology, comparative skin test, and IgE reactivity of fungal extracts[J]. Clin Exp Allergy, 2003,33: 1429- 1438.
[4]张华,郑卓. 广州市气传真菌散布规律与气候的关系[J]. 中山大学学报(医学科学版),2006, 27: 596- 600.
[5]祝戎飞. 武汉市气传花粉和真菌监测及临床意义[D]. 武汉: 华中科技大学,2011:5- 98.
[6]Leino MS, Loxham M, Blume C, et al. Barrier disrupting effects ofAlternariaalternate extract on bronchial epithelium from asthmatic donors[J]. PLoS One, 2013, 8: e72178.
[7]Salo PM, Arbes SJ Jr., Sever M, et al. Exposure to Altetnaria alternate in US homes is associated with asthma symptoms[J]. J Allergy Clin Immunol, 2006, 118: 892- 898.
[8]Katotomichelakis M, Anastassakis K, Gouveris H, et al. Clinical significance ofAlternariaalternate sensitization in patients with allergic rhinitis[J]. Am J Otolaryngol, 2012, 33: 232- 238.
[9]Lloyd CM. Building better mouse models of asthma[J]. Curr Allergy Asthma Rep, 2007, 7: 231- 236.
[10] 朱艳芬, 宋泽庆. 小鼠支气管哮喘模型的研究现状[J].中华哮喘杂志, 2009, 3: 311- 314.
[11] 杜军, 郭宏伟. 哮喘小鼠模型研究现状分析[J]. 中国免疫学杂志, 2011, s1: 1209- 1211.
[12] Jutel M, Jaeger L, Suck R, et al. Allergen-specific immunotherapy with recombinant grass pollen allergens[J]. J Allergy Clin Immunol, 2005, 116: 608- 613.
[13] 谭杰军. 哮喘动物模型建立的思考与体会[J]. 中国中医急症, 2016, 25: 816- 817.
[14] Zhang Y, Lamm WJ, Albert RK, et al. Influence of the route of allergen administration and genetic background on the murine allergic pulmonary response[J]. Am J Respir Crit Care Med, 1997, 155: 661- 669.
[15] 程胜. 滴鼻和雾化两种不同激发方式对小鼠支气管哮喘模型气道炎症的影响[J]. 华中科技大学学报(医学版), 2014, 2: 121- 124.
[16] Barlow JL, Peel S, Fox J, et al. IL- 33 is more potent than IL- 25 in provoking IL- 13-producing nuocytes (type 2 innate lymphoid cells) and airway contraction[J]. J Allergy Clin Immunol, 2013, 132: 933- 941.
[17] Kurokawa M, Matsukura S, Kawaguchi M, et al. Expression and effects of IL- 33 and ST2 in allergic bronchial asthma: IL- 33 induces eotaxin production in lung fibroblasts[J]. Int Arch Allergy Immunol, 2011, 155: 12- 20.
[18] Liew FY, Pitman NI, McInnes IB. Disease-associated functions of IL- 33: the new kid in the IL- 1 family[J]. Nat Rev Immunol, 2010, 10: 103- 110.
[19] Nabe T. Interleukin (IL)- 33: new therapeutic target for atopic diseases[J]. J Pharmacol Sci, 2014, 126: 85- 91.
[20] Kim HK, Lee CH, Kim JM, et al. Biphasic late airway hyperresponsiveness in a murine model of asthma[J]. Int Arch Allergy Immunol, 2013, 160: 173- 183.
[21] 何胜东.小鼠哮喘模型气道反应性检测方法的建立[J]. 广东医学, 2006, 27: 1659- 1661.