磺酸甜菜碱型两性离子亲水作用色谱固定相的制备及色谱性能评价
2017-04-10李文婧赵丽娟魏缠玲戴小军龚波林
李文婧, 赵丽娟, 魏缠玲, 戴小军*, 龚波林,2*
(1. 宁夏大学化学化工学院, 宁夏 银川 750021; 2. 北方民族大学化学与化学工程学院, 宁夏 银川 750021)
研究论文
磺酸甜菜碱型两性离子亲水作用色谱固定相的制备及色谱性能评价
李文婧1, 赵丽娟1, 魏缠玲1, 戴小军1*, 龚波林1,2*
(1. 宁夏大学化学化工学院, 宁夏 银川 750021; 2. 北方民族大学化学与化学工程学院, 宁夏 银川 750021)
以丙烯酸二甲氨基乙酯(DMAEA)和1,3-丙磺酸内酯为原料,合成了含磺酸甜菜碱型两性离子的N,N-二甲基-N-丙烯酰氧乙基-N-丙基磺酸铵(DMAEAPS)功能单体,通过原子转移自由基聚合(ATRP)技术将其接枝到硅胶表面,制备了磺酸甜菜碱型两性离子色谱固定相(Sil-DMAEAPS)。研究了该固定相对安息香、维生素B6、芸香叶苷、对香豆酸和咖啡酸5种极性溶质的亲水作用色谱分离性能。结果表明,在典型的亲水作用色谱条件下,极性溶质的保留主要由静电作用和亲水作用控制;而在典型的反相色谱条件下,极性溶质则表现出反相柱的分离特征。与ZIC®-HILIC商品柱进行对比,自制色谱柱对5种极性溶质表现出不同的分离选择性。将自制色谱柱用于芦丁片中芸香叶苷含量的测定,操作方法简单,为极性样品的分离提供了新方法。
原子转移自由基聚合;磺酸甜菜碱;两性离子固定相;亲水作用色谱;色谱性能
近年来,随着生物医药技术、环境监测和食品安全等研究领域的迅速发展,强极性物质成为分析化学领域的重要研究对象。但此类化合物在反相色谱上保留较弱、分离困难。亲水相互作用色谱(HILIC)作为正相色谱的一个分支,非常适用于强极性样品定性、定量分析[1]。
HILIC固定相种类繁多,其主要特征为固定相表面含有与水能够发生良好亲和作用的强极性基团,常见的强极性基团有羟基、酰胺基和两性离子[2,3]。Irgum等[4]将两性离子固定相引入离子色谱,用于无机化合物和蛋白质的分离。两性离子固定相因其表面具有良好的亲水性和较低的电荷密度,不存在强离子交换作用,十分适于HILIC。表面键合磺酸甜菜碱型两性离子的ZIC®-HILIC商品柱已广泛应用于氨基糖苷、小分子极性化合物、吗啡和水稻中多种呼吸代谢产物的分离分析[5]。况媛媛等[6]通过原位聚合法制备了磺酸甜菜碱型两性离子亲水毛细管整体柱,并应用毛细管液相色谱法和加压毛细管电色谱法分离了酚类、核苷类等极性混合物。在对HILIC固定相的研究中发现,其分离选择性不仅受亲水功能基种类的影响,还受功能基键合密度的影响[7]。
原子转移自由基聚合(ATRP)技术可以通过控制反应物与催化剂比率、聚合时间等反应条件来控制聚合物的链长。在功能材料的制备领域,采用ATRP技术已合成了多种功能材料[8]。Hemstrom等[9]用ATRP技术制备的反相色谱分离介质具有优异的抗水解性能;王婀娜等[10]采用ATRP技术在硅胶表面成功接枝了甲基丙烯酰氧乙基三甲基氯化铵,制得了强阴离子交换色谱填料,并用于酸性蛋白质的分离;盖青青[11]等采用ATRP技术制备了表面印迹牛血清白蛋白(BSA)和溶菌酶(Lyz)聚合物材料,其对模板蛋白质表现出较强的吸附能力和较高的选择性;白海红等[12]利用表面引发原子转移自由基聚合(SI-ATRP)技术,以带有双键的氨基葡萄糖(GMAG)为单体,成功制备了新型核壳型亲水聚合物-硅胶杂化填料,并将该材料用于N-糖链的富集检测。本课题组近年来利用ATRP技术,制备了用于手性配体交换色谱、反相作用色谱以及HILIC等的多种固定相[13,14]及分子印迹材料[15]。
本文以2-溴异丁酰溴氨丙基硅胶(Sil-Br)为引发剂、溴化亚铜(CuBr)/2,2′-联二吡啶(Bpy)为催化体系、甲醇为溶剂,采用ATRP技术将N,N-二甲基-N-丙烯酰氧乙基-N-丙基磺酸铵(DMAEAPS)功能单体接枝到硅胶表面,得到了含DMAEAPS功能单体的磺酸甜菜碱型两性离子色谱填料(Sil-DMAEAPS),将该填料装入不锈钢管中制得色谱柱,并对其色谱性能进行了评价。
1 实验部分
1.1 仪器与试剂
LC-20AT高效液相色谱仪,配有SPD-M20A二极管阵列检测器(日本岛津公司);Bruker Avance核磁共振仪(400 MHz,瑞士Bruker公司);PE Frontier红外光谱仪(美国珀金埃尔默公司);KQ-3200E型超声波清洗器(昆山市超声仪器有限公司);BS224S型电子天平(赛多利斯科学仪器有限公司)。
UniSil硅胶(粒径5 μm,孔径10 nm,苏州纳微科技有限公司); Bpy、CuBr、2-溴异丁酰溴(纯度97%)、丙烯酸二甲氨基乙酯(DMAEA)、1,3-丙磺酸内酯、甲酸铵(广州化学试剂厂);甲醇(分析纯,天津大茂化学试剂厂);安息香(benzoin)、维生素B6(pyridoxine)、对香豆酸(p-coumaric acid)、咖啡酸(caffeic acid)、芸香叶苷(rutin hydrate)(分析纯,阿拉丁(上海)试剂有限公司);乙腈(色谱纯,美国Sigma公司);芦丁片(临汾宝珠制药有限公司)。
1.2 两性离子固定相的制备
1.2.1 DMAEAPS功能单体的制备
根据文献[16,17]的制备方法,称取15.75 g DMAEA和34.54 g丙酮置于100 mL三口烧瓶中,用恒压滴液漏斗逐滴加入12.21 g 1,3-丙磺酸内酯和34.54 g丙酮的混合液,2 h内滴加完毕,于室温下磁力搅拌20 h,过滤,用100 mL丙酮-乙醚混合溶液(8∶2, v/v)洗涤滤饼3次,得到大量白色晶体,即为DMAEAPS功能单体,将其置于55 ℃真空干燥至质量恒定。具体反应式见图1。

图 1 DMAEAPS功能单体反应方程式Fig. 1 Reaction equation of DMAEAPS functional monomer DMAEAPS: N,N-dimethyl-N-acryloyloxyethyl-N-ammonium propane sulfonate.
1.2.2 Sil-DMAEAPS色谱填料的制备
称取3.0 g Sil-Br(按文献[7]制备)、0.011 5 g CuBr、0.025 0 g Bpy于100 mL圆底烧瓶中;称取0.6 g DMAEAPS功能单体于另一圆底烧瓶中,加入30 mL甲醇,使其溶解。将两个圆底烧瓶分别密封,通氮气,抽真空循环除氧30 min,然后将含有DMAEAPS功能单体的溶液完全注入另一圆底烧瓶中,于室温下反应24 h,砂芯漏斗抽滤,用0.1 mol/L乙二胺四乙酸二钠盐(EDTA-2Na)溶液洗涤至滤液颜色消失,然后依次用30 mL甲醇、丙酮各洗涤3次,于60 ℃真空干燥8 h,最终得到Sil-DMAEAPS。具体合成路线见图2。

图 2 Sil-DMAEAPS磺酸甜菜碱型两性离子固定相的合成路线Fig. 2 Synthetic route of Sil-DMAEAPS sulfobetaine zwitterionic stationary phase Sil-Br: 2-bromoisobutyryl bromide allyl silicone; ATRP: atom transfer radical polymerization; Sil-DMAEAPS: N,N-dimethyl-N-acryloyloxyethyl-N-ammonium propane sulfonate grafted stationary phase.
1.3 色谱柱的填充
称取3.0 g Sil-DMAEAPS,以甲醇为匀浆液和顶替液,超分散均匀后,在40 MPa压力下装入不锈钢管(15 cm×0.46 cm)中。
1.4 色谱条件
柱温:25 ℃;流动相:乙腈-甲酸铵缓冲溶液;等度洗脱;流速:1.0 mL/min;检测波长:254 nm;进样体积:20 μL。
1.5 样品前处理
取芦丁药品数片,研细后,精密称取200 mg芦丁粉末,置于100 mL容量瓶中,加适量50%(v/v)甲醇溶液超声溶解后,用50%(v/v)甲醇溶液定容至刻度,摇匀,用45 μm微孔滤膜过滤。
1.6 溶液的配制
1.6.1 供试品溶液的配制
精密量取5 mL 1.5节制备的滤液,置于50 mL容量瓶中,用50%(v/v)甲醇溶液定容至刻度,摇匀,配制芦丁片供试品溶液。
1.6.2 芸香叶苷标准溶液的配制
精密称取200 mg芸香叶苷对照品,置于100 mL容量瓶中,用50%(v/v)甲醇溶液稀释并定容至刻度,配制质量浓度为200 mg/L的芸香叶苷标准溶液;随后取适量上述溶液,用50%(v/v)甲醇溶液稀释并配制质量浓度为20、40、60、80、100和120 mg/L的芸香叶苷系列标准工作液。
精密称取已知含量的芦丁粉末25 mg,用50%(v/v)甲醇超声溶解后,置于100 mL容量瓶中,定容至刻度,分别移取1 mL溶液于3支试管中;量取10 mL 100 mg/L的芸香叶苷标准工作液,置于100 mL容量瓶中,用50%(v/v)甲醇定容至刻度,分别量取2.5、5.0、7.5 mL溶液于上述3支试管中,混合摇匀,得到芦丁加标工作液。
1.6.3 极性溶质混合液的配制
称取适量安息香、维生素B6、芸香叶苷、对香豆酸、咖啡酸标准品,以甲醇为溶剂,分别配制质量浓度为200 mg/L的上述5种极性溶质的标准储备液;分别取10 mL 5种标准储备液混合,待用。
2 结果与讨论
2.1 DMAEAPS功能单体的表征
2.1.11H-NMR表征
以重水(D2O)作溶剂,对DMAEAPS功能单体进行核磁共振氢谱(1H-NMR, 400 MHz)的表征。结果显示,δ6.48(d,J=17.3 Hz,1H,CHH=CH);δ6.25(dd,J=17.3、10.5 Hz,1H,CH2=CH);δ6.05(d,J=10.9 Hz,1H,CHH=CH);δ4.68(dd,J=15.9、13.7 Hz,2H,COOCH2);δ3.87~3.77(m,2H,CH2NR);δ3.65~3.54(m,2H,CH2SO3);δ3.22(s,6H,2CH3);δ3.04~2.94(m,2H,NRCH2);δ2.28(ddd,J=17.3、12.3、6.3 Hz,2H,CH2)。该结果与文献[16]报道一致,说明已成功制备DMAEAPS功能单体。

图 3 DMAEAPS功能单体的FT-IR光谱图Fig. 3 FT-IR spectrum of DMAEAPS functional monomer
2.1.2 FT-IR表征
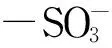
2.2 元素分析
将合成的Sil-DMAEAPS色谱固定相进行元素分析,测定其C、H、N的含量(见表1)。可以看出,其C、H元素的含量明显增加,说明通过ATRP反应,已成功地将DMAEAPS功能单体键合到Sil-Br的表面,制备出Sil-DMAEAPS色谱固定相。同时根据文献[7]的公式,计算得到其接枝率为2.07 mg/m2。

表 1 Sil-DMAEAPS固定相的元素分析结果
Sil-NH2: allyl silicone.
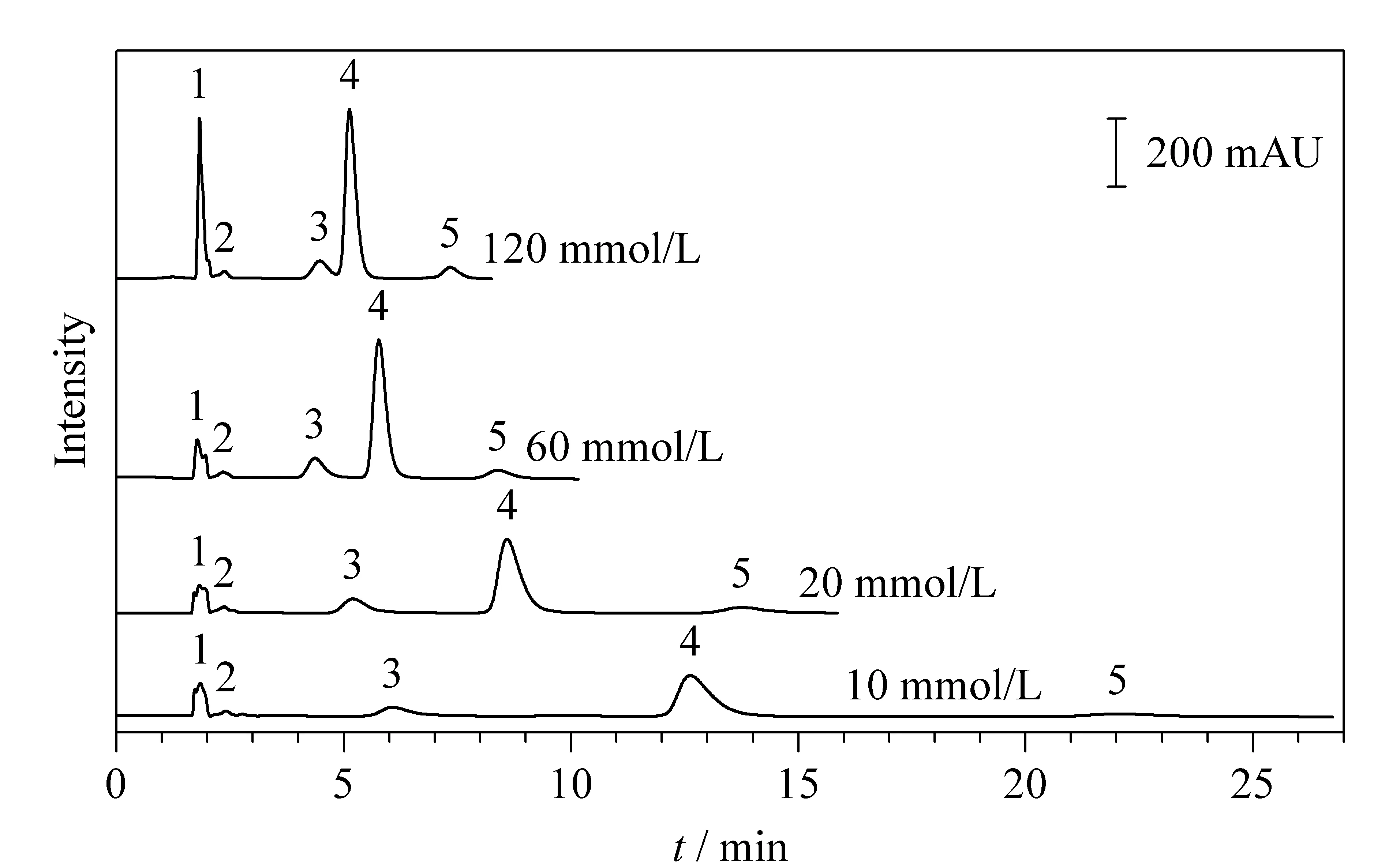
图 4 甲酸铵浓度对极性溶质保留时间的影响Fig. 4 Effect of concentration of ammonium formate on the retention time of polar solutes Mobile phases: acetonitrile (ACN)-ammonium formate (pH 6.0) (90∶10, v/v); flow rate: 1.0 mL/min; wavelength: 254 nm; column temperature: 25 ℃; mass concentration: 200 mg/L. Peaks: 1. benzoin; 2. pyridoxine; 3. rutin hydrate; 4. p-coumaric acid; 5. caffeic acid.
2.3 极性溶质保留时间的考察
2.3.1 甲酸铵浓度对保留时间的影响
分别配制10、20、60和120 mmol/L的甲酸铵溶液(pH 6.0),将其作为流动相的水相,考察安息香、维生素B6、芸香叶苷、对香豆酸、咖啡酸5种极性溶质在Sil-DMAEAPS色谱柱上的保留行为(见图4)。结果表明,酸性溶质(对香豆酸、咖啡酸)的保留时间随着甲酸铵浓度的增大显著减小,这是因为该两性离子固定相表面“双电层”会带正电荷,盐浓度的增大,抑制了分析物与固定相之间的静电作用和偶极作用,使带电荷的对香豆酸、咖啡酸溶质的保留时间显著减小;芸香叶苷随着甲酸铵浓度的增大其保留时间略有减小;安息香、维生素B6几乎不受甲酸铵浓度的影响。当甲酸铵溶液浓度为10 mmol/L时,极性溶质的保留时间最长,选为实验所用。下文均以保留时间越长越好为标准,考察流动相的pH值和乙腈体积分数对极性溶质保留时间的影响。
2.3.2 流动相pH值对保留时间的影响
流动相的pH值会影响溶质的质子化程度,进而影响溶质的保留和选择性。分别配制pH值为3.0、4.0、5.0和6.0的10 mmol/L甲酸铵,并将其作为流动相的水相,考察目标化合物的保留行为(见图5)。酸性溶质(对香豆酸、咖啡酸)随着甲酸铵pH值的减小,其保留时间逐渐减弱,因为随着pH值的减小,固定相表面“双电层”的正电荷减少,酸性溶质的电离会被抑制,两者之间的静电作用降低;安息香、维生素B6几乎不受流动相pH值的影响,因为在此pH值范围内安息香、维生素B6不发生解离;芸香叶苷随流动相pH值的减小保留时间略有减小。当流动相的pH值为6.0时,极性溶质的保留时间最大,故选为实验所用。

图 5 流动相pH值对极性溶质保留时间的影响Fig. 5 Effect of the pH value of mobile phases on the retention time of polar solutes Mobile phases: ACN-10 mmol/L ammonium formate (90∶10, v/v); flow rate: 1.0 mL/min; wavelength: 254 nm; column temperature: 25 ℃; mass concentration: 200 mg/L. Peaks 1-5 are the same as in Fig. 4.
2.3.3 乙腈体积分数对保留时间的影响
在HILIC模式下,溶质保留时间随流动相中有机相比例的增大而增大,而在RP-LC模式下,溶质保留时间随流动相中有机相比例的增大而减小。本实验考察了流动相中有机相乙腈的体积分数(10%~90%)对目标分析物保留行为的影响(见图6)。当流动相中乙腈的体积分数由10%增大到80%时,安息香、芸香叶苷、对香豆酸、咖啡酸4种极性溶质的保留时间均逐渐减小,这是由于固定相的制备采用了聚合反应,链接功能基和基材的碳链对溶质的保留起了作用,体现出反相色谱的保留机理。当乙腈的体积分数大于80%时,芸香叶苷、对香豆酸、咖啡酸3种极性溶质的保留时间反而增大,转变为亲水作用色谱的典型特征,此时溶质的保留主要由与磺酸甜菜碱两性离子的静电作用控制。维生素B6由于其自身结构,在该固定相上的保留较弱,几乎不受乙腈体积分数的影响[18]。因此本实验将乙腈的体积分数设为90%。

图 6 乙腈体积分数对极性溶质保留时间的影响Fig. 6 Effect of volume percentage of ACN on the retention time of polar solutes Mobile phases: ACN-10 mmol/L ammonium formate (pH 6.0); flow rate: 1.0 mL/min; wavelength: 254 nm; column temperature: 25 ℃; mass concentration: 200 mg/L.
2.3.4 与商品柱保留时间的比较
为进一步研究自制Sil-DMAEAPS色谱柱的色谱性能,在相同色谱条件下,本实验将其与商品化的ZIC®-HILIC色谱柱(150 mm×4.6 mm, 5 μm,孔径20 nm,德国Merck SeQuant公司)进行比较(见图7)。结果表明,酸性溶质(对香豆酸、咖啡酸)在自制色谱柱上的保留较强,这与ATRP技术能提供较高的功能基键合密度有关。说明该自制色谱柱对酸性溶质有较强的选择吸附性,在分离酸性溶质方面具有一定的优势。

图 7 采用(a)自制柱与(b)商品柱分离5种极性溶质的色谱图Fig. 7 Chromatograms of the five polar solutes by (a) homemade and (b) commercial columns Commercial column: ZIC®-HILIC column (150 mm×4.6 mm, 5 μm); mobile phases: ACN-10 mmol/L ammonium formate (pH 6.0) (90∶10, v/v); flow rate: 1.0 mL/min; wavelength: 254 nm; column temperature: 25 ℃; mass concentration: 200 mg/L. Peaks 1-5 are the same as in Fig.4.
2.4 线性范围、回收率与精密度
取1.6.2节制备的芸香叶苷系列标准工作液,在最优条件下依次进样分析,以峰面积为纵坐标(y)、质量浓度为横坐标(x, mg/L)绘制标准曲线,得到的回归方程为y=2.82×104x-3.32×105,相关系数(r2)>0.999。
取1.6.2节制备的3个不同添加水平的芦丁加标工作液进行加标回收率试验,结果见表2。芸香叶苷的加标回收率为90.8%~100.8%, RSD为1.7%~5.6%(n=3)。

表 2 芦丁片中芸香叶苷的加标回收率和相对标准偏差(n=3)
2.5 芦丁药片中芸香叶苷含量的测定
芦丁为维生素P属的一种,是一种脱氢黄素酮的糖苷,在食物中常与维生素C共存,在体内能增强和促进维生素C的作用和蓄积能力[19]。实验对200 mg/L芸香叶苷标准溶液和芦丁片供试品溶液进行分析,其色谱图见图8。同时计算芦丁片供试品溶液中芸香叶苷的含量,为197.7 mg/g。

图 8 (a)芸香叶苷标准溶液(200 mg/L)和(b)芦丁片供试品溶液中芸香叶苷的色谱图Fig. 8 Chromatograms of rutin hydrate in (a) a standard solution (200 mg/L) and (b) a test solution Mobile phases: ACN-10 mmol/L ammonium formate (pH 6.0) (95∶5, v/v); flow rate: 1.0 mL/min; wavelength: 254 nm; column temperature: 25 ℃.
3 结论
本文利用ATRP技术将DMAEAPS功能单体键合到硅胶基材上,制备了磺酸甜菜碱型两性离子色谱固定相,并对其色谱性能进行了考察。在典型的亲水色谱条件下,极性溶质保留时间主要由静电作用和亲水作用控制。将制备的固定相应用于芦丁药品中芸香叶苷的含量测定,操作方法简单,线性关系、精密度良好,具有一定的应用价值。
[1] Alpert A J. J Chromatogr, 1990, 499: 177
[2] Shen A J, Guo Z M, Liang X M. Progress in Chemistry, 2014, 26(1): 10
沈爱金, 郭志谋, 梁鑫淼. 化学进展, 2014, 26(1): 10
[3] Liu S J, Qiao X Q, Yang Y J, et al. Chinese Journal of Chromatography, 2014, 32(10): 1079
刘士佳, 乔晓强, 杨艳军, 等. 色谱, 2014, 32(10): 1079
[4] Jiang W, Irgum K. Anal Chem, 2001, 73(9): 1993
[5] Wade K L, Garrard I J, Fahey J W. J Chromatogr A, 2007, 1154(1/2): 469
[6] Kuang Y Y, Wang Y, Gu X, et al. Chinese Journal of Chromatography, 2014, 32(4): 388
况媛媛, 王彦, 谷雪, 等. 色谱, 2014, 32(4): 388
[7] Yang J, Dong J B, Ye Z D, et al. Acta Chimica Sinica, 2012, 70(16): 1725
杨静, 董佳斌, 冶正得, 等. 化学学报, 2012, 70(16): 1725
[8] Ni G, Yang W, He X Y, et al. Progress in Chemistry, 2005, 17(6): 1074
倪刚, 杨武, 何晓燕, 等. 化学进展, 2005, 17(6): 1074
[9] Hemstrom P, Szumski M, Irgum K. Anal Chem, 2006, 78(20): 7098
[10] Wang E N, Duan S J, He X W, et al. Acta Chimica Sinica, 2010, 68(23): 2421
王婀娜, 段淑静, 何锡文, 等. 化学学报, 2010, 68(23): 2421
[11] Gai Q Q, Qu F. Chinese Journal of Chromatography, 2015, 33(5): 475
盖青青, 屈锋. 色谱, 2015, 33(5): 475
[12] Bai H H, Fan C, Shen B Q, et al. Chinese Journal of Chromatography, 2015, 33(3): 221
白海红, 范超, 沈丙权, 等. 色谱, 2015, 33(3): 221
[13] Sun Y, Xu F, Gong B L. Chinese Journal of Chromatography, 2011, 29(9): 918
孙杨, 徐飞, 龚波林. 色谱, 2011, 29(9): 918
[14] Wang F Q, Chang S P, Dai X J, et al. Chinese Journal of Analytical Chemistry, 2012, 40(3): 415
王富强, 常素萍, 戴小军, 等. 分析化学, 2012, 40(3): 415
[15] Ma M H, Niu Y L, Gong Y R, et al. Chinese Journal of Pesticide Science, 2014, 16(2): 165
马梅花, 牛玉玲, 龚艳茹, 等. 农药学学报, 2014, 16(2): 165
[16] Ding W, Mao C, Yu T, et al. Science and Technology in Chemical Industry, 2011, 18(5): 15
丁伟, 毛程, 于涛, 等. 化工科技, 2011, 18(5): 15
[17] Xiao H, Hu J, Jin S L, et al. Bull Korean Chem Soc, 2013, 34(9): 2616
[18] Karatapanis A E, Fiamegos Y C, Stalikas C D. J Chromatogr A, 2011, 1218(20): 2871
[19] Sun Y H. Anhui Medical and Pharmaceutical Journal, 2012, 16(1): 30
孙银华. 安徽医药, 2012, 16(1): 30
Preparation and evaluation of chromatographic properties of sulfobetaine zwitterionic hydrophilic interaction chromatography stationary phase
LI Wenjing1, ZHAO Lijuan1, WEI Chanling1, DAI Xiaojun1*, GONG Bolin1,2*
(1.SchoolofChemistry&ChemicalEngineering,NingxiaUniversity,Yinchuan750021,China;2.SchoolofChemistry&ChemicalEngineering,BeifangUniversityofNationalities,Yinchuan750021,China)
A zwitterionic sulfobetaine functional monomerN,N-dimethyl-N-acryloyloxyethyl-N-ammonium propane sulfonate (DMAEAPS) was synthesized. Dimethyl amino ethyl acrylate (DMAEA) and 1,3-propyl sulfonic acid ester as raw materials were used to synthesize the functional monomer. The DMAEAPS functional monomer was characterized by1H-NMR and FT-IR. 2-Bromoisobutyryl bromide allyl silicone (Sil-Br) was used as the initiator, CuBr and 2,2-bipyridyl (Bpy) as the catalytic system, and the functional monomer DMAEAPS was grafted on the surface of Sil-Br by atom transfer radical polymerization (ATRP). Then the sulfobetaine zwitterionic stationary phase (Sil-DMAEAPS) was obtained. The Sil-DMAEAPS stationary phase was characterized by element analysis. Chromatographic evaluation in hydrophilic interaction chromatography (HILIC) mode showed that the materials were suitable for use as stationary phase, and the column showed a dual retention mechanism, HILIC mode in acetonitrile-rich mobile phases and RP mode in highly aqueous mobile phases. The separation selectivity and retention of the five polar solutes (benzoin, pyridoxine, rutin hydrate,p-coumaric acid and caffeic acid) on the Sil-DMAEAPS stationary phase were different from the commercially available ZIC®-HILIC. A method for the determination of rutin hydrate in rutin tablets was established. It is simple and accurate for the determination of polar compounds.
atom transfer radical polymerization (ATRP); sulfobetaine; zwitterionic stationary phase; hydrophilic interaction chromatography (HILIC); chromatographic properties
10.3724/SP.J.1123.2016.09035
2016-09-17
国家自然科学基金(31360077,31271868);宁夏自然科学基金(NZ13045).
Foundation item: National Natural Science Foundation of China (Nos. 31360077, 31271868); Natural Science Foundation of Ningxia (No. NZ13045).
O658
A
1000-8713(2017)04-0382-06
* 通讯联系人.E-mail:xjdai@nxu.edu.cn(戴小军);E-mail:gongbl@nxu.edu.cn(龚波林).
