榆耳酸溶性多糖对肝癌H22小鼠的抑瘤作用研究*
2017-04-10蔡恩博图力古尔包海鹰
王 红,赵 岩**,蔡恩博,图力古尔,李 伟,李 玉,包海鹰,**
(1.吉林农业大学中药材学院 长春 130118;2. 吉林农业大学食药用菌教育部工程研究中心长春 130118)
榆耳酸溶性多糖对肝癌H22小鼠的抑瘤作用研究*
王 红1,赵 岩1**,蔡恩博1,图力古尔2,李 伟1,李 玉2,包海鹰1,2**
(1.吉林农业大学中药材学院 长春 130118;2. 吉林农业大学食药用菌教育部工程研究中心长春 130118)
目的:研究榆耳酸溶性多糖对小鼠H22移植瘤的生长抑制作用及其机理。方法:以抑瘤率、肝指数、胸和脾脏指数、白细胞介素-2、γ-干扰素、肿瘤坏死因子-α等指标来考察榆耳酸溶性多糖对H22荷瘤小鼠肿瘤抑制作用,以H&E染色法观察肿瘤组织的病理改变,采用TUNEL法检测细胞凋亡情况。结果:榆耳酸溶性多糖3个剂量组能显著抑制肿瘤的增殖,提高荷瘤小鼠脾脏、胸腺指数以及血清细胞因子IL-2、IFN-γ和TNF-α;肿瘤组织H&E染色和TUNEL实验表明,榆耳酸溶性多糖可以通过诱导肿瘤细胞凋亡而发挥抑制肿瘤生长作用。结论:榆耳酸溶性多糖具有显著的抗肿瘤作用,其作用机制可能与免疫调节、促细胞凋亡、保护肝脏功能有关。
榆耳酸溶性多糖 H22荷瘤小鼠 抗肿瘤 H&E染色 TUNEL
榆耳(Gloeostereum incamatumS.Ito et Imai)学名为“肉红胶韧革菌”,别名“榆蘑、肉蘑、胶韧革菌”等[1],多生长在榆、春榆和糖槭树上,主要分布于中国辽宁、黑龙江、吉林等地以及日本的北海道区域[2]和前苏联西伯利亚地区[3]。现代药理学研究证明,榆耳作为一种药食兼用的高等真菌,具有较好的抑菌[4]、抗氧化[5]、增强免疫[6]、抗炎[7]、抗疲劳[8]等作用。近年来的研究发现,榆耳对肿瘤细胞的增长具有一定的抑制作用[9],但关于榆耳酸溶性多糖抗肝癌相关研究尚未见报道,为了系统的研究榆耳的抗肿瘤活性,本研究采用小鼠体内移植性肿瘤肝癌H22模型,观察榆耳酸溶性多糖对小鼠的抑瘤作用及免疫增强作用,为其临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
雄性SPF级ICR小鼠,体重18-22 g,购自长春亿斯实验动物技术有限公司,动物合格证号:SCXK(吉)2011-0004。
1.1.2 主要仪器与试药
SW-CJ-2FD型超净工作台(上海苏净实业有限公司);LA 114型电子分析天平(常熟市百灵天平仪器有限公司);SPECTRA MAX 190酶标仪(美谷分子仪器(上海)有限公司)。
榆耳(栽培品)由吉林省四平市叶赫镇栽培基地提供;H22肝癌细胞株(中国科学院上海细胞所);注射用环磷酰胺(江苏恒瑞医药股份有限公司,生产批号:14121721);小鼠白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)、(美国R&D公司)肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(长春百金生物工程有限公司,生产批号:201604)。其他试剂均为分析纯。
1.2 实验方法
1.2.1 榆耳酸溶性多糖的制备
干燥后的榆耳经95%乙醇脱脂后,用6倍体积的pH=2盐酸室温浸泡过夜,超声提取3 h,提取3次,过滤,透析,离心,上清液加NaOH中和,减压浓缩,浓缩液加入3倍体积的95%乙醇醇析,沉淀反复用乙醇清洗,即得榆耳酸溶性多糖(以下简称“GI-A多糖”)。
1.2.2 H22皮下移植瘤模型
参照王欢等[10]实验方法进行:常规方法复苏H22肝癌细胞,取0.2 mL细胞悬液注射到小鼠腹腔内,连续传两代。抽取腹水瘤小鼠的腹水(无菌条件下),用灭菌后的生理盐水稀释,稀释后离心(1 000 r·min-1,5 min),离心后用灭菌后的生理盐水洗涤细胞2次,置于显微镜下观察,调整细胞密度为1×107个/mL,取0.2 mL 瘤细胞悬液接种到小鼠的右腋窝皮下。
1.2.3 动物分组及处理
小鼠饲养1周后接种H22肝癌细胞,接种第3天开始分组给药。其中,把小鼠随机分成空白对照组、模型组、治疗组(多糖高、中、低剂量组)和阳性对照组,每组10只。给药剂量依据《药理实验方法学》换算,其中的阳性对照组腹腔注射给药环磷酰胺(CTX,30 mg·kg-1),治疗组分为高、中、低3个剂量组灌胃给予多糖(300、150和75 mg·kg-1)。每日1次,模型组和空白对照组以等量的生理盐水灌胃。各组动物连续给药10天,末次给药后禁食不禁水16 h后,眼球取血,断颈处死,完整剥离瘤块,收集各组织。整体动物实验重复开展2次,实验结果综合2次实验数据而定。
1.2.4 测定小鼠抑瘤率、脏器指数以及血清指标
分别称取小鼠体重、瘤重量,计算抑瘤率。并称取肝脏、胸腺、脾脏重量,计算肝脏指数、胸腺指数和脾脏指数。将剥离的瘤块以及脾脏用10%甲醛溶液固定。分离血清,ELISA法测IL-2、TNF-α、IFN-γ含量。计算公式如下:

1.2.5 肿瘤组织及脾脏H&E染色
采用Wang T[11]等报道的方法进:取10%甲醛溶液固定后的小鼠H22细胞皮下移植瘤组织及脾脏组织块(大小约0.5 cm×0.5 cm×0.3 cm),经常规脱水、透明、浸蜡后石蜡包埋。切片机5 μm连续切片,展开于聚赖氨酸处理过的载玻片上,室温保存备用。苏木素染色,脱水,伊红染色,脱水,二甲苯透明、中性树胶固封;置于光学显微镜下进行病理形态学观察。
1.2.6 TUNEL法测定各组肿瘤组织凋亡情况
采用Qu H[12]等报道的方法进行实验:石蜡包埋的切片经预处理常规脱蜡脱水,蛋白酶K室温孵育;37℃孵育15 min后,PBS洗涤2次,滴加TUNEL反应混合溶液,在湿盒中37℃孵育60 min;PBS冲洗3次,加入转化剂-POD,在湿盒中37℃孵育30 min;PBS冲洗3次,加入DAB底物溶液,室温孵育10 min,PBS冲洗3次;苏木素复染细胞核,封片,于光学显微镜下进行病理形态学观察。采用细胞凋亡指数(AI)[12]作为评价肿瘤细胞的凋亡情况,凋亡指数为阳性细胞与总细胞的百分比,其中阳性细胞为高倍镜(×400)下,每只动物提供2张切片,每张切片选取5个不同的视野,每个视野中的100个肿瘤细胞中的阳性细胞数。
1.2.7 统计学方法
采用SPSS 11.5统计软件进行各组平均值和标准差的计算,数据以±s表示,组间均数比较采用独立样本(Independent Samplest-Test)进行单因素方差分析,P<0.05或P<0.01表示数据差异具有统计学意义。
2 结果
2.1 对小鼠肿瘤生长的影响
给药后,GI-A多糖各剂量组小鼠肝癌H22移植瘤的生长明显受到抑制。本实验分别从5个组中选取一个具有代表性的肿瘤图片。由图1可知,从左至右分别为模型组、CTX组、GI-A低剂量组、GI-A高剂量组和GI-A中剂量组,肿瘤大小差异显著;与模型组比较,GI-A多糖组和CTX组荷瘤小鼠瘤重量显著减轻,GI-A多糖3个剂量组中以高剂量组抑瘤效果最佳,其效果与CTX组接近,并呈现一定的剂量依赖性(表1)。
2.2 对小鼠体重和脏器指数的影响
如表2所示,实验开展10天后,H22肝癌移植瘤小鼠实验前后的体重以及脏器指数均发生明显变化。与空白组相比,模型组各脏器指数均有显著差异。与模型组比较,作为免疫抑制剂[13]的CTX组小鼠脾指数和胸腺指数均显著降低。与CTX组比较,GI-A多糖组小鼠肝指数显著降低,脾脏指数和胸腺指数显著升高,说明GI-A多糖各剂量组对脏器有一定的保护作用。

图1 榆耳酸溶性多糖对肝癌H22移植瘤小鼠肿瘤生长的影响
表1 榆耳酸溶性多糖对肝癌H22移植瘤小鼠肿瘤生长的影响(±s,n=10)
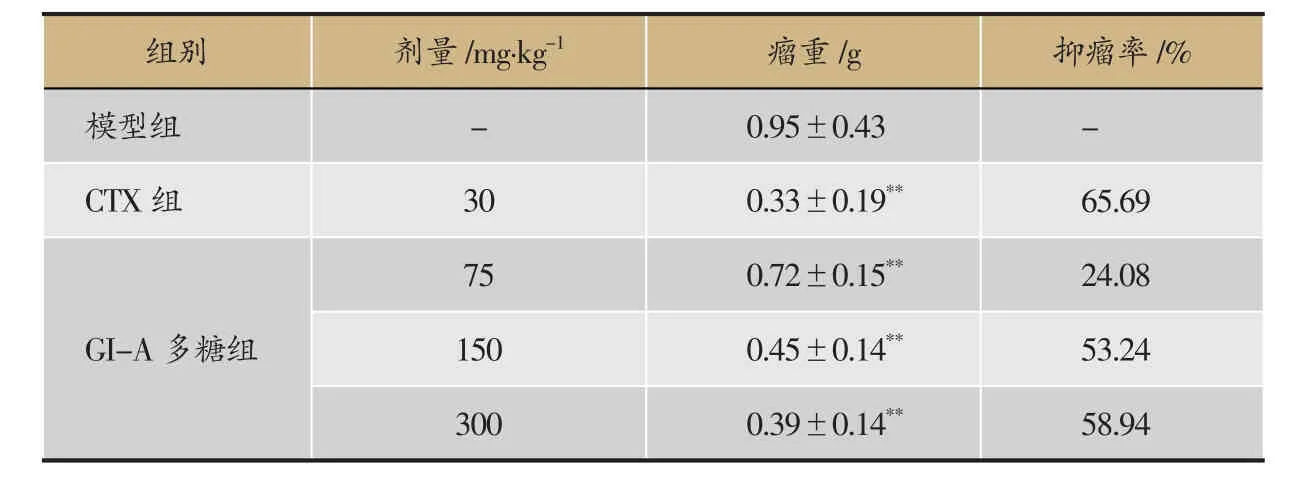
表1 榆耳酸溶性多糖对肝癌H22移植瘤小鼠肿瘤生长的影响(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。
75 0.72±0.15**24.08 150 0.45±0.14**53.243000.39±0.14**58.94组别剂量/mg·kg-1瘤重/g抑瘤率/%模型组-0.95±0.43 -CTX组30 0.33±0.19**65.69 GI-A多糖组
2.3 对小鼠血清细胞因子的影响
与空白组比较,模型组小鼠的IL-2、IFN-γ、TNF-α水平均显著降低。与模型组比较,GI-A多糖各剂量组的IL-2、IFN-γ、TNF-α水平显著升高,并呈一定的剂量依赖;CTX组的IL-2、TNF-α水平显著升高。结果见表3。
2.4 H22荷瘤小鼠组织H&E染色
2.4.1 H22荷瘤小鼠肿瘤组织H&E染色
通过H&E染色可以直接观察H22小鼠移植瘤组织内部肿瘤细胞状态,进一步判断榆耳多糖抑制肿瘤生长的机制。在高倍镜(×400)下观察小鼠肿瘤切片(图1)。由此可见,模型组肿瘤组织内部细胞排列整齐,生长旺盛且状态良好,可明显地观察到细胞核。与模型组比较,CTX组可见大面积的坏死区域,其肿瘤组织松散,细胞排列不规则,细胞数明显减少。GI-A多糖给药组肿瘤组织细胞亦呈现一定的坏死区域,尤其是GI-A多糖高剂量组中细胞凋亡明显,组织松散,GI-A多糖中低剂量也可看到一定的坏死区域,但其作用效果没有高剂量明显,说明榆耳多糖具有明显抗肿瘤作用,且随着剂量的增加,坏死区域增加,具有一定的剂量依赖性。
表2 榆耳酸溶性多糖对肝癌H22移植瘤小鼠体重及免疫器官指数的影响(±s,n=10)

表2 榆耳酸溶性多糖对肝癌H22移植瘤小鼠体重及免疫器官指数的影响(±s,n=10)
注:与空白组比较,#P<0.05,与模型组比较,*P<0.05,**P<0.01;与CTX组比较,△P<0.05。
75 20.37±1.07 27.40±1.93 45.34±2.11**△4.73±1.29**△1.81±0.17△150 20.32±1.37 27.86±2.61 46.97±3.68**△4.95±1.03**△1.94±0.78△300 20.49±1.42 30.43±1.79 49.86±2.68**△5.04±0.53△2.20±0.11△△体重/g肝指数/mg·g-1脾指数/mg·g-1胸腺指数/mg·g-1实验前实验后空白组20.26±1.08 30.42±1.36 48.72±1.51 4.52±0.23 1.69±1.08模型组-20.13±1.1529.81±2.21 45.40±2.28#5.39±1.07#1.87±0.77#CTX组30 20.22±1.10 26.44±1.32 53.13±2.77**3.95±0.31*1.33±0.44*组别剂量/mg·kg-1GI-A多糖组
表3 榆耳酸溶性多糖对肝癌H22移植瘤小鼠血清细胞因子IL-2、IFN-γ、TNF-α等的影响(±s,n=10)
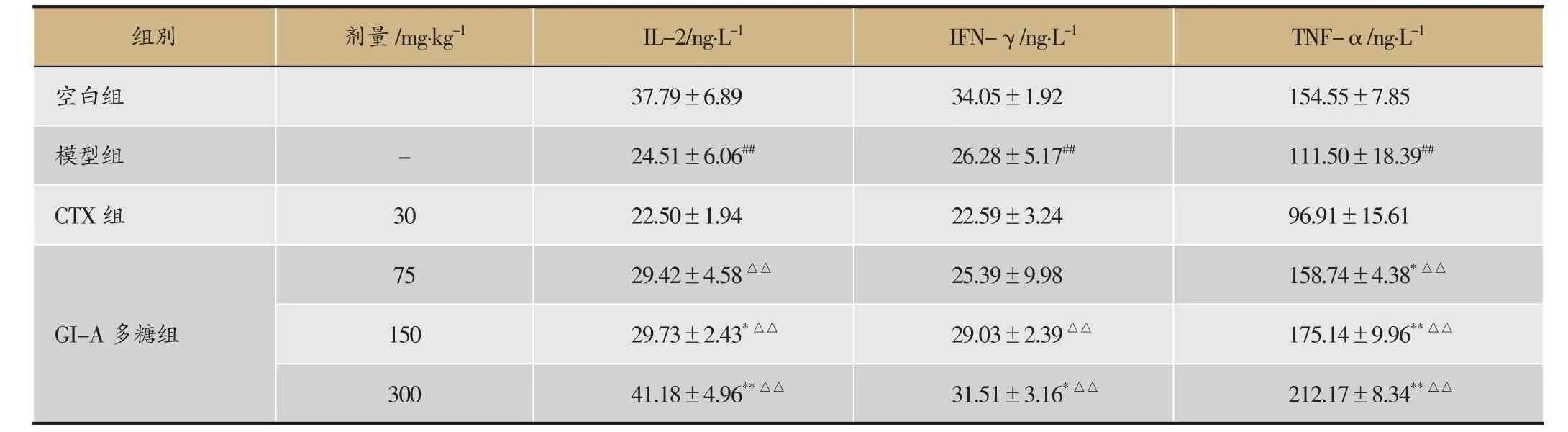
表3 榆耳酸溶性多糖对肝癌H22移植瘤小鼠血清细胞因子IL-2、IFN-γ、TNF-α等的影响(±s,n=10)
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01;与CTX 组比较,△P<0.05。
75 29.42±4.58△△25.39±9.98 158.74±4.38*△△150 29.73±2.43*△△29.03±2.39△△175.14±9.96**△△300 41.18±4.96**△△31.51±3.16*△△212.17±8.34**△△组别剂量/mg·kg-1IL-2/ng·L-1IFN-γ/ng·L-1TNF-α/ng·L-1空白组37.79±6.89 34.05±1.92 154.55±7.85模型组-24.51±6.06##26.28±5.17##111.50±18.39##CTX组3022.50±1.94 22.59±3.24 96.91±15.61 GI-A多糖组
2.4.2 H22荷瘤小鼠脾脏组织H&E染色
高倍镜(×40)下观察小鼠的脾脏H&E染色切片(图2)。由此可见,空白组小鼠的脾脏切片中,白髓和红髓区域明显,有明显的分界,且有清晰的边缘区;而模型组小鼠的脾脏中,组织质地松散无明显的边缘区。与模型组比较,CTX组小鼠脾脏组织有明显的边缘区,红髓结构尚清楚,白髓比例明显降低,但仍不及空白组小鼠脾脏。GI-A多糖低剂量组小鼠脾脏切片中尚存在明显的边缘区,但出现白髓增多的现象;而中、高剂量组小鼠脾脏显示明显的白髓和红髓界限,边缘区也清晰可见,与空白组比较,红、白髓比例无明显差异。说明GI-A多糖对脾有保护作用,可提高机体免疫。
2.5 TUNEL法检测H22荷瘤小鼠肿瘤组织细胞凋亡情况
经原位末端标记法染色后,其表达主要在细胞核中,呈现棕黄(褐)色的为阳性细胞(凋亡细胞),蓝染的细胞为苏木复染的阴性细胞(图3、表4)。在显微镜下观察发现,与模型组比较,实验组(GI-A多糖组和CTX组)可见大量的TUNEL阳性细胞,整个细胞着色较深,细胞核内有较强的棕色颗粒,而胞质内TUNEL染色较少,且GI-A多糖组的凋亡指数明显上升,差异具有统计学意义。实验组细胞凋亡指数(AI)明显高于模型组,表明GI-A多糖诱导了肿瘤组织凋亡率的提高。
3 讨论
现代研究表明,食用菌多糖具有良好的抗肿瘤、调节免疫力[14]、抗肝损伤[15]、抗氧化[16]、降血脂[17]等多种药理活性,因而成为一个研究热点。本研究通过建立H22小鼠移植瘤模型,证明了榆耳酸溶性多糖具有很好的抗肿瘤作用。给药10天后,GI-A多糖各剂量组均有一定抗肿瘤作用,均能抑制荷瘤小鼠肿瘤的生长,且呈现一定的剂量依赖。此外,与作为免疫抑制剂的CTX组相比,榆耳多糖能够显著增加荷瘤小鼠的胸腺指数、脾脏指数,提示榆耳多糖对荷瘤小鼠免疫器官有一定的保护作用。

图2 H22荷瘤小鼠肿瘤组织H&E染色(×400,200 μm)

图3 H22荷瘤小鼠脾组织 H&E 染色(×40,50 μm)
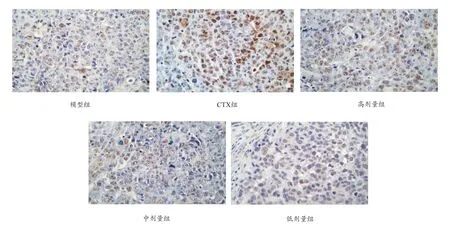
图4 H22荷瘤小鼠肿瘤组织TUNEL检测(×400,200 μm)
目前,大多数学者认为,肿瘤的发展是由于细胞凋亡过少、而增殖过旺,若能够抑制肿瘤细胞增殖、诱导其细胞凋亡,就可能产生抗肿瘤作用,达到治疗效果[18]。而IL-2、TNF-α和IFN-γ是机体内重要的细胞因子。IL-2是细胞免疫应答过程中的关键调节因子,其水平在某种程度上反映细胞免疫能力[19],具有明显的抗肿瘤作用[20]。TNF-α具有直接杀伤肿瘤细胞并诱导细胞凋亡及肿瘤组织坏死作用,可以抑制多种肿瘤的增殖,并诱导的肿瘤细胞凋亡[10]。本研究的实验结果表明,榆耳多糖(尤其是高剂量组)能够显著提高肝癌H22移植瘤小鼠血清IL-2、IFN-γ、TNF-α水平,且呈现一定的剂量依赖,而作为免疫抑制剂的CTX组的小鼠的血清指标均下降(与空白组比较),同时榆耳酸溶性多糖组小鼠的血清IL-2、IFN-γ、TNF-α水平较CTX组均有提高,说明榆耳多糖能够通过调节IL-2、IFN-γ、TNF-α等细胞因子水平而发挥抗肿瘤作用,同时验证了CTX的免疫抑制作用,而榆耳酸溶性多糖可能是通过调节免疫能力来实现抗肿瘤作用。H&E染色结果表明,CTX组与GI-A多糖组均呈现一定的坏死区域,但CTX组的坏死区域较大,而GI-A多糖组坏死区域较CTX组小,同时TUNNLE实验表明,CTX组的凋亡指数为32.86%,而GI-A多糖组高剂量组的凋亡指数为26.83%,通过H&E染色实验与TUNNLE实验表明,环磷酰胺与榆耳多糖可以通过诱导肿瘤细胞凋亡而发挥抑制肿瘤生长的作用,但其诱导细胞凋亡的作用机理还有待进一步研究,且榆耳多糖是一种成分复杂的天然提取物,对于其抗肿瘤作用的发生是否还存在其他途径和通道将进一步深入探讨研究。
表4 榆耳酸溶性多糖对肝癌H22移植瘤小鼠肿瘤组织TUNEL凋亡指数的影响(±s,n=10)
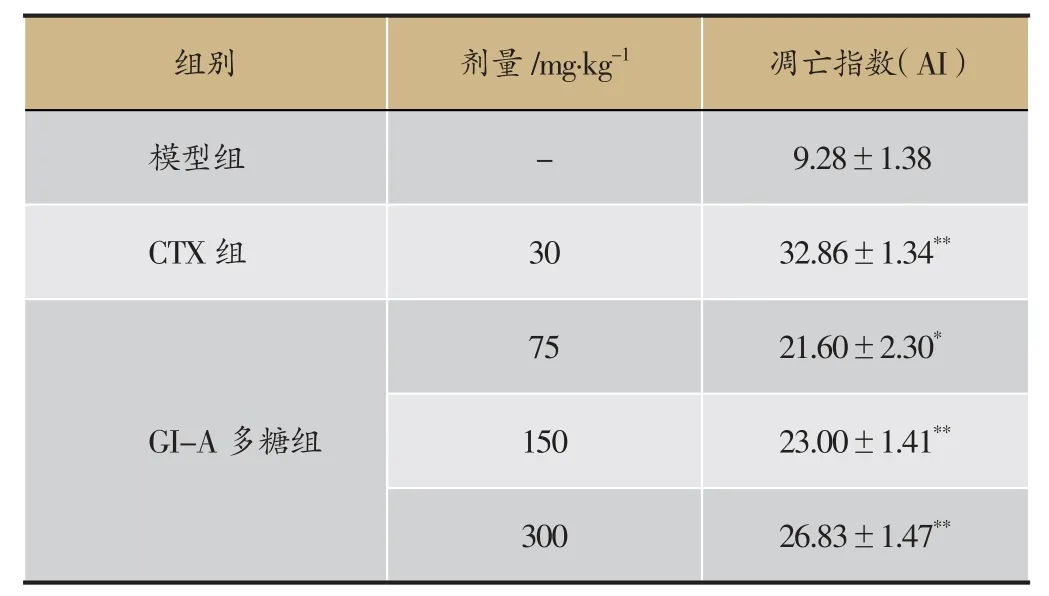
表4 榆耳酸溶性多糖对肝癌H22移植瘤小鼠肿瘤组织TUNEL凋亡指数的影响(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。
30026.83±1.47**组别剂量/mg·kg-1凋亡指数(AI)模型组- 9.28±1.38 CTX组30 32.86±1.34**75 21.60±2.30*GI-A多糖组150 23.00±1.41**
综上所述,榆耳酸溶性多糖具有一定的抗肿瘤作用,其作用机制可能与免疫调节、促细胞凋亡、保护肝脏功能有关,本研究对榆耳酸溶性多糖的开发利用具有一定的指导意义。
1 丁湖广,彭彪. 名贵珍稀菇菌生产技术问答. 北京:金盾出版社,2011:306-310.
2 赵义涛. 榆耳高产栽培技术. 中国蔬菜,2003,25(4):53-54.
3 Petersen R H, Parmasto E. A redescription ofGloeostereum incarnatum. Mycological Research. Mycological Research,1993,97(10):1213-1216.
4 李士怡,周一荻. 关于榆耳抑菌作用有效成分的研究. 中华中医药学刊,2006, 24(5):928-928.
5 王宏雨,谢宝贵,邓优锦,等. 45种食用菌液体发酵产物的抗氧化活性. 福建农林大学学报:自然科学版, 2010, 39(1):84-89.
6 翁丽丽,翁砚,邱金文. 榆耳多糖对动物免疫功能的影响. 吉林中医药,2009,29(7):626-627.
7 李典忠. 榆耳(Gloeostereum incarnatum)子实体及发酵液化学成分和药理活性研究. 吉林:吉林农业大学博士学位论文,2002:28-40.
8 常桂英. 榆耳中氨基酸的组成及功能特性分析. 轻工科技,2012,28(3):24-26.
9 吕金超,宋慧,苏玲,等. 4种真菌粗多糖体外抗肿瘤作用研究.安徽农业科学, 2010, 38(13):7160-7161.
10 王欢,关大朋,李伟,等. 熟桔梗对H22荷瘤小鼠的抑瘤作用及皂苷类成分分析. 毒理学杂志, 2015, 29 (1):49-53.
11 Wang T, Hartner W C, Gillespie J W,et al. Enhanced tumor delivery and antitumor activity in vivo of liposomal doxorubicin modified with MCF-7-specific phage fusion protein.Nanomedicine, 2014, 10(2):421-430.
12 董静,吴勃岩,车艳新,等. 熟地黄多糖诱导H22荷瘤小鼠细胞凋亡作用的研究. 中医药信息, 2015(4):32-34.
13 Qu H M, Liu S J, Zhang C Y. Antitumor and antiangiogenic activity of Schisandra chinensis polysaccharide in a renal cell carcinoma model.Int J Biol Macromol, 2014, 66(5):52-56.
14 Fan L, Ding S, Ai L,et al.Antitumor and immuno-modulatory activity of water-soluble polysaccharide from Inonotus obliquus.Carbohydr Polym, 2012, 90(2):870-874.
15 崔海丹,沈明花. 榛蘑多糖对小鼠急性肝损伤的保护作用.食品科技,2011,36(10):170-172.
16 沈明花,崔海丹,王欣彤. 榛蘑多糖的抗氧化作用研究. 食品科技,2010,35(5):77-79.
17 Li H, Zhang M, Ma G. Hypolipidemic effect of the polysaccharide from Pholiota nameko.Nutrition, 2010, 26(5):556-562.
18 吴玲芳,张家莹,李师,等. 藏药余甘子抗肿瘤作用研究进展. 世界科学技术—中医药现代化, 2016,7:1177-1181.
19 金爱花,朴龙,尹学哲,等. 草苁蓉环烯醚萜苷对H22小鼠肝癌移植瘤的抑瘤作用. 中草药,2012,43(2):332-335.
20 王梓. 热裂解人参皂苷的的分析、制备工艺及抗肿瘤活性研究. 吉林:吉林农业大学博士学位论文, 2015:43-54.
A Research on the Anti-tumor Effects of Acid-Soluble Polysaccharides from Gloeostereum incamatum in H22Tumor Bearing Mice
Wang Hong1, Zhao Yan1, Cai Enbo1, Bau Tolgor2, Li Wei1, Li Yu2, Bao Haiying1,2
(1. College of Chinese Medicinal Material, Jilin Agricultural University, Changchun 130118, China; 2. Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, Jilin Agricultural University, Changchun 130118, China)
This study aimed at exploring the inhibitory effect behind its mechanism on acid-soluble polysaccharides fromG. incamatumin transplanted H22 tumor mice. Different indices, including tumor inhibitory rate, organ index of liver, thymus and spleen, IL-2, IFN-γ and TNF-α were detected for the evaluation of antitumor effects and the mechanism. Furthermore, HE staining and TUNEL assay were adopted to investigate the pathological changes of tumor tissue and cell apoptosis, respectively. As a result, the three dose groups of acidsoluble polysaccharides ofG. incamatumsuccessfully inhibited the proliferation of tumor cells, while organ indexes of spleen and thymus were improved and serum IL-2, IFN-γ and TNF-α increased. H&E staining and TUNEL assay showed the polysaccharides induced cell apoptosis, playing a significant role in the inhibition of tumor growth. In conclusion, acid-soluble polysaccharides ofG. incamatumpossessed significant anti-tumor effects, behind which the mechanism could be related to the regulation of immune regulation, cell apoptosis, and the protection of liver function.
Acid-soluble polysaccharides ofGloeostereum incamatum, H22tumor bearing mice, anti-tumor, H&E staining, TUNEL
10.11842/wst.2017.01.021
R285.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-11-12
修回日期:2016-12-16
* 教育部长江学者与创新团队项目(IRT_15R25):重要菌物资源保育与可持续利用研究,负责人:图力古尔。
** 通讯作者:赵岩,教授,硕士生导师,主要研究方向:天然药物研究;包海鹰,教授,博士生导师,主要研究方向:菌物生药学研究。
