高中学生化学学科核心素养培养的教学思考
2017-04-10应化德
应化德
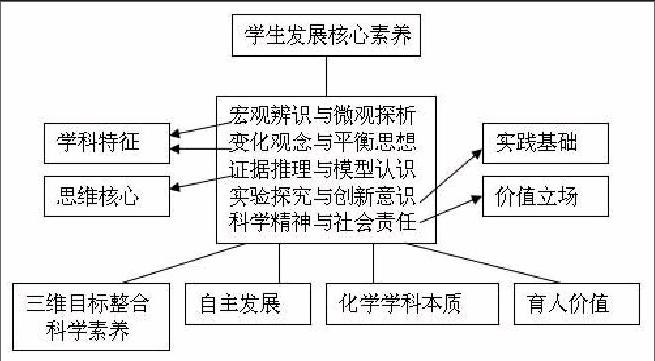
国家教育部课程标准制订委员会,已基本完成对原《课堂标准》的修改,确立了以学生核心素养发展为导向上的课程目标,优化课程结构,提高课程的适应性和灵活性,使知识向能力和素养的转化,整合三维目标,提出化学学科核心素养,化学核心素养为宏观辨识与微观探析,变化观念与平衡思想,证据推理与模型认知,实验探究与创新意思,科学精神与社会责任,称五大核心素养。
原电池的学习内容是培养学生学科核心素养的好素材,根据本人的教学经验,知道不同的教师教学这个课题时效果相差很大,有的教师做完铜锌原电池的实验得出原电池的形成条件,然后用该条件去判断是否形成原电池,没有微观探析原电池的本质,也没有让学生自主讨论得出结论,从而抑制学生的思维,没有将知识转化成能力和素养。下面介绍本人对原电池的教学设计和核心素养的形成过程。
一、原电池教学设计思想
二、教学过程
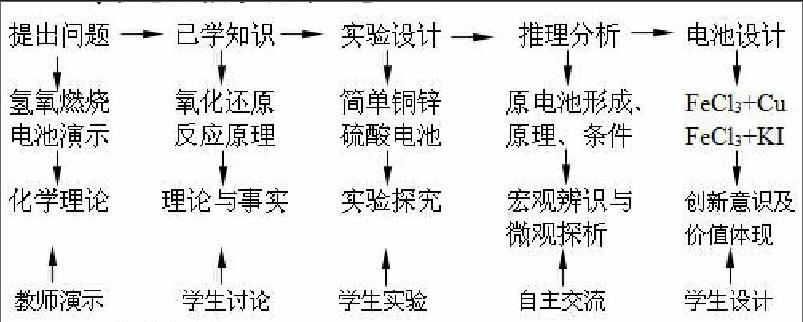
1.回顾知识、提出问题
水电解会分解H2和O2,而H2与O2点燃会生成水,那么H2和O2在常温常压下会发生反应吗?
做演示实验,在U形管中先电解水,去掉外加电流,把两个石墨电极连接生日贺卡,唱起了生日歌(学生惊讶),为什么?
设计目的:引起学生的好奇心,求知欲
2.已学知识,分析思考
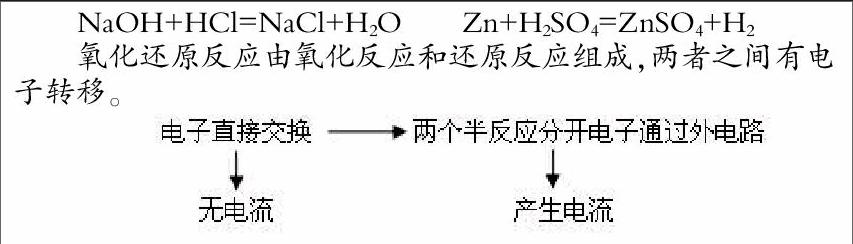
根据已有经验比较下列反应,从反应速率、能量变化、反应类型、化合价变化、电子转移等方面比较。
NaOH+HCl=NaCl+H2O Zn+H2SO4=ZnSO4+H2
氧化还原反应由氧化反应和还原反应组成,两者之间有电子转移。
设计目的:充分利用已学知识,体现学科特色
3.实验设计、学生动手
① Zn、Cu分别插入稀硫酸溶液中
Zn、Cu同时插入稀硫酸溶液中
③ Zn、Cu用连有电流计的导线连接,并插入稀硫酸溶液中
④ Cu、C用连有电流计的导线连接,并插入稀硫酸溶液中
第④个实验是对比实验,帮助学生对原电池的本质的理解,记录实验现象。
4.推理分析,自主讨论
通过宏观辨识和微观的探析,理解原电池本质这是学习本节内容最关键的一步。必须做好三点:一是设计有效的问题;二是通过自主学习,讨论与交流,让学生自主得出结论,达到自主发展;三是归纳、总结、提高。
问题设计:
(1) 实验①Zn与稀硫酸反应的电子是如何交换的?
(2) 实验③有电流的产生,判断电子的流向,并说明H+能在铜片上得电子的原因。
(3) 实验①、③的电子交换有什么不同?
(4) 两个电极的作用是什么?说说如何形成闭合回路?
(5) 实验④为什么没有电流产生(或微小的电流)?那么形成电流的前提条件是什么?
(6) 什么是原电池?形成原电池的一般条件是什么?
(7) 对电极材料有什么要求?
讨论归纳:
(1) 原电池的概念
利用合适的材料作电极,将氧化还原反应的氧化反应和还原反应分开,使电子通过外电路,形成电流的装置。或者,将化学能转变为电能的装置。
(2) 形成原电池的一般条件
a.存在一个自发的放热的氧化还原反应
b.选择合适的材料作电极
c.与电解质(或电解质溶液)形成闭合回路
(3) 电极材料的选择
由反应物的性质决定
(4) 原电池的正负极
失去电子(流出电子)发生氧化反应的电极为负极
得到电子(接纳电子)发生还原反应的电极为正极
5.原电池的设计,实验论证
(1) Cu+2FeCl3=2FeCl2+CuCl2
(2) 2FeCl3+2KI=2FeCl2+I2+KCl
画出实验装置,电极反应,实验验证
学生获得成功感、快乐感、价值得到体现。
6.归纳与总结
微观探析,必须到位,如本节教学关键是:
(1) 形成原电池,必须存在一个自发的氧化还原反应,能把两个半反应分开,有时必需用盐桥。
(2) 在Cu、Zn、稀硫酸原电池中,H+为什么移动Cu极,而不移向Zn极
(3) 形成闭合回路,必须在电极上有电子的得失
(4) 分子极、离子极混合,为什么必须用盐桥
(5) 原电池的电板材料由氧化还原反应决定,也不一定是活性不同。
通过上述教学过程,充分体现了宏观辨析与微观探析变化观(闭合回路),平衡思想(FeCl3与KI原电池),实验探究,创新意识,了解原电池的设计与应用,认识化学学科在社会发展的作用,体现价值观等化学学科的核心素養。
