甘氨酸-氟硼荧近红外荧光分子探针的合成及性能测试
2017-04-10王坤朋孟舒献冯亚青
董 雪,张 杰,王坤朋,方 硕,刘 洋,孟舒献*,冯亚青
(1.天津大学化工学院,天津 300072; 2.天津化学化工协同创新中心,天津 300072;3.天津力生制药股份有限公司,天津 300111; 4.浙江大学医学院附属第二医院PET中心,杭州 310009)
恶性肿瘤是一种严重威胁人类健康的多发疾病,已经成为人类死亡的主要原因之一。早期的肿瘤显像有助于减少无益的有创手术和治疗方案的确定,而早期的肿瘤显像的实现主要归功于分子影像学的发展。分子影像学的关键技术是分子探针的制备和应用。其中以近红外(near-infrared, NIR)荧光探针为主的光学分子探针发展尤为迅速[1]。其具有非离子低能量辐射、高通量成像、不同光谱特征、可连续实时监测、无创性或微创性、设备价格相对廉价等优势。
设计和合成近红外荧光染料是荧光探针的核心内容。而氟化硼络合二吡咯甲川类化合物氟硼荧(Boradiazaindacenes difluoro-bora-dipyrro-methenes, 简称BODIPY)类化合物因其母体结构是共轭平面结构,具有良好的光稳定性、较高的摩尔消光系数和荧光量子产率,能广泛应用于金属离子的检测[2-10]、pH值测试[11-13]、敏化染料太阳能电池[14-17]等诸多领域。同时由于其具有结构易于修饰、发射波长可调变到近红外光谱范围(大于700 nm),不易受环境影响等独特的性能在分子影像学领域受到广泛关注[18-19]。
本研究首先以氟硼二吡咯烷(BOD)为起始原料,通过缩合反应以反式的双键作为连接桥,将两个N-苯基亚胺基二苄引入到氟硼荧中的吡咯环中,得到了荧光发射光谱处于近红外区域的荧光染料——IDB-BDP,接着用N-羟基琥珀酰亚胺为活化试剂,将具有羧基的IDB-BDP染料与甘氨酸甲酯反应连接在一起,得到了具有肿瘤细胞亲和性的近红外荧光分子探针——IDB-gan。最后,将得到IDB-2和IDB-gan进行光学性能和生物学性能测试,并将试验结果进行了比较分析。实验结果显示:含有甘氨酸甲酯基团的氟硼荧化合物IDB-gan与肺癌细胞具有较好亲和力,数值达到23.65。
1 实验部分
1.1 试剂与仪器
实验所用试剂:二氯二氰基苯醌(DDQ)、三氟乙酸、三乙胺、三氟化硼乙醚、冰醋酸、氢氧化钠、对醛基苯甲酸甲酯来自天津光复试剂有限公司,均为分析纯;2,4-二甲基吡咯来自浙江清泉化工厂为化学纯;哌啶、苯、无水甲醇、无水乙醇来自天津杰尔正公司,均为分析纯。
实验所用仪器:Bruker AVANCE III 400M核磁共振仪;基质辅助激光解吸附-串联飞行时间质谱(Bruker Autoflex tof/tof III);Shimadzu UV-1800紫外-可见分光光度计;Varian Cary Eclipse型荧光分光光度计;倒置荧光显微镜;流式细胞仪(BD FACSCalibur)。
1.2 氟硼吡咯化合物的合成与表征
原料8-对甲氧羰基苯基-1,3,5,7-四甲基二吡咯烯氟硼化合物(BOD)按照本实验室方法[20]合成。
1.2.13,5-二(4-二苯基亚胺基苯乙烯基)-8-对甲氧羰基苯基-1,7-二甲基二吡咯烯氟硼化合物IDB-BDP的合成
将20.0 mg (52.4 μmol) BOD和39.1 mg (157.0 μmol, 2.5 eq.) IDB-CHO溶于10 mL苯,向溶液中加入0.1 mL(1.0 mmol)哌啶和0.1 mL(1.7 mmol)冰醋酸。磁力搅拌下,在90 ℃油浴中进行回流反应,TLC分析,直至原料反应完,柱层析分离得到IDB-BDP。1H NMR (400 MHz, CDCl3)δ8.15 (d,J=8.3 Hz, 2H), 7.54~7.32 (m, 12H), 7.30~7.27 (m, 6H), 7.13 (d,J=16.2 Hz, 2H), 6.63~6.53 (m, 6H), 3.97 (s, 3H), 3.01 (s, 8H), 1.38 (s, 6H)。MALDI Tof:m/z;理论值C63H51BF2N4O2944.41,实验值944.81。
1.2.23,5-二(4-二苯基亚胺基苯乙烯基)-8-对羧基苯基-1,7-二甲基二吡咯烯氟硼化合物IDB-2的合成
向25 mL圆底烧瓶中加入10.0 mg (10.6 μmol) IDB-BDP、12.7 mg (317.8 μmol, 30 eq.)氢氧化钠、12 mL无水乙醇和2 mL水。磁力搅拌下,在80 ℃油浴中进行回流反应,TLC分析监测,直至原料点消失。稀盐酸水洗反应液,氯仿萃取,进行柱层析分离,得到IDB-2。1H NMR (400 MHz, CDCl3)δ8.20 (d,J=8.3 Hz, 2H), 7.57~7.32 (m, 13H), 7.28 (dd,J=9.3, 4.0 Hz, 7H), 7.14 (d,J=16.1 Hz, 2H), 6.65~6.53 (m, 6H), 3.01 (s, 8H), 1.39 (s, 6H)。MALDI Tof:m/z;理论值 C62H49BF2N4O2930.39,实验值 930.79。
1.2.33,5-二(4-二苯基亚胺基苯乙烯基)-8-对(氮-甲氧羰基乙基)氨基甲酰基苯基-1,7-二甲基二吡咯烯氟硼化合物IDB-gan的合成
向25 mL圆底烧瓶中加入10.0 mg IDB-2、2.0 mg (1.5 eq)氮-羟基琥珀酰亚胺,2.8 mg 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、3 mL DMF,常温搅拌12 h,水洗、二氯甲烷萃取,柱层析分离。称取5 mg上述产物于10 mL圆底烧瓶中,加入1.7 mg (4 eq.)甘氨酸甲酯,0.1 mL三乙胺,2 mL DMF,室温搅拌12 h。经水洗、二氯甲烷萃取。柱层析分离,得到IDB-gan。1H NMR (400 MHz, CDCl3)δ7.94 (d,J=8.1 Hz, 2H), 7.43 (m, 12H), 7.31~7.27 (m, 6H), 7.13 (d,J=16.3 Hz, 2H), 6.63~ 6.51 (m, 6H), 4.29 (d,J=4.9 Hz, 2H), 3.83 (s, 3H), 3.01(s, 8H),1.38 (s, 6H)。C65H54BF2N5O3理论值1 001.43,实验值1 003.75。

图1 化合物IDB-2、IDB-gan的合成路线Fig.1 Synthesis of IDB-2 and IDB-gan
1.3 光学性能测试
1.3.1紫外-可见吸收光谱(UV-Vis)测试
所有待测样品均以二氯甲烷为溶剂,配制成浓度为3.0×10-6mol/L的溶液,用紫外-可见分光光度仪测试样品的紫外-可见吸收光谱,扫描的波长范围设定为300~800 nm,间隔为0.2 nm。
1.3.2稳态荧光光谱测试
所有待测样品均以二氯甲烷为溶剂,配制成浓度为3.0×10-6mol/L的溶液,用荧光分光光度计测试样品的荧光光谱。
1.3.3荧光量子产率的测试
所有待测样品均以二氯甲烷为溶剂,配制5种不同浓度(0,3.0×10-7,6.0×10-7,9.0×10-7,1.2×10-6mol/L)的溶液,用紫外-可见分光光度仪测试样品的紫外-可见吸收光谱,用荧光分光光度计测试样品的稳态荧光光谱并计算其积分面积。以紫外吸收强度为横坐标,以荧光积分面积为纵坐标作图,计算其斜率,按公式(1)[21]计算。
(1)
式(1)中,下标s代表标准样品,x代表待测样品。φ代表量子产率,η代表溶剂折射率,Grad代表用紫外吸收强度-荧光积分面积作图的斜率。
1.3.4荧光寿命的测试
荧光寿命是在瞬态荧光测试系统测试的。测试用的为液体样品。溶剂为二氯甲烷,浓度为3×10-6mol/L。
1.4 生物学性能测试
1.4.1细胞的培养
本研究中使用的细胞为肺癌细胞GLC-82。肺癌细胞GLC-82的培养液(45 mL RPMI-1640+5 mLNBS血清+0.5 mL双抗)。
细胞培养箱条件:饱和湿度,二氧化碳浓度为5%,温度为 37 ℃。
1.4.2荧光显微镜实验
将加入探针的细胞进行荧光显微镜实验考察探针的特异性。
分别使用IDB-2、IDB-gan对GLC-82细胞进行染色后荧光显微镜成像。步骤如下:取处于对数生长期的细胞,加入1 mL经37 ℃水浴槽预热的胰蛋白酶溶液,置于细胞培养箱中2~3 min消化细胞。然后加入2~3 mL培养基,中止胰酶的消化作用,吹打成单细胞悬液,分别使用IDB-2、IDB-gan(浓度10-6mol/L)在细胞培养箱中培养细胞1 h,然后用PBS缓冲溶液冲洗3次,目的是为了洗掉残存的探针。然后在倒置荧光显微镜下进行成像。
1.4.3流式细胞实验
将探针培养过的细胞进行流式细胞实验可以考察探针的亲和力大小。
取生长旺盛的GLC-82细胞(对数生长期),吸弃培养液,用3 mL PBS洗涤后吸弃PBS,加入1 mL经37 ℃水浴槽预热的胰蛋白酶溶液,置于细胞培养箱中2~3 min消化细胞。然后加入2~3 mL培养基,中止胰酶的消化作用,吹打分散细胞,移入离心管中,800 r/min离心3 min,吸弃上清液。加2~4 mL RPMI-1640,吹打悬浮液均匀分散细胞,取10 μL细胞液,用细胞计数板计取细胞数并计算细胞总数。转移细胞至10 mL离心管中,每管细胞数为0.2×106个。然后用探针培养细胞1 h。然后800 r/min离心5 min,吸弃上清液。然后再用PBS缓冲溶液吹打悬浮液均匀分散细胞,800 r/min离心5 min。重复此过程3次。每个离心管中加入0.5 mL PBS缓冲溶液分散均匀细胞,用流式细胞仪逐个检测。流式细胞仪器的记录数据用BD FACSDiva软件分析。
1.4.4iRGD多肽影响实验
1.4.4.1考察加入iRGD多肽后对荧光显微镜成像的影响
步骤同1.4.2,只是在加入IDB-2(或IDB-gan)前先加iRGD(浓度10-4mol/L)1 mL培养1 h。
1.4.4.2考察加入iRGD多肽后对流式细胞实验的影响
步骤同1.4.3,只是在加入IDB-2(或IDB-gan)前先加iRGD(浓度10-4mol/L)1 mL培养1 h。
2 结果与讨论
2.1 光学测试结果分析
2.1.1紫外-可见吸收光谱(UV-Vis)和稳态荧光光谱测试结果
图2和图3分别为 IDB-2、IDB-gan的紫外-可见吸收光谱和稳态荧光光谱。

图2 IDB-2、IDB-gan的紫外-可见吸收光谱(3×10-6 mol/L)Fig.2 Absorption spectra of IDB-2 and IDB-gan in CH2Cl2 solution (3×10-6 mol/L)
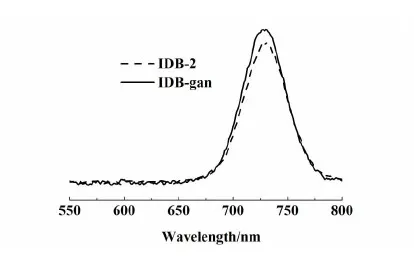
图3 IDB-2、IDB-gan的稳态荧光光谱(3×10-6 mol/L)Fig.3 Fluorescence spectra of IDB-2 and IDB-gan in CH2Cl2 solution ((3×10-6 mol/L))
通过图2可以发现,化合物IDB-2、IDB-gan最大吸收峰分别为703和702 nm二者没有明显的区别。图3为氟硼二吡咯化合物IDB-2、IDB-gan的荧光发射光谱。其发射波长分别为728和730 nm。这2个化合物结构不同之 处仅在于IDB-gan是在IDB-2的基础上引入1个甘氨酸,这个氨基酸的结构简单不足以影响整个分子电子排布情况,所以这2个分子的紫外吸收光谱和荧光发射光谱没有很大区别。但二者的荧光发射光谱均超过了700 nm,可有效的避开生物组织中内源性物质(有氧、无氧血红蛋白、黑色素、水和胆红素等)的吸收、散射等对光学造成的影响(一般在600~650 nm附近)。而在近红外区域(700~900 nm),组织的吸收、散射和自发荧光背景都比较低,能在动物组织内达到最大穿透深度,并能进行深层组织成像,因此IDB-gan具有良好的近红外光学性能。
2.1.2荧光量子产率和荧光寿命的测试结果
荧光量子产率和荧光寿命的计算结果列在表1中。

表1 IDB-2、IDB-gan的荧光量子产率和荧光寿命的计算结果
a激发波长/nm: IDB-2 703, IDB-gan 702。
b以在CH2Cl2溶剂中 5,10,15,20-tetraphenylporphyrin (TPP)为标准(φf=0.11)。
结果显示引入氨基酸以后量子产率有所增加,从0.024到0.038。荧光量子产率的数值越大则化合物的荧光越强,这就表示引入氨基酸增加了IDB-2的荧光强度。而荧光寿命有所降低,从2.62 ns降低到2.48 ns。荧光寿命表示粒子在单线激发态下存在的平均时间。荧光寿命越短表示荧光衰减更快一些。因此IDB-gan荧光衰减较快,荧光寿命有所降低。
2.2 生物学性能测试结果
2.2.1荧光显微镜测试结果
图4为IDB-2、IDB-gan的可见光和荧光图像。

图4 IDB-2、IDB-gan的可见光和荧光图像Fig.4 Bright-Field and inverted fluorescence images of IDB-2 and IDB-gan
如图4所示,A1-A3白色背景的是可见光图像也就是白光图像。 B1-B3深色背景的是荧光图像。相同背景的图像处理时都采用了相同的比例尺(scale bar)设定。A1-B1:是单纯肺癌细胞GLC-82的成像结果;A2-B2:是GLC-82采用IDB-2荧光分子培养后的成像结果;A3-B3:是GLC-82采用IDB-gan荧光分子培养后的成像结果。通过对荧光显微镜谱图(图4)分析可得:加入IDB-2和IDB-gan后,肿瘤细胞的荧光强度显著提高,与未添加的肺癌细胞相比,无论是亮度还是清晰度均明显改善。而IDB-2和IDB-gan在荧光强度上没有明显区别,说明甘氨酸的引入对于荧光强度没有显著影响。
2.2.2流式细胞结果
流式细胞仪是用来检测探针与肺癌细胞GLC-82的亲和力大小。如图5所示,Data001是阴性对照,即单纯细胞的流式细胞图,Data005是IDB-2培养细胞后的流式细胞图,Data006是IDB-gan培养细胞后的流式细胞图。

图5 IDB-2、IDB-gan的流式细胞测试结果Fig.5 Flow cytometric analysis of IDB-2 and IDB-gan
通过分析流式细胞数据发现,引入甘氨酸后探针与肺癌细胞的亲和力增大比较明显,从4.05增大至23.65。说明引入亲和基团甘氨酸后,显著提高了探针与肿瘤细胞的亲和力。
2.2.3iRGD多肽对生物学的影响
iRGD多肽c(CRGDKGPDC)[22-24],是一种新型的环状多肽,其结构为含有9个氨基酸即半胱氨酸-精氨酸-甘氨酸-天冬氨酸-赖氨酸-甘氨酸-脯氨酸-天冬氨酸-半胱氨酸组成的环状多肽。可以和肿瘤细胞上特有的整合素和神经纤毛蛋白质作用,提高细胞膜的通透性,有利于将药物或探针引入到细胞或组织内部,提高药物作用效果或提高探针的成像灵敏度[22]。
2.2.3.1加入iRGD后IDB-2、IDB-gan的荧光显微镜成像结果
加入iRGD后 IDB-2、IDB-gan的可见光和荧光图像见图6。
如图6所示,A1-A3白色背景的是可见光图像也就是白光图像。 B1-B3深色背景是荧光图像。相同背景的图像处理时都采用了相同的比例尺(scale bar)设定。A1-B1:是iRGD培养肺癌细胞GLC-82的成像结果;A2-B2:是GLC-82先用iRGD培养1 h再用IDB-2荧光分子培养后的成像结果;A3-B3:是GLC-82先用iRGD培养1 h再用IDB-gan荧光分子培养后的成像结果。通过对荧光显微镜谱图(图5)分析可得,加入IDB-2、IDB-gan后肿瘤细胞与未添加荧光分子的肿瘤细胞相比都呈现了清晰地的荧光图像。与2.2.1结果相同。

图6 加入iRGD后 IDB-2、IDB-gan的可见光和荧光图像Fig.6 Bright-Field and inverted fluorescence images of IDB-2 and IDB-gan with iRGD
2.2.3.2加入iRGD后IDB-2、IDB-gan的流式细胞测试结果
加入iRGD后IDB-2、IDB-gan的流式细胞测试结果如图7所示。Data009是阴性对照,即经过iRGD培养后细胞的流式细胞图,Data013是先经过iRGD培养再用IDB-2培养细胞后的流式细胞图,Data014是先经过iRGD培养再用IDB-gan培养细胞后的流式细胞图。

图7 加入iRGD后IDB-2、IDB-gan的流式细胞测试结果Fig.7 Flow cytometric analysis of IDB-2 and IDB-gan with iRGD
通过分析流式细胞数据发现,IDB-gan与肺癌细胞的亲和力优于IDB-2,从1.01增大至2.03。说明引入亲和基团甘氨酸后,提高了探针与肿瘤细胞的亲和力与2.2.2的趋势一致。但是可以发现添加iRGD后,不但没有明显提高探针与肿瘤细胞的结合力,反而有所降低。这可能是因为先加入iRGD后,而iRGD易于与肿瘤细胞膜进行特异性结合,占据了细胞膜上的一部分受体,导致后续加入的探针IDB-2和IDB-gan没有足够多的受体相结合,说明IDB-2和IDB-gan只是结合在肿瘤细胞膜表面,没有进入肿瘤细胞内部。
因此引入iRGD多肽后,不仅没有发挥其穿膜肽的作用,反而与探针发生竞争作用,阻碍了探针与肿瘤细胞受体的结合。但是IDB-2和IDB-gan与肺癌细胞结合力大小顺序没有发生变化,还是具有亲和基团的IDB-gan亲和力明显大于IDB-2。
3 结论
首先以氟硼二吡咯烷(BOD)为原料,通过缩合反应,将具有强供电子作用的N-苯基亚氨基二苄引入到氟硼荧中,得到了荧光光谱处于近红外区的甘氨酸-氟硼荧化合物,其次用N-羟基琥珀酰亚胺为活化剂,将具有生物相容性的甘氨酸甲酯引入到荧光基团-氟硼荧(BDDIPY),最终得到具有生物亲和性的甘氨酸-氟硼荧分子荧光探针——IDB-gan。通过光学测试说明IDB-2和IDB-gan的荧光发射光谱均超过了700 nm,避免了生物组织中内源性物质对于光学的影响。通过生物学测试尤其是流式细胞实验说明IDB-2和IDB-gan均与肿瘤细胞具有一定亲和力,且引入亲和基团甘氨酸后,显著提高了探针与肿瘤细胞的亲和力,从4.05提高到23.65。说明IDB-gan与肺癌细胞具有更好亲和力。最后通过添加iRGD多肽试验说明IDB-2和IDB-gan两种物质结合到肿瘤细胞的表面,没有渗透到细胞内部。通过以上实验显示了IDB-gan是一种具有良好应用前景的近红外荧光分子探针。
参考文献:
[1]Shadgan B, Macnab A J. Using near-infrared spectroscopy (NIRS) technology in a clinical setting to address an important issue[J]. J Trauma, 2008, 65(5): 1 205-1 206
[2]Yamada K, Nomura Y, Citterio D,etal. Highly sodium-selective fluoroionophore based on conformational restriction of oligoethyleneglycol-bridged biaryl boron-dipyrromethene[J]. J Am Chem Soc, 2005, 127: 6 956-6 957
[3]Baruach M, Qin W W, Valle’e R A,etal. A Highly potassium-selective ratio metric fluorescent indicator based on BODIPY azaerown ether excitable with visible light[J]. Org Lett, 2005, 7(20): 4 377-4 380
[4]Namkung W, Padmawer P, Mills A D,etal. Cell-Based fluorescence screen for K+channels and transporters using an extra-cellular triazacryptand-based K+sensor [J]. J Am Chem Soc, 2008, 130: 7 794-7 795
[5]Wang Y, Yu M, Yu Y,etal. A colorimetric and fluorescent turn-on chemo-sensor for Al3+and its application in bio-imaging[J]. Tetrahedron Lett, 2009, 50: 6 169-6 172
[6]Peng X, Du J, Fan J,etal. A selective fluorescent sensor for imaging Cd2+in living cell[J]. J Am Chem Soc, 2007, 129: 1 500-1 501
[7]Cheng T, Xu Y, Zhang S. A highly sensitive and selective OFF-ON fluorescent sensor for cadmium in aqueous solution and living cell[J]. J Am Chem Soc, 2008, 130(48): 16 160-16 161
[8]Coskun A, Yilmaz M D, Akksya E U. Bis(2-pyridyl)-Substituted boratriazaindacene as an NIR-emitting chemosensor for Hg(II)[J]. Org Lett, 2007, 9(4): 607-609
[9]Zhang X, Xiao Y, Qian X. A ratiometric fluorescent probe based on FRET for imaging Hg2+ions in living cells[J]. Angew Chem Int Ed, 2008, 47 (42): 8 025-8 029
[10]Qi X, Jun E, Xu L,etal. New BODIPY derivatives as OFF-ON fluorescent chemosensor and fluorescent chemo-dosimeter for Cu2+: Cooperative selectivity enhancement toward Cu2+[J]. J Org Chem, 2006, 71(7): 2 881-2 884
[11]Rurack K, Kollmannsberger M, Daub J. A highly efficient sensor molecule emitting in the near infrared (NIR): 3,5-distyryl-8-(p-dimethylaminophenyl) difluoroboradiazas-indacene[J]. New J Chem, 2001, 25: 289-292
[12]Baruah M, Qin W W, Basaric N,etal. BODIPY-Based hydroxyaryl derivatives as fluorescent pH probes[J]. J Org Chem, 2005, 70(10): 4 152-4 157
[13]Han J Y, Loudet A, Barhoumi R. A ratiometric pH reporter for imaging protein-dye conjugates in living cells[J]. J Am Chem Soc, 2009, 131(5): 1 642-1 643
[14]Lee C Y, Hupp J T. TiO2sensitization with a bodipy-porphyrin antenna system[J]. Langmuir, 2010, 26(5): 3 760-3 765
[15]Francis D S, Anu N A, Mohamed E E,etal. Control over photoinduced energy and electron transfer in supramolecular polyads of covalently linked azaBODIPY-bis porphyrin ‘Molecular clip’ hosting fullerene[J]. Journal of American Chemistry Society, 2012, 134 (1): 654-664
[16]Sule E M, Deniz Y, Burcak I,etal. A panchromatic boradiazaindacene (BODIPY) sensitizer for dye-sensitized solar cells[J]. Organic Letters, 2008, 10 (15): 3 299-3 302
[17]Safacan K O, Altan B, Yusuf C,etal. Optimization of distyryl-bodipy chromophores for efficient panchromatic sensitization in dye sensitized solar cells [J]. Chemical Science, 2011, 2 (5): 949-954
[18]Haugland R P. Handbook of fluorescent probes and research chemicals[M]. 6th Edition. Eugene (OR, USA): Molecular Probes, 1996
[19]Karolin J, Johansson L B A, Strand L,etal. Fluorescence and absorption spectroscopic properties of dipyrromethene-boron difluoride (BODIPY) derivatives in liquids, lipid membranes, and proteins [J]. Journal of the American Chemical Society, 1994, 116 (17): 7 801-7 806
[20]刘秀军. 基于增加长波吸收的卟啉类敏化染料的设计及光电性能研究[D]. 天津:天津大学,2013
Liu Xiujun. Design and photoelectric properties of porphyrin sensitizers for increasing of long wavelength absorption[D]. Tianjin: Tianjin University, 2013(in Chinese)
[21]Zhang N, Feng Y, Li Y,etal. Synthesis and characterization of simple trans-AB-porphyrins for dye-sensitized solar cells[J]. New J Chem, 2013, 37(4): 1 134-1 141
[22]Ye Y, Zhu L, Ma Y,etal. Synthesis and evaluation of new iRGD peptide analogs for tumor optical imaging [J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(4): 1 146-1 150
[23]Sugahara K N, Teesalu T, Karmali P P,etal. Tissue-Penetrating delivery of compounds and nanoparticles into tumors [J]. Cancer Cell 2009, 16(6): 510-520
[24]Sugahara K N, Teesalu T, Karmali P P,etal. Coadministration of a tumor-penetrating peptide enhances the efficacy of cancer drugs [J]. Science, 2010, 328(5 981): 1 031-1 035
