中国药品定价和补偿政策及其效果
2017-04-10JiaHuEliasMossialos
Jia Hu,Elias Mossialos
英国伦敦政治经济学院英国伦敦
中国药品定价和补偿政策及其效果
Jia Hu*,Elias Mossialos
英国伦敦政治经济学院英国伦敦
背景:近年来,中国药物政策存在着药品费用快速增长,以及质量、定价和提供能力等方面的问题,其解决的关键在于理清其中的定价和补偿问题。方法:本文较为系统收集了药物领域的学术文献和灰色文献,以及中国政府的官方统计数据,并结合中国国务院发展研究中心举办的研讨会信息,概述了中国的药品定价和补偿情况。结果:通过一个融合了供应方、代理方和需求方多方政策的框架,分析了定价与补偿政策。在目前药品政策的相互影响下,出现了药品价格高、质量低、不合理开药等问题。分立的监管环境也不利于药品政策的改革。结论:提高药品质量标准、市场集中度、政府补贴,以质量为导向的招标、扩大零差率政策的实施范围、建立补偿与合理开药的联动机制以及促进卫生技术评估与比较效能研究来改善定价和补偿政策。另外,整合广泛的监管分立体制、改善透明度和打击腐败等问题将有助于确保制定出具有一致性的、循证的政策。
药品政策;定价;补偿;中国
1 引言
药品支出占中国卫生保健总支出的40%,远远高于OECD国家的平均水平(19%)。[1,2]2000—2012年,药品支出以平均每年14%的速度快速增长。[2]按照价值排位,预计2017年中国将成为世界第二大药品市场。[3]在药品质量、可及性或覆盖范围方面,这个支出水平不一定会产生最佳回报。虽然,中国正致力于从多方面改革药品政策,但由于缺乏一致的政策策略,改革面临巨大挑战。
药品政策的两个主要方面是定价和补偿,定价指如何确定药品的价格,而补偿则关系到保险方如何以及在什么范围内补偿。中国的定价和补偿政策不仅影响了药品的可及性和支付能力,也关系着卫生服务体系其他领域的改革,包括医保覆盖范围、药品质量和医院改革。2009年,中国颁布了深化医药卫生体制改革方案,其中药品政策是五大支柱之一。[4]尽管已进行多项改革,但是目前中国的卫生体系依然面临许多问题。比如,监管分立带来了各级政府和各部门间不明确;卫生服务和药品覆盖间的巨大差异引起了可支付性问题;药品制造和分销行业分立引起的质量和定价问题;定价和补偿政策无法激励合理的药品生产和处方行为。
本文概述了中国药品和卫生服务体系环境的复杂性和面临的挑战,重点介绍了定价和补偿政策,并采用一个融合了供方、代理方和需方多方政策的框架,将造成高药品成本和低药品质量的因素概念化;最后,提出了改善定价和补偿决策流程的政策建议。
2 资料与方法
本文采用结合了四大数据流的多方位分析方法,包括系统性综述和叙述性综述相结合的综述、中国政府文件和统计手册、一系列医药政策研讨会总结、实地调研资料和访谈资料。
系统性综述和叙述性综述相结合的综述是一种系统性文献检索方式,包含叙述性整合和分析的混合方法,旨在批判性地评价和总结药品定价和补偿的可用证据。综述资料来源于英文学术文献和灰色文献,尤其是来自市场研究公司和多边机构的报告。当关于某个主题的学术文献非常有限时,而灰色文献报告采用广泛的方法,并提供大量证据时,这被认为是合适的。学术文献检索范围是2005年—2015年9月之间的出版物,主要来自于MEDLINE(生物医学数据库),EconLit(经济学数据库)和商业资源全文数据库(企业数据库)。同时,也审核了主要文章中参考文献,以鉴定其他出版物;还采用类似的检索词汇对2010—2015年的灰色文献报告进行审核。综述的第二部分涉及与药品政策相关的政府文件、新闻资料和政府统计手册等中文文献。此外,本文也借鉴了作者所在学术部门和中国国务院发展研究中心组织的关于中国药品政策的一系列研讨会中的见解和材料。所借鉴的三个联合研讨会分别是:2014年在北京召开的研讨会,2014年10月在伦敦召开的研讨会以及2015年6月在北京召开的研讨会。研讨会之后,通过对出席研讨会的专家和中国药品政策方面的其他专家进行有针对性的半结构化访谈,并对研讨会40多份报告和访谈信息进行了总结。比如,涉及健康保险的机构会被问到关于保险覆盖水平的问题,而涉及定价的机构会被问到更多关于招标和其他定价政策。
3 中国卫生服务体系的背景与医药环境
3.1 中国卫生服务体系的背景
20世纪80年代初,随着市场经济的推行,公共投入大幅减少。1978—2001年,中央政府卫生支出占卫生总费用的比例由32%下降至15%,个人卫生支出(OOP)占比从20%上升至58%。[2]20世纪80年代晚期至90年代,政府允许医院和医生加价15%销售药品,来弥补资金的不足。政府对医院和医生基本工资的直接补贴较低,因此鼓励医生销售药品,以提高医院收入;与此同时,医生可以从其部门或整个医院的药品销售收入中获取相应的奖金,从而大大提高个人收入。[5]
随着人们对中国卫生服务体系状况的普遍不满,中国政府于2009年4月启动了新一轮医药卫生体制改革。[6,7]其中,对药品市场的改革中,政府寻求制定涵盖药品开发、注册、制造和分销,以及定价和补偿等方面的政策。编制基本药品目录(以下简称基本药物目录)旨在确保能够在全国范围内提供基本、高质量、低成本的药品。
3.2 中国的卫生服务和药品支出趋势
目前,中国卫生支出占国内生产总值(GDP)的5.4%,显著低于OECD国家的平均水平(9.3%),低于金砖国家中的巴西(10%)、俄罗斯(7%)和南非(9%),但高于印度(4%)[8,9]。在过去几十年,卫生支出总额(THE)和药品支出总额(TPE)快速增长。自2000年以来,THE的增长速度超过TPE的增长速度。[2]TPE占THE的比例由60%逐渐下降为40%左右[2],但仍高于巴西(12%),俄罗斯(18%)或印度(26%)[9-12]。TPE占GDP的比例(2.28%),显著高于OECD国家的平均水平(1.5%)。[1,2]此外,尽管全国范围内THE有所增加,但各省间差异显著。
与其他国家不同的是,中国大部分的药品是在医院而不是在药店购买。[13]2012年,按照价值划分,中国69.6%的药品是在医院出售,在药店出售的仅有31.4%。[2]在欧洲国家,医院药品市场仅占药品市场总额的13%~26%。[14-16]
医院药品支出历年来受药品销量和价格提高的驱动。[17]近年来,销量增长超过价格增长,但价格仍然非常高。药品支出增长的一部分原因是医保扩面带来的需求释放。15%的药品加成政策也推高了药价和激励医生过度开药。此外,担心国产仿制药质量的患者会购买更加昂贵的专利过期的原研药(抬高价格)。与临床结果无关的药品补偿政策可能会导致不合理开药或不必要的药品需求(抬高销量)。
3.3 卫生服务的治理和监管结构
对卫生服务的监管分散在多个部委,而所有这些部委都受国务院的领导。不同部委之间交叉的责任分工和中央部委与省级/区域级别的部门之间垂直的责任分工存在显著的协调障碍,导致无法制定并执行一致的政策。比如,不同的部委对如何有效制定国家药品招标准则持不同意见,而省级政府有自由裁量权执行各项政策,从而导致各省存在显著的差异。[18-21]监管责任分散使得卫生服务体系更加缺乏透明度,表现在:国内和国外药品制造商进行充分的协商、决策的不可预测性[22];开药行为和支出方面的可用数据非常有限。腐败也是一个严重问题,为遏制腐败,国家卫生计生委出台了《关于印发加强医疗卫生行风建设“九不准”的通知》,禁止医生收取患者或公司的回扣。[23]尽管近年来已进行了改革,但是,药企向医生提供回扣的现象仍然存在。
3.4 医疗保险机制和可支付能力
加大医疗保险覆盖范围是药品可及性的重要组成部分。新一轮医改已经使医保基本实现了全覆盖,但覆盖深度和广度仍然存在巨大差异[25]。中国的三大医疗保险制度各自覆盖特定的人群,并且其基金池相互独立。由于三类医疗保险制度的筹资水平不同,覆盖内容、共付水平、起付线和补偿上限的差异显著[4,26-29]。由于地方政府提供的医保缴费补贴差异,保障水平取决于当地的经济发展程度。此外,三种制度的转移接续问题,使得大量的农民工对卫生服务的可及性较低。[30]这些因素导致卫生服务和药品的个人支出处于高位。比如,约12.9%的中国家庭在2011年经历了灾难性卫生保健支出。[29]两项研究表明,每日药品支出可能是低工资人员每日工资的数倍。[31,32]
3.5 药品制造和销售流通体系分散
中国的药品制造和分销行业高度分散。2011年,有4 629家药厂,而前5大药厂合计市场份额仅13.2%。[1,33]面对如此众多的药品制造商,仅靠某个或几个部门难以有效监管,药品质量也难以得到保障。中国药品流通企业超过13 853家,而在美国只有75家。[13,34]中国前三大分销商仅占22%的市场份额。[34]同样,中国前四大连锁药店仅占5.1%的市场份额。[35]由于在供应链中层层加价,患者支付的价格可能是出厂价格的5~10倍。[24]
4 定价和补偿政策综述
药品从市场授权到患者的过程如图1:第一步是获取食品药品监管总局的批准和市场授权。获批之后,药品需要列入基本药物目录或国家医保药品目录(NRDL)。最近,中国已开始出台重大疾病计划,将重大疾病的昂贵药品列入这两大补偿目录;这个计划可能将一些新药列入。
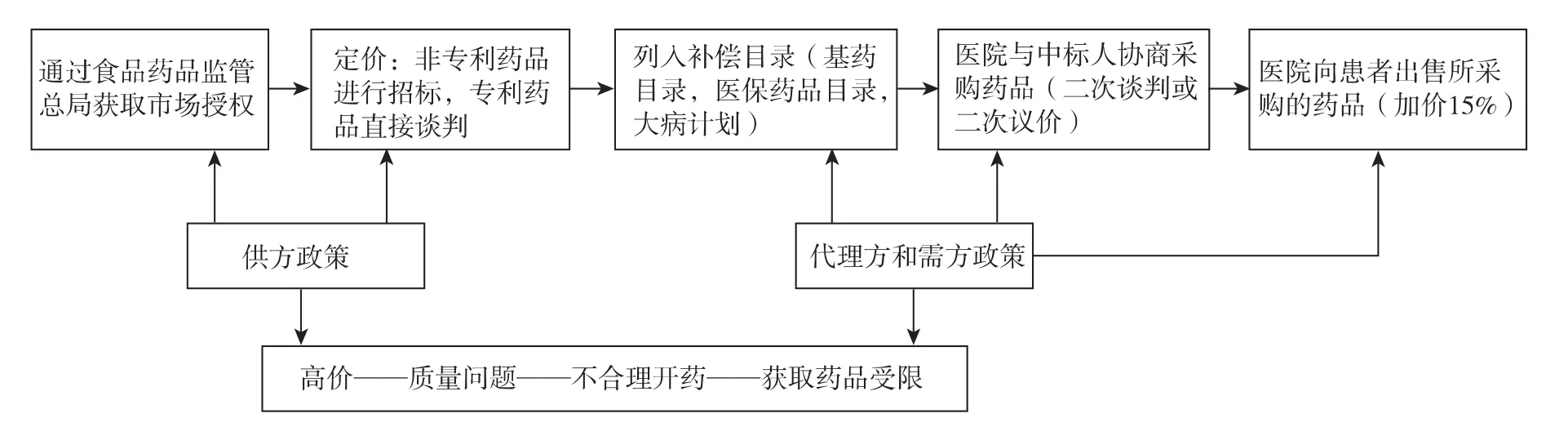
图1 药品从市场授权到患者使用,以及相关的供方、代理方和需方的政策过程
其后的药品定价很大程度上通过招标(针对非专利药品)或直接谈判(针对专利药品)确定。在这两种情况下,药品质量在定价过程中起到重要的作用。本文重点关注医院的招标,因为这是最大的市场。在宣布中标者之后,个别医院在被称为“二次议价”的过程中与药厂建立联系。实际上是在二次议价时确定药品价格,这时,医院获得的价格通常低于中标价格。最后,医院将药品直接加价15%销售给患者。从药厂到医院这条供应链中可能涉及多家分销商,并层层加价。基层医疗卫生机构和药店的定价过程略不同。各省为其所有的基层医疗卫生机构直接向中标者采购[22],而药店能够绕过招标过程直接与药厂谈判[22]。
通过一个融合了供方政策、代理方政策和需方政策的框架来分析定价和补偿有助于在目前的体系中将挑战概念化。[36]供方政策包括市场授权过程和药品质量监管以及直接定价政策。代理方政策指影响作为患者代理方的卫生保健供应商确定患者用药的因素。需方政策指直接影响患者需求(比如补偿目录)的因素。
4.1 供方政策
4.1.1 市场授权推迟
虽然影响市场授权和药品质量的政策不是直接的定价和补偿问题,但在中国,其对药品价格有着显著的影响。比如,推迟批准新药会导致药品价格升高,患者无法获取重要的药品。市场分散已导致许多公司寻求获取相同仿制药的批准。2014年,227种小分子药中有10个或以上的新药申请,而8种小分子药中有100个以上新药申请[37]。因此,2014年总共有8 868个新药申请,这导致等待批准的申请积压数达18 597个。[37]为了规避价格上限或下调,一些药品仅仅在改变不重要的配方或名称之后便能取得批准。[38,39]卫生技术评估(HTA)或疗效比较研究(CER)在指导哪些药品应该优先审批方面没有发挥作用。因此,临床上优于现有治疗方法和即将过专利期的新仿制药往往无法得到及时批准,因此,损失了新药的临床效益,同时,无法节省实际上需要节省的仿制药成本。
4.1.2 低药品质量对定价的影响
监管标准不完善和市场过度分散引起的药品质量低下,是导致药品价格上升和对患者造成伤害的另一个主要问题。直至最近的专利过期药品仍能够根据其他仿制药而不是原研药进行生物等效性试验来获取批准。这种监管规范在维持药品质量方面是有问题的,因为专利过期的原研药和仿制药在溶出曲线上往往有显著的差异。[40]虽然药厂必须通过《药品生产质量管理规范》认证,但是在执行过程中有相当大的差异。[41,42]每一检验年,只有一小部分厂商会被检验。这种环境已导致了一些质量问题。[43]2015年,食品药品监管总局颁布了更严格的生物等效性标准,要求必须根据专利过期的原研药进行仿制药的试验。[44]
另外,人们对药品质量的担心让跨国公司生产的昂贵的专利过期原研药有大量的市场需求。[45]调查表明,专利过期的原研药价格可达到国产仿制药价格的10~20倍[31,32,46]。一项关于2002—2011年间中国药品价格的大型调查表明,专利过期的原研药和国产仿制药有40%的平均价差。[40]因此,国产药品质量的低下提高了跨国公司生产高质原研药的需求,从而导致药品平均价格上涨。
4.1.3 价格上限和价格下调
为应对药品价格每年以高于两位数字的速度增长的趋势[38],政府设定了不同产品的价格上限和价格下调规定。1997—2013年,政府颁布了超过30项药品价格控制措施。[47]但是,大量的证据表明这些政策作用有限。虽然目标药品的价格平均下降了15%~20%,但是,药品支出总额仍稳定增长。[47]一项关于1996—2005年抗生素价格差距的研究表明,目标抗生素的价格下降了47%,但是,抗生素的支出总额上升了205.7%。[48]由于受加价15%政策的鼓励,医生通过更换更昂贵的抗生素或开更大量的药品来规避价格上限。[48]由于这些价格控制措施不起作用,国家发展改革委在2015年6月废除了价格上限规定。[49]即便价格上限规定已被正式废除,但有时仍然为了招标而下调价格,在各轮招标中甚至强制下调价格。[21]
4.1.4 招标
按省份进行的招标已成为遏制药品价格上涨的主要机制,只有中标的公司有权在省内销售中标药品。政府会进一步强制医疗卫生机构购买中标公司的大部分(约80%)药品。[50]2009—2010年,招标已成功将基本药物目录药品价格平均下调了25%,在一些省份,下调幅度超过50%。[51]
中国各省通过不同的“双信封”(质量与价格)招标制度确定中标企业。然后,采用综合得分确定中标企业。在一些省份,只有1家公司能中标,而在另外一些省份,最多可以有3家制造商中标[22]。如何平衡价格和质量,以及采用的招标分类数量,各个省份有显著的差异。比如,大部分省份将专利过期的原研药和仿制药分开招标,其依据认为原研药的质量较高。当专利过期的原研药可能是一个招标类别中的唯一产品时,竞争会较少,因此,价格下降压力不大。但即便在仿制药类别中有被认为质量较高的药品,比如,首次上市的仿制药,有时也只能在仿制药招标类别中进行竞标。[22]
尽管通过招标能够降低价格,但是招标政策已受到一些质疑,尤其是其过分强调价格优先这一点,因为这会导致无法生产足够数量的药品,或生产的药品质量低下。另一个受批评的是,中标的公司往往只有一家,这将会导致垄断,若中标的公司陷入生产困境,还会导致供给不足[52]。还有,招标与采购并不关联即“量价不挂钩”。因此,医院必须在招标结束之后与药厂通过二次谈判来确定具体的药品量和价格。[24]由于认识到这些问题,中国的招标制度目前正在进行重大改革,尤其是在质量评估和二次谈判方面。2015年上半年,国务院和国家卫生计生委颁布了若干个关于招标过程的关键政策指南文件。[53,54]
质量评估是招标改革中讨论的最重要的问题之一。[22]质量评估一直强调质量的权重应更高。在药品市场较为成熟的国家,根据严格的生物等效性试验和GMP标准,所有的仿制药与原研药在质量上被认为是一样的。由于中国在生物等效性试验和GMP标准方面的不足,真正的质量评估是非常困难的。比如,某省份的质量评估计分卡由15个评估项目组成,其中大部分项目是基于公司的信誉、收入和由政府各部门而不是客观的药品质量数据确定的行业排名。[21]事实上,15个标准中只有4个与GMP或质量有关,而其余的都是基于主观排名、年度销售额或公司信誉。
关于招标过程中省级价格比较方面,许多新药投标者呼吁根据以前全国招标的平均价格或最低价格确定价格上限。[22]历年来,中标价格和二次议价属于保密信息,现在,国家趋于呼吁中标价格和二次议价更加透明化。[55]中标价格透明化对确切的价格比较至关重要,因为中标价格而非竞标价格,才是医院实际支付的价格[22]。上海、北京和浙江属于第一批引入透明化采购流程的城市,同时,在2015年末,国家卫生计生委为搭建全国集中招标平台奠定了基础。[56,57]网络平台的出现和集中采购将促进透明化和价格合理化。
4.1.5 专利药品的国际参考定价和谈判
2012年,国家发展改革委要求一些跨国制药公司提供其产品在10个国际市场上的价格。该次调查表明,虽然60%的药品价格在国际价格范围内,但是,其中一半处于全球药品价格的高价位。[24]此外,20%的药品在中国的价格比其在全球其他地方的价格都更昂贵。2015年7月,国家发展改革委出台的一份文件表明,跨国公司必须提供其药品在原产地英国、法国、荷兰、欧洲其他12个国家、美国以及在亚洲和非洲市场上的价格[58]。虽然尚未正式宣布国际参考定价,但是,收集此类数据将为下一步改革铺平道路。虽然目前专利药品市场规模较小,但是,预计未来会迅速增长。[45]国家卫生计生委正在制定国家专利药品价格谈判指南。将以历史采购和零售价格作为定价依据,再进一步参考省际和国际参考定价[59]。
4.1.6 卫生技术评估(HTA)和疗效比较研究(CER)
卫生技术评估(HTA)和疗效比较研究(CER)在中国比较新颖。2009年深化医改方案要求,制药公司寻求新药批准时,应增加卫生经济学数据。[60]2010年,中国国家健康发展研究中心和英国国家健康和护理研究所(UK National Institute of Health and Care Excellence)签署了一份聚焦临床路径和指南的谅解备忘录。[61]国家卫生计生委目前正在制定可以制度化的国家HTA指南。[29]浙江省卫生计生委设立了药品经济评估委员会,以在招标定价过程中提供协助。[21]总的来说,虽然已经进行了HTA的研究和试点,但其尚未被广泛纳入政策。[62]CER不考虑经济情况,审视各种疗法在临床疗效方面的差异。虽然在方法论上,CER较HTA容易,但其尚未被广泛应用于定价或补偿决策中。
4.2 代理方政策
4.2.1 二次议价
为了确定交易量,药厂和医院需要进行二次议价,这往往导致最终价格低于中标价格。二次议价的主要问题是,招标价和二次议价的差价将被分配给医院和医生或中间机构。若允许将差价给医院,则可以看作是为了促进谈判效率,但这有可能鼓励医院购买昂贵的产品,等于允许变相加价。[22]因此,二次议价一直颇受争议。部分部委支持这项政策,推出了各种试点。一些部委则反对这项政策[22],并颁布文件呼吁禁止二次议价或至少将所节省的差价交给政府[54]。
4.2.2 15%药品加成和零差率
15%加成政策一直是代理方主要的推动力,并鼓励过量开药。为了应对这项政策造成的问题,政府推出了药品零差率政策。社区卫生服务机构已普遍实施药品零差率政策。此外,超过一半的县级医院和几十家城市试点医院也已实施这项政策。[63]在2015年医改工作计划中,政府要求所有的县级医院在2015年底前实施药品零差率政策,所有城市医院在2017年前实行这项政策[64]。由于医院的大部分收入来源于药品销售,因此,实施这项政策极具挑战性,同时将需要显著提高政府直接补贴,或提高医疗服务费。
尽管,政府补贴不足以弥补药品收入的损失,在目前的资金水平下,药品零差率政策的可持续性比较脆弱。[51,65]目前多项研究表明,零差率政策使基层医疗卫生机构药品收入减少药品价格下降,不合理开药现象减少,服务量增加。[66-69]城市医院在实施药品零差率政策之后,药品收入减少,而服务相关的收入增加,政府补贴增加,仍无法足额弥补零差率减少的损失。[70,71]在较高级别医院进行药品零差率政策试点的范围有限,尚未取得具体的证据,不过,国家卫生计生委、财政部和国务院最近宣布的城市医院试点评估表明了不同结果[72]。
4.3 需方政策
4.3.1 基本药物目录
基本药物目录最初针对基层医疗卫生机构,而最终将扩大至医院。[4]2009年首次发布国家基本药物目录,并在2012年进行更新,预计在2015年会再次更新。[22]将药品列入基本药物目录的标准包括临床必要性、有效性、安全性和可购性。2009年的基本药物目录包含了205种西药和102种中药,并允许各省份适度补充,共有3个省份补充了化药200多种,16个省份补充了100~200种,10个省份补充了0~ 100种,只有2个省份无补充。[73]一项研究表明,基本药物目录核心的药物一般都根据列入标准适当列入,但各省补充的药物通常不适当。[74]为了应对各省对基本药物目录大范围调整,中国政府将2012年基本药物目录上的药品增加至317种化药和203种中成药,但规定各省只能进行小范围变更。
原则上,中国的三大医疗保险制度均覆盖基本药物目录上的全部药物。事实上,由于自付额和保险封顶线不同,药物覆盖率取决于不同地区的资源情况。2012年,基本药物目录化药的平均价格下降了16.9%,基本药物目录的实施似乎已成功降低了药品价格。[74]一项针对中国3个省份的评估发现,不合理开药现象有所减少,这可能是对基本药物目录药物实施零差率政策的结果。然而,此次评估也发现,药品供应的可靠性下降,社区卫生服务机构的收入减少。[75]一项有关陕西省的研究表明,2010和2012年,部分基本药物目录药物在公立医院和私人药房的可购性相对较低(普遍<50%)。[31,32]政府认为基本药物目录在中国的医药体系发挥着越来越重要的作用。若按照价值划分,预计2020年底基本药物目录将占中国药品市场28%的份额。[45]
4.3.2 国家医保药品目录
与基本药物目录相比,国家医保药品目录是时间较早、覆盖范围较大且比较标准的补偿目录。基本药物目录药品和国家医保目录药品的区别包括:基本药物目录药品补偿水平较高,对基本药物目录药品强制实施零差率政策,两者的管理部门不同。国家医保药品目录编制于2000年,并在2004和2009年更新。2009年版的医保药品目录包含了1 140种西药和987种中成药,覆盖范围显著比基本药物目录的大。医保药品目录将药品分为甲类药和乙类药。[76]甲类药(349种西药和154种中成药)是疗效较好的基本药品,价格较便宜,且能够完全补偿。2009年版的基本药物目录中的全部药品都在医保目录的甲类药品目录中。医保药品目录中的乙类药(791种西药和833种中成药)不是基本药品,各省的分摊付款额水平也不同。各省根据医保药品目录编制各自的省级补偿目录。所有的甲类药品必须列入省级补偿目录,但可根据当地需求对15%的乙类药进行更改。医保药品目录的补偿水平差异显著。一些省份编制一份不同于国家医保药品目录,覆盖范围较小,如由新型农村合作医疗保险承保的药品目录[77]。
除了覆盖范围不同之外,医保药品目录的另一个主要问题是很少更新。本应该每两年更新一次,但最近一次更新是在2009年。①2016年10月,人力资源和社会保障部发布关于《2016年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案(征求意见稿)》公开征求意见的通知,要求2016年底前完成医保药品目录调整工作[78]两次更新时间间隔延长意味着,新药品的批准和补偿时间间隔延长4~5年。[79]2009年以来,无新药列入医保药品目录,因此,2003—2013年在中国获批的360种新分子药品中,只有76种(21%)被列入医保药品目录。[79]没被列入医保药品目录的药品不能获得补偿。
4.3.3 重大疾病保险计划
重大疾病保险计划作为一种覆盖昂贵专利药品的保险首先出现在比较富裕的省份和城市。除了基本的医疗保险补偿限额之外,这些计划还针对有新的或昂贵的治疗方法的疾病,比如癌症,提供补充性保险。政府正在考虑让商业保险公司经办这些医保计划[29]。2015年7月,李克强总理在一次国务院高层会议上宣布,到2015年底,重大疾病保险计划的省级试点研究应该扩大至全国,且至少覆盖50%的药品,并于2017年底实现全面覆盖。[80]截至2015年底,重大疾病保险计划仍然在制定中。
4.3.4 补偿上限
补偿上限是一项内部参考定价政策,旨在代替价格上限。[49]补偿上限的一种潜在用途是缩小专利过期的原研药和仿制药之间的价差。福建省三明市是积极推行补偿上限政策的一个试点。对14种化药执行补偿限制,这14种化药的国产仿制药和跨国公司制造的原研药质量差异较小。补偿上限的设定为,最便宜的国产仿制药的补偿上限显著低于跨国公司制造的原研药的价格。这项举措被认为能促使跨国公司自愿大幅降价[59]。虽然缩小价差是一个重要目标,但是要想在更广范围内实施需要考虑质量。
补偿上限也可以用来指导医生开药(比如,只补偿适当的药品)和提高药品质量(比如,质量较高药品的补偿更高)。虽然政府正在强力推行补偿上限,但是实际执行情况仍然模糊不清。各部委的责任划分仍然不清晰,有人主张应由作为主补偿人的人力资源社会保障部牵头;而有人主张应由具有丰富专业知识的国家卫生计生委牵头。[22]如何设定补偿水平是一个更加复杂的问题。国家发展改革委宏观经济研究院公布的一份文件表明,药品成本、药品质量和中标价格可能都会纳入补偿水平,但缺乏明确的指导[81]。
5 改善决策环境的政策选择
基于上文分析,很明显,中国的药品决策环境存在药品质量低、药品批准流程不完善、监管乏力等问题。制造和分销市场过度分散,导致质量低下,价格高昂。政府对医疗卫生的直接投入仍然较低,导致医疗卫生机构不得不依赖药品销售收入。从供方的角度来看,招标往往不重视质量,而且很少运用HTA和CER。从代理方的角度来看,药品15%加成政策正被废除,但实施零差率政策有连锁效应,必须密切监测。从需方的角度来看,目前的补偿政策无法指导合理开药。最后,整体监管环境存在责任分散、缺乏透明度和腐败等问题。建议通过以下措施改善中国医药环境。
5.1 改善审批流程和提高质量标准
改善药品审批流程和提高药品质量标准至关重要。食品药品监管总局应出台较高的生物等效性标准和较高的GMP标准来提高药品质量(比如,只根据原研药进行生物等效性试验)。这些较高的标准应与增强的检验能力相匹配。食品药品监管总局最近一直致力于简化审批流程,以解决审批积压问题[44]。2015年5月,食品药品监管总局宣布提高新药申请注册费,这有助于为增加的工作量提供资金,同时也能阻止外来药品申请。[83]
5.2 提高市场集中度
制造商分散导致质量问题,进而带来不良健康结果、跨国公司的原研药和国产仿制药存在较大价格差异、以及食品药品监管总局的监管负担加重等问题。同时,分销链分散导致了层层加价,从而显著加大了零售价与出厂价之间的价差。鼓励并购的行业政策有助于提高市场集中度。这些政策包括让收购融资变得容易,制定有利于兼并的税收政策,以及(最重要的一点)不再扶持弱势企业。食品药品监管总局提高质量标准,限制对不必要药品的审批,并实施以质量为导向的招标制度和补偿制度也将迫使规模较小、质量低下的制造商退出市场。巩固药品市场迫在眉睫,但非常困难,因为地方对弱势企业实施保护主义。因此,强大的政治意向是必要的。
5.3 具有针对性的政府补贴
有必要多个层次提高政府财政补助。随着零差率政策的实施,医院药品收入不断下降,需要更多的财政支持,同样,也需要提高医生的工资,以抑制过度开药或过度诊疗行为。医院和医生的奖金应与鼓励合理开药和更佳的临床实践的业绩目标挂钩。应该用与医生临床护理表现相关的奖金替代目前与药品销售有关的奖金。最后,有必要提高政府资助,以扩大补偿覆盖的深度,尤其是新型农村合作医疗保险和城镇居民基本医疗保险。鉴于地方政府贫富差距大,中央政府的转移支付非常重要。
5.4 完善招标政策
招标对降低价格非常有效,但制造商往往会降低药品质量,因为质量在招标决策公式中所占的权重不高,且质量标准与公司规模、排名和销售收入有关。但是,质量标准应关注客观的药品质量数据,比如,生物等效性结果和GMP检验结果。各省应通过具有准确价格数据(招标和二次议价数据)的网络平台促进透明化。另外,总体质量标准与发达国家标准更具有可比性时,招标也就能更重视价格。
5.5 零差率和合理的补偿政策
药品零差率对消除15%加成政策产生的负面激励效果至关重要。基层医疗卫生机构和县级医院的实践表明,零差率政策有效减少了这些医疗卫生机构对药品收入的依赖。政府应继续将这项政策扩大至更高级别的医院。然而,在政府不提供财政补助弥补药品收入损失的情况下,有证据表明,医生通过看更多患者来提高收入,制定补偿上限可促进合理开药和提高药品质量。同时定期更新补偿目录,尤其是国家医保药品目录,让患者能获取新药,是非常重要的。
5.6 鼓励在整个卫生服务体系内使用HTA和CER
应鼓励在卫生服务体系多层次使用HTA和 CER。从监管的角度来看,它们可指导优先批准哪些药品。从供方的角度来看,HTA和CER可用来作为价格谈判指南。从需方的角度来看,使用HTA或CER进行基于价值的补偿,有助于医生合理开药。虽然,HTA和CER具有挑战性,可能需要很多年才能纳入体系,但是,政府已开始采取措施进行探索。
5.7 改善整体监管环境
在治理分散、缺乏透明度和腐败的监管环境下,实施上述6条建议面临着重重障碍。应以相互协调和透明化的方式制定政策。制定涉及所有主要政府利益相关者的药品战略,并用来指导总体改革的国家医药战略尤为重要。应收集更多关于药品价格和处方行为的数据,以对目前的改革评估提供指导。继续控制政府官员、医院和医生的腐败,对有效实施医药政策改革至关重要。
由于需要巨大的政治资本,对整体监管环境进行改革将会是中国面临的最困难的任务之一,但这方面存在乐观迹象,比如公开讨论将中国三大保险制度之中的两大保险制度合并,以简化和合并补偿程序;政府一直加大力度,推进建设更加集中的、甚至单一的国家招标制度等。
[1]OECD.Health at a glance 2013-OECD indicators[R].Paris,2013.
[2]National Health Development Research Center.China National Health Accounts Report[R].Beijing,2013.
[3]IMS Health.The global use of medicines:outlook through 2017[R].London,2013.
[4]Yip WCM,Hsiao WC,Chen W,et al.Early appraisal of China's huge and complex health-care reforms[J].Lancet,2012(379):833-842.
[5]Ran L M,Luo K J,Wu Y C,et al.An analysis of china's physician salary payment system.Journal of Huazhong University of Science and Technology[J].Medical Sciences,2013(33):309-314.
[6]Chen Z.Launch of the health-care reform plan in China[J].The Lancet,2009(373):1322-1324.
[7]Central Committee of the Communist Party and State Council.The standing conference of State Council of China adopted guide-lines for furthering the reform of health-care system in principle[EB/OL].[2015-07-01].http://news.xin-huanet.com/newscenter/2009-04/06/content11138803.html
[8]OECD.How does China compare?[R].Paris,2014.
[9]WHO.WHO Global Health ExpenditureDatabas[EB/OL].[2015-05-02].http://apps.who.int/nha/database/View-Data/Indicators/en
[10]McKinsey.India Pharma 2020[R].Mumbai,2014.
[11]Deloitte.2015 life sciences outlook Brazil[R].Sao Paulo,2015.
[12]BMI Research.Russia Pharmaceuticals&Healthcare Report[R].London,2015.
[13]Center for Health Statistics and Information.China health statistical handbook[R].Beijing,2013.
[14]Tordoff J M,Norris P T,Reith D M.Price management and its impact on hospital pharmaceutical expenditure and the availability of medicines in New Zealand hospitals[J].Value Health,2008(11):1214-1226.
[15]Mossialos E,Oliver A.An overview of pharmaceutical policy in four countries:France,Germany,the Netherlands and the United Kingdom[J].International Journal of Health Planning and Management,2005(20):291-306.
[16]LopezBastida J,Mossialos E.Pharmaceutical expenditure in Spain:cost and control[J].International Journal of Health Services,2000(30):597-616.
[17]IMS Health.IMS market prognosis:China[R].London,2014.
[18]NDRC.The current status,existing problems and reform recommendations of China's pharmaceutical production and distribution system[R].NDRC,2014.
[19]State Council.State Council Organization chart[EB/OL].[2015-04-15].http://english.gov.cn/statecouncil/2014/09/03/content 281474985533579.htm
[20]Wang K,Lin G.Pharmaceutical IP and competition law in China:overview[R]Shanghai,2014i.
[21]McTiernan R.Au revoir to Anhui?China's shape-shifting tenders[R].Shanghai,2014.
[22]State Council Development Research Center.Development Research Center joint seminars[R].Beijing,2015.
[23]NHFPC.Prohibition on 9 unethical conducts to strengthen morals in the healthcare industry[R].Beijing,2013.
[24]State Council Development Research Center.Development Research Center joint seminars[R].Beijing,2014.
[25]Chen Z.Early results of China's historic health reforms: the view from minister Chen Zhu.Interview by Tsung-Mei Cheng[J].Health Affairs,2012(31):2536-2544.
[26]Barber S L,Yao L.Health insurance systems in China:a briefing note[R].Geneva,2010.
[27]Niu L.Healthcare in China:a Kieger report on the Chinese healthcare market[R].Zurich,2015.
[28]Hsiao W,Li M,Zhang S.Universal health coverage:the case of China[R].Geneva,2014.
[29]Meng Q,Yang H,Chen W,Sun Q,Liu X.People's Republic of Chinahealth system review[R].Geneva,2015.
[30]Gong P,Liang S,Carlton E J,et al.Urbanisation and health in China[J].Lancet 2012(379):843-852.
[31]Jiang M,Yang S,Yan K,et al.Measuring access to medicines:a survey of prices,availability and affordability in Shaanxi province of China[J].PLoS ONE,2013,8 (8):e70836.
[32]Jiang M,Zhou Z,Wu L,Shen Q,et al.Medicine prices,availability,and affordability in the Shaanxi Province in China:impli-cations for the future[J].International Journal of Clinical Pharmacy,2014,37(1):12-17.
[33]IBIS World Industry Report.Pharmaceutical manufacturing in China[R].Beijing,2015.
[34]Tse E,Pan P,Sun S,Ma K.Changing landscape of China'spharmaceu-ticaldistributionindustryShanghai[R].Beijing,2012.
[35]IBIS World Industry Report.Pharmacies&drugstores in China[R].Beijing,2015.
[36]Mossialos E,Mrazek M,Walley T.Regulating pharmaceuticals in Europe:striving for efficiency,equity and quality[M].Berkshire:Open University Press,2004.
[37]CFDA Center for Drug Evaluation.2014 annual report on drug review[R].Beijing,2015.
[38]World Bank.Financing,pricing,and utilization of pharmaceuticals in China:the road to reform.Washington DC,2010.
[39]Qi M.The analysis of Chinese drug safety supervision and management[J].Chinese Law and Government,2012 (45):3-8.
[40]Hu S,Zhang Y,He J,et al.A case study ofpharma-ceutical pricing in China:setting the price for off-patent originators[J].Applied Health Economics and Health Policy,2015(13):13-20.
[41]Vincent D W.Quality and compliance in the Asian pharmaceutical industry[EB/OL].[2015-08-08].http://www.ivtnetwork.com/article/quality-and-compliance-asian-pharmaceutical-industry
[42]Sun Y.The situation on GMP and regulatory compliance for APIs manufactured in China.Beijing:Beijing CHNMED Pharmaceutical Consulting[R.]2007.
[43]US-China Economic and Security Review Commission.2014 report to congress of the US-China Economic and Security Review Commission[R].Washington DC,2014.
[44]CFDA.On soliciting public opinions regarding policies to expedite the reduction of drug registration application backlog:Document#140[R].Beijing,2015.
[45]Boston Consulting Group.New rules for winning in China's pharmaceutical market[R].Hong Kong,2014.
[46]Wang X,Fang Y,Yang S,et al.Accesstopaediatric essential medicines:a survey of prices,availability,afford-ability and price components in Shaanxi province,China[J].PLOS ONE,2014,9(3):e90365.
[47]Wu B,Zhang Q,Qiao X.Effects of pharmaceutical price reg-ulation:China's evidence between 1997 and 2008[J].Journal of the Asia Pacific Economy,2014,20(2): 290-329.
[48]Han S,Liang H,Su W,et al.Can price controls reduce pharma-ceutical expenses?A case study of antibacterial expenditures in 12Chinese hospitals from 1996 to 2005[J].International Journal of Health Services,2013,43(1): 91-103.
[49]NDRC.Promoting reform of the current drug pricing scheme[R].Beijing,2014.
[50]Yang C,Lei L.Drug procurement bidding[R].Washington DC,2010.
[51]Hu S.Essential medicine policy in China:pros andcons[J].Journal of Medical Economics,2013,16(2): 289-294.
[52]Barber S L,Huang B,Santoso B,et al.The reform of the essential medicines system in China:a comprehensive approach to universal coverage[J].Journal of Global Health,2013,3(1):10303.
[53]State Council.Implementing and improving centralized bidding and procurement of drugs[R].Beijing,2015.
[54]NHFPC.Implementing and improving centralized bidding and procurement of drugs[R].Beijing,2015.
[55]Pharmnet.Perspective on new tendering platforms in three provinces:will drug prices collapses?[EB/OL].[2015-01-13].http://news.pharmnet.com.cn/news/2015/07/09/423811.html
[56]Sai B.NHFPC:transparent tendering and secondary negotiations[EB/OL].[2016-01-30].http://info.pharmacy.hc360.com/2015/10/220858577827.shtml
[57]Pharm Net.Three provinces to centralize tendering and procurement[EB/OL].[2016-01-30].http://news.pharmnet.com.cn/news/2015/07/09/423811.html
[58]NDRC.Improving the monitoring of drug prices-discussionpaper[J].Beijing,2015.
[59]McTiernan R.Pricing play:NDRC reveals liberalization hand[R].Shanghai,2015.
[60]Oortwijn W,Mathijssen J,Banta D.The role of health technology assessment on pharmaceutical reimbursement in selected middle-income countries[J].Health Policy,2010,95(2-3):174-184.
[61]Zhao K.HTA in development assistance to health:potential and challenge in China[C].Beijing,2014.
[62]Kennedy-Martin T,Mitchell BD,Boye KS,et al.The health technology assessment environment in Mainl and China,Japan,South Korea,and Taiwan—implications for the evaluation of diabetes mellitus therapies[J].Value in Health Regional Issues,2014(3):108-116.
[63]Ellis S.China's“zero markup”hospital reforms mixedbagfor patented drugs[EB/OL].[2016-03-13].http://www.bioworld.com/content/chinas-zero-markup-hospital-reforms-mixed-bag-patented-drugs-2
[64]State Council.State Council healthcare reform 2015 work plan[R].Beijing,2015.
[65]Zhang X,Wu Q,Liu G,et al.The effect of the National Essential Medicines Policy on health expenditures and service delivery in Chinese township health centres:evidence fromalongitudinalstudy[J].BMJOpen,2014 (4):e006471.
[66]Song Y,Bian Y,Petzold M,et al.The impact of China's national essential medicine system on improving rational drug use in primary health care facilities:an empirical study in four provinces[J].BMC Health Services Research,2014,14(1):1-7.
[67]Chen M,Wang L,Chen W,et al.Does economic incentive matter for rational use of medicine?China's experience from the essential medicines program[J].Pharmacy economics,2014,32(3):245-255.
[68]Xiang X,Yang C,Wang D,et al.Effects of China's national essential medicines policy on the use of injection in primary health facilities[J].Journal ofHuazhong University of Science and Technology:Medical Sciences,2012(32):626-629.
[69]Yi H,Miller G,Zhang L,et al.Intended and unintendedconsequences of China's Zero Markup Drug Policy[J].Health Affairs,2015,34(8):1391-1398.
[70]Zhou Z,Su Y,Campbell B,et al.Thefinan-cial impact of the Zero-Markup Policy for Essential Drugs on patients in county hospitals in western rural China[J].PLOS ONE,2015,10(3):e0121630.
[71]Zhou Z,Su Y,Campbell B,et al.The impact of China's Zero-Markup Drug Policy on county hospital revenue and government subsidy levels[J].Journal of Asian Public Policy,2015(8):102-116.
[72]Wang Y.NHFPC,MOF,State Council Joint Evaluation of Public Hospital Reform[EB/OL].[2015-08-13].http://www.cbda.cn/html/MDnews/20150729/64734.html.
[73]IMS Health.Exploring impacts of the revised EDL and associatedpolicies[R].Shanghai,2013.
[74]Tian X,Song Y,Zhang X.National Essential Medicines List and pol-icy practice:a case study of China's health care reform[J].BMC Health Services Research 2012 (12):401.
[75]Li Y,Ying C,Sufang G,et al.Evaluation,in threeprovinces,of the introduction and impact of China's National Essen-tial Medicines Scheme[J].Bulletin of the World Health Organization,2013(91):184-194.
[76]Yoong thong W,Hu S,Whitty JA,et al.National drug policies to localformulary decisions in Thailand,China,and Australia:drug list-ing changes and opportunities[J].Value Health,2012(15):126-131.
[77]IMS Health.China IMS pharmaceutical pricing&reimbursement con-cise guide[R].London,2013.
[78]Ngorsuraches S,Meng W,Kim BY,et al.Drug reimburse-ment decision-making in Thailand,China,and South Korea[J].Value Health,2012(15):S120-125.
[79]IMS.Health research report on establishing an optimal reimburse-ment system in China[R].Beijing,2014.
[80]Xue K.Le Keqiang announce major diseases scheme:who benefits?Who will pay?How will it be implemented?[EB/OL].[2015-08-13].http://info.pharmacy.hc360.com/2015/07/270910566332.shtml
[81]NDRC Academy of Macroeconomic Research.NDRC:approaching reimbursement caps[R].Beijing,2015.
[82]Reynolds L,McKee M.Factorsinfluencing antibiotic prescribing in China:an exploratory analysis[J].Health Policy,2009(90):32-36.
[83]McTiernan R.Pipe dreams CDE offers dose of realism on DAL DRR reforms[R].Shanghai,2015.
(编辑刘博)
Pharmaceutical pricing and reimbursement policy and its effect in China
Jia Hu,Elias Mossialos
LSE Health,London School of Economics and Political Science,United Kingdom
Background:In recent years,there has been rapid growth in pharmaceutical spending in China.In addition,the country faces many challenges with regards to the quality,pricing and affordability of drugs.Pricing and reimbursement are important aspects of pharmaceutical policy that must be prioritised in order to address the many challenges.Methods:This review draws on multiple sources of information.A review of the academic and grey literature along with official government statistics were combined with informa-tion from seminars held by China's State Council Development Research Center to provide an overview of pharmaceutical pricing and reimbursement in China.Results:Pricing and reimbursement policy were analysed through a framework that incor-porates supply-side policies,proxy-demand policies and demand-side policies.China's current pharmaceutical policies interact in such a way to create dysfunction in the form of high prices,low drug quality,irrational prescribing and problems with access.Finally,the country's fragmented regulatory environment hampers pharmaceutical policy reform.Conclusions:The pricing and reimbursement policy landscape can be improved through higher drug quality standards,greater market concentration,an increase in government subsidies,quality-oriented tendering,wider implementation of the zero markup policy,through linking reimbursement with rational prescribing,and the promotion of health technology assessment and comparative effectiveness research.Addressing broader issues of regulatory fragmentation,the lack of transparency and corruption will help ensure that policies are created in a coherent,evidence-based fashion.
Pharmaceutical policy;Pricing;Reimbursement;China
R197
A
10.3969/j.issn.1674-2982.2017.02.002
2016-07-10
2016-12-12
*通讯作者:Elias Mossialos.E-mail:e.a.mossialos@lse.ac.uk
本文原文刊载于Health Policy,2016,120(5):519-534,原标题为Pharmaceutical pricing and reimbursement in China:When the whole is less than the sum of its parts,经Elsevier授权翻译刊载,内容略有删减
