碳毡基体上电沉积Ni-Mo合金及其催化析氢性能
2017-04-09王宏智张晓振张卫国姜世圣姚素薇
王宏智,张晓振,黄 波,张卫国,姜世圣,姚素薇
(天津大学化工学院 杉山表面技术研究室,天津 300072)
能源危机和环境问题的不断加剧使清洁能源氢能成为了研究的热点。氢能是一种清洁的二次能源,电解水制氢是实现大规模工业化制氢、获得氢能的重要手段,然而电解水制氢中的高能耗问题对析氢电极材料提出了挑战,因此研究开发具有高催化活性、成本低廉、能够有效降低析氢过电位的新型析氢电极材料显得十分重要[1-2]。近年来,关于析氢电极材料的研究受到人们的广泛关注[3-6]。Ni-Mo合金电极因其优异的催化析氢性能被国内外深入研究[7-9]。电沉积镍钼合金具有电极制备简单、成本低廉、镀层均匀且具有良好的电催化活性和稳定性而广受青睐。但水溶液体系中电沉积制备的电极材料易发生氢脆现象,从而影响到材料的实际应用。
离子液体(Ionic Liquids)因其电势窗口宽、蒸汽压低、热稳定性好、不易燃、离子电导率高、液态温度范围宽等优点,在金属电沉积方面受到越来越多的关注[10-15]。深共融溶剂[16-17]作为离子液体的一种,除了具备离子液体的优点外,它对空气和水的稳定性使其在金属沉积方面颇具优势。之前的报道主要是在深共融溶剂中电沉积合金[18-22],但对沉积的合金进行催化析氢性能研究却很少。作为深共融溶剂的一种,胆碱类离子液体价格低廉且无污染。本课题组曾采用胆碱类离子液体在铜基材上制备出催化析氢性能优良的Ni-Mo合金[23],但铜基材成本较贵。活性炭纤维制成的碳毡为三维网络结构,比表面积大的同时还具有导电性好、耐热、耐腐蚀等优点,是一种有潜力的电极材料。本研究通过恒电流沉积方法,以成本较经济的碳毡为基体,首先采用瓦特镀镍工艺获得碳镍电极(C-Ni),并以C-Ni电极为基体,在氯化胆碱-尿素体系中制备出Ni-Mo合金电极,将其与水溶液中制备出的Ni-Mo合金电极、C-Ni电极的催化析氢性能进行了对比研究,并对镀层形貌和结构进行了表征。
1 实验部分
1.1 镀液的配制
首先,按照n(氯化胆碱)∶n(尿素)为1∶2的比例称量后将二者混合于干燥烧杯中,然后将其置于85 ℃水浴锅中,磁力搅拌至二者完全溶解,最终形成无色透明黏稠状的离子液体。向离子液体中依次加入氯化镍(0.15~0.45 mol·L-1)、柠檬酸(0.5 mol·L-1)、钼酸铵(0.1~0.4 mol·L-1)并加热搅拌,获得不同钼盐和镍盐含量的电镀液。本实验所采用的试剂均为分析纯等级。
1.2 碳镍电极的制备
为了克服碳毡材料质地较软的缺点,实验首先采用瓦特型镀镍工艺,在碳毡表面电沉积金属镍,制成碳-镍电极,记为C-Ni。具有三维网络结构的C-Ni电极不仅继承碳毡本身比表面积大的优势,还具备优良的机械强度。
1.3 Ni-Mo合金的制备工艺
以电镀液中钼盐含量、镍盐含量、电流密度和电镀液温度为考察因素,设计正交试验L16(44),采用恒电流法电沉积制备Ni-Mo合金,在离子液体中以1.2中制备的C-Ni电极为基体,阳极为钌钛网,通过测量所制备电极在6 mol·L-1的NaOH溶液中的阴极极化曲线,以其在0.1 A·cm-2电流密度下的析氢电位值作为考察标准,确定了离子液体中碳毡基体上电沉积Ni-Mo合金的最适宜工艺条件,如表1所示。水溶液中铜基体上电沉积Ni-Mo合金的最适宜工艺条件[23]列于表1。

表1 离子液体和水溶液中沉积Ni-Mo合金最适宜工艺条件
在最适宜工艺条件下分别在离子液体和水溶液中恒电流沉积1 h,并将离子液体中以C-Ni为基体、水溶液中以紫铜为基体制备的Ni-Mo合金分别记为Ni-Mo/C-Ni和 Ni-Mo/Cu(Aqu)。
1.4 镀层形貌和结构表征
采用捷克TESCAN公司型号为VEGATS-5130SB的扫描电镜和PANALYTICAL公司的X射线衍射仪(D/Max-2500)对镀层形貌和结构进行表征。
1.5 电化学性能测试
在电化学工作站(CHI660B,上海辰华仪器有限公司)上采用三电极体系对电极的催化析氢性能进行测试。其中,研究电极为绝缘胶带封装成面积为1 cm×1 cm 待测试电极,辅助电极为钌钛电极,参比电极为饱和甘汞电极,电解液为6 mol·L-1的NaOH溶液,室温。方波电位测试的起始电位为各测试电极的开路电位,阶跃幅度为±5 mV;极化曲线测试的电位扫描范围为-0.8 ~-2.0 V,扫描速度为1 mV·s-1;电极的交流阻抗测试起始电极电位为-1.2 V(vs.SCE),振幅为5 mV,频率范围 0.01~1×105Hz;合金电极的连续电解和断电流测试条件为:电流密度0.1 A·cm-2,连续电解时间12 h,断电流测试每3 h断1次电。
2 实验结果与讨论
2.1 碳毡、碳镍和镍钼电极形貌
图1分别为碳毡(C Felt)电极、碳镍(C-Ni)电极、离子液体中电沉积制备的碳镍基Ni-Mo合金电极(Ni-Mo/C-Ni)和水溶液中制得的紫铜基镍钼合金电极[Ni-Mo/Cu(Aqu)]的SEM照片。由图1a)可以看出碳毡电极为三维网络结构,内部有较大的表面积和空间;由图1b)可以看出,碳毡表面镀上了1层镍,电极本身也呈现1种三维网络结构;比较图1c)和图1d),Ni-Mo/C-Ni合金电极表面结晶较Ni-Mo/Cu(Aqu)电极表面更加致密,没有观察到裂纹。

图1 不同电极的SEM照片Fig.1 SEMs of different electrodes
2.2 Ni-Mo/C-Ni合金镀层组成和结构
图2a)为Ni-Mo/C-Ni合金电极插图区域1的能谱图(EDS)。由谱图可知,镀层中含有Ni和Mo,其中Mo的质量分数约为5.12%。
图2b)为Ni-Mo/C-Ni合金电极的XRD谱图。对比标准谱图可知,2θ角为44.4°附近的宽化峰是Ni的(111)面心立方(FCC)晶面。而Mo因与Ni形成固溶体存在于Ni的面心立方(FCC)晶格中而未被检测到[24]。根据Debye-Scherrer公式[25]
(1)
可计算得Ni-Mo/C-Ni合金的晶粒尺寸约为2.2 nm。

图2 Ni-Mo/C-Ni电极的EDS和XRD谱图Fig.2 EDS and XRD pattern of Ni-Mo/C-Ni electrode
图3为Ni-Mo/C-Ni电极、Ni-Mo/Cu(Aqu)电极、C-Ni电极和碳毡电极(C Felt)的电流-时间响应曲线。根据双电层电容(Cd)计算公式及材料的真实表面积计算公式[23],可计算出Ni-Mo/C-Ni合金电极的真实表面积S。
根据电极表面粗糙度计算公式(2)可以计算出不同电极的表面粗糙度r,式(2)中,S为真实面积,S1为表观面积。计算结果如表2所示。
(2)

表2 不同电极的双电层电容、真实表面积和表明粗糙度
实验结果表明,离子液体中沉积的碳镍基Ni-Mo合金较水溶液中沉积紫铜基Ni-Mo合金具有较大的表面粗糙度。

图3 不同电极的电流密度-时间响应曲线Fig.3 Current density-time curves of different electrodes
2.3 电极的催化析氢性能研究
图4中曲线a、b、c和d分别为Ni-Mo/C-Ni电极、Ni-Mo/Cu(Aqu)电极、C-Ni电极和碳毡(C Felt)电极在NaOH溶液中的阴极极化曲线。

图4 NaOH溶液中不同电极的阴极极化曲线Fig.4 Cathodic polarization curves of different electrodes in NaOH solution(vs.SCE)
从图4可以看出,在0.1 A/cm2电流密度下,Ni-Mo/C-Ni合金电极在NaOH溶液中的析氢电位较碳毡(C felt)电极正移约557 mV,较碳镍(C-Ni)电极的析氢电位正移约108 mV,而较Ni-Mo/Cu(Aqu)电极析氢电位正移约50 mV左右,表现出良好的催化析氢活性。
2.4 电极的交流阻抗测试
图5为Ni-Mo/C-Ni电极、Ni-Mo/Cu(Aqu)电极、C-Ni电极的交流阻抗谱图。采用Zsimpwin软件进行拟合,由于弥散效应[26-27]的存在,用常相位角元件(CPE)代替微分电容Cd;图5中插图为电极等效电路图,图5中Rs、Rr分别表示溶液电阻、电化学反应电阻。拟合后的交流阻抗图呈半圆形。

图5 -1.2 V下,不同电极的交流阻抗谱图(vs.SCE)Fig.5 Electrochemical impedance spectra of different electrodes under the potential of-1.2 V (vs.SCE)
表3是3种电极拟合后动力学参数。

表3 不同电极的拟合参数值
由表3可知,Ni-Mo/C-Ni电极、Ni-Mo/Cu(Aqu)电极、C-Ni电极所对应的电化学反应析氢电阻Rr分别为4.359,28.810和34.530 Ω·cm-2。实验结果表明,在同一极化电位下,Ni-Mo/C-Ni电极的析氢电化学反应电阻最小,因而催化析氢性能最好。
通过以上极化曲线和交流阻抗测试分析可知,离子液体中电沉积的Ni-Mo/C-Ni合金电极具有高的催化活性和优良的电化学性能。其原因是多方面的,目前普遍认为的除了能量因素即Ni、Mo的协同作用促使反应活化能降低、催化析氢性能提高[28-30]外,还包括纳米晶粒的界面效应和小尺寸效应[31]和几何因素[32-33]等,离子液体中电沉积的Ni-Mo/C-Ni合金电极具有较大的表面积,使析氢反应的电流密度降低,减小了电极极化。
2.5 电极连续电解和断电流测试
图6为Ni-Mo/C-Ni合金电极在0.1 A·cm-2电流密度下的恒电流电解曲线。
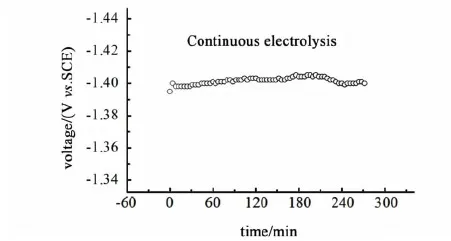
图6 Ni-Mo合金电极恒电流电解曲线Fig.6 Constant current electrolysis curve of the Ni-Mo/C-Ni electrode
由图6可知,长时间的连续电解后,电极电位变化在10 mV以内,电极电位波动较小。Ni-Mo/C-Ni合金电极催化析氢阴极断电流测试数据列于表4。

表4 Ni-Mo/C-Ni合金电极断电流测试数据
测试结果表明,碳镍基Ni-Mo合金电极在电解过程中强制断电后,在通电瞬间能在较短时间内恢复到断电前的电极电位,表明Ni-Mo/C-Ni合金电极具有很强的抗反向电流腐蚀性能。这些测试结果表明,所制备的Ni-Mo/C-Ni合金电极具有较好的电化学稳定性,实用前景广阔。
3 结论
在离子液体中以碳镍电极为基体,采用恒流法电沉积制备了碳镍基Ni-Mo合金电极。SEM及EDS测试表明,离子液体中得到的碳镍基Ni-Mo合金镀层表面颗粒均匀致密,镀层中Mo质量分数约为5.12%;方波电位测试表明碳镍基Ni-Mo合金电极真实表面积更大,表面粗糙度更高;XRD测试表明得到的Ni-Mo合金平均晶粒尺寸约2.2 nm,为纳米晶结构;极化曲线测试表明,碳镍基Ni-Mo合金电极相比其他电极析氢电位均有正移,催化析氢性能最佳;交流阻抗测试表明,碳镍基Ni-Mo合金电极较C-Ni电极具有较小的电化学反应电阻,展现了更优良的电化学性能。
参考文献:
[1]高鹏, 曹立新, 屠振密. 镍合金析氢电极研究概述[J]. 材料保护, 2010, 43(4): 68-71
Gao Peng, Cao Lixin, Tu Zhenmi. Summary of nickel alloy electrodes for hydrogen evolution[J]. Materials Protection, 2010, 43(4): 68-71(in Chinese)
[2]高峻峰, 孟令局, 玄兆坤, 等. 去合金化法制备多孔镍-硫-钴电极及其催化析氢性能[J]. 电镀与涂饰, 2013, 32(11): 5-8
Gao Junfeng, Meng Lingju, Xuan Zhaokun,etal. Electrocatalytic behavior of hydrogen evolution on porous nickel-sulfur-cobalt electrode prepared by dealloying method[J]. Electroplating and Finishing, 2013, 32(11): 5-8(in Chinese)
[3]Trasatti S. Electrocatalysis of hydrogen evolution: Progress in cathode activation[J]. Advances in Electrochemical Science and Engineering, 1992, 2: 1-85
[5]Dominguez-Crespo M A, Torres-Huerta A M, Brachetti-Sibaja B,etal. Electrochemical performance of Ni-RE (RE=rare earth) as electrode material for hydrogen evolution reaction in alkaline medium[J]. International Journal of Hydrogen Energy, 2011, 36(1): 135-151
[6]Rosalbino F, Maccio D, Saccone A,etal. Fe-Mo-R (R=rare earth metal) crystalline alloys as a cathode material for hydrogen evolution reaction in alkaline solution[J]. International Journal of Hydrogen Energy, 2011, 36(3): 1 965-1 973
[7]刘萍, 唐致远, 宋全生, 等. Ni-Mo合金电极的制备条件对其析氢性能的影响[J]. 电镀与精饰, 2006, 28(3): 11-14
Liu Ping, Tang Zhiyuan, Song Quansheng,etal. Effect of preparation condition of Ni-Mo alloy on electrocatalytic activity for hydrogen evolution[J]. Plating and Finishing, 2006, 28(3): 11-14(in Chinese)
[8]魏海兴, 周振芳, 吕东方, 等. 脉冲电沉积制备Ni-Mo合金析氢电极[J]. 舰船科学技术, 2011, 33(9): 124-127
Wei Haixing, Zhou Zhenfang, Lü Dongfang,etal. Pulse plating of Ni-Mo alloy electrodes for hydrogen evotion[J]. Ship Science and Technology, 2011, 33(9): 124-127(in Chinese)
[9]张卫国, 王飙, 刘春松, 等. 离子膜电解槽用纳米Ni-Mo合金阴极的制备及其催化析氢性能[J]. 氯碱工业, 2006, 12: 12-14
Zhang Weiguo, Wang Biao, Liu Chunsong,etal. The preparation of nano-Ni-Mo alloy cathodes for ion-exchange membrance electrolyzers and their catalytic hydrogen evolution property[J]. Chlor-Alkali Industry, 2006, 12: 12-14(in Chinese)
[10]张锁江,徐春明,吕兴梅,等. 离子液体和绿色化学[M]. 北京: 科学出版社, 2009
Zhang Suojiang, Xu Chunming, Lü Xingmei,etal. Ionic Liquids and Green Chemistry[M]. Beijing:Science Press, 2009
[11]You Y, Gu C, Wang X,etal. Electrodeposition of Ni-Co alloys from a deep eutectic solvent[J]. Surface and Coatings Technology, 2012, 206(17): 3632-3638
[12]Endres F, MacFarlane D, Abbott A. Electrodeposition from Ionic Liquids [M]. New York: John Wiley & Sons, 2008
[13]尹小梅, 徐联宾, 单南南, 等. TMPAC-AlCl3离子液体中恒电流电沉积铝[J]. 化工学报, 2012, 64(3): 1 022-1 029
Yin Xiaomei, Xu Lianbin, Shan Nannan,etal. Constant current eletrodeposition of alumnium from TMPAC-AlCl3ionic liquids[J]. CIESC Journal, 2012, 64(3): 1 022-1 029(in Chinese)
[14]杨志, 闫瑞景, 梁镇海. 离子液体中脉冲电镀[J]. 材料保护, 2013, 46(1): 31-34
Yang Zhi, Yan Ruijing, Liang Zhenhai. Pulse aluminum electroplating on Cu substrate in ionic liquid medium[J]. Materials Protection, 2013, 46(1): 31-34(in Chinese)
[15]Zheng Y, Zhang S, Lv X,etal. Low-Temperature electrodeposition of aluminium from Lewis acidic 1-allyl-3-methylimidazolium chloroaluminate ionic liquids[J]. Chin J Chem Eng, 2012, 20(1): 130-139
[16]Zhang Q, Vigier K D O, Royer S,etal. Deep eutectic solvents: Syntheses, properties and applications[J]. Chemical Society Reviews, 2012, 41(21): 7 108-7 146
[17]Abbott A P, Capper G, Davies D L,etal. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications, 2003, (1): 70-71
[18]王小娟, 李慧, 王娇, 等. 钴锌合金在氯化胆碱-尿素离子液体中的电沉积行为[J]. 材料保护, 2010, 43(3): 1-5
Wang Xiaojuan, Li Hui, Wang Jiao,etal. Eletrodeposition of Co-Zn alloy in choline chloride-urea ionic liquid[J]. Materials Protection, 2010, 43(3): 1-5(in Chinese)
[19]Florea A, Anicai L, Costovici S,etal. Ni and Ni alloy coatings electrodeposited from choline chloride-based ionic liquids-electrochemical synthesis and characterization[J]. Surface and Interface Analysis, 2010, 42(6/7): 1 271-1 275
[20]Abbott A P, Capper G, McKenzie K J,etal. Electrodeposition of zinc-tin alloys from deep eutectic solvents based on choline chloride[J]. Journal of Electroanalytical Chemistry, 2007, 599(2): 288-294
[21]Abbott A P, El-Ttaib K, Frisch G,etal. Electrodeposition of copper composites from deep eutectic solvents based on choline chloride[J]. Physical Chemistry Chemical Physics, 2009, 11(21): 4 269-4 277
[22]Abbott A P, El-Ttaib K, Frisch G,etal. The electrodeposition of silver composites using deep eutectic solvents[J]. Physical Chemistry Chemical Physics, 2012, 14(7): 2 443-2 449
[23]王宏智, 黄波, 张卫国, 等. 深共融溶剂中电沉积Ni-Mo合金及其催化析氢性能[J]. 化工学报, 2014, 65(11): 4 524-4 529
Wang Hongzhi, Huang Bo, Zhang Weiguo,etal. Electrodeposition of Ni-Mo alloy from deep eutectic solvents and its catalytic properities for hydrogen generation[J]. CIESC Journal, 2014, 65(11): 4 524-4 529(in Chinese)
[24]Lu G, Zangari G. Corrosion resistance of ternary Ni-P based alloys in sulfuric acid solutions[J]. Electrochimica Acta, 2002, 47(18): 2 969-2 979
[25]Warren B E. X-Ray diffraction[M]. Middlesex: Courier Corporation, 1969
[26]Jeyaprabha C, Sathiyanarayanan S, Venkatachari G. Effect of cerium ions on corrosion inhibition of PANI for iron in 0.5 M H2SO4[J]. Applied Surface Science, 2006, 253(2): 432-438
[27]Liu X, Chen S, Ma H,etal. Protection of iron corrosion by stearic acid and stearic imidazoline self-assembled monolayers[J]. Applied Surface Science, 2006, 253(2): 814-820
[28]Brewer L. The generalized Lewis acid-base theory: Surprising recent developments[J]. J Chem Educ, 1984, 61: 101-104
[29]Brewer L. Bonding and structures of transition metals[J]. Science, 1968, 161(3 837): 115-122
[30]Parsons R. The rate of electrolytic hydrogen evolution and the heat of adsorption of hydrogen[J]. Transactions of the Faraday Society, 1958, 54: 1 053-1063
[31]李贺, 姚素薇, 张卫国, 等. 电化学技术制备析氢电极材料的研究进展[J]. 化工进展, 2005, 24(7): 718-722
Li He, Yao Suwei, Zhang Weiguo,etal. Recent progress in electrochemical preparation of electrode materials for hydrogen evolution[J]. Chemical Industry and Engineering Progress, 2005, 24(7): 718-722(in Chinese)
[32]Liu H, He P, Li Z,etal. High surface area nanoporous platinum: Facile fabrication and electrocatalytic activity[J]. Nanotechnology, 2006, 17(9): 2 167-2 173
[33]Liu H, Liu Y, Li J. Ionic liquids in surface electrochemistry[J]. Physical Chemistry Chemical Physics, 2010, 12(8): 1 685-1 697
