木醋液对碱性土壤微生物数量及酶活性的影响
2017-04-08王紫泉卞永荣和文祥吕家珑
程 虎,王紫泉,周 琨,钱 爽,卞永荣,和文祥*,吕家珑
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2. 中国科学院南京土壤研究所中国科学院土壤环境与污染修复重点实验室,江苏 南京 210008;3.中国科学院大学,北京 100049)
木醋液对碱性土壤微生物数量及酶活性的影响
程 虎1,2,3,王紫泉1,周 琨1,钱 爽1,卞永荣2,和文祥1*,吕家珑1
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2. 中国科学院南京土壤研究所中国科学院土壤环境与污染修复重点实验室,江苏 南京 210008;3.中国科学院大学,北京 100049)
采用室内培养方法,研究了添加不同浓度木醋液对碱性土壤微生物区系和土壤酶活性的影响.结果表明:培养期内,添加木醋液可显著增加碱性土壤中真菌、细菌的数量,且在3d内有效激活土壤酶活性,土壤蔗糖酶、脲酶、碱性磷酸酶和脱氢酶活性均有不同程度的增加;添加高浓度木醋液,短期内抑制碱性土壤中部分微生物活性;添加木醋液使微生物生长对氮元素的需求增加,特别是培养后期,土壤营养状况变差,容易造成作物与微生物竞争营养物质.因此木醋液的施用要注意浓度的大小以及氮元素的供给.
木醋液;塿土;微生物;土壤酶活性
木醋液是木材在碳化或干馏过程中产生的烟气经冷凝回流和再分离得到的有机混合物,又被称作植物酸,主要成分是乙酸,含有少量酮类、酚类、酯类、醛类、醇类以及微量金属元素[1-2].木醋液直接来源于天然木材,是一种绿色产品,同时,也是对木材生产加工过程中产生废气的回收应用.因此,木醋液的相关研究与应用对环境保护和绿色农业的推广具有重要意义.
有研究表明木醋液施用于土壤中,能够改变土壤理化性质,显著增加土壤有效态养分含量[3-4],提高土壤微生物数量[5-7],促进植物生长和品质提升.土壤微生物是土壤生物活性的根本,其数量直接反映土壤质量状况,是土壤环境质量评价的重要生物学指标之一.土壤酶是土壤中的生物催化剂,在物质循环,能量交换和环境净化等过程中发挥重要作用,是衡量土壤质量水平的关键指标[8-10].土壤微生物区系和土壤酶活性均易受外源物质的影响[11-13].中国西北土壤为石灰性土壤,pH值偏高,有效态养分含量相对偏低,木醋液为酸性小分子混合物,添加到土壤中可能是改良碱性土壤微生物学性质的有效途径.
本试验通过长期室内培养实验,向碱性土壤中添加不同浓度的木醋液,测定土壤微生物数量与土壤酶活性随时间的变化,分析木醋液应用的浓度,时间效应,探讨木醋液对碱性土壤微生物学性质的影响.
1 材料与方法
1.1 试验材料
试验土样采自西北农林科技大学农作一站小麦试验田耕层土壤,土壤母质为塿土,采样深度0~20cm,样品采回后风干,过2mm筛,混匀,4℃存储备用.供试土壤理化性质:有机质含量为14.82g/kg,全氮含量为1.11g/kg,速效P、K含量分别为21.03,178.71mg/kg,碱解氮含量为43.75mg/kg,阳离子交换量为18.12cmol/kg, pH值8.42.
木醋液试剂由陕西亿鑫生物能源科技开发有限公司提供,主要由苹果树提炼而成,有机碳33.5g/L,电导率3.37ms/cm, pH =3.6[14].
1.2 试验处理
称取500g 风干土,喷洒不同浓度的木醋液,使土壤含水量达到田间持水量的60%,搅拌至均匀,放置于1L塑料培养瓶中,加盖,于28℃下恒温培养,培养期间保持土壤含水量为田间持水量的60%.对照处理喷洒等量去离子水.
试验设置7个不同浓度木醋液处理:(1) CK:对照处理(蒸馏水); (2) C1:木醋液原液稀释1000倍; (3) C2:木醋液原液稀释500倍; (4) C3:木醋液原液稀释400倍; (5) C4:木醋液原液稀释300倍; (6) C5:木醋液原液稀释200倍; (7) C6:木醋液原液稀释100倍.每个处理重复3次.
1.3 测定项目与方法
微生物数量[15]:细菌、真菌和放线菌分别采用牛肉膏蛋白胨培养基,马铃薯琼脂培养基和高氏1号培养基培养.1、3、7、15d后取出土壤样品,采用平板计数法分离测定土壤中的细菌、真菌、放线菌数量.
土壤酶活性[16]:本试验选择测定与土壤碳、氮、磷循环密切相关的蔗糖酶、脲酶、碱性磷酸酶与脱氢酶活性.取培养1,3,7,15,30,60d后的土壤样品,水杨酸比色法测定土壤蔗糖酶,靛酚蓝比色法测定脲酶,磷酸苯二钠比色法测定碱性磷酸酶,TTC比色法测定脱氢酶活性.
1.4 数据处理与分析
采用Microsoft Excel 2013和SPSS 20.0进行数据统计分析, Origin 8.5进行图形绘制.
2 结果
2.1 木醋液对土壤微生物数量的影响
细菌是土壤中数量最多的微生物类群,约占土壤微生物的70%~90%[17],能够快速分解土壤有机物,促进土壤有机碳、氮转换,加快物质循环,提高土壤有效态养分含量.
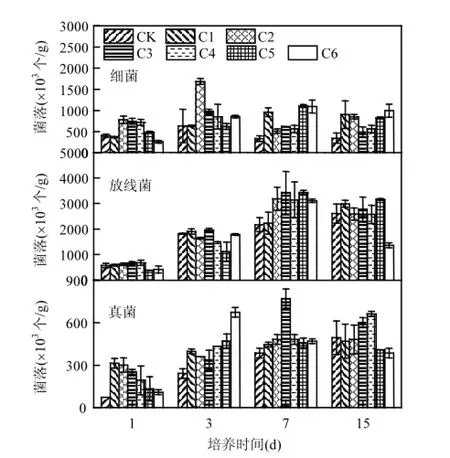
图1 木醋液对土壤微生物数量的影响Fig.1 The effects of pyroligneous acid on quantity of soil microorganism
从图1看出,除第1d外,添加木醋液可有效增加土壤细菌数量,且木醋液的浓度影响增加效果.第1d,低浓度木醋液(C1)处理效果不显著,C2、C3和C4处理均显著促进土壤细菌的繁殖,细菌数量分别增加92%、82% 和76%, C5处理仅增加21%.由细菌数量变化可知,木醋液浓度增大,促进效果逐渐弱化,C6处理时出现高浓度抑制细菌数量的状况.除对照外,土壤中细菌数量随培养时间出现先增加后降低到平缓的趋势.
土壤环境中,放线菌发挥着保障土壤健康的重要作用,不仅能加速土壤氮磷钾等养分的转化、循环,而且可通过营养抗性来抵御和抑制有害生物(土传病害)的生长繁殖,是评估土壤健康与安全的重要指示菌[18].室内恒温培养条件下,除第7d外,添加木醋液对土壤中放线菌数量无显著的促进作用,且存在高浓度抑制现象.第7d时,除低浓度处理(C1), C2~C6处理放线菌数量均显著增加,分别增加47%、58%、45%、58% 和43%.第15d时,C6处理放线菌数量受到显著抑制,抑制率达到37%.放线菌数量随时间呈现先上升后平稳的趋势.
真菌是土壤微生物的重要组成部分[19],能够加快土壤物质循环,抑制土传病害等的发生,维护土壤安全与健康,是评价土壤安全与肥力的重要指标.从图1看出,短期内(7d内),添加木醋液可以促进真菌数量的增加;培养15d时,相对于对照处理均无显著性差异.第1d时,C1、C2和C3处理真菌数量显著增加,增幅分别为335%、318% 和251%;C4、C5和C6处理,真菌数量增加不显著,木醋液浓度增加,真菌数量增加效果逐渐减小.第3d时,添加木醋液处理,真菌数量均显著增加,增幅分别为:65%、50%、40%、80%、95% 和180%;并且呈现出木醋液添加浓度越高,真菌数量越多的趋势.第7d时,效果减小,除C3处理外,差异均不显著,C3处理真菌数量相对增加了100%.
2.2 木醋液对土壤酶活性的影响
蔗糖酶广泛分布在土壤中,通过水解蔗糖,增加易溶性营养物质的含量,提高有机物利用率,其活性能够反映土壤有机碳累积与分解转化的速率.各处理条件下,蔗糖酶活性总体表现出先上升后下降的趋势(图2).培养1d后,除C1处理外,蔗糖酶活性较对照均显著增加; C5处理蔗糖酶活性最高,达到558 μg/(g·h),较对照增加了53%; 3,7, 15,30d,各处理蔗糖酶变化规律较复杂;培养60d时,各处理无显著差异.
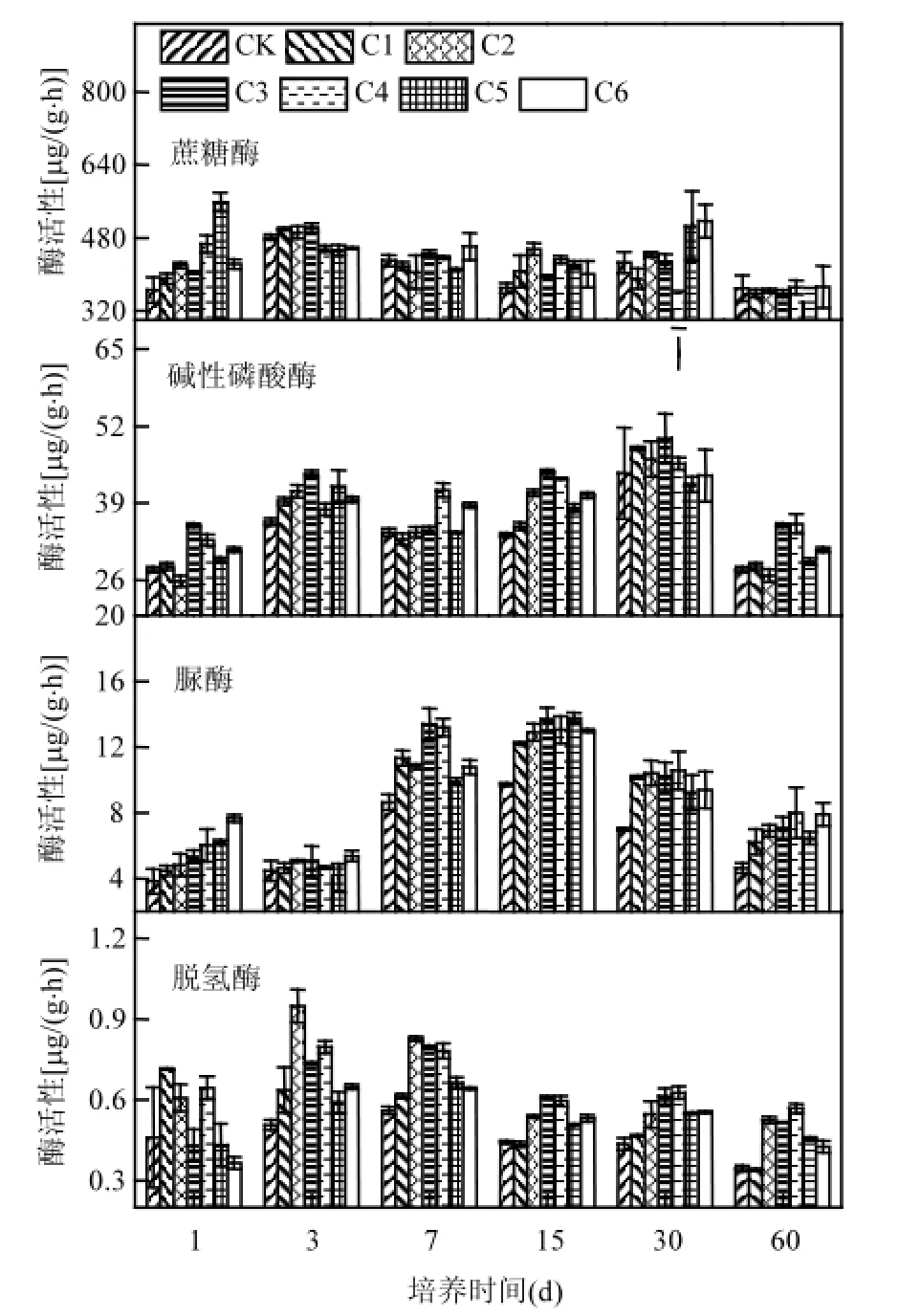
图2 木醋液对土壤酶活性的影响Fig.2 The effects of pyroligneous acid on soil enzyme activity
碱性磷酸酶能够提高有效磷含量,加速土壤磷素循环,通过磷酸酶活性可以对土壤磷素转化方向和强度进行准确评估[20].从图2看出,碱性磷酸酶活性随培养时间的增加呈现先上升后下降的趋势,30d时碱性磷酸酶活性最大,在42.208~49.969μg/(g·h)之间;培养时间相同时,碱性磷酸酶活性随添加木醋液浓度的增加呈现先增加后降低的趋势,C3和C4处理效果最好,表明添加木醋液可提高碱性磷酸酶活性,但添加浓度需适度.
土壤脲酶具有水解尿素的能力,是促进氮素循环的重要土壤酶之一.脲酶活性与土壤碳、磷、有机质等含量正相关,能够综合反映土壤养分水平[21].如图2所示,随培养时间增加,各处理脲酶活性整体上呈现出先上升后下降的趋势.培养15d时达到最大值,C0~C6处理脲酶活性分别为9.7,12.2,12.9,13.7,13.1,13.7,13.0μg/(g·h).除第3d外,各培养阶段均显示木醋液的添加可以增加脲酶活性.培养1d后,脲酶活性均增加,并且木醋液的添加浓度越大,脲酶活性增加越大.培养3d后,脲酶活性稍微降低,但处理间差异不显著.培养7,15,30,60d后,添加木醋液处理土壤脲酶活性均显著性高于对照,表明添加木醋液可提高土壤脲酶活性,且效应持续60d仍未消失.高浓度木醋液(C6)对脲酶活性没有抑制作用.
土壤脱氢酶是一种胞内酶,在细胞外无活性,与土壤微生物活性正相关,其活性可以表征土壤微生物活性和功能多样性.脱氢酶活性随培养时间的增加呈现先增强后减弱的趋势,不同处理酶活性达到至高点所需时间不一致.从图2看出,培养期间,除第1d外,C2~C6处理脱氢酶活性均高于对照,表明C2~C6处理可在长时间内(60d)增加土壤脱氢酶活性,加速土壤有机物代谢. C1处理前7d内,脱氢酶活性均高于对照,后期无显著差异,表明低浓度木醋液的添加7d内可增加脱氢酶活性,7d后效应弱化至不显著;对照处理(C0)酶活性在第7d时最高,为0.56 μg/(g·h);低浓度处理(C1)培养1d后酶活性达到最高;C2处理第3d酶活性最高,其余处理酶活性均在第7d达到酶活性最高点,表明添加低浓度木醋液短时间内可促进提高脱氢酶活性,并达到较高水平,高浓度木醋液会出现延迟效应.在各个培养阶段,土壤脱氢酶活性随木醋液的添加浓度的升高呈现出先增加,后降低的趋势,表明高浓度木醋液的添加对脱氢酶活性存在一定的抑制作用.
3 讨论
3.1 木醋液对土壤微生物的影响
木醋液是木材蒸馏过程中小分子有机物的混合体,添加到土壤中,其中一部分小分子有机物可被微生物直接吸收利用,加快微生物繁殖;另一部分有机物可被进一步分解,增加土壤中的碳源,促进微生物数量与活性的增加.同时,木醋液中部分小分子有机物对微生物有毒害作用,减少微生物数量或活性.本试验表明,添加适宜浓度木醋液,可促进碱性土壤微生物(真菌,放线菌,细菌)数量的增加,其中细菌和真菌最为显著.胡春花等研究表明木醋液的添加可显著地增加土壤细菌数量,与本文研究结果一致[7].添加高浓度木醋液(C6),相对于其他处理,短时间内出现抑制微生物繁殖和活性的现象,放线菌和细菌培养1d后菌落数量小于对照,真菌数量虽高于对照组,但低于C1~C5处理.随培养时间增加,高浓度木醋液抑制效果逐步减弱,一段时间后,促进效果显现并逐渐占据主导地位;添加低浓度木醋液(C1)对放线菌影响不显著,对细菌后期(7d)具有显著影响,对真菌前期(3d)具有显著影响,对放线菌影响不显著.为解释此现象提出以下假设: (1)木醋液中含有大量酚类和有机酸类化合物,抑制微生物繁殖与活性[22];添加高浓度木醋液时,酚类和有机酸类化合物数量多,对微生物的毒害抑制强,抑制微生物的繁殖和生物活性,培养一段时间后,部分有机物被分解或挥发,毒害抑制作用减弱,且经分解进一步提供营养物质,促进微生物繁殖,提高微生物活性,添加少量木醋液,毒害抑制作用相对较小,繁殖速度与微生物活性变化相对较小.(2)试验供试土壤pH值为8.42,木醋液原液pH值 3.6,添加高浓度木醋液(C6),可能瞬间改变周边微域土壤环境pH值[4]、氧化还原电位等,对微生物尤其是喜好偏中性的放线菌和细菌生长不利,虽同时提供营养物质,但由于微生物生存环境的瞬时改变,繁殖与活性均受到一定抑制,培养一定时间后,环境逐渐恢复,微生物逐渐适应新环境,且部分物质再次分解为可被微生物直接吸收利用的营养物质,从而促进微生物繁殖,提高微生物活性;然而,添加低浓度木醋液,对环境微域改变较小,且提供额外的碳源,促使微生物短时间繁殖.
Sulaiman等[23]的研究也表明,高浓度的木醋液会抑制微生物的生长,培养时间增加,有害物质或者有机酸被真菌分解利用,土壤pH值和氧化还原电位升高,土壤环境变得适宜放线菌和细菌生长,两者数量显著增加.培养后期,木醋液逐渐被分解利用,土壤中营养物质减少,微生物生长处于稳定停滞状态.
本研究发现,细菌和真菌在1d内被有效激活 ,分别可持续15d和7d,放线菌在第7d时被有效激活,第15d时激活效果不显著.杜相革等[6]的研究发现添加木醋液可使土壤微生物10d内被有效地激活,与本文结果一致.
3.2 木醋液对土壤酶活性的影响
土壤酶活性反映了土壤养分转化速率的能力.本研究发现:添加木醋液后,土壤蔗糖酶、脲酶、碱性磷酸酶和脱氢酶活性均有不同程度的增加,其中脲酶和脱氢酶增幅最大,且受影响可持续60d以上.蔗糖酶、脲酶和脱氢酶活性在添加木醋液后1d内显著增加,碱性磷酸酶活性在第3d时显著增大.木醋液含有大量有机小分子物质,为土壤微生物提供大量有效的碳源,可增加微生物数量及活性,其生长繁殖进一步增加营养物质的需求量,致使微生物分泌与所需营养物质相关的酶,从而表现为酶活性增大;其次木醋液中部分有机物质可作为底物,诱导微生物产生酶,从而表现为酶活性升高.
通过相关分析,土壤碱性磷酸酶活性与真菌、放线菌数量显著正相关(r=0.546**;0.472*);土壤脲酶活性与真菌和放线菌数量极显著正相关(r=0.563**;0.754**),脱氢酶活性与细菌、真菌数量显著相关(r=0.409*;0.416*).证实土壤酶活性与土壤微生物活性相关.
3.3 木醋液对土壤养分的影响
土壤养分含量和比例直接影响作物生长和产品质量,是土壤肥力的重要参数之一.不同微生物在不同生长时期内对营养物质的需求不一样,通过分泌不同的土壤酶消耗不同比例的养分.土壤蔗糖酶、脲酶、碱性磷酸酶分别是土壤碳、氮、磷循环中的重要酶类.其活性可以表征土壤碳、氮、磷养分的消耗速率,其比值可以一定程度上反映土壤碳、氮、磷速效养分平衡关系[24-27].
通过相关分析,蔗糖酶活性与微生物数量不相关,表明木醋液可为土壤微生物提供小分子碳源,直接被微生物吸收利用,满足碳营养的需求,所以蔗糖酶不分泌或者分泌很少,对土壤碳元素有一定的积累贡献.土壤碱性磷酸酶、脲酶、脱氢酶活性与微生物相关,表明木醋液的添加提高了土壤有效态养分含量,以满足微生物生长的需求.

图3 木醋液对土壤酶比值的影响Fig.3 The effects of pyroligneous acid on soil enzyme ratio
土壤蔗糖酶/碱性磷酸酶、蔗糖酶/脲酶比值与真菌和放线菌数量显著负相关(r=-0.580**; -0.561**;-0.453*;-0.654**),碱性磷酸酶/脲酶比值与放线菌数量极显著负相关(r=-0.529**),表明土壤酶活性比值与微生物各营养需求比例之间有良好的相关性,证实土壤酶活性比值可以反映微生物生长的各营养元素需求状况.
由图3看出,土壤蔗糖酶/脲酶的比值在前3d内增加,随后降低,在第15d达到最小,之后又有增大,说明微生物在培养前期对碳源要求较高,随后由于生长繁殖需要,对氮源的需求更大,因此微生物分泌更多与获取氮相关的酶,脲酶作为其中一种,酶活性也相应增加,从而导致蔗糖酶/脲酶比值减小,在后期微生物群落趋于稳定,对氮的需求也相对稳定.木醋液各处理土壤蔗糖酶/脲酶比值小于对照土壤,表明在供给碳源的情况下,微生物生长对氮源的需求较大.土壤蔗糖酶/碱性磷酸酶比值呈现逐渐减小后上升趋势,培养期间蔗糖酶活性变化不大,总体表现出先上升后下降的趋势,碱性磷酸酶活性逐渐增加后下降.表明在培养前期供给碳源的情况下,微生物生长对磷源的需求较大,但各处理间对磷源需求差异较小.土壤脲酶/碱性磷酸酶比值在培养期间呈现先降低再增加然后下降的过程.培养7d后,木醋液处理土壤脲酶/碱性磷酸酶比值均大于对照,说明施用木醋液,微生物生长对氮的需求大于磷.
4 结论
4.1 碱性土壤添加木醋液可促进微生物生长繁殖,土壤细菌、真菌和放线菌数量都有一定程度上的增加.除第1d外,添加木醋液可有效促进土壤细菌数量的增加,第1d存在高浓度抑制效应;低浓度木醋液可增加放线菌数量,但不显著,高浓度时存在抑制效应;真菌数量在7d内持续增加.
4.2 碱性土壤添加木醋液可在一定时间内激活土壤酶活性.蔗糖酶、碱性磷酸酶和脲酶均在木醋液添加1d后升高,脱氢酶在第3d显著增加,并且在一定时间内酶活性维持较高水平.
4.3 木醋液原液稀释300~500倍效果最好,培养期间,促进微生物生长,有效激活土壤酶.木醋液提供大量碳源,有助于碳元素的累积;有利于微生物生长,分泌更多的酶,使酶活性增加,促进营养物质循环.木醋液作为肥料使用,还应注意土壤氮元素的供给,避免微生物与植物发生争氮效应.
[1] 平 安.木醋液在农业上的应用研究进展 [J]. 中国农学通报, 2009,25(19):244-247.
[2] 王远兰.木醋液对大棚瓜果品质及土壤微量元素的影响 [D].杨凌:西北农林科技大学, 2014.
[3] 胡春花.木醋液和炭醋肥对设施蔬菜土壤肥力及蔬菜产量的影响 [J]. 中国农学通报, 2011,27(10):218-223.
[4] 李忠徽.灌施木醋液对土壤性质和植物生长的影响 [J]. 植物营养与肥料学报, 2014,20(2):510-516.
[5] Lu H, Lashari MS, Liu X, et al. Changes in soil microbial community structure and enzyme activity with amendment of biochar-manure compost and pyroligneous solution in a saline soil fromCentral China [J]. European Journal of Soil Biology,2015,70(7):67-76.
[6] 杜相革.木醋液及其主要成分对土壤微生物数量影响的研究[J]. 中国农学通报, 2004,20(2):59-62.
[7] 胡春花.木醋液及炭醋肥对设施土壤微生物数量及相关性的影响 [J]. 土壤通报, 2012,43(4):815-820.
[8] 王 平.长期不同施肥方式对小麦/玉米间作土壤蔗糖酶活性的影响 [J]. 农业现代化研究, 2009,30(5):611-614.
[9] 赵仁竹.吉林西部盐碱田土壤蔗糖酶活性和有机碳分布特征及其相关关系 [J]. 生态环境学报, 2015,24(2):244-249.
[10] 王 兵,刘国彬,薛 萐.退耕地养分和微生物量对土壤酶活性的影响 [J]. 中国环境科学, 2010,30(10):1375-1382.
[11] 肖 敏,高彦征,凌婉婷,等.菲、芘污染土壤中丛枝菌根真菌对土壤酶活性的影响 [J]. 中国环境科学, 2009,29(6):668-672.
[12] 律 泽.佳乐麝香和镉复合污染对土壤中放线菌数量的影响[J]. 生态学杂志, 2014,33(6):1501-1507.
[13] 吴小虎.5种除草剂对土壤蔗糖酶和脲酶活性的影响 [J]. 农药学学报, 2015,17(2):179-184.
[14] 毕巍扬.喷施木醋液对叶菜产量和品质及土壤性质的影响 [D].杨凌:西北农林科技大学, 2013.
[15] 程丽娟.微生物学实验技术 [M]. 北京:科学出版社, 2012: 36-53.
[16] 关松荫.土壤酶及其研究方法 [M]. 北京:农业出版社, 1986:260-339.
[17] 贾洪柏.石油污染土壤的微生物修复及对相关土壤细菌群落多样性的影响 [D]. 哈尔滨:东北林业大学, 2013.
[18] 谢 静.西藏林芝土壤放线菌抗肿瘤活性菌的筛选及鉴定 [J].微生物学通报, 2013,40(11):2037-2046.
[19] 吴照祥.三七根腐病株根际土壤真菌群落组成与碳源利用特征研究 [J]. 菌物学报, 2015,34(1):65-74.
[20] 张建林.有机物料配比施用对土壤碱性磷酸酶活性的影响 [J].土壤通报, 2001,32(2):75-79.
[21] 杨清平.不同生态茶园土壤微生物及脲酶活性研究 [J]. 湖北大学学报(自然科学版), 2014,36(4):300-306.
[22] Wei Q, Ma X, Dong J. Preparation, chemical constituents and antimicrobial activity of pyroligneous acids fromwalnut tree branches [J]. Journal of Analytical and Applied Pyrolysis, 2010,87(1):24–28.
[23] Sulaiman O, Murphy R J, HashimR, et al. The inhibition of microbial growth by bamboo vinegar [J]. Journal of Bamboo and Rattan, 2005,4(1):71-80.
[24] Sinsabaugh R L, Follstad Shah J. Ecoenzymatic stoichiometry and ecological theory [J]. Annual Reviewof Ecology, Evolution, and Systematics, 2012,43(11):313-343.
[25] 徐丽丽.不同肥料对稻田红壤碳、氮、磷循环相关酶活性的影响 [J]. 应用生态学报, 2013,24(4):909-914.
[26] 张彦军.黄土丘陵区小流域土壤碳氮比的变化及其影响因素[J]. 自然资源学报, 2012,27(7):1214-1223.
[27] Rousk J, Bååth E. Fungal and bacterial growth in soil with plant materials of different C/N ratios [J]. FEMS Microbiology Ecology, 2007,62(3):258–267.
Effects of pyroligneous acid on quantity of microorganismand enzyme activity in alkaline soil.
CHENG Hu1,2,3,WANG Zi-quan1, ZHOU Kun1, QIAN Shuang1, BIAN Yong-rong2, HE Wen-xiang1*, LÜ Jia-long1
(1.College of Resources and Environment, Northwest A&F University, Yangling 712100, China;2.Key Laboratory of Soil Environment and PollutionRemediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;3.University of the Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2017,37(2):696~701
A laboratory incubationexperiment was conducted to explore the effects of different concentrations of pyroligneous acid onquantities of microorganismand enzyme activity inalkaline soil. Results showed that the quantity of fungi and bacteria inalkaline soil were significantly increased with the presence of pyroligneous acid. Besides, soil enzyme activity was effectively activated withinthree days. Soil invertase, urease, alkaline phosphatase and dehydrogenase activity were increased to some extent respectively. However, microbial activity inalkaline soils was partly inhibited by high-concentrationof pyroligneous acid ina short time. The demand of microbial growth for nitrogennutrient was increased with the additionof pyroligneous acid, which would cause nutritioncompetitionbetweencrop and microorganismespecially inthe later incubationperiod. Consequently, attentionshould be paid to the concentrationof pyroligneous acid and the applicationof nitrogento soil simultaneously whenusing pyroligneous acid.
pyroligneous acid;Lou soil;microorganism;soil enzyme activity
X712,S154.3
A
1000-6923(2017)02-0696-06
程 虎(1994-),男,安徽淮北人,中国科学院南京土壤研究所博士研究生,主要从事环境污染与化学控制方向.
2016-06-23
国家自然科学基金项目(41571245):西北农林科技大学大学生科创项目资助
* 责任作者, 教授, wxhe1968@163.com
