臭氧作用下酮洛芬的降解行为及机理研究
2017-04-08林晓璇刘国光李若白孔青青陈智明李富华陆一达
林晓璇,刘国光,李若白,孔青青,陈智明,李富华,陈 平,陆一达
(广东工业大学环境科学与工程学院,广东广州 510006)
臭氧作用下酮洛芬的降解行为及机理研究
林晓璇,刘国光*,李若白,孔青青,陈智明,李富华,陈 平,陆一达
(广东工业大学环境科学与工程学院,广东广州 510006)
利用臭氧(O3)氧化降解酮洛芬(KET)模拟废水,考察了初始pH值,臭氧流量(QO3),反应温度(T)及KET初始浓度(C0)对臭氧降解KET效果的影响.在KET初始浓度为20µmol/L,臭氧流量0.4L/min的反应体系中,室温条件下,研究了pH=4,7,10时O3和羟基自由基(·OH)分别对KET降解的贡献率.采用竞争法,以布洛芬和苯甲酸为分子探针,分别测定了KET与O3,·OH的二级反应速率常数.结果表明,不同实验条件下臭氧降解KET符合准一级动力学.pH值,QO3及T的增大促进了KET降解,C0的增大抑制了KET的降解.通过对实验数据进行拟合得到表观一级动力学的幂指数方程(k=154439exp(-32831/RT) QO30.679C0-0.2[OH]0.07).体系中O3和·OH同时对KET存在氧化作用.在设定的条件下,pH值为4,7和10时O3对KET降解的贡献率分别为18.4%,11.0%和6.2%,而·OH对KET降解的贡献率分别为81.6%,89.0%和93.8%.测得KET与O3的二级反应速率常数为1.09L/(mol·s),与·OH的二级反应速率常数为8.82×109L/(mol·s).
臭氧氧化;羟基自由基;酮洛芬;表观动力学方程;二级速率常数
近年来,药品及个人护理用品(PPC Ps)作为一类新兴环境污染物备受关注.酮洛芬(KET, C16H14O3)是一种常见的PPC Ps类物质,被广泛应用于消炎解热镇痛以及治疗风湿性疾病.目前我国每年生产和使用KET约92t[1],其对环境造成的影响不容忽视.研究指出KET存在于污水处理厂出水,环境水体以及饮用水水源中[2-5],浓度通常在μg/L~ng/L量级,由于自来水厂传统的工艺不能完全去除这一类污染物,因此饮用水中可能含有低浓度KET,长期饮用将带来健康风险[6].目前关于降解KET的研究较少,Real等[7]通过研究紫外光对KET的降解,得出10min内KET的去除率可达99%;通过研究酮洛芬的光化学行为得知[8],酮洛芬的光量子产率为0.14,对光子的利用率较低.此外,采用电芬顿法降解KET[9],得出5min内KET的降解率可达85.7%,但该方法对pH值的要求较高,不利于实际应用.
臭氧(O3)是一种清洁的,环境友好的强氧化剂,近20年来得到广泛的研究与应用[10-12].O3能直接氧化有机污染物,氧化还原电位2.07V.在一定的条件下,O3能自分解产生活泼的羟基自由基(·OH)[13-14],·OH是一种强氧化剂,氧化还原电位为2.8V,能将水体中难降解的大分子有机污染物氧化降解成低毒或无毒的小分子物质[15].臭氧对不同类型PPC Ps的降解效果有很大差异.其中,臭氧可以高效降解水中的抗抑郁药西酞普兰[16],广谱抗菌药磺胺甲恶唑[17],抗炎药双氯酚酸[18],而对抗惊厥药安定[19]及脂调节剂氯贝酸[20]的降解效果较差.此外,目前关于臭氧降解KET这方面的研究仍未有系统报道.
本文研究了初始pH值,臭氧流量,反应温度以及KET初始浓度4个因素对降解效果的影响,并建立了臭氧氧化法降解KET的表观动力学方程.以竞争法测定了O3以及·OH与KET的反应速率常数.研究工作可为臭氧氧化技术在处理KET的应用提供理论参考和技术支持.
1 材料与方法
1.1 试剂
KET(KET,AR,纯度≥98%, TCI公司);苯甲酸(BA,AR,阿拉丁公司);乙腈(色谱纯,美国ACS恩科化学);碘化钾,叔丁醇,氢氧化钠,硫酸,冰乙酸(AR,天津致远化学试剂);实验用水为超纯水;以NaOH,H2SO4调节溶液的初始pH值.
1.2 仪器
高效液相色谱(LC-20A,SHIMADZU);色谱柱(ZORBAX Eclipse XDB-C18, 4.6×150mm, 5μm, SHIMADZU);检测器为光电二极管阵列检测器(SPD-M20A);pH计(PHS-3C,上海雷磁科学仪器有限公司);臭氧发生器(QJ-8002K,铨聚科技);臭氧氧化反应器(自制玻璃材质,高径比>5,有效容积600mL,以锡箔纸密闭遮光);臭氧浓度检测器(UT-500,美国独资爱迪尔测控技术有限公司);流量计(LZB-3WB,浙江余姚工业自动化仪器厂);超声仪(AS20500BDT,AUTO SCIENCE);超纯水机(Smart2,德国TKA);恒温水浴器(SY-2-4,天津欧诺仪器仪表有限公司).
1.3 臭氧氧化KET的实验方法
臭氧氧化KET模拟废水的反应装置如图1所示,实验过程中首先根据所设定的初始浓度配制500mL反应液加入反应器中,调节气体流量,初始pH值以及反应温度至设定值,打开臭氧发生器,气体通过通气管下端的气体分散器分散后进入反应体系,尾气中多余的臭氧通过KI吸收后排空.距离反应器底部5cm处有取样口,当通气第0,2,4,8,12,16,24min时取1.5mL样品测定KET的剩余浓度.
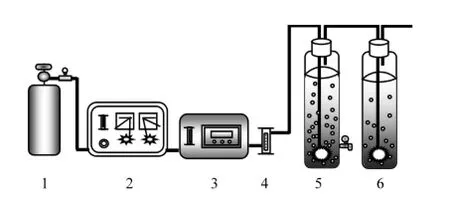
图1 反应装置Fig.1 Schematic diagramof O3reactor system
1.4 臭氧浓度测定方法
将臭氧发生器产生的混合气体通入已预热的臭氧浓度检测器中,待其检测稳定后读取浓度值,经检测,混合气体中臭氧浓度为0.8mg/L.
1.5 KET浓度测定方法
用高效液相色谱仪(HPLC)测定剩余KET浓度,色谱条件:流动相为0.5%冰乙酸:乙腈= 55:45(体积比),流动相流速为1.0mL/min,柱温40℃,检测波长260nm,进样量为10μL.
2 结果与讨论
2.1 初始pH值的影响
pH值是臭氧氧化体系中一个重要的影响因素,因为它可能会影响水溶液中有机物的解离状态以及OH的浓度,从而影响臭氧降解KET的速率.本实验在酸性,中性和碱性的条件下分别对KET进行臭氧氧化,实验在室温下进行,KET初始浓度为20μmol/L,臭氧流量0.4L/min,设置了4,5,7,9,10共5个pH值,最终求得不同pH值条件下的反应速率常数.结果如图2所示,本文所有图中的误差线均表示一倍标准偏差.

图2 不同pH值对KET降解的影响Fig.2 Influence of pH on KET degradation
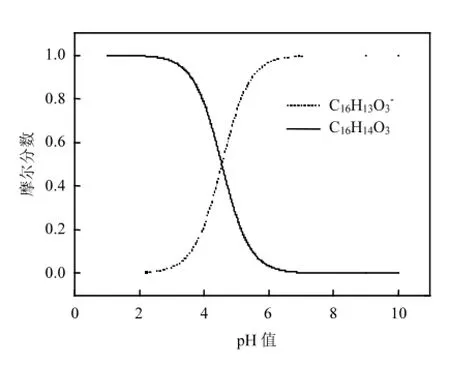
图3 KET的解离平衡Fig.3 Dissociation equilibriumof KET
在碱性的条件下,臭氧降解KET的效果明显优于酸性和中性条件.当pH值从4增大到10时,KET的降解速率常数从0.018增大到0.050, min-1,pH值从4增大到7,k增大0.011, min-1,从7增大到10, k增大0.021,min-1.O3直接进攻反应物选择性比较强而且主要在酸性条件下反应,而·OH反应无选择性,反应速度快[15,21].·OH的引发过程有赖于OH,在碱性条件下,溶液中的OH浓度相较于中性和酸性来说比较大,因此引发更多O3发生链式反应产生·OH,使得·OH浓度增大,更多KET被氧化.
另外,有机物在溶液中的解离性质也会影响它被降解的能力,KET的解离图如图3,其pKa值为4.55,当pH大于这个值时,它在溶液中主要是以电离出一个氢离子的负离子状态存在的,负离子基团附近的电子云密度大,更容易受到氧化剂的攻击.
2.2 臭氧流量的影响
臭氧是氧化反应的外在动力,本文通过改变臭氧的流量从而改变通入体系的总臭氧量,考察了不同臭氧投加量对KET降解的影响,KET的初始浓度为20 μmol/L且保持不变,反应液初始pH值为7.0,反应在室温下进行,臭氧流量分别为0.06,0.2,0.3,0.4,0.6L/min.实验结果如图4所示.
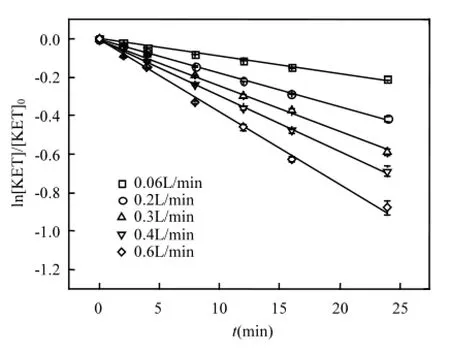
图4 不同臭氧流量对KET降解的影响Fig.4 Influence of ozone flowon KET degradation
结果显示,提高臭氧的量有利于KET降解,实验进行24min后,随着流量增大,不同流量下对应的降解速率常数分别为0.008,0.017,0.024, 0.029,0.037min-1,半衰期从87min减小到19min.这主要是因为臭氧量增多,水中存在的溶解态O3分子的量以及其在溶液中分解产生的·OH的浓度增大[21],而KET的量不变,即单位KET对应的氧化剂的比值加大,这有利于KET的降解;De Witte等[22]研究了臭氧降解环丙沙星,发现臭氧投加量越大,降解效果越好.另一方面,当臭氧流量按照0.06,0.2,0.3,0.4,0.6L/min变化时对应的增大比例为1:3.33:5:6.67:10,而相应的KET降解速率常数增大比例为1:2.12:3:3.63:4.63.可明显看出,KET降解速率并未随着臭氧流量的增加而等比例增大,臭氧流量越大,单位浓度臭氧氧化KET的效率越低.因此,在实际应用时,应综合考虑臭氧的氧化速率和KET的降解速率,从而选择合适的臭氧流量.
2.3 温度的影响
温度会影响臭氧在水中的溶解度,稳定性以及体系中的化学反应速率,因此本实验研究了288,293,301,308和318K共5个温度下KET的降解情况,实验在臭氧流量0.4L/min, KET初始浓度20μmol/L, pH值为7的条件下进行,实验过程中将反应器置于恒温水浴箱中控制所设定的温度,实验结果如图5所示.
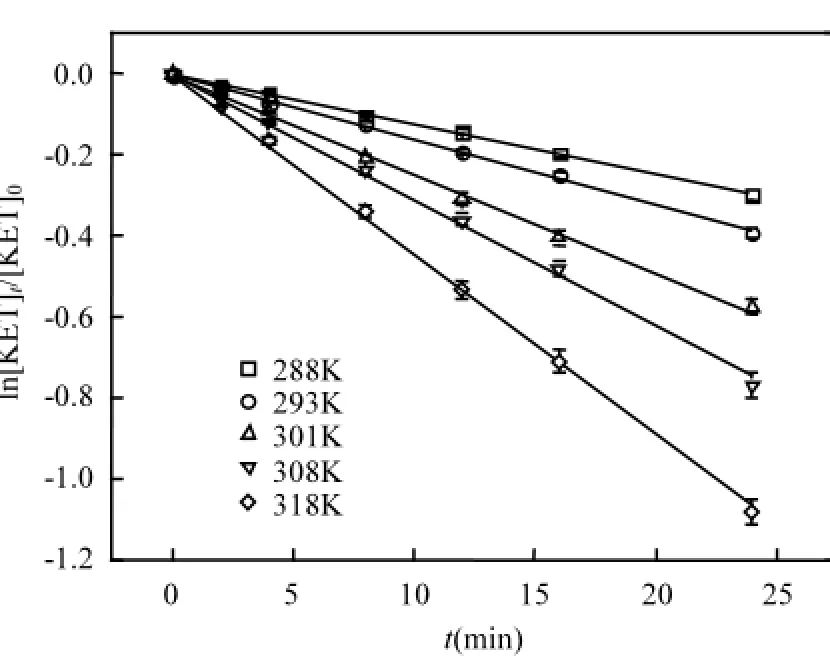
图5 不同温度对KET降解的影响Fig.5 Influence of temperature on KET degradation
随着温度从288升至318K,KET的降解速率常数从0.015增大到0.059(min-1),一般来说,对于普通化学反应,升高温度有利于提高反应速率.根据Arrhenius方程以及Eying方程:

式中:A为指前因子,可通过式(1)~(2)求得,活化能E,焓变H和熵变S分别为32.83kJ/mol,30.32kJ/ mol,-165.75J/(mol·K).活化能的大小显著地影响反应速率,反应活化能越小,反应速率越快,因为活化能越小,能达到临界能量的活化分子越多,因此反应速率就越快.一般氧化反应活化能为70~170kJ/mol[23],而臭氧体系氧化降解KET所需的活化能为32.83kJ/mol,说明臭氧氧化降解KET过程较容易进行,属于快速反应.焓变和熵变分别为30.32kJ/mol和-165.75J/ (mol·K),表明该实验是一个吸热反应.根据Lechatelier's理论,升高温度可以提高整个体系中反应物的平均动能,使更多分子转化为活化分子,也就是说单位体积内的分子间的有效碰撞机率增大,导致反应速率加快,从而提高降解效率.
2.4 KET初始浓度的影响
污染物初始浓度是影响其降解的一个重要因素之一,本实验在臭氧量为0.4L/min, pH值为7的室温条件下考察了初始浓度在2~40 μmol/L范围内KET的降解动力学.结果如图6所示.

图6 不同初始浓度对KET降解的影响Fig.6 Influence of initial KET concentration on KET degradation
结果表明,不同初始浓度下KET的降解符合一级动力学,初始浓度从2 μmol/L增大到40 μmol/L,速率常数从0.046(min-1)减小到0.025(min-1);在实验条件一致的情况下,理论上水中溶解的臭氧以及臭氧分解产生的·OH的量是一定的,因此随着KET浓度增大,溶液中KET分子之间相互竞争氧化剂的作用增大,从而使其氧化速率随着初始浓度增大而降低.另外,KET初始浓度越高,降解过程中生成的副产物越多,这些副产物会和母体竞争氧化剂,从而降低母体的降解速率.Gago-Ferrero等[24]研究了臭氧降解防晒剂BP-3也有相同的现象,即BP-3浓度的增大不利于BP-3自身的降解.
2.5 表观动力学模型
由前文的研究可知,臭氧氧化过程中,KET降解速率常数与污染物初始浓度,臭氧加投量,体系初始pH值和反应温度有关,因此,k是关于初始浓度,臭氧投加量,初始pH值及温度的函数,并由一般化学反应表观动力学模型可知[23,25-26],
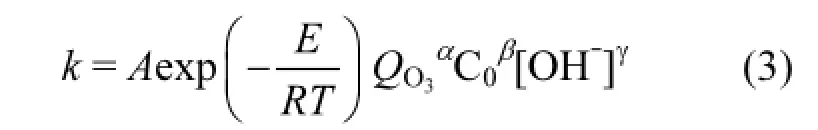
式中:A为指前因子; k为表观反应速率常数, min-1; E为表观反应活化能,J/mol; QO3为臭氧投量,L/min; R为气体常数,8.314J/(mol·K); T为反应温度,K; [OH]为初始OH浓度,mol/L; α,β,γ为指数.
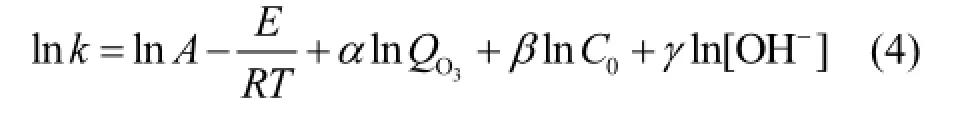
lnk对1/T,ln QO3,ln C0,ln[OH]作线性回归方程,结果如图7所示,可求得,α=0.679,β=-0.2,γ= 0.07,-Ea/R=-3949;从数值上看,α,γ大于0,即臭氧流量以及pH与速率常数值k呈正相关,臭氧流量或者体系初始pH越大,KET速率越快;而β为负数,KET初始浓度与k呈负相关,随着初始浓度增大,降解速率减小;另外,E/R的值恒大于0,也就是说,对于任何非特殊的化学反应,升高温度反应速率都会提高,而臭氧氧化降解KET是一个吸热反应(H=30.32kJ/mol),升高温度有利于反应正向进行,因此升高温度既加快反应速率又加大反应限度,这与2.1,2.2,2.3,2.4中得出的结果是一致的.

图7 ln k/T与1/T的关系(a); ln k与ln C0的关系(b); ln k与ln Q的关系(c); ln k与ln[OH]的关系(d)Fig.7 relationship between lnk/T and 1/T (a), lnk and lnC0(b), lnk and lnQ (c), lnk and ln[OH](d)
常数项ln A平均值为11.95,因此A的值为154439,最终动力学方程如下,
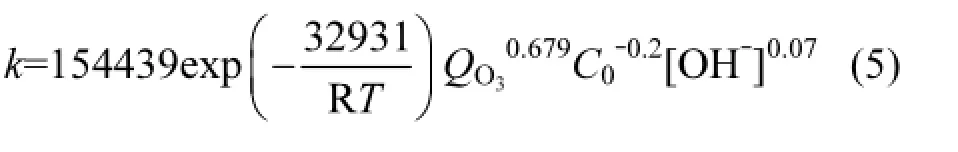
2.6 臭氧作用下KET的氧化降解机理
一般来说,臭氧对PPC Ps的降解是受到臭氧分子和·OH的共同氧化[15,18].叔丁醇(TBA)被认为是一种有效的·OH抑制剂,在·OH淬灭实验中的到广泛地应用[18,22,27].
为了探究KET臭氧氧化过程中的氧化机制,本实验在pH值为4,7,10时分别设置了加入过量叔丁醇与不加叔丁醇进行对比实验,实验在室温下进行, KET初始浓度为20μmol/L,臭氧流量0.4L/min.结果如表1所示,不加叔丁醇,pH值为4,7,10,KET的降解速率常数为0.018,0.029,0.050 (min-1);加入叔丁醇后,KET的降解受到了明显的抑制,pH值为4,7,10,其降解速率常数分别为0.0034,0.0032,0.0031min-1.
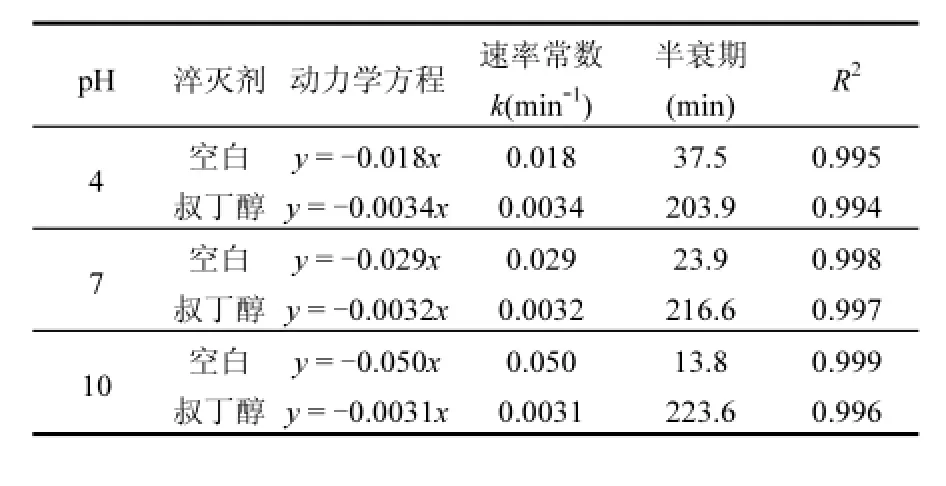
表1 pH=4,7,10及分别加入1mL叔丁醇KET的降解情况Table 1 Degradation kinetics of KET with or without TBA at pH 4, 7,10
根据式(6)可以估算出·OH在整个KET降解过程中的贡献率,

式中: R·OH代表·OH对KET降解的贡献率; k,KET代表KET在体系中的降解速率常数; k·OH代表·OH对KET的降解速率常数; kTBA代表体系中存在叔丁醇的条件下KET的降解速率常数.
pH值为4,7,10时·OH的贡献率分别为81.6%,89.0%及93.8%,即臭氧的贡献率为18.4%, 11.0%,6.2%;可证明·OH对KET的降解起主导作用.
2.7 KET与O3及·OH二级速率常数的测定
由于臭氧化降解过程的复杂性,在进一步地认识反应机理的过程中,有机物与臭氧及·OH反应速率常数的求解一直是研究重点.一般来说,臭氧氧化降解有机物是由于臭氧和·OH共同引起的,因此其降解动力学方程可由(式7,8)表示,

式中: [C]0,[C]t分别代表反应物起始时刻和t时刻的浓度值; kC分别代表反应物在体系中的降解速率常数; kO3,C, k·OH,C分别代表反应物与臭氧及·OH反应的速率常数
本实验采用竞争法测KET分别与臭氧及·OH的反应速率常数.实验选用布洛芬(IBP)作为竞争臭氧分子的探针物质,布洛芬与KET拥有相似臭氧反应动力学常数并且已知其与臭氧反应的速率常数值为7.2L/(mol·s)[13],分别配制500mL含20μmol/L KET和20μmol/L布洛芬的反应液于反应器中,实验在臭氧流量0.4L/min,室温条件下进行.为消除·OH对反应的影响,将反应液pH调至2,在反应溶液中添加1mL叔丁醇对·OH进行淬灭,实验进行第0,2,4,8,12,16,24min后取样后分别测定KET和布洛芬的浓度.KET与布洛芬的降解动力学如表2所示.

表2 竞争实验中KET和布洛芬的降解Table 2 Degradation kinetics of KET and IBP that measured in the competition experiment
KET和布洛芬的降解均符合一级动力学.

根据式(9),(10)及(11)可求得,KET与臭氧分子的反应速率常数为1.09L/(mol·s),与文献[21]指出的不同结构性质有机物与O3反应速率常数在10-2~109L/(mol·s)之间结果相一致.
同理,选用苯甲酸(BA)作为间接法测定KET与·OH反应速率常数的探针物质,为了确保体系中有大量的·OH,实验设置在pH值为10,臭氧流量0.4L/min,室温下进行,分别配制500mL含20μmol/L KET和20 μmol/L苯甲酸的反应液于反应器中,实验开始后按一定时间取样分别测定KET和苯甲酸的浓度.KET与苯甲酸的动力学方程分别如表3所示.

表3 竞争实验中KET和苯甲酸的降解Table 3 Degradation kinetics of KET and BA that obtained in the competition experiment
KET和苯甲酸的降解均符合一级动力学.

在该实验条件下,·OH对KET降解的贡献率为93.8%,同时测得·OH对苯甲酸降解的贡献率为96%,为了更准确地求得KET与羟基自由的反应速率常数,对公式进行修正,引入了·OH的贡献率[28]:
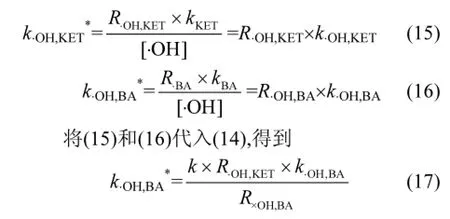
已知苯甲酸与·OH的二级反应速率常数5.9×109L/(mol·s)[29],求得k为1.526,可以计算出KET和·OH的二级反应速率常数8.82×109L/ (mol·s),与Real等[7]的研究结果[(8.4±0.3)×109L/ (mol·s)]基本一致,也符合·OH与有机物反应的速率常数范围(106~109量级)[30].
由此可看出,KET与臭氧直接反应的速率常数为1.09L/(mol·s),远小于其与·OH的反应速率常数8.82×109L/(mol·s),进一步说明臭氧氧化KET体系中,·OH氧化占主导地位.
3 结论
3.1 臭氧氧化法能够有效地降解KET,其降解效率受溶液初始浓度,臭氧浓度,pH值和温度的影响.KET的初始浓度越大,其降解速率越小;臭氧流量的增大,KET降解速率增大;pH值对反应有很大影响,碱性环境对KET降解有利;温度越高对KET降解越有利.
3.2 臭氧降解KET的活化能E=32.83kJ/mol,低于一般化学反应的活化能(70~170kJ/mol),说明臭氧法降解KET比较容易进行.
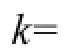
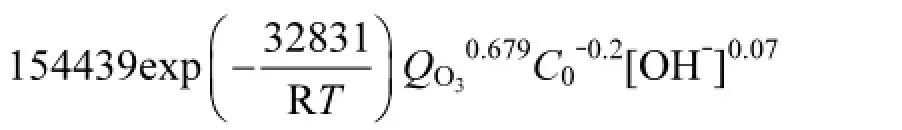
3.4 臭氧作用下KET的氧化降解既包含了O3的直接氧化,也包含了O3诱发产生的·OH的间接氧化.
3.5 在KET初始浓度为20 μmol/L,臭氧流量0.4L/min,室温条件下,初始pH值为4,7,10时,O3对KET降解的贡献率分别为18.4%,11.0%,6.2%,而·OH对KET降解的贡献率分别为81.6%,89.0%及93.8%.KET与O3的二级反应速率常数为1.09L/(mol·s),与·OH的二级反应速率常数为8.82×109L/(mol·s).
[1] Duan Y P, Meng X Z, Wen Z H, et al. Acidic pharmaceuticals in domestic wastewater and receiving water fromhyperurbanization city of China (Shanghai): environmental release and ecological risk [J]. Environmental Science and Pollution Research, 2013,20(1):108-116.
[2] Nakada N, Tanishima T, Shinohara H, et al. Pharmaceutical chemicals and endocrine disrupters in municipal wastewater inTokyo and their removal during activated sludge treatment [J]. Water Research, 2006,40(17):3297-3303.
[3] Santos J L, Aparicio I, Alonso E. Occurrence and risk assessment of pharmaceutically active compounds in wastewater treatment plants. A case study: Seville city (Spain) [J]. Environment International, 2007,33(4):596-601.
[4] Lindqvist N, TuhkanenT, Kronberg L. Occurrence of acidic pharmaceuticals inrawand treated sewages and inreceiving waters [J]. Water Research, 2005,39(11):2219-2228.
[5] Cao J, Shi J, Han R, et al. Seasonal variations in the occurrence and distribution of estrogens and pharmaceuticals in the Zhangweinanyun River System[J]. Chinese Science Bulletin, 2010,55(27/28):3138-3144.
[6] Rahman MF, Yanful E K, JasimS Y. Endocrine disrupting compounds: Pharmaceuticals and personal care products strategic research initiative [J]. Journal of W ater and Health, 2009,7(2): 224-243.
[7] Real F J, Benitez F J, Acero J L, et al. Kinetics of the Chemical Oxidation of the Pharmaceuticals Primidone, Ketoprofen, and Diatrizoate in Ultrapure and Natural W aters [J]. Industrial & Engineering Chemistry Research, 2009,48(7):3380-3388.
[8] 邓 芠,刘国光,吕文英,等.水中无机氮形态变化对酮洛芬光降解的影响 [J]. 中国环境科学, 2016,(5):1456-1462.
[9] Feng L, Oturan N, Van Hullebusch E D, et al. Degradation of anti-inflammatory drug ketoprofen by electro-oxidation: comparison of electro-Fenton and anodic oxidation processes [J]. Environmental Science and Pollution Research, 2014,21(14): 8406-8416.
[10] Broseus R, Vincent S, Aboulfadl K, et al. Ozone oxidation of pharmaceuticals, endocrine disruptors and pesticides during drinking water treatment [J]. W ater Research, 2009,43(18):4707-4717.
[11] Pratarn W, Pornsiri T, Thanit S, et al. Adsorption and ozonation kinetic model for phenolic wastewater treatment [J]. Chinese Journal of Chemical Engineering, 2011,19(1):76-82.
[12] Parka C, Choia E, Jeonb H, et al. Effect of nitrate on the degradation of bisphenol A by UV/H2O2and ozone/H2O2oxidation in aqueous solution [J]. Desalination and Water Treatment, 2014,52:797-804.
[13] Vel Leitner N K, Roshani B. Kinetic of benzotriazole oxidation by ozone and hydroxyl radical [J]. W ater Research, 2010,44(6): 2058-2066.
[14] 皮运正,王建龙.臭氧氧化水中4-氯酚的机理和反应途径 [J].中国科学(B辑化学), 2006,(1):87-92.
[15] 皮运正,王建龙.臭氧氧化水中2,4,6-三氯酚的反应机理研究[J]. 环境科学学报, 2005,(12):47-51.
[16] Horsing M, Kosjek T, Andersen H R, et al. Fate of citalopramduring water treatment with O3, ClO2, UV and fenton oxidation [J]. Chemosphere, 2012,89(2):129-135.
[17] Beltran F J, Aguinaco A, Garcia Araya F J, et al. Ozone and photocatalytic processes to remove the antibiotic sulfamethoxazole fromwater [J]. W ater Research, 2008,42(14):3799-3808.
[18] Sein MM, Zedda M, Tuerk J, et al. Oxidation of diclofenac with ozone in aqueous solution [J]. Environmental Science & Technology, 2008,42(17):6656-6662.
[19] Klavarioti M, Mantzavinos D, Kassinos D. Removal of residual pharmaceuticals fromaqueous systems by advanced oxidation processes [J]. Environment International, 2009,35(2):402-417.
[20] Huber MM, Canonica S, Park G, et al. Oxidation of pharmaceuticals during ozonation and advanced oxidation processes [J]. Environmental Science & Technology, 2003,37(5): 1016-1024.
[21] Von Gunten U. Ozonation of drinking water: Part I. Oxidation kinetics and product formation [J]. Water Research, 2003,37(7): 1443-1467.
[22] De W itte B, Dewulf J, Demeestere K, et al. Ozonation and advanced oxidation by the peroxone process of ciprofloxacin in water [J]. Journal of Hazardous Materials, 2009,161(2/3):701-708.
[23] 张 凌,陶 莹,常志显,等.臭氧法降解水中对甲基苯磺酸的动力学研究 [J]. 环境科学学报, 2011(10):2185-2191.
[24] Gago Ferrero P, Demeestere K, Diaz-Cruz S, et al. Ozonation and peroxone oxidation of benzophenone-3in water: Effect of operational parameters and identification of intermediate products [J]. Science of The Total Environment, 2013,443:209-217.
[25] 郑 可,周少奇,杨梅梅.臭氧降解高浓度腐殖酸动力学 [J]. 环境科学, 2012,(3):879-884.
[26] Dai Q, W ang J, Chen L, et al. Degradation of p-acetamidophenol in aqueous solution by ozonation: performance optimization and kinetics study [J]. Industrial & Engineering Chemistry Research, 2014,53(29):11593-11600.
[27] Cong J, Wen G, Huang T, et al. Study on enhanced ozonation degradation of para-chlorobenzoic acid by peroxymonosulfate in aqueous solution [J]. Chemical Engineering Journal, 2015,264:399-403.
[28] Chen P, Lv W Y, Chen Z M, et al. Phototransformation of mefenamic acid induced by nitrite ions in water: mechanism, toxicity, and degradation pathways [J]. Environmental Science and Pollution Research, 2015,22(16):12585-12596.
[29] Ji Y F, Zhou L, Zhang Y, et al. Photochemical degradation of sunscreen agent 2-phenylbenzimidazole-5-sulfonic acid in different water matrices [J]. W ater Research, 2013,47(15):5865-5875.
[30] 赵 翔,曲久辉,李海燕,等.催化臭氧化饮用水中甲草胺的研究[J]. 中国环境科学, 2004,34(3):77-80.
Study on ketoprofen degradation behavior and mechanismunder ozonation.
LIN Xiao-xuan, LIU Guo-guang*, LI Ruo-bai, KONG Qing-qing, CHEN Zhi-ming, LI Fu-hua, CHEN Ping, LU Yi-da
(School of Environmental Science and Technology, Guangdong University of Technology, Guangzhou 510006, China). China Environmental Science, 2017,37(2):598~605
Oxidization of the simulated ketoprofen (KET) wastewater was investigated by ozone (O3). The effect of the initial solution pH, ozone flow(QO3), temperature (T), and initial KET concentration (C0) on KET degradation were investigated. To assess the contribution of O3and hydroxyl radicals (·OH) to the degradation of KET, experiments have been conducted under the conditions comprising initial KET concentration of 20µmol/L, ozone flowat 0.4L/min, pH at 4, 7, or 10under roomtemperature. In the competition experiments, ibuprofen and benzoic acid were used as the probe to measure the second-order rate constants of KET degradation with respect to O3and ·OH, respectively. Results indicated that KET degradation followed the pseudo first-order kinetics. Increasing pH, QO3and T accelerated KET degradation, while KET degradation rate decreased with the increase of C0. The apparent kinetics equation (k=154439exp (-32831/RT)QO30.679C0-0.2[OH]0.07) was obtained by fitting experimental data. Both O3and ·OH are contributed to the degradation of KET. Results also showed that the contribution of O3to KET degradation were 18.4%,11.0%, and 6.2%, while to ·OH were 81.6%, 89.0% and 93.8% at pH 4, 7, and 10, respectively. The second-order rate constants of KET were 1.09, and 8.82×109L/(mol·s) with respect to O3and ·OH, respectively.
ozonation;ketoprofen;apparent kinetics equation;hydroxyl radical;second-order rate constant
X131.2
A
1000-6923(2017)02-0598-08
林晓璇(1991-),广东广州人,广东工业大学硕士研究生,主要从事水中污染物治理与环境行为方面的研究.
2016-03-22
国家自然科学基金资助项目(21377031);广东省科技项目(2013B020800009)
* 责任作者, 教授, liugg615@163.com
