氨氮负荷波动对城市污水短程硝化-厌氧氨氧化工艺硝态氮的影响
2017-04-08张树军杨延栋谷鹏超彭永臻
程 军,张 亮,张树军,杨延栋,谷鹏超,彭永臻*
(1.北京工业大学,国家工程实验室,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京 100124;2.北京城市排水集团有限责任公司科技研发中心,北京污水资源化工程技术研究中心,北京 100022;3.哈尔滨工业大学,黑龙江 哈尔滨 150090)
氨氮负荷波动对城市污水短程硝化-厌氧氨氧化工艺硝态氮的影响
程 军1,张 亮1,张树军2,杨延栋3,谷鹏超2,彭永臻1*
(1.北京工业大学,国家工程实验室,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京 100124;2.北京城市排水集团有限责任公司科技研发中心,北京污水资源化工程技术研究中心,北京 100022;3.哈尔滨工业大学,黑龙江 哈尔滨 150090)
亚硝酸盐氧化菌(NOB)增长是导致城市污水短程硝化-厌氧氨氧化(partial nitrification/anammox,PN/A)工艺脱氮效率降低的主要原因之一.采用SBR反应器研究了周期性的进水氨氮负荷变化对城市污水PN/A工艺出水硝酸盐的影响.结果表明:恒定曝气量和曝气时间,进水氨氮负荷周期性降低时,PN/A工艺出水硝态氮逐渐增长,导致系统脱氮性能下降.在硝态氮增长之后,保持进水氨氮负荷稳定,系统的脱氮性能未恢复.进一步分析表明:低氨氮浓度下,NOB对于溶解氧的竞争是出水硝态氮增长的主要原因.因此,在城市污水PN/A工艺中,为了维持稳定的脱氮性能需要控制溶解氧和出水氨氮浓度.
负荷波动;短程硝化-厌氧氨氧化(PN/A);DO;NOB
短程硝化-厌氧氨氧化(PN/A)自养脱氮工艺是一种经济、节能的新型脱氮工艺[1-2].其工艺原理是:在好氧条件下氨氧化菌(AOB)将部分氨氮(NH4+-N)转化为亚硝态氮(NO2-N),在缺氧条件下,厌氧氨氧化菌(Anammox)以生成的亚硝态氮为电子受体,将剩余氨氮转化为氮气的生化反应过程[3].目前,短程硝化-厌氧氨氧化工艺主要应用于高氨氮废水的处理[4].与传统硝化反硝化工艺相比,短程硝化-厌氧氨氧化工艺仅需要将一半的NH4+-N转化为NO2-N,从而减少曝气量.根据报道,采用厌氧氨氧化脱氮工艺将使城市污水处理厂能耗降低40%~50%[5-6];其次,短程硝化-厌氧氨氧化自养脱氮工艺无需投加外加碳源,脱氮效率不受进水碳氮比的影响[7];最后,通过回收污水中有机碳源用于厌氧消化产甲烷,可能实现污水处理厂的能量平衡甚至产能[8-9].
经过多年的试验研究,城市污水厌氧氨氧化工艺已经在接种污泥的富集培养[10]、反应器的启动和运行控制[11-12]、低温条件下系统的稳定运行[13-14]、系统破坏和恢复策略等方面做了大量研究[15].研究结果显示,PN/A工艺普遍存在NOB增长引起出水硝酸盐增加、总氮去除率下降的问题.有效地抑制NOB的增长是城市污水PN/A工艺稳定运行的关键[16].
进水波动是实际污水处理厂普遍存在的现象[17],为确保出水水质,传统硝化-反硝化工艺通过输入过量能量以保证硝化完全,因此进水波动对传统工艺影响较小.然而,对于控制要求更高的PN/A工艺,进水负荷波动对于系统稳定性的影响还不明确.研究负荷波动条件下城市污水短程硝化-厌氧氨氧化工艺硝态氮增长方式并分析其作用机制,对于控制硝态氮的增长保证系统稳定运行具有重要意义.本文采用SBR反应器,通过控制进水氨氮浓度模拟城市污水处理厂负荷波动,考察系统出水硝态氮、氨氮等水质参数的变化规律,探索进水氨氮负荷波动对于系统硝态氮的影响,并给出城市污水一体化短程硝化-厌氧氨氧化工艺硝态氮增长的原因和控制策略.
1 材料和方法
1.1 反应装置和接种污泥
试验采用2个相同的SBR反应器(图1).反应器采用有机玻璃制成,内径20cm,高40cm,有效容积12L.反应器外围设置水浴加热;为了保证混合和传质效果,反应器设置有搅拌装置;曝气采用曝气泵和曝气砂盘,转子流量计控制曝气量.反应器接种污泥来自一个稳定运行的高氨氮废水一体化厌氧氨氧化反应器[18],污泥形态为絮体和颗粒污泥混合形式,接种污泥反应器总氮去除负荷平均为0.8kgN/(m3·d),污泥平均粒径269μm,其中絮体污泥(粒径小于200μm)占到41%.接种污泥用自来水冲洗4次之后投加到反应器中,初始混合液污泥浓度分别为3354,3510mg/L.
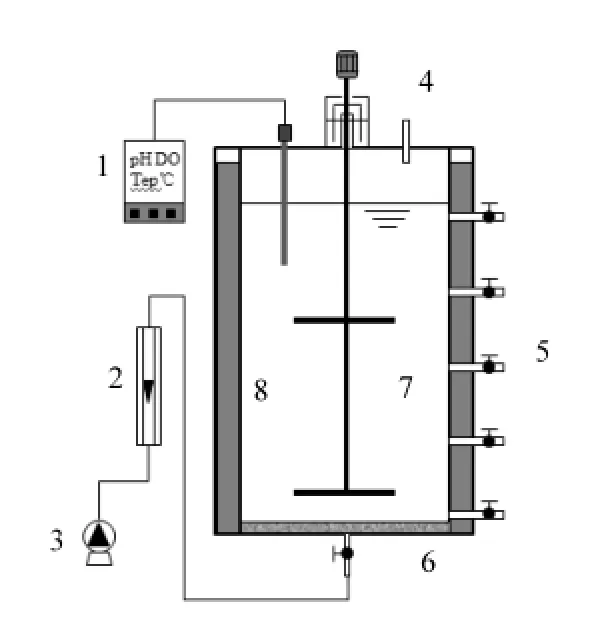
图1 SBR反应器示意Fig.1 Schematic diagramof the SBR reactor
1.2 进水水质和试验方案
试验采用配水,每周期进水量相同,通过改变进水氨氮浓度模拟城市污水进水氨氮负荷的波动.配水以自来水为本底,投加NH4HCO3.进水水质(mg/L):COD:8.7~16.0;:18.6~92.5;-N:0.0~2.2;:0.0~6.3. pH: 7.2~8.1.
试验分为3个阶段,表1为进水氨氮浓度和负荷.阶段Ⅰ:启动和稳定期.系统接种污泥后,进水氨氮浓度从80mg/L降低到40mg/L,相应的反应时间从4h缩短至2h,稳定运行62个周期;阶段Ⅱ:负荷波动.进水氨氮浓度以40mg/L为基准进行波动,SBR1和SBR2每隔一个周期进水浓度分别降低为30,20mg/L,试验进行81个周期;阶段Ⅲ:进水氨氮浓度稳定维持40mg/L,用于系统恢复,试验持续42个周期.
两个反应器除进水氨氮浓度以外,其他指标控制相同.反应器运行方式为:进水10min,连续曝气120min,沉淀25min,排水10min,每天运行3个周期.试验过程中控制曝气量恒定,溶解氧浓度为0.06~0.28mg/L,控制反应器内温度26±1℃,通过投加NaHCO3以保持反应出水pH值不低于6.8.
可利用对各信任评价集的隶属度来反映直接信任的大小,节点的某个信任因素在不同信任评价集上的隶属度可组成这个节点在该单因素上的模糊向量,此向量可以用来表示节点在各因素上的信任值评价大小。本文设置了4个程度的模糊子集Ui(i=1,2,3,4)分别表示节点信任的不同程度{不可信,低可信,中可信,高可信}。

表1 试验各阶段进水氨氮浓度和负荷Table 1 Influent ammoniumconcentration and NLR presented in each phase
1.3 检测指标和方法
pH值、温度和DO采用便携式检测仪(WTW 340i,Germany)进行检测,进出水水样分别检测氨氮、亚硝态氮、硝态氮等指标.检测方法如下:采用纳氏试剂分光光度法测定;采用N-(1萘基)-乙二胺分光光度法测定;采用麝香草酚分光光度法测定.污泥浓度采用滤纸过滤称重法;好氧呼吸速率(OUR)采用活性污泥呼吸仪(Strathkelvin Instruments, UK)检测.
2 结果和讨论
2.1 进水负荷对系统硝态氮的影响
2.1.1 反应器启动和稳定运行 SBR1和SBR2启动和稳定运行结果分别如图2和图3第Ⅰ阶段所示.启动初期进水浓度为80~90mg/L,出水浓度维持在10mg/L左右,出水浓度约为10mg/L,硝态氮产生比例为0.1左右.反应器稳定运行15个周期后进水浓度降低为40mg/L.出水维持在10mg/L左右,浓度持续低于1mg/L,出水浓度进一步降低,硝态氮产生比例低于0.1,总氮去除负荷维持在0.24kgN/(m3·d),反应器稳定运行62个周期.试验结果表明保持进水氮负荷恒定,可以实现稳定的一体化短程硝化-厌氧氨氧化自养脱氮.

图2 SBR 1氮素污染物浓度变化Fig.2 The variation of N-compounds concentration in SBR1
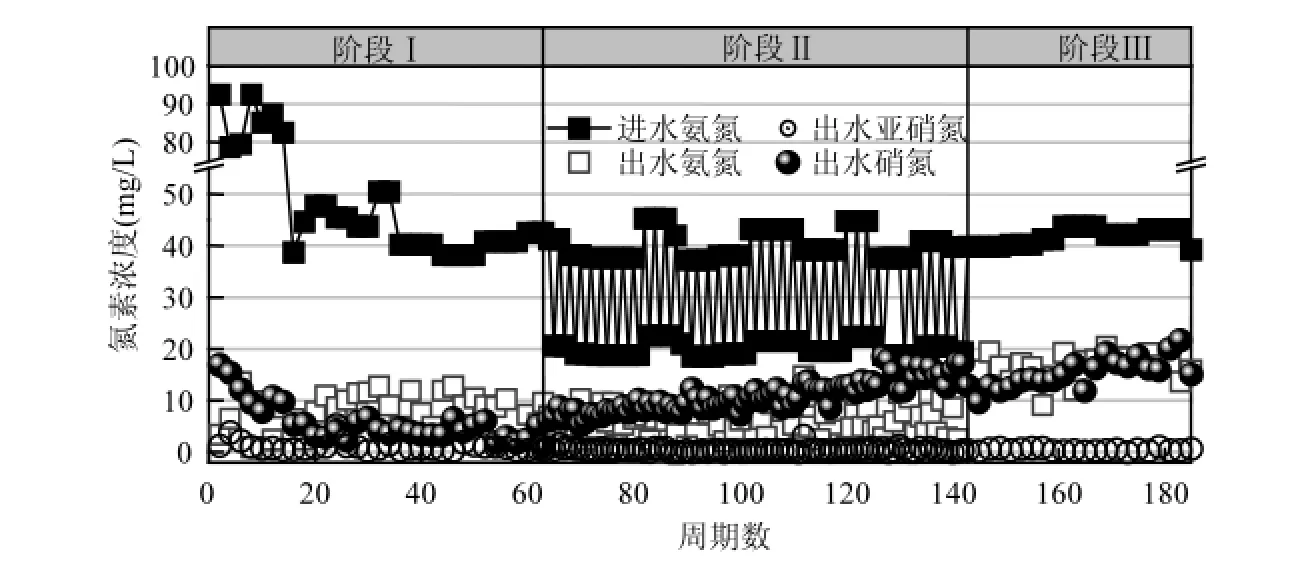
图3 SBR 2氮素污染物浓度变化Fig.3 The variation of N-compounds concentration in SBR2
2.1.2 进水负荷周期性波动 图2和图3第Ⅱ阶段反映了进水负荷波动时SBR1和SBR2出水氮素浓度变化.结果表明进水负荷发生波动时,出水硝态氮浓度呈现迅速升高,之后缓慢增加的趋势,其增长速率基本恒定.反应器出水浓度在0~10mg/L之间波动,出水浓度低于1mg/L.由图4可知,硝态氮产生比例Δ/ Δ随着波动的延续逐渐升高,最终增长到0.8左右,其中进水低负荷时的硝态氮产生比例显著高于高进水负荷,且波动比例越大硝态氮产生比例越高.随着波动的延续,SBR1和SBR2出水总氮逐渐升高,总氮去除负荷从0.24kgN/(m3·d) 分别降低到0.1,0.03kgN/(m3·d),总氮去除率从80%分别降低到42%和21%.
反应第62、138和171周期分别检测了SBR1和SBR2反应器中AOB、NOB的好氧呼吸速率,表2为其结果.
由表2可知,进水氨氮负荷发生波动时,2个反应器均出现了AOB活性降低,NOB活性显著升高的现象.从而引起总氮去除负荷和总氮去除率的下降.
反应器出水硝态氮浓度变化以及微生物活性检测结果均表明:在一体化短程硝化-厌氧氨氧化反应器中,进水负荷波动能够引起NOB增长.

图4 硝酸盐生成量与氨氮转化的变化Fig.4 Variation of the ratio between nitrate produced and ammoniumcon

表2 活性污泥好氧呼吸速率变化Table 2 Variation of theoxygen uptake rate for activated sludge

图5 进水波动阶段出水氨氮浓度与硝态氮产生比例之间的关系Fig.5 The correlation between effluent ammoniumconcentration and nitrate production ratio
2.2.1 硝态氮产生比例和出水氨氮之间的关系 由图5可知,出水氨氮浓度越低,硝态氮产生比例越高.在SBR1中,当出水氨氮浓度高于3.86mg/L时能够控制在0.2左右;而在SBR2中,当出水氨氮浓度高于7.98mg/L时Δ约为0.3.因此,出水氨氮浓度与硝态氮的产生具有一定的相关性.已有研究(表3)指出控制较高的剩余氨氮浓度是抑制NOB增长实现短程硝化,稳定运行的有效策略之一.

表3 通过控制剩余氨氮浓度实现短程硝化Table 3 Achieving shortcut nitrification by controlling residue ammonium
2.2.2 出水氨氮浓度对NOB的影响机制 图6说明了典型周期内(第118周期)反应器氮素浓度和溶解氧、pH值沿程变化.反应初期氨氮浓度较高,反应器溶解氧迅速降低,NO2-N少量积累之后很快下降到0.7mg/L以下.反应过程中溶解氧浓度维持在0.03~0.38mg/L范围内,而在反应末段氨氮浓度降低,溶解氧迅速升高,NO3-N增长速率加快.这可能是NOB增长的主要原因.
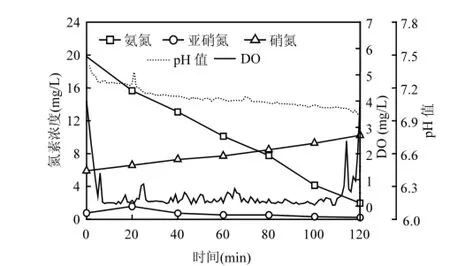
图6 反应器全周期氮素浓度及DO、pH值变化Fig.6 N-compounds concentration and DO、pH variation in one cycle
试验第Ⅰ阶段,出水氨氮浓度能够稳定在10mg/L左右,反应过程中保持低溶解氧和较高的氨氧化速率,NOB难以竞争到溶解氧,出水硝态氮浓度持续较低.试验第Ⅱ阶段,进水氨氮负荷降低,引起反应末段氨氮浓度和氨氧化活性降低,反应器溶解氧升高,从而导致NOB竞争到溶解氧是硝态氮增长的主要原因.Regmi等[12]以短程硝化-反硝化反应器为研究对象,结果表明保持一定的剩余氨氮对于NOB的抑制和淘洗是必要的;Perez等[22]以一体化厌氧氨氧化颗粒污泥反应器为研究对象建立模型指出:控制一定的剩余氨氮浓度能够有效抑制NOB的增长,一定的溶解氧条件下存在相应抑制NOB增长的最小氨氮浓度.所以当氨氮浓度降低时应该及时降低溶解氧浓度以保持NOB的持续抑制[23].当进水负荷连续较低或发生过曝气时(反应第92、112、129周期),将会加剧NOB的增长,出水硝态氮迅速增加.因此,保持进水负荷稳定、控制一定的出水氨氮浓度是抑制NOB增长的有效策略[24].
2.3 系统恢复与调控策略
负荷波动是污水处理厂的一个普遍现象,在城市污水短程硝化-厌氧氨氧化系统中,为了维持稳定的脱氮性能,当进水负荷发生波动时根据进水氨氮浓度确定曝气时间[12],以反应器中氨氮浓度作为曝气终止的指示性指标[20],可以有效避免氨氮浓度过低和溶解氧升高,从而抑制NOB增长.维持系统的稳定运行.
3 结论
3.1 进水氨氮负荷周期性波动会引起短程硝化-厌氧氨氧化工艺硝态氮增长;
3.2 进水氨氮负荷降低引起反应末段氨氮浓度降低和溶解氧升高,NOB竞争到溶解氧进而表达活性,是PN/A工艺硝态氮增长的主要原因;
3.3 在硝态氮增长之后,保持恒定的进水氨氮负荷,提高出水氨氮浓度系统脱氮性能未恢复;
3.4 在城市污水短程硝化-厌氧氨氧化工艺中,保持一定的剩余氨氮浓度,通过实时监测氨氮浓度变化,及时调节曝气是抑制NOB增长的有效途径.
[1] Ali M, Chai LY, Tang CJ, et al. The increasing interest of ANAMMOX research in China: bacteria, process development, and application [J]. Biomed Research International, 2013,10: 1155-1176.
[2] Owusu-Agyeman I, Malovanyy A, Plaza E. Pre-concentration of ammoniumto enhance treatment of wastewater using the partial nitritation/anammox process [J]. Environmental Technology, 2015, 36(10):1256-1264.
[3] Jetten MS M, Strous M, van de Pas-Schoonen K T, et al. The anaerobic oxidation of ammonium[J]. Fems Microbiology Reviews, 1998,22(5):421-437.
[4] Lackner S, Gilbert E M, Vlaeminck S E, er al. Full-scale partial nitritation/anammox experiences-an application survey [J]. Water Research, 2014,55:292-303.
[5] Gao F, Zhang H M, Yang F L, et al. Study of aninnovative anaerobic (A)/oxic(O)/anaerobic(A) bioreactor based ondenitrificationanammox technology treating lowC/N municipal sewage [J]. Chemical Engineering Journal, 2013,232:65-73.
[6] Morales N, Val Del Rio A, Vazquez-Padin JR, et al. Integration of the Anammox process to the rejection water and main streamlines of WWT Ps [J]. Chemosphere, 2015,140:99-105.
[7] De Clippeleir H, Yan X G, Verstraete W, et al. OLAND is feasible to treat sewage-like nitrogen concentrations at lowhydraulic residence times [J]. AppliedMicrobiology and Biotechnology, 2011,90(4):1537-1545.
[8] Kartal B, Kuenen J G, van Loosdrecht MC M. Sewage Treatment with Anammox [J]. Science, 2010,328(5979):702-703.
[9] Siegrist H, Salzgeber D, Eugster J, et al. Anammox brings WWTP closer to energyautarky due to increased biogas production and reduced aeration energy for N-removal [J]. Water Science and Technology, 2008,57(3):383-388.
[10] Wang T, Zhang H, Gao D, et al. Enrichment of Anammox bacteria in seed sludges fromdifferent wastewater treating processes and start-up of Anammox process [J]. Desalination, 2011,271(1-3): 193-198.
[11] A li M, Okabe S. Anammox-based technologies for nitrogen removal: Advances in process start-up and remaining issues [J]. Chemosphere, 2015,141:144-153.
[12] Regmi P, Miller MW, Holgate B, et al. Control of aeration, aerobic SRT and COD input for mainstreamnitritation/ denitritation [J]. Water Research, 2014,57:162-171.
[13] De Clippeleir H, Vlaeminck S E, De Wilde F, et al. One-stage partial nitritation/anammox at 15C on pretreated sewage: Feasibility demonstration at lab-scale [J]. Applied Microbiology and Biotechnology, 2013,97(23):10199-10210.
[14] Isanta E, Reino C, Carrera J, et al. Stable partial nitritationfor low-strength wastewater at lowtemperature inanaerobic granular reactor [J]. Water Research, 2015,80(0):149-158.
[15] Ma B, Wang S Y, Cao S B, et al. Biological nitrogen removal fromsewage via anammox: Recent advances [J]. Bioresource Technology, 2016,200:981-990.
[16] Xu GJ, Zhou Y, Yang Q, et al. The challenges of mainstreamdeammonification process for municipal used water treatment [J]. Applied Microbiology and Biotechnology, 2015,99(6):2485-2490.
[17] 卢 玮,黄伟明,武云志,等.污水处理厂的曝气优化 [J]. 中国给水排水, 2012,28(22):27-30.
[18] 程 军,张 亮,杨延栋,等.一体化厌氧氨氧化反应器的优化及其稳定性研究 [J]. 中国环境科学, 2016,36(4):1027-1032.
[19] Gao DW, Lu JC, Liang H. Simultaneous energy recovery and autotrophic nitrogen removal fromsewage at moderately lowtemperatures [J]. Applied Microbiology and Biotechnology, 2014,98(6):2637-2645.
[20] Laureni M, Falås P, Robin O, ea al. Mainstreampartial nitritation and anammox: Long-termprocess stability and effluent quality at lowtemperatures [J]. Water Research, 2016,101:628-639.
[21] Gilbert E M, Agrawal S, Karst S M, et al. Lowtemperature partial nitritation/anammox in a moving bed biofilmreactor treating lowstrength wastewater [J]. Environment Science and Technology, 2014,48(15):8784-8792.
[22] Perez J, Lotti T, KleerebezemR, et al. Outcompeting nitriteoxidizing bacteria in single-stage nitrogen removal in sewage treatment plants: A model-based study [J]. Water Research, 2014,66:208-218.
[23] Corbala-Robles L, Picioreanu C, van Loosdrecht MC M, et al. Analysing the effects of the aeration pattern and residual ammoniumconcentration in a partial nitritation-anammox process [J]. Environmental Technology, 2016,37(6):694-702.
[24] Malovanyy A, Yang J, Trela J, et al. Combination of upflowanaerobic sludge blanket (UASB) reactor and partial nitritation/ anammox moving bed biofilmreactor (MBBR) for municipal wastewater treatment [J]. Bioresource Technology, 2015,180: 144-153.
The effects ofammoniumloading ratefluctuation on nitrateaccumu lation in municipal wastewater partialnitritation/anammox (PN/A) process.
CHENG Jun, ZHANG Liang, ZHANG Shu-jun, YANG Yan-dong, GU Peng-chao2, PENG Yong-zhen1*
(1.National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology,Engineering Research Center of Beijing, Beijing University of Technology, Beijing 100124, China;2.Research and Development Center of Beijing D rainage Group Corporation, Beijing Wastewater Recycling Engineering Technology Research Center, Beijing 100022, China;3.Harbin Institute of Technology, Harbin 150090, China). China Environmental science, 2017,37(2):520~525
The over-proliferation ofnitrite-oxidizing bacteria (NOB) is one of the main causes for the decrease of the nitrogen removal efficiency in municipal wastewater partial nitritation/anammox (PN/A) process. Municipal wastewater PN/A was established in a sequencing batch reactors (SBR) and the effect of periodic nitrogen loading rate (NLR) fluctuation on nitrate accumulation in the PN/A process was investigated.During the experimental period, influent ammoniumconcentration varied periodically while aeration rate and duration remained constant, inducing a variation of NLR within the range of 0.24~0.48kgN/(m3·d). Effluent nitrate concentration gradually increased under the variation of NLR, resulting in the decline of both nitrogen removal rate and efficiency. Followed by the variation of NLR, the reactor was operated at a stable NLR, which was failed to restore the nitrogen removal performance. NOB was easier to compete for oxygen at lowbulk ammoniumconcentrations, which was the main reason for the unwanted nitrate accumulation. Therefore, a stricterprocess control of DO andresidual ammoniumconcentration was essential to the stable operation ofPN/A systems.
NLR fluctuation;partial nitritation/anammox (PN/A);DO;NOB
X703
A
1000-6923(2017)02-0520-06
程 军(1991-),男,陕西咸阳人,北京工业大学硕士研究生,主要从事污水生物处理理论与应用研究.
2016-06-28
国家自然科学基金(51478013),北京市教委资助项目
* 责任作者, 教授, pyz@bjut.edu.cn
