SNAD工艺在不同间歇曝气工况下的脱氮性能
2017-04-08郑照明杨京月
郑照明,李 军,杨京月,杜 佳
(北京工业大学,北京市水质科学与水环境恢复工程重点实验室,北京 100122)
SNAD工艺在不同间歇曝气工况下的脱氮性能
郑照明,李 军*,杨京月,杜 佳
(北京工业大学,北京市水质科学与水环境恢复工程重点实验室,北京 100122)
探讨了城市污水SNAD生物膜反应器在高溶解氧工况下的脱氮性能. SBR反应器以城市生活污水为进水,反应器内放置鲍尔环生物膜载体,控制温度为30℃,采用间歇曝气方式,曝气阶段曝气量为500L/h,溶解氧浓度达5mg/L.阶段1控制曝气和非曝气时间都为20min,生物膜的NOB活性较低,反应器具有良好的脱氮性能.反应器的总氮平均去除率和出水总氮浓度平均值分别为89%和11mg/L.阶段2、阶段3和阶段4研究了曝气时间对反应器脱氮性能的影响.曝气时间对生物膜的厌氧氨氧化活性影响较小,对生物膜的NOB活性影响较大.阶段3控制曝气时间为60min,生物膜的NOB活性较低,反应器的总氮平均去除率和出水总氮浓度平均值分别为83%和14mg/L.阶段4控制曝气时间为160m in,生物膜的NOB活性较高,反应器的总氮平均去除率降低至50%,出水总氮浓度平均值为35mg/L.
SNAD;生物膜反应器;生活污水;不同间歇曝气工况
含氮污水的大量排放会造成水体富营养化.传统生物脱氮采用硝化反硝化技术,存在着曝气能耗高,污泥产量大,需要额外投加碳源等缺点[1].厌氧氨氧化是一种经济环保的脱氮工艺.在厌氧条件下,厌氧氨氧化菌利用亚硝酸盐氮作为电子受体氧化氨氮,无需消耗有机碳源[2].研究表明在SNAD工艺中,亚硝化菌、厌氧氨氧化菌和反硝化菌可以在一个反应器中相互合作,实现氮素和有机物的去除[3-5].但是SNAD工艺多集中于处理高氨氮高温污水,鲜有关于处理城市生活污水的报道[6-7].
溶解氧浓度对SNAD工艺的脱氮性能具有重要影响[8].因为高浓度溶解氧会抑制厌氧氨氧化菌的活性并且促进NOB的代谢生长,降低反应器的总氮去除能力,所以许多研究在低溶解氧条件下运行SNAD工艺[9-11].但是低浓度溶解氧不利于AOB (ammonia oxidizing bacteria)活性的发挥,导致反应器的脱氮性能低下.研究表明采用生物膜工艺和间歇曝气方式可以有效缓解溶解氧对厌氧氨氧化菌的抑制作用[12-13].此外,间歇曝气工况对NOB的活性具有强烈的抑制作用[8,14].因为从缺氧进入好氧阶段, NOB比AOB需要更长的滞后期才能恢复活性[15].但是,当间歇曝气工况中的曝气时间较长时,厌氧氨氧化菌的活性可能受到抑制, NOB的活性可能增强,导致SNAD工艺的脱氮性能降低.因此有必要研究间歇曝气工况中曝气时间对SNAD生物膜工艺脱氮性能的影响.
本实验拟研究城市生活污水SNAD生物膜工艺在高溶解氧工况下的脱氮性能.考察不同间歇曝气工况对反应器脱氮性能的影响,从而为SNAD工艺在城市污水处理中的工程应用提供指导作用.
1 材料和方法
1.1 实验装置-SNAD生物膜反应器
反应器采用SBR运行方式,安装PLC控制系统实现反应器的自动运行,周期运行完毕之后马上进行下一个周期,装置如图1所示.反应器为圆柱形结构,高79cm,直径为38cm,有效容积为89.5L,反应器内填充鲍尔环作为生物膜载体(K3 载体,AnoxKaldnes,北京),鲍尔环生物膜照片如图2所示,鲍尔环的直径为25mm,分成多个小格,每个小格的直径为4mm,鲍尔环堆积体积为34L,反应器有效盛水容积为77.7L,每周期排水63L,排水比为81%.在底部设置曝气盘,采用温度控制箱在线监测并控制反应器内水温,反应器侧壁(距底部以上20cm处)安装水力搅拌器,排水口设置在底部以上20cm处,排水口直径为20mm.

图2 SNAD生物膜反应器中鲍尔环照片Fig.2 The photo of Kaldnes ring in SNAD biofilmreactor
1.2 SNAD生物膜反应器进水和运行工况
反应器进水采用北京工业大学家属区生活污水,试验阶段主要水质指标如下: CODCr200~300mg/L;60~80mg/L;<1mg/L;<1mg/L; TOC 50~60mg/L; TN 100~140mg/L; pH为7.5~8.0;碱度300~400mg/L.
实验采用的反应器前期已经实现良好的SNAD脱氮性能.整个实验过程曝气量控制为500L/h,温度控制为30℃.实验分为4个阶段,周期运行工况为:进水(5min),间歇曝气工况,后曝气(20min),沉淀(10min),排水(10min),静置(1min).间歇曝气工况由曝气阶段和非曝气阶段组成,在非曝气阶段,曝气停止,水力搅拌器启动,使载体在反应器内处于流化状态,增加微生物和底物的接触.阶段1为SNAD生物膜反应器高效脱氮阶段,阶段2至阶段4研究了曝气时间对反应器脱氮性能的影响,各阶段间歇曝气工况的设置见表1.
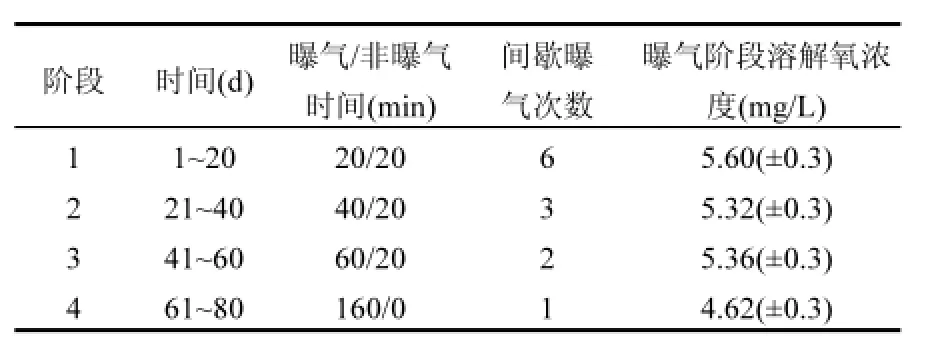
表1 SNAD生物膜反应器运行工况Table 1 Operation conditions in the SNAD biofilmreactor
1.3 批试实验装置及其运行条件
1.3.1 批试污泥 取阶段1(20d)、阶段2(40d)、阶段3(60d)和阶段4(80d)反应器中的鲍尔环进行生物膜的脱氮活性测定.实验前将鲍尔环置于30℃自来水中洗去表面的残留基质.
1.3.2 批试实验水质 实验采用模拟废水,配水氮素组分为NH4Cl和NaNO2.碳源采用无水乙酸钠.其他微量元素组分浓度参照Tang等[16]的文献.各脱氮活性测定时的配水组分见表2.

表2 批试实验主要配水组分(mg/L)Table 2 The synthetic wastewater of batch tests (mg/L)
1.3.3 批试实验装置和程序 实验采用1000mL烧杯,烧杯内放置50个鲍尔环,进行3次平行重复实验.厌氧氨氧化和反硝化活性测定步骤参照文献[16-17]:(1)配置泥水混合液; (2)启动恒温磁力搅拌器,转速为500r/min,用保鲜膜密封烧杯口,通氮气10min (氮气纯度99.999%); (3)停止通氮气,将烧杯连同磁力搅拌器放入30℃的恒温培养箱中. NOB活性测定: (1)配置泥水混合液; (2)往烧杯中鼓入空气,曝气量控制为250mL/min (周期内DO大于6mg/L),启动恒温磁力搅拌器,转速为500r/min,将烧杯连同磁力搅拌器放入30℃的恒温培养箱中.每隔一定时间取样测定主要组分浓度.污泥活性计算根据公式(1).

式中:浓度单位为mg/L;计时终点单位为min;挥发性物质质量单位为g.计时终点的确定:若在取样的时间内,批试装置内的或浓度低于10mg/L,则以或NO2-N浓度刚低于10mg/L的取样时刻为计时终点;若在取样的时间内,批试装置内的或浓度始终高于10mg/L,则以取样结束的时刻为计时终点.污泥活性单位为: kg N/(kg VSS·d).
1.3.4 鲍尔环污泥浓度的确定 用牙签刮落鲍尔环表面附着较为松散的生物膜,将残留有生物膜的鲍尔环放于烧杯中,盛适量水,采用超声设备(VCX105PB)进行处理,振幅设定为90%,超声时间为30min.待鲍尔环表面的生物膜完全脱落,将超声后的泥水混合液和前面的松散污泥混合用滤纸过滤,将截留污泥的滤纸经烘箱和马弗炉处理,烘干时间及温度与常规污泥浓度测量条件相同,得到鲍尔环污泥的干物质量和挥发性物质质量.
1.4 分析方法
1.5 计算方法
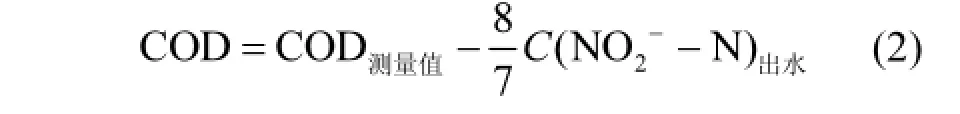
式中: COD和NO2-N单位为mg/L.
采用Y△NO/△NH+−N评价SNAD反应器的脱氮性能,其计算公X式如4下[4]:

式中: C为浓度,单位为mg/L.
2 结果与讨论
2.1 阶段1中SNAD生物膜反应器的脱氮性能阶段1(1~20d), SNAD生物膜反应器采用间歇曝气模式,曝气和非曝气时间都为20min.曝气阶段曝气量控制为500L/h,反应器内的溶解氧浓度达5.60mg/L.图3为反应器的氮素和COD去除性能,反应器具有良好的SNAD脱氮性能.反应器的NH4+-N、COD和TIN平均去除率分别为95%、75%和89%,△NOx-N/△NH4+-N平均值为0.04.出水NH4+-N、NO3-N、TIN和COD浓度平均值分别为2,7,11,56mg/L.图4、图5和图6分别为各阶段生物膜的批试NOB、厌氧氨氧化和反硝化活性测定过程中氮素浓度的变化情况.批试结果表明阶段1生物膜的厌氧氨氧化、反硝化和NOB活性分别为0.267kg TIN/(kg VSS·d), 0.211kg NO2-N/(kg VSS·d)和0.053kg NO2-N/(kg VSS·d),生物膜具有良好的SNAD脱氮性能.
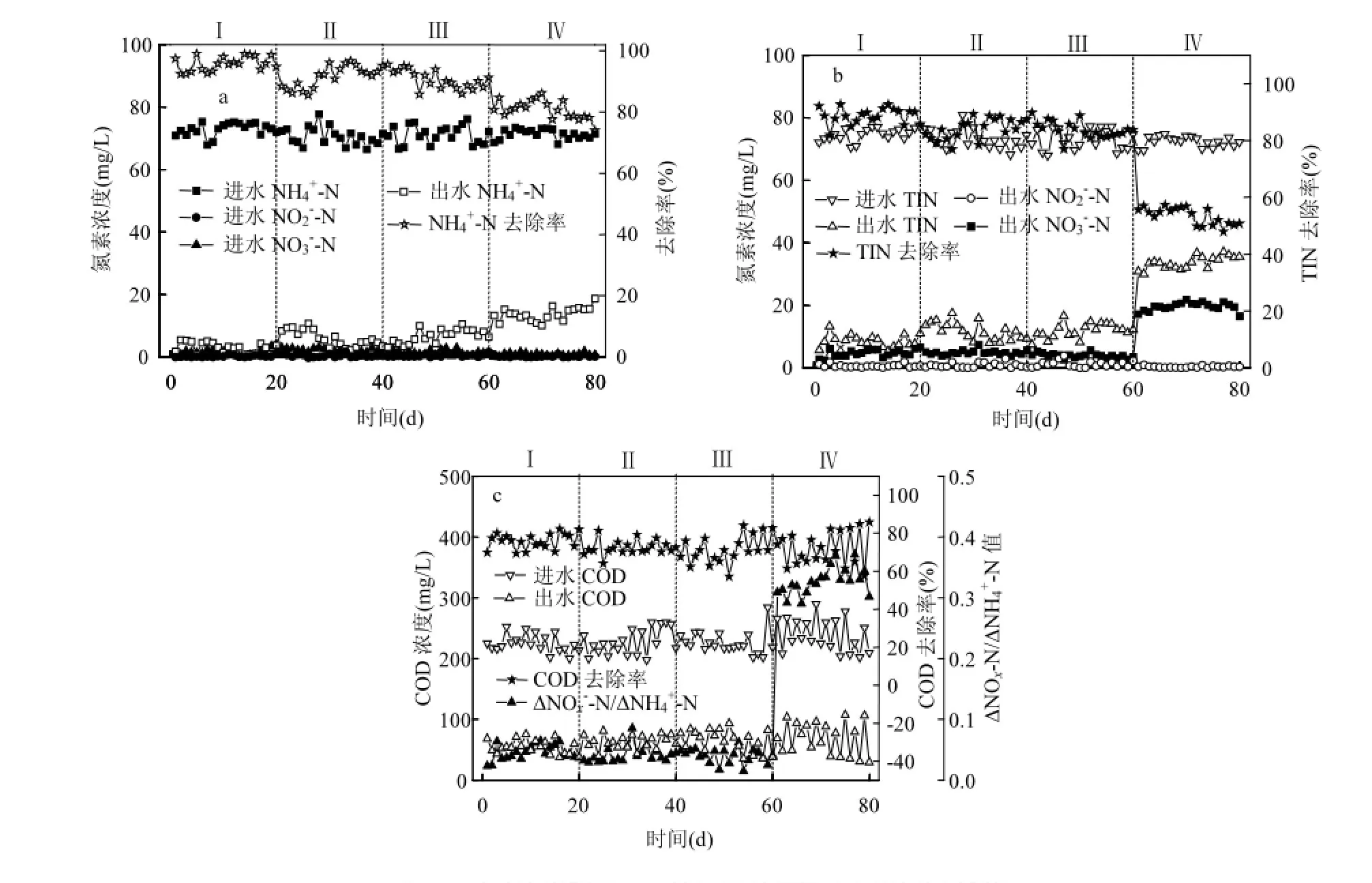
图3 SNAD生物膜反应器的脱氮性能和COD去除性能Fig.3 Evolution of nitrogen compounds and COD removal performance of the reactor
溶解氧会对厌氧氨氧化菌的活性产生抑制作用[20].一些研究表明生物膜工艺和间歇曝气方式可以有效地缓解溶解氧对厌氧氨氧化菌的抑制作用[21-22].在SNAD生物膜工艺中,AOB倾向于生长在生物膜的外表面,厌氧氨氧化菌倾向于生长在生物膜的内部[23-24].因此,生物膜表面的AOB和异养菌对于溶解氧的消耗有助于维持生物膜内部较低的溶解氧浓度[25-26].此外,生物膜对于溶解氧的传质存在阻碍作用,可以为生物膜内部的厌氧氨氧化菌创造有利的厌氧环境[27-28]. Morales等[29]在高溶解氧工况下运行SNAD颗粒污泥工艺(溶解氧浓度为3.0mg/L),微电极分析结果表明当溶液中的溶解氧浓度分别为4和8mg/L时,在颗粒污泥内部150和250 μm处,溶解氧的浓度降低为0mg/L. Sobotka等[8]采用间歇曝气方式运行SNAD活性污泥工艺,控制曝气和非曝气时间分别为9,18min,曝气阶段反应器内的溶解氧浓度为0.8~1.0mg/L,反应器的TIN去除率为72%~89%.Yang等[12]采用间歇曝气方式运行SNAD生物膜工艺,控制曝气和非曝气时间分别为15和45min,曝气阶段反应器内的溶解氧浓度为3.5mg/L,反应器的TIN去除率达到88%.本研究曝气阶段SNAD生物膜反应器内的溶解氧高达5.60mg/L,生物膜的厚度达到2mm(图2),可以有效地缓解溶解氧对厌氧氨氧化菌的抑制作用.
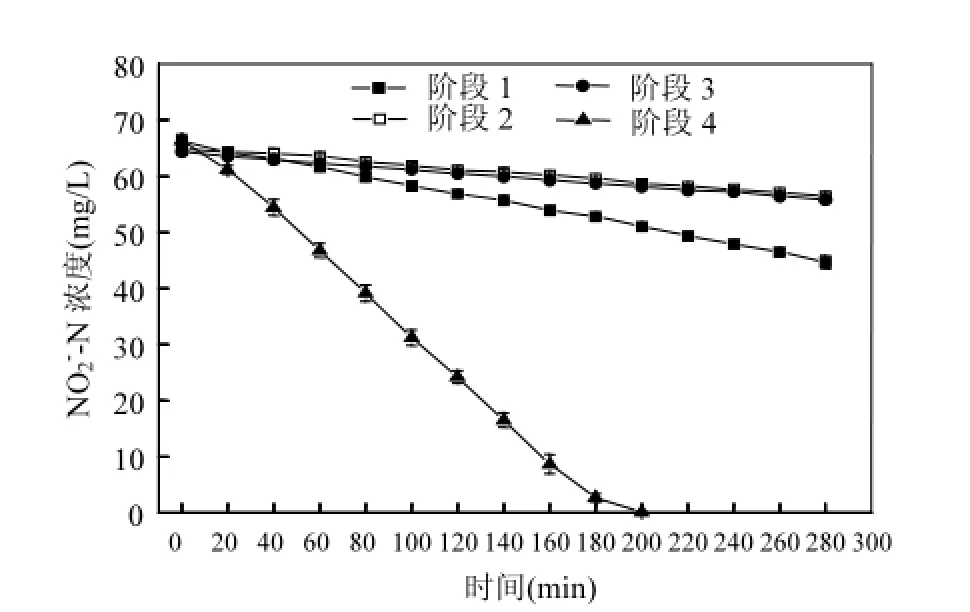
图4 NOB活性测定过程中亚硝酸盐氮浓度变化情况Fig.4 Evolution ofconcentrations in batch tests: the measurement of NOB activity

图5 厌氧氨氧化活性测定过程中氮素浓度变化情况Fig.5 Evolution of nitrogen concentrations in batch tests: the measurement of anammox activity
虽然阶段1曝气阶段反应器内的溶解氧浓度高达5.60mg/L,但是SNAD生物膜的NOB活性较低. Zekker等[13]和Yang等[12]也报道了相似的研究结果. Winkler等[24]指出,NOB倾向于生长在生物膜的外表面,厌氧氨氧化菌和反硝化菌倾向于生长在生物膜的内部.因此,NOB比厌氧氨氧化菌和反硝化菌更容易获取底物亚硝酸盐氮[12].但是,间歇曝气方式有助于抑制NOB的活性[14,30]. Kornaros等[15]的研究表明,从缺氧阶段进入好氧阶段, NOB活性恢复的滞后期比AOB更长. Bournazou等[31]的研究表明,NOB从缺氧阶段进入好氧阶段时, NOB的活性降低,而且缺氧时间长度和NOB的活性降低程度成正相关关系.此外,van等[32]的研究表明,厌氧氨氧化菌对NO2-N的半饱和常数为0.2~5μmol/L,反硝化菌对NO2-N的半饱和常数为4~25μmol/L, NOB对NO2-N的半饱和常数为12~955μmol/L,厌氧氨氧化菌和反硝化菌对NO2-N的亲和能力比NOB更强,有助于抑制NOB的活性.综上所述,阶段1中间歇曝气工况以及厌氧氨氧化菌和反硝化菌对NO2-N的竞争是SNAD生物膜中NOB活性受到抑制的关键因素.

图6 反硝化活性测定过程中亚硝酸盐氮浓度变化情况Fig.6 Evolution of NO2-N concentrations in batch tests: the measurement of denitrification activity
2.2 曝气时间长度对SNAD生物膜反应器脱氮性能的影响
阶段2(21~40d)、阶段3(41~60d)和阶段4(61~80d)研究了曝气时间对SNAD生物膜反应器脱氮性能的影响.阶段2和阶段3采用间歇曝气模式,曝气时间分别控制为40和60min,非曝气时间都控制为20min.阶段4为连续曝气模式,曝气时间为160min.阶段2、3和4曝气阶段曝气量都控制为500L/h,反应器内的溶解氧浓度高达4.6mg/L.如图3所示,阶段2和3反应器的TIN去除效果良好,阶段4反应器的TIN去除效果较差.在阶段2、3和4末期,出水TIN浓度平均值分别为10、14和35mg/L,TIN平均去除率分别为87%、83%和50%.△/△平均值分别为0.047、0.045和0.344.出水浓度平均值分别为5,8,15mg/L,出水浓度都小于2mg/L,出水浓度平均值分别为5, 4, 21mg/L,出水COD浓度平均值分别为61,67, 80mg/L.阶段4出水浓度高于阶段2和3,表明阶段4出现了NOB的大量增殖.阶段2、3和4生物膜的厌氧氨氧化活性相差不大,分别为0.269,0.288,0.274kg TIN/(kg VSS·d)(图5).阶段2、3和4生物膜的NOB活性分别为0.020、0.021和0.246kg/(kg VSS·d)(图4).阶段4生物膜的NOB活性高于阶段2和3,和反应器的脱氮性能一致.
以往的研究表明,控制间歇曝气工况中的好氧时间和缺氧时间分别为5~30min和15~45min,可以有效的抑制SNAD反应器中的NOB活性[12-14].在阶段3中,曝气阶段的时间长达60min, NOB从缺氧阶段进入好氧阶段可以恢复其活性.此外,该阶段溶解氧浓度高达5mg/L,有助于加快NOB的代谢活性并且减少好氧阶段的活性滞后时间[14].但是该阶段生物膜的NOB活性较低,分析原因,在好氧阶段初期, NOB经过活性滞后期才能发挥活性,实际可供NOB进行代谢的时间不足60min.此外,在不同的曝气时间工况下,厌氧氨氧化菌的活性较高,厌氧氨氧化菌和反硝化菌可以表现出较强的亚硝酸盐氮竞争能力,反应器内的亚硝酸盐氮浓度较低,有助于抑制NOB的活性.因此,在阶段2和3中,当曝气时间长度小于60min时,相比于曝气时间长度,厌氧氨氧化菌和反硝化菌对NOB活性的影响较大.
阶段4曝气时间为160min, SNAD生物膜的NOB活性较高.反应器的TIN平均去除率下降至50%,出水浓度平均值增加到21mg/L.生物膜的NOB活性达到0.246kg/(kg VSS·d).阶段4生物膜的厌氧氨氧化活性与阶段2和3相似.因此,厌氧氨氧化菌和反硝化菌仍然可以表现较强的亚硝酸盐氮竞争能力.但是由于阶段4的曝气时间长达160min, NOB有更长的时间利用亚硝酸盐氮进行代谢生长,缓解了缺氧阶段以及厌氧氨氧化菌和反硝化菌对NOB活性的抑制作用,所以生物膜的NOB活性增加.但是其他研究报道一体式亚硝化-厌氧氨氧化工艺可以在连续曝气的工况下表现出较高的总氮去除率. Yang等[12]采用移动床生物膜反应器运行SNAD工艺,控制溶解氧浓度为1.5mg/L,反应器的总氮去除率达到76.1%. Cema等[21]取得了相似的研究结果,控制溶解氧浓度为2.5mg/L,生物膜反应器表现出良好的总氮去除性能.在实际工程中,当采用连续曝气工况时,控制一体式亚硝化/厌氧氨氧化生物膜工艺中的溶解氧浓度在1.5mg/L以下可以有效地抑制NOB的活性[33].在本研究中,连续曝气阶段的溶解氧浓度高于其他研究,从而导致了NOB活性的增加[21,33].因此,有必要研究该连续曝气SNAD生物膜反应器在较低溶解氧浓度下的脱氮性能.
2.3 各阶段SNAD生物膜反应器周期内氮素浓度变化
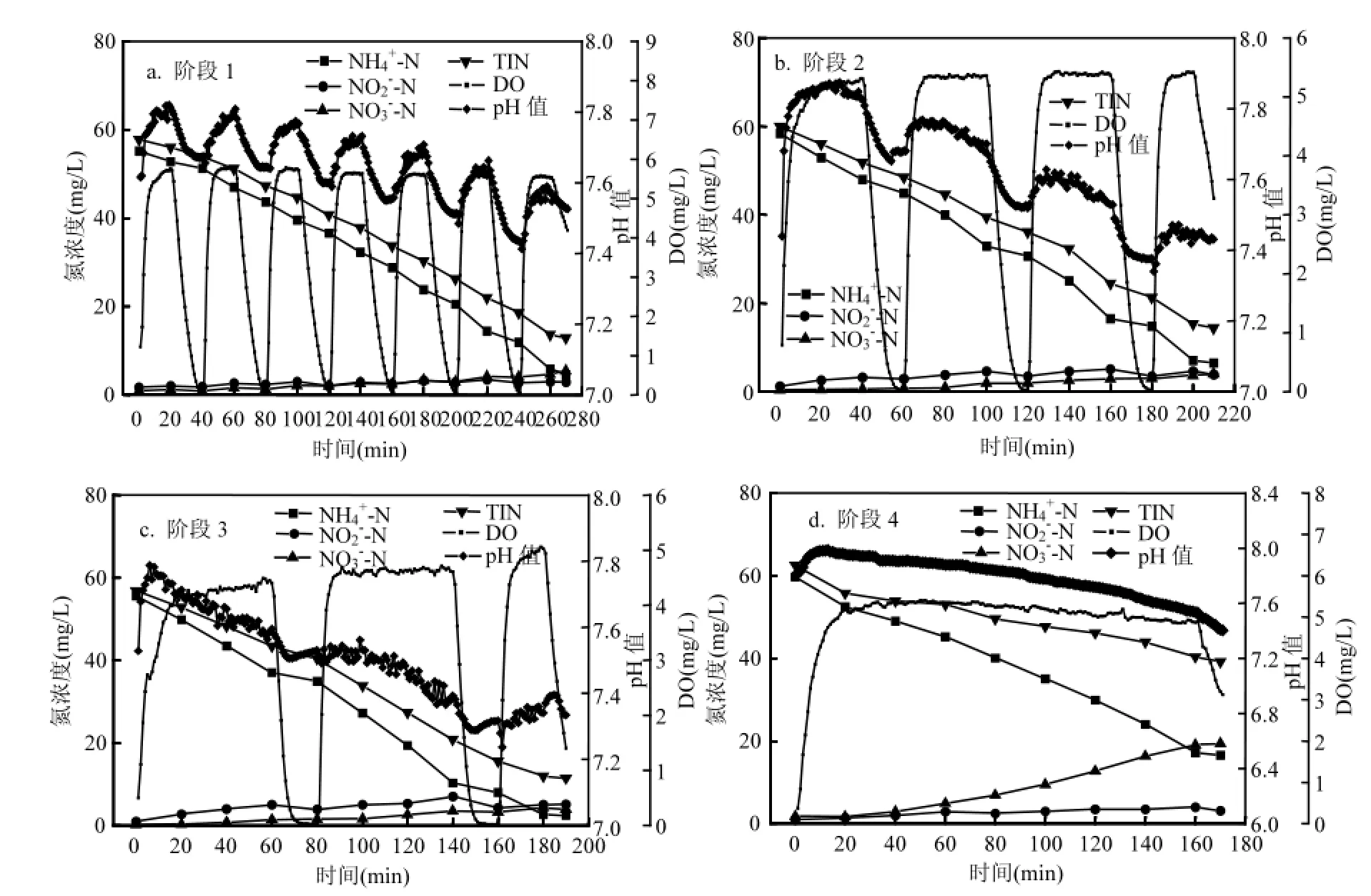
图7 各阶段反应器周期内氮素浓度变化Fig.7 Evolution of nitrogen compounds during one cycle of operation in different phases
图7为阶段1(20d)、阶段2(40d)、阶段3(60d)和阶段4(80d)反应器周期内pH值,DO和各基质浓度随时间的变化情况.各阶段曝气过程中的溶解氧浓度均大于4mg/L.硝化过程会导致pH值下降,厌氧氨氧化和反硝化过程会导致pH值上升.在曝气阶段,硝化过程对pH的影响较大, pH值下降;在非曝气阶段,厌氧氨氧化和反硝化过程对pH的影响较大, pH值上升.阶段1、2和3周期内曝气结束时刻最高的浓度分别为3.5, 5.1,7.0mg/L,非曝气结束时刻最高的浓度分别为2.7,3.5,4.3mg/L,周期内浓度小于7.0mg/L.间歇曝气阶段厌氧氨氧化菌和反硝化菌对亚硝酸盐氮的利用降低了反应器内的亚硝酸盐氮浓度,有助于抑制NOB的代谢生长.阶段4周期内浓度小于4mg/L,出水浓度为19.4mg/L.由于该阶段生物膜的NOB活性较高, NOB可以在曝气过程中获取的亚硝酸盐氮,导致反应器内的亚硝酸盐氮浓度较低.
3 结论
3.1 采用间歇曝气策略,控制曝气和非曝气时间都为20min,曝气阶段反应器内的溶解氧浓度达5.60mg/L,城市污水SNAD生物膜反应器可以取得良好的脱氮性能.反应器的、COD和TIN平均去除率分别为95%、75%和89%, Δ/Δ平均值为0.04.出水、、TIN和COD浓度平均值分别为2,7,11, 56mg/L.生物膜的厌氧氨氧化、反硝化和NOB活性分别为0.267kg TIN/(kg VSS·d), 0.211kg/(kg VSS·d)和0.053kg/ (kg VSS·d).
3.2 在高溶解氧(>4mg/L)和间歇曝气工况下,控制曝气时间小于60min,生物膜的NOB活性较小,周期内的浓度小于7mg/L,反应器具有良好的总氮去除性能.控制曝气时间为160min,生物膜的NOB活性增加,周期内浓度小于4mg/L,反应器的总氮去除性能变差.有必要研究该SNAD生物膜反应器在连续曝气和较低溶解氧浓度下的脱氮性能.
3.3 生物膜可以有效地缓解溶解氧对厌氧氨氧化菌的抑制作用.在高溶解氧(>4mg/L)和间歇曝气工况下,曝气时间对生物膜的厌氧氨氧化活性影响较小,对生物膜的NOB活性影响较大.阶段1、2、3和4的曝气时间分别为20,40,60,160min,生物膜的厌氧氨氧化活性分别为0.267,0.269, 0.288,0.274kg TIN/(kg VSS·d).生物膜的NOB活性分别为0.053,0.020,0.021,0.246kg/(kg VSS·d).
[1] Bagchi S, Biswas R, Nandy T. Autotrophic ammonia removal processes: ecology to technology [J]. Critical Reviews in Environmental Science and Technology, 2012,42(13):1353-1418.
[2] Strous M, Fuerst J A, K ramer E, et al. Missing lithotroph identified as newplanctomycete [J]. Nature, 1999,400(6743): 446-449.
[3] Chen H H, Liu S T, Yang F L, et al. The development of simultaneous partial nitrification,anammox and denitrification (SNAD) process in a single reactor for nitrogen removal [J]. Bioresource Technology, 2009,100(4):1548-1554.
[4] Daverey A, Chen Y C, Dutta K, et al. Start-up of simultaneous partial nitrification, anammox and denitrification (SNAD) process in sequencing batch biofilmreactor using novel biomass carriers [J]. Bioresource Technology, 2015,190:480-486.
[5] 郑照明,李泽兵,刘常敬,等.城市生活污水SNAD工艺的启动研究 [J]. 中国环境科学, 2015,35(4):1072-1081.
[6] Wang C C, Lee P H, Kumar M, et al. Simultaneous partial nitrification, anaerobic ammoniumoxidation and denitrification (SNAD) in a full-scale landfill-leachate treatment plant [J]. Journal of Hazardous Materials, 2010,175(1-3):622-628.
[7] Zhang X J, Zhang H Z, Ye C M, et al. Effect of COD/N ratio on nitrogen removal and microbial communities of CANON process in membrane bioreactors [J]. Bioresource Technology, 2015, 189:302-308.
[8] Sobotka D, Czerwionka K, Makinia J. The effects of different aeration modes on ammonia removal fromsludge digester liquors in the nitritation-anammox process [J]. W ater Science and Technology, 2015,71(7):986-995.
[9] De Clippeleir H, V laeminck S E, Carballa M, et al. A lowvolumetric exchange ratio allows high autotrophic nitrogenremoval ina sequencing batch reactor [J]. Bioresource Technology, 2009,100(21):5010-5015.
[10] Persson F, Sultana R, Suarez M, et al. Structure and composition of biofilmcommunities in a moving bed biofilmreactor for nitritation-anammox at lowtemperatures [J]. Bioresource Technology, 2014,154:267-273.
[11] Veuillet F, Lacroix S, Bausseron A, et al. Integrated fixed-filmactivated sludge ANITA (TM) Mox process - a newperspective for advanced nitrogen removal [J]. Water Science and Technology, 2014,69(5):915-922.
[12] Yang J J, Trela J, Zubrowska-Sudol M, et al. Intermittent aeration in one-stage partial nitritation/anammox process [J]. Ecological Engineering, 2015,75:413-420.
[13] Zekker I, Rikmann E, Tenno T, et al. Nitritating-anammox biomass tolerant to high dissolved oxygen concentration and C/N ratio in treatment of yeast factory wastewater [J]. Environmental Technology, 2014,35(12):1565-1576.
[14] Gilbert E M, Agrawal S, Brunner F, et al. Response of Different Nitrospira Species To Anoxic Periods Depends onOperational DO [J]. Environment Science and Technology, 2014,48(5):2934-2941.
[15] Kornaros M, Dokianakis S N, Lyberatos G. Partial Nitrification/Denitrification Can Be Attributed to the SlowResponse of Nitrite Oxidizing Bacteria to Periodic Anoxic Disturbances [J]. Environmental Science & Technology, 2010, 44(19SI):7245-7253.
[16] Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. Journal of Industrial Microbiology and Biotechnology, 2009,36(8):1093-1100.
[17] 郑照明,杨函青,马 静,等. SNAD反应器中颗粒污泥和絮体污泥脱氮特性 [J]. 中国环境科学, 2015,35(10):2996-3002.
[18] 国家环保总局.水与废水监测分析方法(第四版) [M]. 北京:中国环境出版社, 2002.
[19] Liang Z, Liu H. Control factors of partial nitritation for landfill leachate treatment [J]. Journal of Environmental Sciences-China, 2007,19(5):523-529.
[20] Strous M, Vangerven E, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (Anammox) sludge [J]. Applied and Environmental Microbiology, 1997,63(6):2446-2448.
[21] Cema G, Plaza E, Trela J, et al. D issolved oxygen as a factor influencing nitrogen removal rates in a one-stage systemwith partial nitritation and Anammox process [J]. Water Science and Technology, 2011,64(5):1009-1015.
[22] Zubrowska-Sudol M, Yang J, Trela J, et al. Evaluation of deammonification process performance at different aeration strategies [J]. Water Science and Technology, 2011,63(6):1168-1176.
[23] Volcke E, Picioreanu C, De Baets B, et al. Effect of granule size on autotrophic nitrogen removal in a granular sludge reactor [J]. Environmental Technology, 2010,31(11):1271-1280.
[24] W inkler M, Yang J J, K leerebezemR, et al. N itrate reduction by organotrophic Anammox bacteria in a nitritation/anammox granular sludge and a moving bed biofilmreactor [J]. Bioresource Technology, 2012,114:217-223.
[25] Siegrist H, Salzgeber D, Eugster J, et al. Anammox brings WWTP closer to energy autarky due to increased biogas production and reduced aeration energy for N-removal [J]. Water Science and Technology, 2008,57(3):383-388.
[26] Li J, Guo J S, Fang F, et al. Effect of organic carbon on nitrogen conversion and microbial communities in the completely autotrophic nitrogen removal process [J]. Environmental Technology, 2012,33(10):1141-1149.
[27] Vazquez-Padin J R, Fernandez I, Morales N, et al. Autotrophic nitrogen removal at lowtemperature [J]. Water Science and Technology, 2011,63(6):1282-1288.
[28] Rathnayake R ML D, Song Y, Tumendelger A, et al. Source identification of nitrous oxide on autotrophic partial nitrification in a granular sludge reactor [J]. Water Research, 2013,47(19): 7078-7086.
[29] Morales N, Del Rio A V, Vazquez-Padin J R, et al. Influence of dissolved oxygen concentration on the start-up of the anammoxbased process: ELAN (R) [J]. Water Science and Technology, 2015,72(4):520-527.
[30] Ge S, Peng Y, Qiu S, et al. Complete nitrogen removal frommunicipal wastewater via partial nitrification by appropriately alternating anoxic/aerobic conditions in a continuous plug-flowstep feed process [J]. Water Research, 2014,55(0):95-105.
[31] Bournazou MN C, Hooshiar K, A rellano-Garcia H, et al. Model based optimization of the intermittent aeration profile for SB Rs under partial nitrification [J]. Water Research, 2013,47(10):3399-3410.
[32] van der Star W, Miclea A I, van Dongen U, et al. The membrane bioreactor: A novel tool to growanammox bacteria as free cells [J]. Biotechnology and Bioengineering, 2008,101(2):286-294.
[33] Lackner S, Gilbert E M, V laeminck S E, et al. Full-scale partial nitritation/anammox experiences–An application survey [J]. W ater Research, 2014,55(0):292-303.
Nitrogen removal performance of the SNAD process under different intermittent aerobic conditions.
ZHENG Zhao-ming, LI Jun*, YANG Jing-yue, Du Jia
(Beijing Key Laboratory of Water Science and Water Environmental Restoration, Beijing University of Technology, Beijing 100022, China). China Environmental Science, 2017,37(2):511~519
The simultaneous partial nitrification, anammox and denitrification (SNAD) process for treating domestic wastewater was investigated under high dissolved oxygen (DO) concentration. Intermittent aerobic condition was operated in a sequencing batch reactor (SBR) with the air flowrate of 500L/h at 30℃. The DO concentration was up to 5mg/L. Domestic wastewater was used as influent and Kaldnes rings were used as biomass carriers. In phase 1, the reactor was operated with the aerobic time and non-aerobic time of both 20min. As a result, the biofilmperformed lownitrite oxidizing bacteria (NOB) activity and the reactor achieved high nitrogen removal performance. The average total inorganic nitrogen (TIN) removal efficiency reached 89% with the average effluent TIN concentration of 11mg/L. Besides, the effect of the aerobic time on the SNAD biofilmreactor performance was evaluated during phase 2, phase 3 and phase 4. The results showed that the length of aerobic time p layed a little effect on the anammox activity of the SNAD biofilm, while the NOB activity was largely affected by the length of aerobic time. In phase 3, the aerobic time was controlled at 60min. As a result, the biofilmperformed lowNOB activity and the reactor achieved high nitrogen removal performance. The average TIN removal efficiency reached 83% with the average effluent TIN concentration of 14mg/L. The aerobic time of phase 4was controlled at 160min. On the contrary, the biofilmperformed high NOB activity and the reactor performed poor nitrogen removal performance. The average TIN removal efficiency decreased to 50% with the average effluent TIN concentration of 35mg/L.
SNAD;biofilmreactor;domestic wastewater;different intermittent aerobic conditions
X703.5
A
1000-6923(2017)02-0511-09
郑照明(1989-),男,浙江嵊州市人,北京工业大学博士研究生,主要从事厌氧氨氧化,亚硝化和SNAD工艺研究.发表论文6篇.
2016-05-30
国家水体污染控制与治理科技重大专项(2015ZX 07202-013)
* 责任作者, 教授, jglijun@bjut.edu.cn
