Ag/AgCl可见光催化剂湿法脱除烟气中单质汞
2017-04-08邢微波张安超刘志超
邢微波,路 好*,张安超*,刘 牧,刘志超,胡 松,向 军
(1.河南理工大学机械与动力工程学院,河南 焦作 454000;2.华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
Ag/AgCl可见光催化剂湿法脱除烟气中单质汞
邢微波1,路 好1*,张安超1*,刘 牧1,刘志超1,胡 松2,向 军2
(1.河南理工大学机械与动力工程学院,河南 焦作 454000;2.华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
采用沉淀−光还原法制备了Ag/AgCl可见光催化剂,在湿法脱汞装置上考察了该光催化剂的Hg0脱除特性及SO2、NO和溶液温度等对脱汞性能的影响.利用N2吸附/脱附、扫描电子显微镜及X−射线能量色散谱(SEM-EDS)、X−射线衍射(XRD)、紫外−可见漫反射光谱(DRS)、X−射线光电子能谱(XPS)和电子自旋共振(ESR)技术对新鲜和使用后的光催化剂进行性质表征.结果表明,与单独可见光辐照和单独使用Ag/AgCl相比,Ag/AgCl与荧光灯联合使用的Hg0脱除效率大幅提高.SO2和NO的添加会抑制Ag/AgCl光催化剂对Hg0的脱除;停止通入SO2和NO后,Hg0脱除效率可快速恢复.可见光辐照下,Ag/AgCl光催化剂产生了强氧化性的羟基自由基(·OH)和超氧自由基(·O2–).各活性物种中, ·O2–在Ag/AgCl光催化剂的高效脱汞过程中起关键作用,而·OH、空穴(h+)和Cl2为次要作用.
湿法;可见光;光催化剂;Ag/AgCl;脱汞
随着大气污染的日趋严重,大气汞污染已成为一个全球性亟待解决的问题.中国作为世界上最大的煤炭生产国和消费国,汞排放总量已位居全球首位[1].因此,加强燃煤电站烟气中汞的排放控制势在必行.燃煤烟气中的汞主要以3种形式存在:单质汞(Hg0)、二价汞(Hg2+)和颗粒态汞(Hgp)[2].Hg2+易溶于水,可以通过湿法烟气脱硫装置(WFGD)去除[3];Hgp可以通过现有的布袋或静电除尘设备捕获,而Hg0易挥发且不溶于水,很难通过现有的污染物脱除设备去除.Hg0的有效脱除是当今大气汞污染治理领域的难题[4].
近几年,湿法脱汞技术在燃煤烟气脱汞领域得到深入研究,如NaClO2[5]、K2S2O8/Ag+/Cu2+[6]、H2O2/Na2S2O8[7]、UV/Fenton[8]和UV/H2O2[9]等.其中,以产生强氧化性羟基自由基(·OH)为活性物种的高级氧化工艺(AO Ps)具有广阔的应用前景.但该技术需要紫外光(UV)的照射和大量氧化剂(如NaClO2和H2O2等)的消耗,势必会造成脱汞成本的增加.因此,进一步研究与开发更加廉价的脱汞技术具有重要的应用前景.
迄今,可见光催化技术已在水体污染物处理领域得到广泛研究[10-15].其中,银基可见光催化剂由于其优异的光催化活性和稳定性被认为是一种最具发展潜力的光催化剂.Shu等[14]研究了可见光和太阳光下AgCl@Ag催化剂降解甲基橙和甲基蓝的性能,发现可见光和太阳光下的银基催化剂可以释放出强氧化性能的超氧自由基(·O2—)和空穴(h+),实现对甲基橙和甲基蓝的高效降解.Zheng等[15]利用水热合成法制备了AgCl@Ag光催化剂,研究发现在可见光照射下AgCl@Ag光催化剂可以实现对4-硝基苯酚的高效降解.大量研究表明[10-15],可见光催化技术可以产生大量的强氧化性活性物种,如·OH、·O2—和h+等,可能对烟气中的Hg0具有良好的脱除性能.然而,可见光催化技术在燃煤烟气脱汞领域的报道尚不多见,可见光下活性物种对Hg0氧化脱除的作用机理尚不清楚.
基于以上讨论,本研究以沉淀−光还原法制备的Ag/AgCl为可见光催化剂,研究其液相中可见光照射下的脱汞活性.通过N2吸附/脱附、扫描电子显微镜和X-射线能量色散谱(SEM-EDS)、X-射线衍射(XRD)、紫外-可见漫反射光谱(DRS)、X-射线光电子能谱(XPS)和电子自旋共振(ESR)技术对新鲜和使用后的Ag/AgCl光催化剂进行表征,分析其可见光下的脱汞机理.
1 材料与方法
1.1 光催化剂的制备
采用沉淀-光还原法制备Ag/AgCl可见光催化剂,具体过程如下:将100mL的硝酸银溶液(0.1mol/L)缓慢加入到100mL的氯化钠溶液(0.1mol/L)中,磁力搅拌60min后;将所得到的沉淀物置于紫外灯(60W)下照射30min,静置24h后用去离子水洗涤3~5遍;最后,置于70℃烘箱中干燥24h,研磨、筛分至120目,所得样品记为Ag/AgCl光催化剂.
1.2 光催化剂活性评价
图1为可见光催化氧化脱除Hg0的活性评价的实验装置,它由模拟烟气源、汞蒸气发生装置、湿法鼓泡反应器、恒温加热磁力搅拌器、汞在线分析仪组成.设备的具体介绍和实验方法见文献[16].模拟烟气由N2、O2、CO2、SO2和NO组成,其中N2、O2和CO2为基本烟气成分,O2和CO2的体积含量分别约为6%和12%,N2为平衡气.气体总流量为1.5L/min,进口Hg0的质量浓度(Cin)约为50μg/m3(标准状况下).光催化剂用量为1g/L,湿法鼓泡反应器中去离子水用量为1L.可见光源为11W荧光灯(FSL, YDN11-π.RR型,佛山电器照明股份有限公司).反应前后Hg0蒸气浓度由VM-3000汞分析仪(德国汞仪器有限公司)实时在线记录.Hg0的脱除效率η(%)为:

式中:Cin和Cout分别代表湿法脱汞装置进出口Hg0的质量浓度,μg/m3.
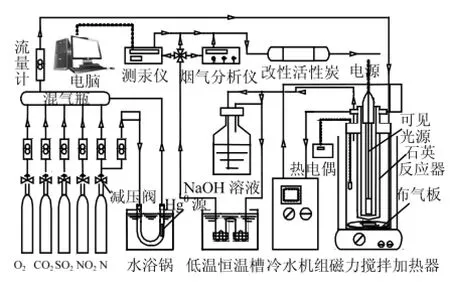
图1 湿法脱汞装置示意Fig.1 Schematic diagramof the wet bubbling Hg0removal setup
1.3 表征方法
光催化剂的比表面积(BET)和孔径结构采用比表面积及孔径分布测试仪(美国康塔仪器公司Autosorb−iQ型)进行测定;扫描电子显微镜和X−射线能量色散谱(SEM−EDS)在日本日立S−4800型场发射扫描电子显微镜上完成;X-射线衍射(XRD)分析在德国布鲁克D8Advance型X射线衍射仪上进行,测定条件为Cu靶(Kα),扫描步幅为0.02°;紫外−可见漫反射光谱(DRS)采用日本日立U-4100型紫外−可见分光光度计测试;X-射线光电子能谱(XPS)分析在美国Thermo Fisher Scientific公司的ESCALAB 250XI型X射线光电子能谱仪上测试,X−射线激发源为Al Kα(Al激光发射源的能量hv=1486.6eV);电子自旋共振(ESR)采用德国Bruker公司的ER200-SRC (λ≥420nm)仪器进行分析,采用5,5-二甲基1-吡咯啉N-氧化物(DMPO)试剂作为自由基捕获剂.
2 结果与讨论
2.1 光催化剂活性
2.1.1 光照的影响 图2为基本烟气成分下可见光辐照对Hg0脱除效率的影响.由图2可以看出,仅有荧光灯辐照时,Hg0脱除效率仅为15%.在黑暗状态下,仅添加Ag/AgCl光催化剂时,Hg0脱除效率约为39%.然而,当Ag/AgCl光催化剂与荧光灯(FSL)联合使用时,Hg0脱除效率大幅提高(90%),说明可见光与Ag/AgCl光催化剂之间有良好的协同效应,且可见光源对银基光催化剂的高效脱汞至关重要.
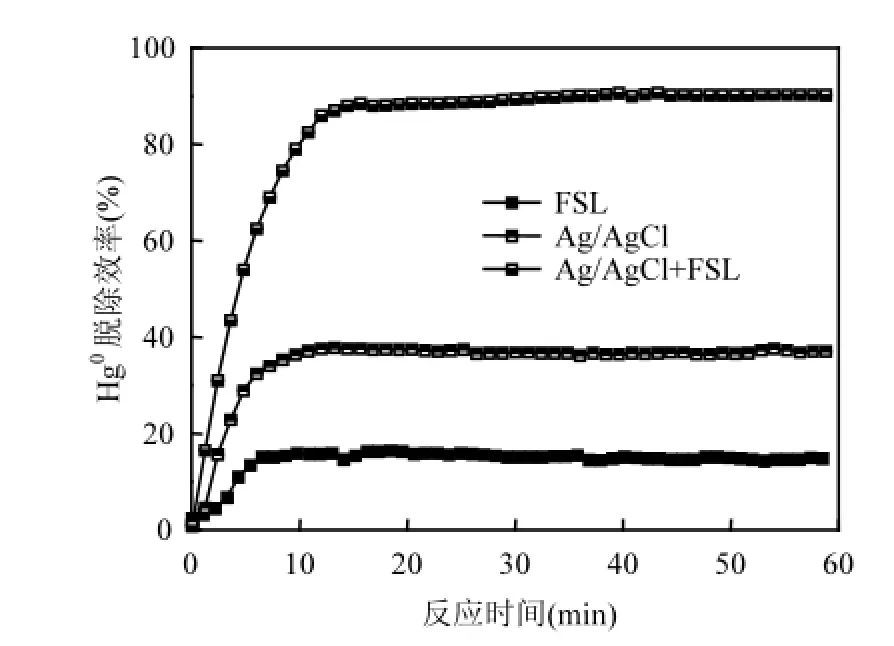
图2 光照对Hg0脱除的影响Fig.2 Effect of visible light irradiation on Hg0removal
2.1.2 SO2和NO的影响 即使燃煤电厂均安装有烟气脱硫脱硝装置,但尾部烟道仍存在少量的SO2和NO气体.研究发现,它们的存在对湿法脱汞技术具有重要影响[8].图3为不同SO2浓度下的Hg0脱除效率.可以看出,添加200mg/m3的SO2浓度后,Hg0脱除效率逐渐降低,表明SO2对银基可见光催化剂的脱汞是抑制的;进一步增加SO2添加量后,Hg0脱除效率继续缓慢降低.在120min时,切断SO2供给后,发现Hg0脱除效率迅速回升,40min后Hg0脱除效率上升至其初始值,表明SO2对Hg0脱汞效率的抑制是可以恢复的.
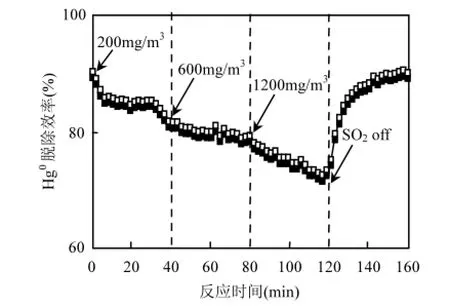
图3 SO2对Hg0脱除的影响Fig.3 Effect of SO2on Hg0removal
图4为不同NO浓度下的Hg0脱除效率.由图4知,在较低NO浓度下,Hg0脱除效率几乎不受其影响.随着NO浓度的逐渐增加,其影响越来越明显.与SO2类似,NO对银基可见光催化剂的脱汞效率亦具有明显的抑制作用.切断NO后,Hg0脱除效率迅速上升至其初始值.
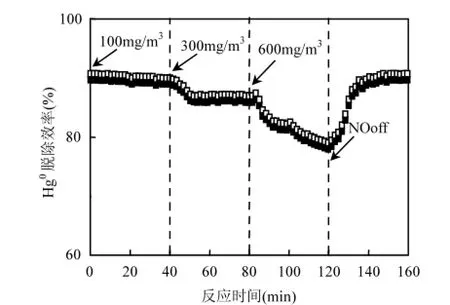
图4 NO对Hg0脱除的影响Fig.4 Effect of NO on Hg0removal
SO2和NO对Hg0脱除抑制的原因可能是它们与反应溶液中的活性物质(如·OH、·O2—和h+等)发生了如下反应[17-19],阻碍了活性物种对Hg0的氧化.

2.1.3 溶液温度的影响 反应溶液温度对气体的溶解性、传质速率和化学反应速率均有明显的影响.因此,开展溶液温度对Hg0脱除效率的影响研究具有重要意义.由阿伦尼乌斯方程知,反应温度提高会加快化学反应的速率[9].但较高的反应溶液温度亦会产生负面的影响.如图5所示,当反应液温度由20℃升高至60℃时,Hg0脱除效率由95%降低为80%,表明提高反应溶液温度不利于Hg0的有效脱除.Zhan[8]、Zhou[20]和Zhang等[16]在研究UV/Fenton、Fe2.45Ti0.55O4/H2O2和Ag/ AgBr-Ag2CO3的脱Hg0性能时也发现了类似的结果.其原因可能是:随着溶液温度的升高,O2和Hg0的溶解性能会明显降低,进而减少活性物质的产生和导致Hg0脱除效率的降低.另外,溶液温度提高可能会抑制光生电子和空穴对的产生,从而降低Hg0的脱除.

图5 溶液温度对Hg0脱除的影响Fig.5 Effect of solution temperature on Hg0removal
2.2 表征分析
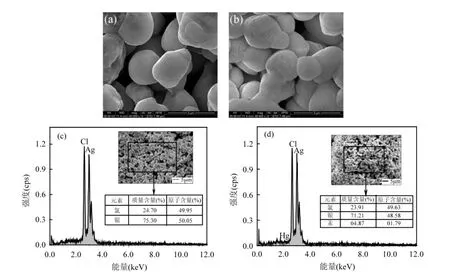
图6 Ag/AgCl(a和c)与Ag/AgCl-Hg(b和d)的SEM形貌与EDS图Fig.6 SEMimages and EDS spectra of Ag/AgCl (a and c) and Ag/AgCl-Hg(b and d)
2.2.1 BET与SEM-EDS分析 利用Brunauer-Emmett-Teller(BET)方法测试得到Ag/AgCl光催化剂的比表面积、总孔容和平均孔径分别为7.661m2/g、0.008cm3/g和1.768nm,表明Ag/AgCl光催化剂的孔隙结构并不丰富,因此Ag/AgCl光催化剂良好的脱除能力为化学反应所致,而非物理吸附.
图6为反应前后Ag/AgCl光催化剂的SEMEDS.由图6(a)可以看出,Ag/AgCl光催化剂表面较光滑,并未发现明显的银纳米颗粒(Ag0N Ps),表明紫外光照方法生成的银粒子高度分散在AgCl表面或生成量较少.脱汞实验后,光催化剂表面出现了较多的微小颗粒(图6(b)).图6(c)显示Ag/AgCl光催化剂中Ag与Cl的原子比约为1:1,表明单质Ag含量颇少.而Ag/AgCl-Hg中检测到少量的Hg(图6(d)),可能以HgCl2的形式存在.
2.2.2 XRD分析 图7为反应前后Ag/AgCl光催化剂的XRD谱图.由图7可以看出,Ag/AgCl光催化剂在2θ=27.9°,32.3°,46.3°,54.9°,57.6°, 67.5°,74.6°,76.8°和85.7°处出现了AgCl的特征衍射峰(JCPDS 31-1238)[21],但未发现Ag0的特征衍射峰,表明Ag0在Ag/AgCl光催化剂表面高度分散或含量较小,该结构与SEM结果一致.然而,脱汞反应后,Ag/AgCl-Hg光催化剂在2θ=38.2°,44.3°, 64.4°处出现了微弱的Ag0特征衍射峰(JCPDS 87-0717)[22],说明在脱汞反应过程中可能存在Ag的富集或还原.

图7 Ag/AgCl和Ag/AgCl-Hg的XRD谱图Fig.7 XRD pattern of Ag/AgCl and Ag/AgCl-Hg
2.2.3 DRS分析 DRS分析可以反映光催化剂对可见光的吸收能力[23],可以清楚的了解光催化剂的光吸收特征.图8为反应前后Ag/AgCl光催化剂的DRS谱图.可以看出,两个样品均呈现典型的紫外-可见漫反射光谱.在200~800nm的波长范围内,它们均表现出强烈的吸收带.新鲜Ag/AgCl在450~600nm范围出现的宽吸收峰为光催化剂表面银纳米颗粒(Ag0N Ps)的表面等离子体共振效应(SPR)引起的.由XRD和SEM知,脱汞实验后催化剂表面出现了Ag0NPs.由于Ag0NPs具有SPR效应,所以Ag/AgCl-Hg的光吸收能力明显增强.

图8 Ag/AgCl和Ag/AgCl-Hg的DRS谱图Fig.8 DRS spectra of Ag/AgCl and Ag/AgCl-Hg
2.2.4 XPS分析 为进一步了解光催化剂表面各原子的存在形态,采用XPS技术对脱汞实验前后的光催化剂进行表征,结果如图9所示.由图9(a)知,新鲜Ag/AgCl光催化剂分别在197.8eV和199.5eV处出现Cl 2p3/2和Cl 2p1/2的峰.脱汞实验后,Ag/AgCl-Hg的Cl 2p3/2和Cl 2p1/2峰均向低结合能方向迁移,且其强度大幅降低,可能是Cl—与氧化后Hg2+结合所致.
图9(b)为Ag/AgCl光催化剂反应前后Ag 3d峰.对于新鲜Ag/AgCl光催化剂,367.5eV和373.5eV处分别对应Ag 3d5/2和Ag 3d3/2峰.与Ag/AgCl相比,Ag/AgCl-Hg的Ag 3d峰向低结合能方向大幅移动,表明脱汞反应后,光催化剂表面的Ag可能发生了还原、富集或与汞发生汞齐反应,从而使其存在形态发生改变.图9(c)为反应后Ag/AgCl-Hg光催化剂的Hg 4f峰.101.7eV处出现的Hg 4f峰表明光催化剂表面的汞以Hg2+形式存在[24],说明光催化剂对Hg0的高效氧化性能.
2.2.5 ESR分析 ESR技术可以定性和定量检测物质原子或分子中所含的不配对电子,并探索其周围环境结构特性.图10为Ag/AgCl光催化剂的ESR谱图.黑暗状态下,ESR分析仪不能捕捉到DMPO-·OH和DMPO-·O2—的信号.然而,经可见光照射5min后,可以清楚地观察到DMPO-·OH和DMPO-·O2—的信号,表明在可见光辐照下,Ag/AgCl光催化剂可以产生强氧化性的·OH和,这有利于Hg0的氧化脱除.
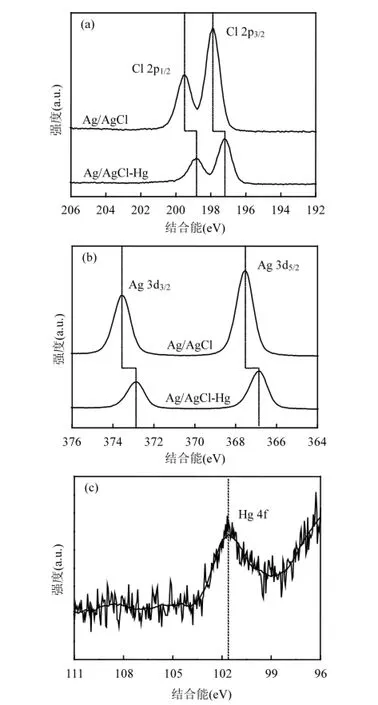
图9 Cl 2p (a), Ag 3d (b), and Hg 4f (c)的XPS谱图Fig.9 XPS spectra of Cl 2p (a), Ag 3d (b), and Hg 4f (c)
2.3 反应机理
如XPS所示,反应后吸附在催化剂表面的Hg以Hg2+形态存在,其实Hg2+也应该存在于反应溶液中.为验证反应溶液中Hg2+的存在,将基本烟气氛围下反应2h后的上清液(50mL)取出置于洗气瓶,采用30mL氯化亚锡溶液(10wt% SnCl2)进行还原,并利用VM-3000单质汞测试仪监测Hg0浓度变化,其结果如图11所示.通入SnCl2溶液前,Hg0浓度维持在0 μg/m3附近.10min时加入SnCl2溶液后,Hg0浓度急剧上升.而去离子水加入SnCl2溶液后,Hg0浓度几乎未发生变化.以上现象表明Hg2+也存在于反应溶液中.

图10 Ag/AgCl催化剂羟基和超氧自由基谱图Fig.10 ·OH and ·O2– spectra of Ag/AgCl photocatalyst
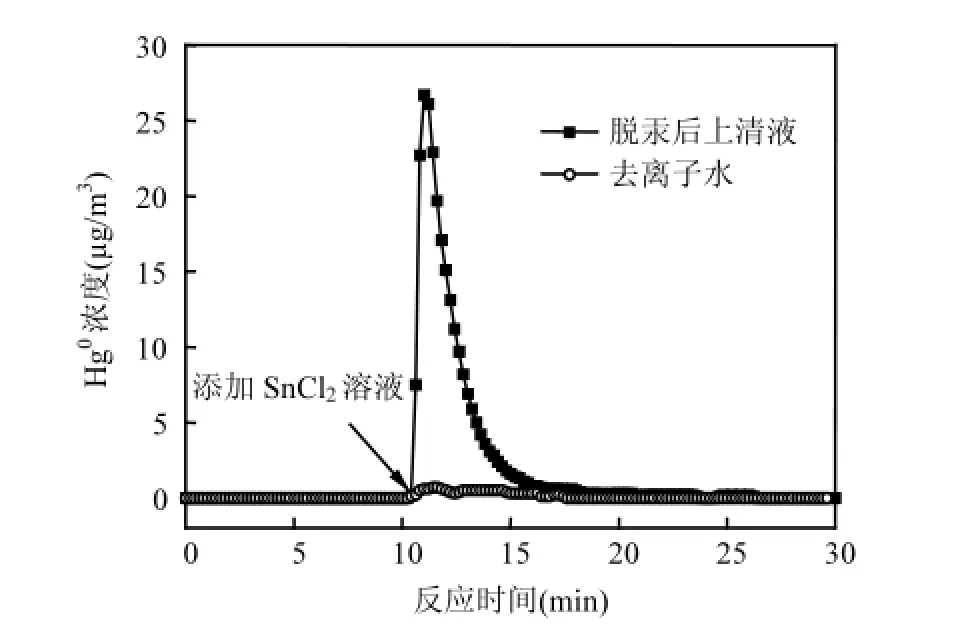
图11 反应液中Hg2+的验证Fig.11 Validation of Hg2+in reaction solution
研究表明[25],可见光催化体系会产生大量的活性物种,如·OH、·O2—和h+.它们均具有强氧化性,可能将Hg0氧化为Hg2+.为了解Ag/AgCl光催化剂的脱汞机理,采用添加消除剂的方法来辨识活性物种的作用.研究中,乙二胺四乙酸二钠(EDTA-2Na)为h+的消除剂[10],苯醌(BQ)为·O2—的消除剂[11],异丙醇(IPA)为·OH的消除剂[12].添加以上消除剂后,脱汞反应60min内的Hg0脱除效率如图12所示.由图12可以看出,IPA或EDTA-2Na的添加对Hg0脱除效率影响较小,但添加BQ后,Hg0脱除效率急剧降低至30%左右,说明在Hg0氧化脱除过程中,起关键作用,而·OH和+则为辅助作用.
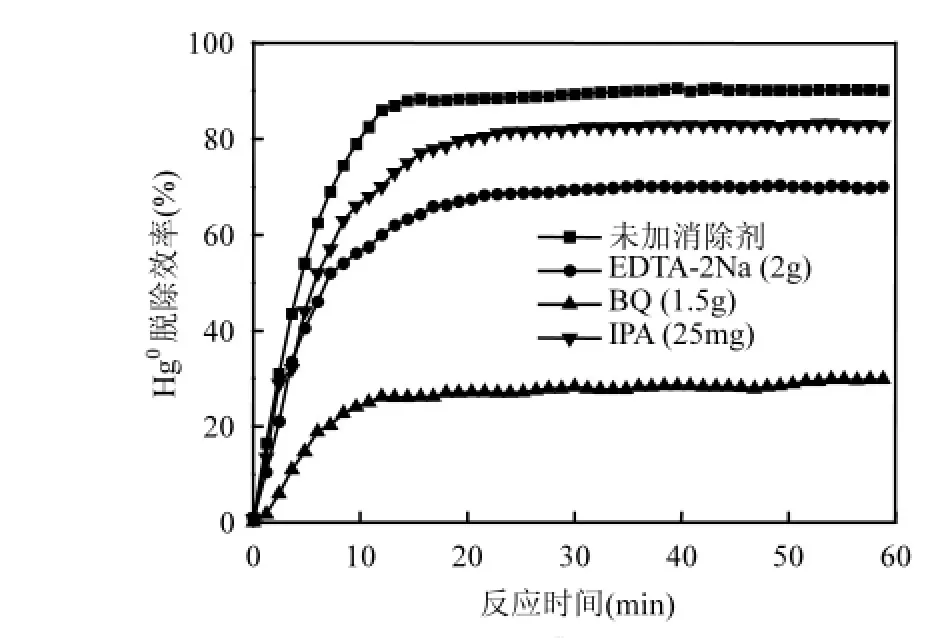
图12 消除剂对Hg脱除效率的影响Fig.12 Effect of scavengers on Hg0 removal
基于以上实验与表征,可以推断出Ag/AgCl光催化剂的高效脱汞机理.由于AgCl较高的带隙能[14],可见光辐照下AgCl并不能直接产生光生电子和空穴(e—+h+)对.但光催化剂表面的Ag0NPs会吸收光子,产生SPR效应[26-27],进而生成e—+h+对[公式(8)].生成的e—会迁移到AgCl导带(CB)[公式(9)],并与吸附在光催化剂表面的O2反应生成·O2−[公式(10)].h+与H2O反应生成·OH[公式(11)],从而达到Ag0NPs表面e—+h+对的有效分离.另外, ·O2−还会与H+反应·HO2,并进一步生成·OH[公式(12~13)].生成的强氧化性·OH、·O2−和h+会与Hg0反应生成Hg2+[公式(14)].

此外,光催化剂表面的Cl−也可能与·OH和h+反应,生成活性物种·ClOH−[28]和Cl2等,进一步促进Hg0的氧化[公式(15)~(20)].
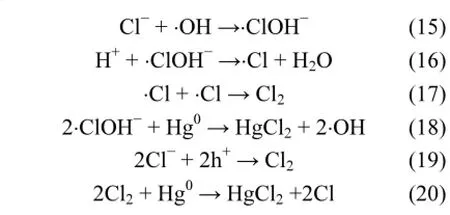
结合消除剂实验知,各活性物种中,·O2在Ag/AgCl光催化剂的高效脱汞过程中起关键作用,而·OH、h+和Cl2则为辅助作用.
3 结论
3.1 与仅有荧光灯辐照和仅添加Ag/AgCl光催化剂相比,Ag/AgCl光催化剂与荧光灯联合使用时,Hg0脱除效率大幅提高至90%,说明可见光与Ag/AgCl光催化剂之间存在良好的协同效应,且可见光源对银基光催化剂的高效脱汞至关重要.
3.2 反应溶液温度升高不利于Hg0的有效脱除.由于SO2和NO与反应溶液中的活性物质(如·OH、·O2—和h+等)发生反应,SO2和NO的添加会抑制Ag/AgCl光催化剂对Hg0的脱除;停止通入SO2和NO后,Hg0脱除效率可以快速恢复.
3.3 紫外光照方法生成的银纳米颗粒高度分散在AgCl表面;脱汞反应会引起Ag/AgCl表面Ag的富集或还原,进而增强其光吸收能力.可见光辐照下,各活性物种中, ·O2—在Ag/AgCl光催化剂的高效脱汞过程中起关键作用,而·OH、h+和Cl2为辅助作用.
[1] Pacyna E G, Pacyna J M, Sundseth K, et al. Global emission of mercury to the atmosphere fromanthropogenic sources in 2005 and projections to 2020 [J]. A tmospheric Environment, 2010, 44(20):2487−2499.
[2] 张安超,张洪良,宋 军,等.Mn-Co/MCM-41吸附剂表征及脱除烟气中单质汞研究 [J]. 中国环境科学, 2015,35(5):1319−1327.
[3] 吴晓云,郑有飞,林克思.我国大气环境中汞污染现状 [J]. 中国环境科学, 2015,35(9):2623−2635.
[4] 乔少华,晏乃强,陈 杰,等.MnO x/α-A l2O3催化氧化燃煤烟气中Hg0的试验研究 [J]. 中国环境科学, 2009,29(3):237−241.
[5] Hutson N D, Krzyzynska R, Srivastava R K. Simultaneous—removal of SO2, NOx, and Hg fromcoal flue gas using a NaClO2-enhanced wet scrubber [J]. Industrial & Engineering Chemistry Research, 2008,47(16):5825−5831.
[6] Xu X, Ye Q, Tang T, et al. Hg0oxidative absorption by K2S2O8solution catalyzed by Ag+and Cu2+[J]. Journal of Hazardous Materials, 2008,158(2/3):410−416.
[7] Yi Z, Hao R, Peng Z, et al. An integrative process for Hg0removal using vaporized H2O2/Na2S2O8[J]. Fuel, 2014,136(10):113−121.
[8] Zhan F, Li C, Zeng G, et al. Experimental study on oxidation of elemental mercury by UV/Fenton system[J]. Chemical Engineering Journal, 2013,232(9):81−88.
[9] Liu Y X, Zhang J, Pan J F. Photochemical oxidation removal of Hg0fromflue gas containing SO2/NO by an ultraviolet irradiation/hydrogen peroxide (UV/H2O2) process [J]. Energy Fuels, 2014,28(3):2135−2143.
[10] Dong R F, TianB Z, Zhang J L, et al. AgBr@Ag/TiO2core–shell composite with excellent visible light photocatalytic activity and hydrothermal stability [J]. Catalysis Communications, 2013, 38(15):16−20.
[11] Yin MC, Li Z S, Kou J H, et al. MechanismInvestigation of Visible light-induced degradation in a heterogeneous TiO2/Eosin Y/Rhodamine B system[J]. Environmental Science & Technology, 2009,43(21):8361−8366.
[12] Li G T, Wong K H, Zhang X W, et al. Degradation of Acid Orange 7 using magnetic AgBr under visible light: The roles of oxidizing species [J]. Chemosphere, 2009,76(9):1185−1191.
[13] Tang Y, SubramaniamV P, Lau T H, et al. In situ formation of large-scale Ag/AgCl nanoparticles on layered titanate honeycomb by gas phase reaction for visible light degradation of phenol solution [J]. Applied Catalysis B: Environmental, 2011,106(3/4): 577−585.
[14] Shu J X, Wang Z H, Xia G Q, et al. One-pot synthesis of AgCl@Ag hybrid photocatalyst with high photocatalytic activity and photostability under visible light and sunlight irradiation[J]. Chemical Engineering Journal, 2014,252(18):374−381.
[15] Zheng Y, Shu J, Wang Z. AgCl@Ag composites with rough surfaces as bifunctional catalyst for the photooxidation and catalytic reduction of 4-nitrophenol [J]. Materials Letters, 2015, 158:339−342.
[16] Zhang A C, Zhang L X, Lu H, et al. Facile synthesis of ternary Ag/AgBr-Ag2CO3hybrids with enhanced photocatalytic removal of elemental mercury driven by visible light [J]. Journal of Hazardous Materials, 2016,314:78−87.
[17] Liu Y X, Zhang J, Sheng C D, et al. Simultaneous removal of NO and SO2fromcoal-fired flue gas by UV/H2O2advanced oxidation process [J]. Chemical Engineering Journal, 2010,162(3):1006− 1011.
[18] Yu C H, Wu C H, Ho T H, et al. Decolorization of C.I. reactive black 5 in UV/TiO2, UV/oxidant and UV/TiO2/oxidant systems: A comparative study [J]. Chemical Engineering Journal, 2010, 158(3):578−583.
[19] Liu Y X, Zhang J, Pan J F, et al. Investigation on removal of NO fromSO2-containing simulated flue gas by UV/Fenton-like reaction [J]. Energy Fuels, 2012,26(9):5430−5436.
[20] Zhou C S, Sun L S, Zhang A C, et al. Elemental mercury (Hg0) removal fromcontaining SO2/NO flue gas by magnetically separable Fe2.45Ti0.55O4/H2O2advanced oxidation processes [J]. Chemical Engineering Journal, 2015,273:381−389.
[21] Zhang X, Li J, Lu X, et al. Visible light induced CO2reduction and Rh B decolorization over electrostatic-assembled AgBr/ Palygorskite [J]. Journal of Colloid and Interface Science, 2012, 377(1):277−283.
[22] Hu C, Lan Y, Qu J, et al. Ag/AgBr/TiO2visible light photocatalyst for destruction of azodyes and bacteria [J]. Journal of Physical Chemistry B, 2006,110(9):4066−4072.
[23] Fu H, Pan C, Yao W, et al. Visible-light-induced degradation of rhodamine B by nanosized Bi2WO6[J]. Journal of Physical Chemistry B, 2005,109(47):22432−22439.
[24] Yang S, Guo Y, Yan N, et al. Remarkable effect of the incorporation of titaniumon the catalytic activity and SO2poisoning resistance of magnetic Mn−Fe spinel for elemental mercury capture [J]. Applied Catalysis B: Environmental, 2011, 101(3/4):698−708.
[25] K imJ, Lee C W, Choi W. Platinized WO3as an environmental photocatalyst that generates OH radicals under visible light [J] Environmental Science & Technology, 2010,44(17):6849−6854.
[26] Xu H, Li H, Xia J X, et al. One-pot synthesis of visible-lightdriven plasmonic photocatalyst Ag/AgCl in ionic liquid [J]. ACS Applied Materials & Interfaces, 2011,3(1):22−29.
[27] Lanz M, Schürch D, Calzaferri G. Photocatalytic oxidation of water to O2on AgCl-coated electrodes [J]. Journal of Photochemistry and Photobiology A: Chemistry, 1999,120(1): 105−117.
[28] Zhao Y, Hao R, Guo Q. A novel pre-oxidation method for elemental mercury removal utilizing a complex vaporized absorbent [J]. Journal of Hazardous Materials, 2014,280:118−126.
Wet process of elemental mercury removal fromflue gas using Ag/AgCl photocatalyst under visible light
XING Wei-bo1,LU Hao1*, ZHANG An-chao1*, LIU Mu1, LIU Zhi-chao1, HU Song2, XIANG Jun2
(1.School of Mechanical and Power Engineering, Henan Polytechnic University, Jiaozuo 454000, China;2.State Key Laboratory of Coal Combustion, Huazhong University of Science and Technology, Wuhan 430074, China). China Environmental Science, 2017,37(2):503~510
A series of studies on the performance of Hg0removal fromsimulated flue gas were carried out in a wet Hg0bubbling reactor using a visible-light-responsive Ag/AgCl photocatalyst prepared by a precipitation-photoreduction method. The effects of SO2, NO, and reaction temperature were also investigated in detail. The properties of fresh and used photocatalysts were characterized by N2adsorption/desorption, scanning electron microscope and energy dispersive X-ray spectroscopy (SEM-EDS), X-ray diffraction (XRD), UV-visible diffuse reflectance spectroscopy (DRS), X-ray photoelectron spectroscopy (XPS) and electron spin resonance (ESR) techniques. The results showed that compared with the Hg0removal efficiencies of only visible light irradiation and only Ag/AgCl, Hg0removal efficiency was greatly enhanced when visible light and Ag/AgCl were employed simultaneously. Due to large amounts of reactive species consumption, the presences of SO2and NO would inhibit the performance of Hg0removal. The activity of Hg0removal could be restored to their initial values when SO2and NO were turned off. The reactive species, such as hydroxyl radicals (·OH), superoxide radicals (·O2−), were produced in the Ag/AgCl solution under visible light. The ·OH, holes (h+), and Cl2, were reactive species responsible for removing Hg0, and in particular the ·O2–played a key role in Hg0removal.
wet process;visible light;photocatalyst;Ag/AgCl;Hg0removal
X511
A
1000-6923(2017)02-0503-08
邢微波(1992−),男,安徽宿州人,河南理工大学硕士研究生,主要从事燃煤烟气多种污染治理技术研究.
2016-06-06
国家自然科学基金资助项目(51306046,51576086, 51676064);河南省高校基本科研业务费项目(NSFRF140204);上海市动力工程多相流动与传热重点实验室开放基金项目
* 责任作者, 路好, 讲师, luhao@hpu.edu.cn; 张安超, 副教授, anchaozhang@126.com
