过氧化物酶体增殖物激活受体2及其磷酸化形式在脂肪干细胞脂向分化过程中的表达
2017-04-08殷国勇
周 炜 张 骏 凡 进 殷国勇
(南京医科大学第一附属医院骨科,江苏 南京 210029)
过氧化物酶体增殖物激活受体2及其磷酸化形式在脂肪干细胞脂向分化过程中的表达
周 炜 张 骏1凡 进 殷国勇
(南京医科大学第一附属医院骨科,江苏 南京 210029)
目的 探讨过氧化物酶体增殖物激活受体(PPARγ)2及其磷酸化形式在脂肪干细胞脂向分化过程中的表达。方法 采用组织块贴壁法培养脂肪干细胞,对第3代细胞进行脂向分化诱导,应用Western印迹检测诱导不同时间的PPARγ2非磷酸化及其磷酸化形式表达,RT-PCR检测诱导不同时间的PPARγ2 mRNA表达。结果 随着脂向分化诱导时间的增长,PPARγ2的非磷酸化与磷酸化形式的相对表达量明显增加,PPARγ2 mRNA相对表达量呈逐渐递增的趋势(P<0.05),其中第7、9天达到峰值差异比较无统计学意义(P>0.05)。结论 PPARγ2在脂肪干细胞脂向分化过程中起着重要作用,作用机制可能是通过自身的磷酸化来促进脂向分化。
脂肪干细胞;过氧化物酶体增殖物激活受体2
现阶段软组织缺损是临床亟需解决的难题,而脂肪组织工程为软组织的修复重建开辟了新的思路,已成为目前临床研究的重要方向。脂肪组织工程需要有合适的种子细胞,而脂肪干细胞来源丰富且具有多项分化能力和较强的增殖能力,已成为脂肪组织工程的理想种子细胞〔1〕。但是目前脂肪干细胞的成脂分子机制尚不明确,进而使组织工程化脂肪的构建受阻。过氧化物酶体增殖物激活受体(PPARγ)2是体外及体内形成脂肪的必须转录因子,在脂肪酸代谢及脂肪细胞发育过程中的作用显著〔2〕。有研究发现通过成体干细胞模型进行脂向分化实验将研究结果转变为临床研究的效果较好〔3〕。本研究旨在探讨PPARγ2及其磷酸化形式在脂肪干细胞脂向分化过程中的表达意义。
1 材料与方法
1.1 材料 8只14 d的绿色荧光蛋白转基因小鼠由中科院上海药物研究所提供;胎牛血清(FBS)购于美国Hyclone公司;0.25%乙二胺四乙酸(ETDA)及二喹啉甲酸(BCA)蛋白含量测定试剂盒购于美国Gibco公司;胰岛素、地塞米松磷酸钠、3-异丁基-1-甲基黄嘌呤购于美国Sigma公司;2×Pfu PCR Master Mix、One Step RNA PCR Kit及柱式小量RNA抽提试剂盒购于日本TaKaPa公司;PCR仪购于美国GE公司;小鼠Anti-PPARγ2单克隆抗体及小鼠Anti-PPARγ2 phosphoSer112单克隆抗体均购于美国Pierce公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG及TRITC标记山羊抗小鼠IgG(H+L)均购于北京中衫金桥公司。
1.2 实验方法
1.2.1 脂肪干细胞提取和培养 小鼠颈椎脱臼后75%酒精浸泡5 min,分离腹股沟脂肪组织并剪碎,贴于培养皿(6 cm)中,组织基本贴壁后加入含10%FBS、改良型α-MEM及100 U/ml的链霉素及青霉素的培养基,置于5% CO2,37℃的培养箱中培养,每3天更换1次培养基。当贴壁细胞融合至80%时使用0.25%的胰蛋白酶消化传代,1×105/ml细胞数目接种继续培养。
1.2.2 脂肪干细胞脂向分化诱导 待细胞融合至80%左右时对第3代干细胞给予脂向诱导分化,培养基主要含有10%FBS、改良型α-MEM、0.5 mmol/L的1,3-异丁基-1-甲基黄嘌呤、10-5mol/L胰岛素、10-6mol/L地塞米松磷酸钠、0.2 mmol/L吲哚嘌呤,并将未诱导分化的干细胞作对照组。分别于诱导后第3、6天给予半量换液。所有样本量均3个复孔,于显微镜下观察细胞质脂滴形成情况和细胞形态,并于诱导5 d后行油红O染色,鉴定脂向诱导情况。
1.2.3 Western印迹检测 分别提取诱导0、1、3、5、7、9 d的细胞蛋白,BCA蛋白含量试剂盒对总蛋白含量进行测定。对30 μg蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,小鼠抗-PPARγ2单克隆抗体及小鼠抗-PPARγ2 phosphoSer112单克隆抗体为一抗,HRP标记山羊抗小鼠IgG为二抗,使用化学发光法对免疫复合物及美国Gel Doc XR系统拍摄结果。利用Quantity-One 4.6.2软件分析PPARγ2及其磷酸化形成的蛋白表达情况及其条带灰度值/GAPDH条带灰度值。
1.2.4 RT-PCR半定量检测 分别对0、1、3、5、7、9 d的脂肪干细胞RNA进行提取诱导。依据反转录试剂盒将提取的RNA反转录为cDNA,具体RT条件:30 min 50℃,5 min 95℃,10 min 4℃。以1 μl cDNA为模板添加1 μl上、下游引物、10 μl 2×Pfu PCR Master Mix,补齐ddH2O至20 μl后行PCR反应,具体条件:3 min 94℃;30 s 94℃,65℃30 s(每2个循环降低1℃),1 min 72℃,20个循环;30 s 94℃,30 s 55℃,1 min 72℃,20个循环;5 min 72℃;5 min 4℃。对5 μl Marker及6 μl PCR产物行20 g/L琼脂糖凝胶电泳,电压120 V进行30 min,结束后采用凝胶成像系统拍摄电泳结果,并分析PPARγ2的表达水平。
1.3 统计学方法 采用SPSS19.0统计学软件进行方差分析、LSD检验。
2 结 果
2.1 脂肪干细胞形态学观察 油红O可观察到,在条件诱导培养基下,随着诱导时间的增长,脂滴逐渐融合变大,脂滴呈橙红色,见图1。
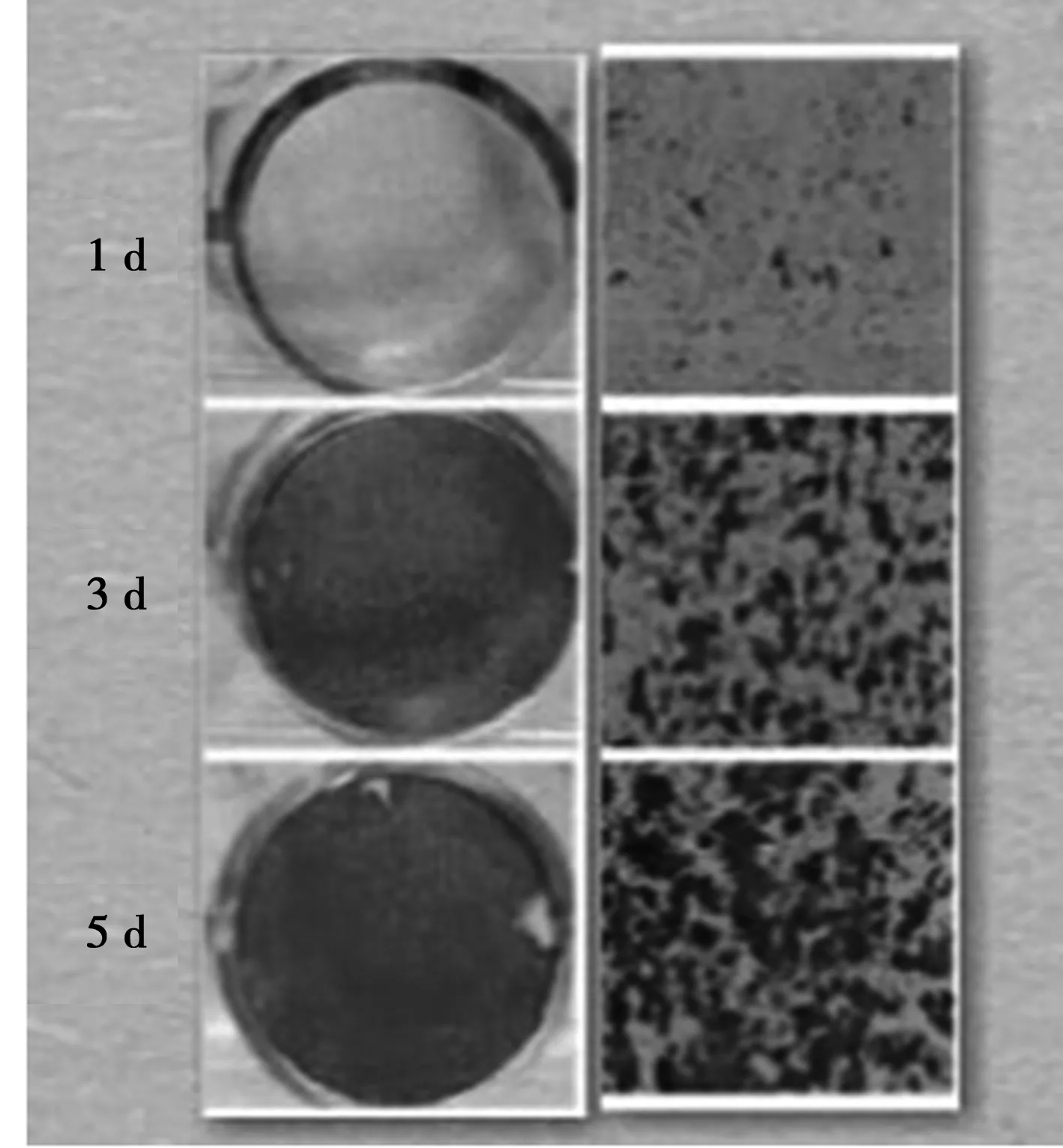
图1 油红O染色观察(×100)
2.2 半定量RT-PCR结果 随着脂向分化诱导时间的增长,PPARγ2 mRNA相对表达量呈逐渐递增的趋势(P<0.05),0 d:0.102±0.002,1 d:0.124±0.006,3 d:0.201±0.005,5 d:0.301±0.022,7 d:0.368±0.012,9 d:0.387±0.011,其中第7天和第9天差异无统计学意义(P>0.05)。见图2。

图2 诱导不同时间PPARγ2 mRNA表达
2.3 Western印迹结果 随着脂向分化诱导时间的增长,PPARγ2的非磷酸化与磷酸化形式的相对表达量明显增加(P<0.05),见表1,图3。
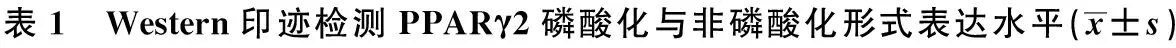

时间非磷酸化PPARγ2PPARγ20d0.562±0.0640.212±0.0411d0.682±0.0321)0.401±0.0211)3d0.832±0.1021)0.703±0.0741)5d1.211±0.1041)1.031±0.2211)7d1.403±0.1201)1.134±0.1501)9d1.603±0.1351)1.230±0.1511)F/P值7.302/<0.056.891/<0.05
与0 d比较:1)P<0.05
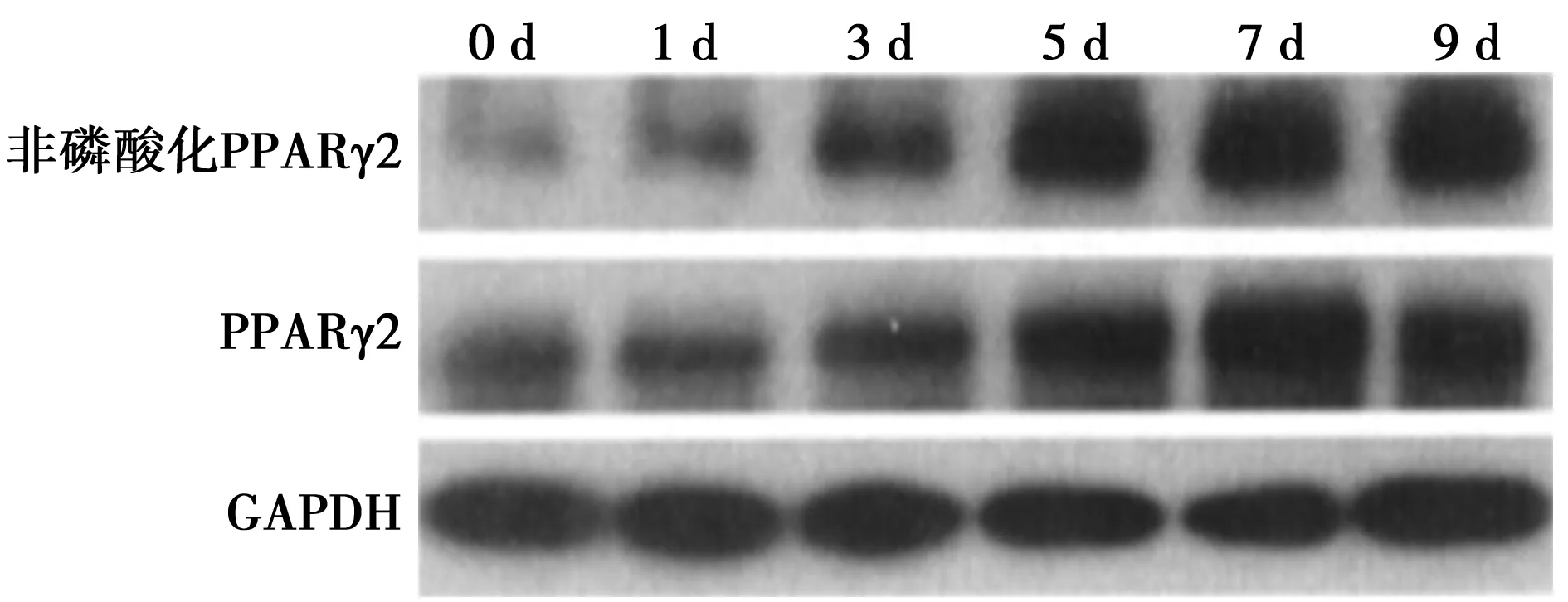
图3 PPARγ2的磷酸化与非磷酸化形式的Western印迹检验
3 讨 论
肥胖的产生因素较多,脂肪细胞增大是重要原因。此外,脂肪细胞数目的增加也是导致肥胖的重要因素,而存在于脂肪组织内多潜能干细胞的脂向分化是脂肪细胞数目增多的重要来源,并且于相关因素的刺激下,骨髓间充质干细胞等其他器官的干细胞也可募集到脂肪组织分化为脂肪细胞〔4,5〕。脂肪细胞的分化可分为多能干细胞、前脂肪细胞及脂肪细胞3个阶段〔6〕。现阶段对于脂肪细胞分化的研究主要集中于小鼠前脂肪细胞到成熟脂肪细胞阶段,脂肪细胞的调节机制也是目前研究的重要方向。
PPARγ2被认为是脂肪分化的重要转录调节因子。脂肪细胞中最具有代表性的PPAR目的基因是脂肪酸结合蛋白基因,其含有一个典型的PPAR/视黄醇X受体结合位点〔7〕。PPAR可通过此结合位点与配体直接结合、调节磷酸化状态及热休克蛋白结合配体方式激活,进而与RXR形成异二聚体,复合物中RXR能与目的基因的PPAR反应元件相互作用,进行目的基因的转录及表达相关研究〔8~10〕发现PPARγ2的异常表达可使成肌细胞、前脂肪细胞及成纤维细胞进行脂向分化,增强子CCAAT结合蛋白α于PPARγ2缺失的条件下无法诱导脂向分化,但PPARγ2可在增强子CCAAT结合蛋白α缺失的条件下诱导脂向分化,还可诱导多种脂肪细胞特异基因的表达。本研究结果充分说明PPARγ2为脂肪分化的重要转录因子,在脂肪分化的过程中地位显著。
本研究发现未分化的脂肪干细胞的PPARγ2及其磷酸化形式存在弱表达,与Lynch等〔11〕的研究相符。项芬芬等〔12〕的研究发现,未分化的骨髓充质干细胞也存在PPARγ2及其磷酸化形式存在弱表达。PPARγ含磷蛋白质,与其他细胞核受体相似,其转录活性与磷酸酶及激酶的交互作用影响较大,但PPARγ通过磷酸化调节的活性较复杂并存在争议。PPARγ2及其磷酸化蛋白与脂肪干细胞脂向分化关系主要有以下两点〔13,14〕:(1)PPARγ的磷酸化可被MAPK家族中的JNK、ERK同时作用,通过激活MAPK通路磷酸化PPARγ,并降低其转录活性进而抑制脂向分化;(2)112位丝氨酸无法被磷酸化的突变体中,PPARγ可帮助细胞抵抗有丝分裂源诱发的脂向分化抑制。但是,不是所有的磷酸化均可抑制脂肪分化。高浓度血清可增加PPARγ及其磷酸化形式的表达,进而促进脂向分化。
此外,胰岛素处理可促进PPARγ及其磷酸化形式的表达,并增加配体依赖性的PPARγ转录活性和增强TZD诱导的PPARγ转录激活功能。本研究结果提示PPARγ可能是通过自身磷酸化而加强脂向分化。
1 吕 妍,徐金娥,杨晓菊,等.过氧化物酶体增殖物激活受体β在妊娠期糖尿病孕妇腹直肌及腹部皮下脂肪中的表达及意义〔J〕.中国糖尿病杂志,2015;42(6):372-6.
2 史婷婷,庄让笑,周红萍,等.芹菜素对大鼠非酒精性脂肪性肝炎肝组织过氧化物酶体增殖物激活受体表达的影响〔J〕.中华肝脏病杂志,2015;23(2):124-9.
3 李冬梅,史 勇,楚洪波,等.低剂量硝酸镧对糖尿病大鼠脂肪组织中过氧化物酶体增殖物激活受体-γ和葡萄糖转运蛋白4表达的影响〔J〕.环境与健康杂志,2014;31(2):104-6.
4 徐 凯,王效京,刘 宏,等.过氧化物酶体增殖物激活受体α在猪肝脏组织中发育性表达研究〔J〕.中国畜牧兽医,2014;41(10):178-82.
5 夏燕萍,俞茂华,陈 蔚,等.茶多酚对代谢综合征大鼠过氧化物酶体增殖物激活受体及胰岛素信号传导通路的作用研究〔J〕.中国糖尿病杂志,2016;24(1):69-73.
6 陈 晶,李 丽,叶月芳.青蒿琥酯对非酒精性脂肪炎大鼠肝组织中过氧化物酶体增殖物激活受体γ和固醇调节元件结合蛋白-1c表达的影响〔J〕.中国医药导报,2014;14(23):4-7.
7 唐 丹,周永健,李瑜元,等.基础研究姜黄素对脂肪变性肝细胞过氧化物酶体增殖物活化受体-α的去甲基化作用〔J〕.广东医学,2014;35(2):175-9.
8 Pellerito O,Notaro A,Sabella S,etal.WIN induces apoptotic cell death in human colon cancer cells through a block of autophagic flux dependent on PPAR down-regulation〔J〕.Apoptosis,2014;19(6):1029-42.
9 许 新,姜 曼,李江文,等.过氧化物酶体增殖物激活受体γ基因rs3856806位点多态性与非酒精性脂肪性肝病的相关性分析〔J〕.临床肝胆病杂志,2015;31(7):1088-91.
10 严 黄,颉欣妮,徐 成,等.过氧化物酶体增殖物激活受体γ与适应性产热调节〔J〕.国际药学研究杂志,2015;42(1):1-7.
11 Lynch PJ,Thompson EE,Mcginnis K,etal.Chromatin changes at the PPAR-γ2,promoter during bone marrow-derived multipotent stromal cell culture correlate with loss of gene activation potential〔J〕.Stem Cells,2015;33(7):2169-81.
12 项芬芬,张学梅,马 艳,等.作用于过氧化物酶体增殖物激活受体药物的研究进展〔J〕.生命科学研究,2015;19(4):372-6.
13 Vanella L,Tibullo D,Godos J,etal.Caffeic acid phenethyl ester regulates PPAR's levels in stem cells-derived adipocytes〔J〕.PPAR Res,2016;2016:7359521.
14 章 琳,杨渭临.过氧化物酶体增殖物激活受体在肺纤维化中的作用〔J〕.国际呼吸杂志,2014;34(4):310-4.
〔2016-10-09修回〕
(编辑 滕欣航)
国家自然科学基金(No.81401800)
殷国勇(1965-),男,博士,主任医师,主要从事骨科及脊柱临床与基础研究。
周 炜(1982-),男,博士在读,副主任医师,主要从事骨科、脊柱外科临床与基础研究。
R3
A
1005-9202(2017)06-1304-03;
10.3969/j.issn.1005-9202.2017.06.002
1 浙江省人民医院骨科
