絮凝剂对雨生红球藻采收的影响
2017-04-07苏会波林海龙
彭 超,苏会波,熊 强,李 凡,林海龙
(1.中粮集团营养健康研究院,北京102209; 2.国家能源生物液体燃料研发(实验)中心,北京102209)
絮凝剂对雨生红球藻采收的影响
彭 超1,2,苏会波1,2,熊 强1,2,李 凡1,2,林海龙1,2
(1.中粮集团营养健康研究院,北京102209; 2.国家能源生物液体燃料研发(实验)中心,北京102209)
为了找到可以加速雨生红球藻采收的絮凝剂,选用几种常用的无机絮凝剂和生物絮凝剂对雨生红球藻进行处理,研究不同絮凝剂对雨生红球藻采收的影响。结果表明:聚合硫酸铁(SPFC)是絮凝效果最好的无机絮凝剂。其最佳使用条件:添加SPFC的质量浓度为1.5 g/L,絮凝时间为120 min,絮凝率达到90.0%。壳聚糖作为一种性状优良的生物絮凝剂也被应用于本研究中,其最佳的使用条件:pH为4.0,分子量(Mw)为5.0×103,添加壳聚糖的质量浓度为20 mg/L,絮凝率达到74.8%。另外,当SPFC和壳聚糖协同作用时,雨生红球藻的絮凝率达到最大值(97.0%),远远高于二者单独使用时的絮凝率;也缩短了最大絮凝率的时间,仅为90 min,絮凝效果明显提高。SPFC和壳聚糖复合使用可应用于雨生红球藻大规模生产的采收。
雨生红球藻;虾青素;絮凝;壳聚糖
雨生红球藻(Haematococcuspluvialis)是一种单细胞淡水绿藻,其生活史复杂多样,它的生长过程主要包括营养细胞生长(绿色细胞)和虾青素积累(红色细胞)两个阶段。雨生红球藻是迄今发现的虾青素含量最高的生物,被誉为天然虾青素的“浓缩品”[1-2]。目前,雨生红球藻有着较高的综合利用价值和广阔的应用前景,然而由于雨生红球藻生长速度较慢、细胞密度较低(约1 g/L)、细胞个体小、微藻细胞与培养液之间的密度差异较小等因素,使得雨生红球藻采收方法的选择成为雨生红球藻大规模工业化生产的一个技术难点。从综合成本上考虑,雨生红球藻的采收过程占整个雨生红球藻藻粉生产成本的20%~30%,甚至更高。因此,亟待开发出高效、环境友好的采收方法,提高雨生红球藻采收的效率和经济性,促进雨生红球藻的产品开发和应用[4-5]。
目前,关于微藻采收方法的研究工作主要集中在过滤法、气浮法、离心法以及絮凝法等方面[9-10]。其中,过滤法和气浮法主要依赖于藻种的特性,且过滤法涉及滤膜堵塞与污染等问题不能较好地被解决,导致其在大规模工业化生产中很少应用;离心法虽然普适性强,但是从较低密度的藻液中,特别是在开放培养方式中的藻液中收集微藻生物质将会导致设备的能耗极高。絮凝法是利用微藻表面的负电荷与絮凝剂所带有的正电荷相结合的原理,使微藻细胞絮凝形成小的聚集体,从而达到藻体采收的目的。与其他微藻采收方法相比较,絮凝法可应用于微藻的大规模采收,其藻种适用范围较广,而且能耗相对较低,被认为是更经济可靠的微藻采收方法[11]。
常用的絮凝剂主要包括无机絮凝剂类和生物絮凝剂类这2大类。无机絮凝剂是工业应用最多的一类絮凝剂,具有生产工艺成熟、絮凝效率高等特点,如:FeCl3、Al2(SO4)3、聚合氯化铝、聚合硫酸铁等都是工业上常用的无机絮凝剂。然而,添加无机絮凝剂处理微藻的时候,由于絮凝过程中金属离子的引入将在一定程度上限制微藻的后续应用[12-13]。生物絮凝剂是近年来发展起来的一类高效絮凝剂,其中,壳聚糖的应用最广泛。壳聚糖是一种天然的高分子化合物,近年来因其无毒、可降解等优点,被广泛应用于微藻的絮凝研究[14-16]。
本论文中,笔者主要考察不同絮凝剂对雨生红球藻采收的影响,并对两类絮凝剂的使用条件进行优化,以确定其最佳使用条件。同时,笔者尝试通过将这两类絮凝剂进行复合添加来提高雨生红球藻的采收率,以进一步降低雨生红球藻的生产成本,减少无机絮凝剂的使用量和金属离子在藻液中的残留量,从而为雨生红球藻的商业化应用奠定技术基础。
1 材料与方法
1.1 藻种及絮凝剂
雨生红球藻原始藻种(藻种编号为FACHB-875)从中国科学院武汉水生生物研究所淡水藻种库购买,经过一系列分离、纯化等工作,获得了1株性状优良的藻种,保存于中粮营养健康研究院生物技术中心,藻种编号为NHRI A753.1。
FeCl3、KAl(SO4)2·12H2O(明矾)、Al2(SO4)3、聚合氯化铝(PAC)、聚合硫酸铁(SPFC)和不同分子量的壳聚糖均来源于国药集团化学试剂有限公司。
1.2 培养基
雨生红球藻生长培养基(BBM培养基,g/L):NaNO3250,K2HPO475,NaCl 25,MgSO4·7H2O 75,CaCl2·2H2O 25,KH2PO4175,维生素B10.001,生物素2.5×10-7,维生素B121.5×10-7,Na2EDTA 0.75,MnCl2·4H2O 0.041,ZnCl2·7H2O 0.005, Na2MoO4·2H2O 0.004,FeCl3·6H2O 0.097,CoCl2·6H2O 0.002。
1.3 培养方法
1.3.1 雨生红球藻培养方法
将配制好的BBM培养液分装至1 000 mL摇瓶中,装液量为100 mL,121 ℃灭菌30 min,冷却后在无菌条件下接入5 mL处于对数生长期的雨生红球藻细胞,置于光照培养箱中培养,光照强度2 000 lx,培养温度25 ℃,光暗比12 h∶ 12 h,通气进行培养。
1.3.2 无机絮凝剂对雨生红球藻采收的影响
取30 mL待采收的藻液于50 mL锥形瓶中,测定初始吸光值(A680)。加入絮凝剂FeCl3(1.0 g/L)、KAl(SO4)2·12H2O(1.6 g/L)、Al2(SO4)3(1.4 g/L)、PAC(1.4 g/L)和SPFC(1.0 g/L),速度由快至慢搅拌,直至絮凝剂完全溶解后,室温静置,定时取样测定上清液A680,每组设2个平行。
1.3.3 生物絮凝剂(壳聚糖)对雨生红球藻絮凝效果的影响
1)pH对雨生红球藻絮凝效果的影响。取30 mL待采收的藻液于50 mL锥形瓶中,测定初始A680。以2 mol/L HCl和2 mol/L NaOH调节藻液的pH至4.0、5.0、6.0、8.0、9.0和10.0,藻液初始pH为7.0,室温静置,定时取样测定上清液A680,每组设2个平行。
2)壳聚糖分子量(Mw)大小对雨生红球藻絮凝效果的影响。取30 mL待采收的藻液于50 mL锥形瓶中,测定初始A680。在预实验基础上,按15 mg/L的质量浓度分别添加分子量5.0×103、5.0×104、1.0×105以及8.0×105的壳聚糖,同时设立对照组,速度由快至慢搅拌至壳聚糖完全溶解后,室温静置,定时取样测定上清液A680,每组设2个平行。室温静置,定时取样测定上清液A680,每组设2个平行。
1.3.4 壳聚糖添加浓度对雨生红球藻絮凝效果的影响
取30 mL待采收的藻液于50 mL锥形瓶中,测定初始A680。加入不同浓度的壳聚糖,添加质量浓度分别为10、20、30和40 mg/L,同时设立空白对照组,速度由快至慢搅拌至壳聚糖完全溶解后,室温静置,定时取样测定上清液A680值,每组设2个平行。室温静置,定时取样测定上清液A680,每组设2个平行。
1.3.5 正交优化实验
利用正交方法设计实验,进行3因素4水平正交实验,剂量(A)、分子量(B)和pH(C)。取30 mL待采收的藻液于50 mL锥形瓶中,测定初始A680。加入壳聚糖,调节pH,速度由快至慢搅拌至壳聚糖完全溶解后,室温静置,定时取样测定上清液A680,每组设2个平行。
1.3.6 复合絮凝剂对雨生红球藻絮凝效果的影响
取30 mL待采收的藻液于50 mL锥形瓶中,测定初始A680。加入3种不同的絮凝剂(SPFC、壳聚糖、SPFC+壳聚糖),速度由快至慢搅拌,直至絮凝剂基本上溶解后,室温静置,定时取样测定上清液A680值,每组设2个平行组。
1.4 分析检测方法
1)藻液浓度。用紫外分光光度计在波长为680 nm处测定藻液浓度,用吸光度值A680表示雨生红球藻藻液的浓度。
2)藻液絮凝率。待测藻液经充分振荡混匀后,测定藻液A680值,计算细胞浓度N0;加入絮凝剂后,静置,按时取上清液,测定A680值,计算t时刻的细胞浓度Nt;则t时的细胞采收率计算见式(1)
(1)
2 结果与讨论
2.1 无机絮凝剂种类对雨生红球藻絮凝效果的影响
为了考察不同的无机絮凝剂在雨生红球藻采收工艺中的应用效果,本试验选用5种常用的无机絮凝剂,包括FeCl3、KAl(SO4)2·12H2O、Al2(SO4)3、PAC及SPFC,考察添加不同无机絮凝剂对雨生红球藻絮凝效果的影响,结果如图1所示。

图1 无机絮凝剂对雨生红球藻絮凝率的影响Fig.1 Effects of inorganic flocculants types on the flocculation efficiency of Haematococcus pluvialis
由图1可知:添加5种不同絮凝剂应用到雨生红球藻采收的研究时,絮凝效率均远远高于空白对照组。当絮凝时间在120 min以内时,所有试验组的絮凝率都呈明显上升趋势;这是因为无机阳离子絮凝剂通过水解作用,生成带正电的金属离子,而藻液中的微藻细胞带有负电荷,两者发生电中和作用,使微藻表面的负电荷减弱,从而增强了微藻的絮凝效率;絮凝初期(0~60 min),带正电的金属离子与带负电的微藻细胞未完全接触,因而金属离子对絮凝率的影响并不大。而当絮凝时间超过60 min后,电中和作用比较完全,絮凝率在120 min左右时已达到最大。其中,添加Al2(SO4)3和SPFC为絮凝剂时,絮凝效果最优,絮凝率分别达88.5%和87.8%,对照组在实验结束时絮凝率为18.6%。
研究发现,当絮凝时间超过120 min的时候,添加PAC试验组的絮凝率出现明显的降低,可能是因为发生了微藻细胞的自融,部分微藻细胞碎片进入上层液体导致其OD值上升。除此之外,其他试验组(包括空白对照组)的絮凝率缓慢变化或维持不变。分析原因,此阶段的电中和作用已消失,絮凝剂的存在不会对微藻的絮凝起到显著的促进作用,这个阶段的微藻絮凝作用还是依靠微藻的理化特性自然沉降。
2.2 无机絮凝剂添加浓度对雨生红球藻絮凝效果的影响
以上研究结果表明,当添加Al2(SO4)3和SPFC这两种无机絮凝剂作为絮凝剂时,絮凝效率最高。为了进一步研究这两种无机絮凝剂的最佳添加浓度,本实验设计了5个不同的添加梯度(0.5、0.8、1.0、1.5和2.0 g/L),絮凝时间为120 min,结果如图2所示。
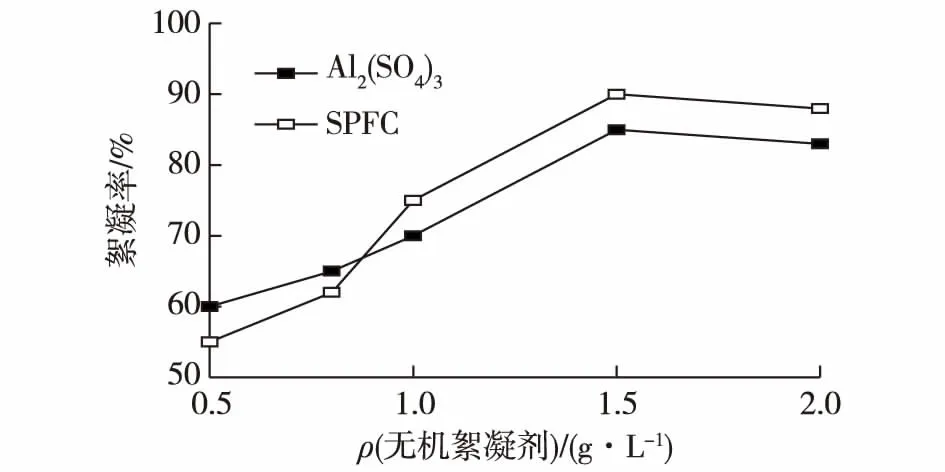
图2 无机絮凝剂添加浓度对雨生红球藻采收的影响Fig.2 Effects of inorganic flocculants concentration on the flocculation efficiency of Haematococcus pluvialis
由图2可知:当这两种无机絮凝剂(Al2(SO4)3和SPFC)的添加质量浓度低于0.8 g/L时,絮凝率的变化较慢,但Al2(SO4)3的絮凝效率要高于SPFC。当添加质量浓度高于0.8 g/L时,絮凝率均急剧上升,当质量浓度达到1.5 g/L时,絮凝率达到最大值,其中添加SPFC试验组的絮凝率达到90%左右,稍高于Al2(SO4)3试验组的值(85.0%)。因此,选择SPFC作为雨生红球藻采收的絮凝剂使用时,其使用条件:添加质量浓度为1.5 g/L,絮凝时间为120 min。
2.3 壳聚糖对雨生红球藻絮凝率的影响
无机絮凝剂的残留和毒性等安全问题,可能会使雨生红球藻在食品工业的应用受到一定的限制。壳聚糖是一种天然的絮凝剂,安全性高,它在食品工业中使用不受限制。壳聚糖是一种高分子线性多糖,因为其具有阳离子聚电解质的性质,故可通过静电吸引和吸附架桥使悬浮于藻液中的细胞形成大的絮凝团而沉降。此外,壳聚糖具有无毒、可生物降解等优点,目前被普遍认为是最为安全有效的微藻絮凝剂。因此,本研究选择壳聚糖这种生物絮凝剂应用到雨生红球藻的采收研究,在提高絮凝效率和降低生产成本方面进行了一些初步的探索。
2.3.1 单因素考察结果
过往的研究结果表明,藻液的pH、壳聚糖的分子量和添加浓度这3个外部因素对壳聚糖在微藻絮凝研究方面应用的影响比较显著[15-16]。因此,本研究首先对这3个重要的影响因素(pH、分子量、添加浓度)进行了单因素考察。
图3为不同藻液pH条件下的雨生红球藻絮凝效率变化曲线。由图3可知,藻液的pH控制在酸性(4.0、5.0和6.0)条件时,红球藻的絮凝效率明显高于藻液pH在中性和碱性条件(7.0、8.0、9.0和10.0)的絮凝效率。这可能因为当pH较低时,藻液呈酸性,带有正电荷,与带负电荷的藻细胞发生电中和作用,此时细胞发生 “脱稳现象”,从而产生絮凝;而当pH较高时,藻液呈碱性,带有负电荷,使得微藻表面的电负性增强,细胞之间相互排斥作用加大,难以聚集,因而絮凝率降低。相关研究表明,pH对胶体颗粒的表面电荷Z电位、絮凝剂的性质以及絮凝作用有较大影响。一般情况下,阳离子型絮凝剂适合于在酸性和中性的环境下使用,阴离子型絮凝剂适合于在中性和碱性的环境下使用。因此,壳聚糖作为絮凝剂进行添加时,藻液的最佳pH控制在pH 4.0~6.0。

图3 藻液初始pH对雨生红球藻絮凝率的影响Fig.3 Effects of initial pH on flocculation efficiency of Haematococcus pluvialis
图4为添加不同分子量的壳聚糖(添加浓质量度均为15 mg/L)对雨生红球藻絮凝率的影响。由图4可知:添加低分子量(5.0×103和5.0×104)的壳聚糖作为絮凝剂,其絮凝效果明显优于对照组。然而,添加高分子量的壳聚糖(1.0×105和8.0×105)对雨生红球藻絮凝率的提高效果并不显著。并且,当添加分子量为8.0×105的壳聚糖时,絮凝率与空白对照试验组一致,没有起到任何絮凝效果。这可能是因为低分子量的壳聚糖聚合度较低,与高分子量壳聚糖相比较更容易在水中溶解,并与微藻细胞形成共絮凝体系。因此,添加分子量为5.0×103的壳聚糖,最利于雨生红球藻的絮凝。
图5为不同质量浓度的壳聚糖(Mw=5.0×103)添加量对雨生红球藻絮凝率的影响。由图5可知:与空白对照组相比,壳聚糖的加入可显著提高藻体的絮凝率。当壳聚糖的添加浓度较低时,藻体的絮凝率随壳聚糖浓度的加大而升高,添加质量浓度为30 mg/L时,絮凝效果最佳,可达到43.0%。但是,当添加质量浓度超过30 mg/L时,其絮凝效率却显著降低,这可能因为过高浓度的壳聚糖无法完全溶解于藻液中,反而阻碍了藻体的絮凝,导致絮凝效率降低。因此,壳聚糖的添加量为30 mg/L时,雨生红球藻的絮凝效率最高。
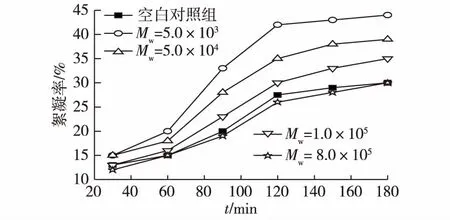
图4 壳聚糖分子量对雨生红球藻絮凝率的影响Fig.4 Effects of chitosan MW on flocculation efficiency of Haematococcus pluvialis
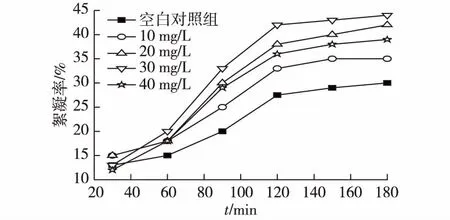
图5 壳聚糖添加量对雨生红球藻絮凝率的影响Fig.5 Effects of chitosan dosage on flocculation efficiency of Haematococcus pluvialis
2.3.2 正交优化实验结果
根据单因素考察的试验结果,进一步开展了壳聚糖浓度、壳聚糖分子量以及藻液pH的正交实验,按3因素4水平设计正交试验表,研究结果如表1所示。
由表2可知:3个因素(添加量、分子量、藻液pH)对雨生红球藻絮凝效果的影响比较显著。除此之外,通过比较极差R来判断3个因素对雨生红球藻絮凝效果的影响,研究发现藻液pH的影响最大,壳聚糖分子量其次,添加浓度的影响最小。通过K值的大小判定各因素的最优水平,因此,3个因素的最优条件组合为A1B1C1,即:pH为4,分子量为5.0×103,添加质量浓度为20 mg/L时,雨生红球藻的絮凝效果最佳,絮凝率达到74.8%。
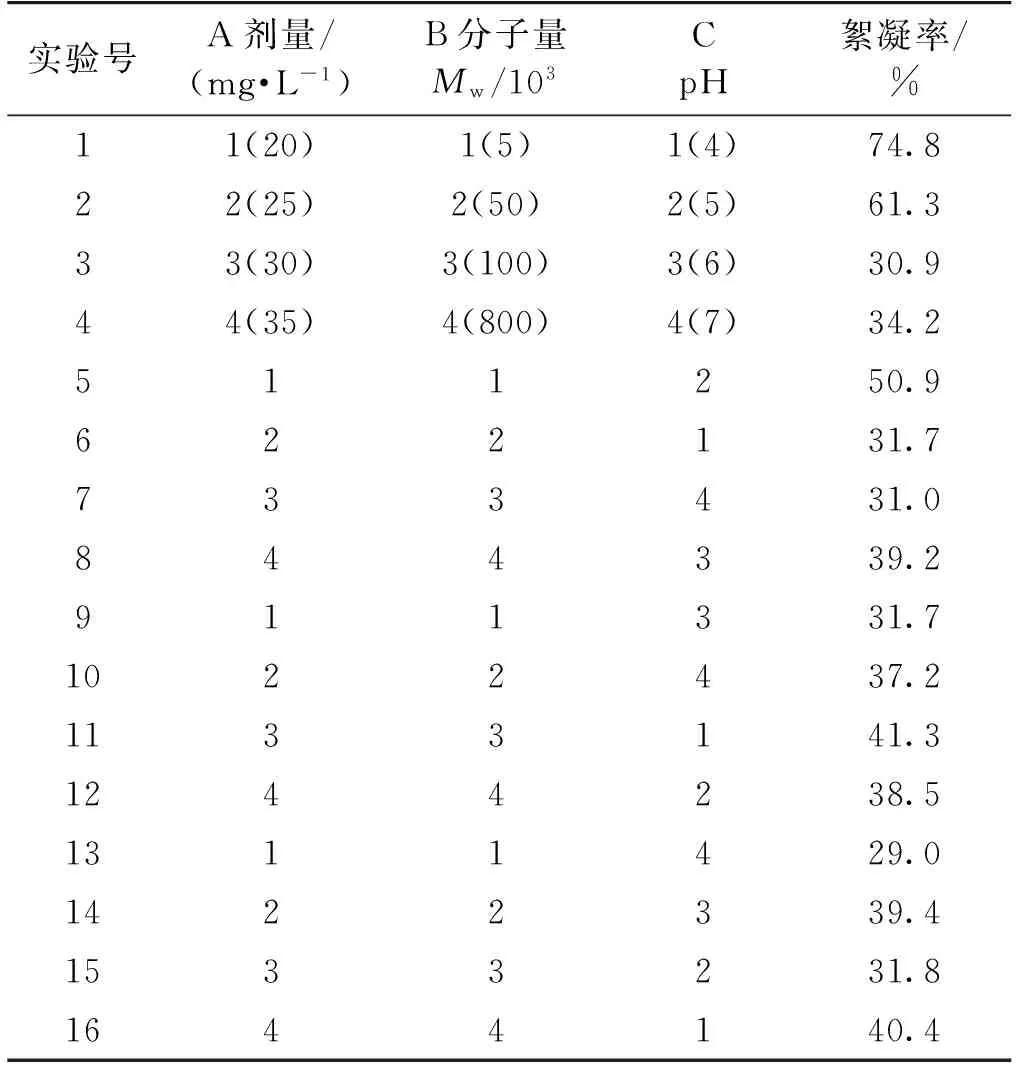
表1 正交实验设计及结果
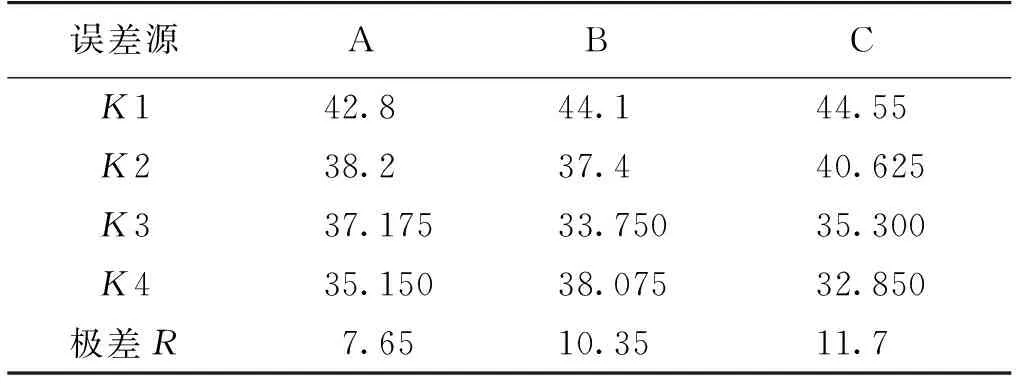
表2 极差分析表
2.4 复合絮凝剂对雨生红球藻絮凝效果的影响
为了进一步研究无机絮凝剂(SPFC)和生物絮凝剂(壳聚糖)在雨生红球藻絮凝过程中的协同作用,根据前期的单一絮凝剂添加条件优化试验结果,本研究尝试通过将无机絮凝剂的添加量减少1/4,与少量壳聚糖一起加入雨生红球藻培养液,考察复合絮凝剂对雨生红球藻絮凝效果的影响,结果如表3所示。由表3可知:当SPFC和壳聚糖协同作用时,絮凝率达到最大值(97.0%),远远高于二者单独使用时的絮凝率。并且,通过二者协同作用,达到最大絮凝率的时间缩短了,仅为90 min,这对絮凝效率的提升和生产成本的降低也至关重要。分析原因,这可能是因为壳聚糖包覆在SPFC的表面,高分子链缠绕在SPFC周围,比表面积增大,大大地增加了絮凝剂和雨生红球藻的接触机会,因此用量减少,同时絮凝效果改善。另外,二者协同作用,还可以大大地避免无机絮凝剂(SPFC)过度使用对雨生红球藻后续产品应用所带来的负面影响。

表3 不同絮凝方法的比较结果
3 结论
本研究将几种常用无机絮凝剂应用到雨生红球藻采收工艺,SPFC作为絮凝剂使用时的絮凝效果最好,达到88.0%,最佳的添加质量浓度为1.5 g/L,最佳的絮凝时间为120 min。同时,壳聚糖作为一种常见的生物絮凝剂,可以较好地被应用到雨生红球藻采收工艺研究中,其最佳的使用条件是:pH为4.0,分子量为5.0×103,添加质量浓度为20 mg/L,絮凝率可达到74.8%,最佳的絮凝时间为120 min。为了减少无机絮凝剂(SPFC)的过多加入对雨生红球藻后续产品应用的影响,本研究尝试性的将SPFC的添加量减少1/4,并且和壳聚糖混合使用作为复合絮凝剂应用于雨生红球藻的采收工艺中,研究结果表明,SPFC和壳聚糖协同作用时,絮凝率达到最大值(97.0%),远远高于二者单独使用时的絮凝率。并且,通过二者协同作用,达到最大絮凝率的时间缩短了,仅为90 min,这对雨生红球藻絮凝效率的提升和生产成本的降低至关重要。
[1] MILLEDGE J J.Commercial application of microalgae other than as biofuels:a brief review.Rev Environ Sci Biotechnol 2011,10:31-41.
[2] 孙雯,黄和,林海龙.抗生素对雨生红球藻无菌化培养的影响.生物加工过程,2015,13(4):11-16
[3] ZHANG W D,WANG J F,WANG J L,et al.Attached cultivation ofHaematococcuspluvialisfor astaxanthin production.Bioresour Technol,2014,158:329-335.
[4] LI J,ZHU D L,NIU J F,et al.An economic assessment of astaxanthin production by large scale cultivation ofHaematococcuspluvialis.Biotechnol Adv 2011,29(6):568-574.
[5] AFLALO C,MESHULAM Y,ZARKA A,et al.On the relative efficiency of two-vs.one stage production of astaxanthin by the green algaHaematococcuspluvialis.Biotechnol Bioeng 2007,98(1):300-305.
[6] LIANG H,YANG Y L,GONG W J,et al.Effect of pretreatment by permanganate/chlorine on algae fouling control for ultrafiltration (UF) membrane system.Desalination,2008,222(1/2/3):74-80.
[7] KURNIAWATI H A,ISMADJI S,LIU J C.Microalgae harvesting by flotation using natural saponin and chitosan.Bioresour Technol,2014,166:429-434.
[8] HEASMAN M,DIEMAR J,O′CONNOR W,et al.Development of extended shelf-life microalgae concentrate diets harvested by centrifugation for bivalve mollusks:a summary.Aquacultural Res,2000,31(8/9):637-659.
[9] WU J H,LIU J X,LIN L,et al.Evaluation of several flocculants for flocculating microalgae.Bioresour Technol,2015,197:495-501.
[10] WU Z C,ZHU Y,HUANG W,et al.Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium.Bioresour Technol,2012,110:496-502.
[11] VANDAMME D,FOUBERT I,MUYLAERT K.Flocculation as a low-cost method for harvesting microalgae for bulk biomass production.Trends Biotechnol,2013,31(4):233-239.
[12] CHEN F,LIU Z,LI D,et al.Using ammonia for algae harvesting and as nutrient in subsequent cultures.Bioresour Technol,2012,121:298-303.
[13] PAPAZI A,MAKRIDIS P,DIVANACH P.HarvestingChlorellaminutissimausing cell coagulants.J Appl Phycol,2010,22(3):349-355..
[14] XU Y N,PURTON S,BAGANZ F.Chitosan flocculation to aid the harvesting of the microalgaChlorellasorokiniana.Bioresour Technol,2013,129:296-301.
[15] BEACH E S,ECKELMAN M J,CUI Z,et al.Preferential technological and life cycle environmental performance of chitosan flocculation for harvesting of the green algaeNeochlorisoleoabundans.Bioresour Technol,2012,121:445-449.
[16] RASHID N,REHMAN M S U,HAN J I.Use of chitosan acid solutions to improve separation efficiency for harvesting of the microalgaChlorellavulgaris.Chem Eng J,2013,226:238-242.
(责任编辑 荀志金)
Effects of Flocculants on recovery ofHaematococcuspluvialis
PENG Chao1,2,SU Huibo1,2,XIONG Qiang1,2,LI Fan1,2,LIN Hailong1,2
(1. Nutrition and Health Research Institute,COFCO,Beijing 102209,China;2. National Energy Biological Liquid Fuel R&D Center,Beijing 102209,China)
Aimed to find the optimum flocculants to accelerate the gathering ofHaematococcuspluvialis,several commonly used inorganic and biological flocculants were selected to study their effects on recovery ofHaematococcuspluvialis.The results indicated that polymeric ferric sulfate(SPFC) was the best inorganic flocculant.The optimum conditions were as follows:1.5 g/L,120 min,and the flocculation rate reach up to 90.0%. Chitosan,as an excellent bioflocculant,was also used in this study.The optimum conditions were as follows:pH 4.0,5.0×103,20 mg/L,and the flocculation rate reach up to 74.8%.Furthermore,when SPFC and chitosan were add to the culture broth ofHaematococcuspluvialistogether,the flocculation rate reaches the maximum value(97.0%),more than the best result controlled by single use of either flocculant.By using this mixed flocculants,the time for maximum recovery was shortened obviously(90 min),flocculation effect is significantly improved.SPFC and chitosan could be used in the large-scale collection ofHaematococcuspluvialis
Haematococcuspluvialis;astaxanthin;flocculants;chitosan
10.3969/j.issn.1672-3678.2017.02.001
2016-09-13
国家高技术研究发展计划(863计划)(2012AA023107、2014AA021906)
彭 超(1985—),男,湖南汉寿人,博士,研究方向:生物能源与生物化工,E-mail:pengchao@cofco.com
Q949.2
A
1672-3678(2017)02-0001-06
