固定化细胞技术应用于酒精发酵中的研究进展
2017-04-07张强嵇冶
张强,嵇冶
(长春理工大学生命科学技术学院,吉林 长春 130022)
固定化细胞技术应用于酒精发酵中的研究进展
张强,嵇冶
(长春理工大学生命科学技术学院,吉林 长春 130022)
固定化细胞技术出现在20世纪70年代后期,是在固定化酶基础上发展起来的。近年来,固定化细胞技术被广泛应用于燃料酒精的研究与生产中。因其可以反复使用、连续发酵以及提高酒精得率等优势显示了巨大的发展潜力。研究固定化细胞酒精发酵具有十分重要的现实意义。本文综述了固定化细胞技术在酒精发酵领域的研究进展,介绍了酒精生产中常用的细胞固定化方法、特性及优势、固定化细胞技术在酒精发酵中应用以及在酒精发酵中存在的问题及解决办法等。指出开展细胞与细胞、细胞与酶的共固定化技术,无载体自絮凝细胞固定化技术以及开发新型酒精专用固定化载体材料是未来固定化细胞技术在酒精工业规模化应用的关键。
生物工程;固定化;酒精;发酵
自从20世纪70年代石油危机爆发以来,燃料短缺以及日益恶化的环境问题,使燃料酒精作为可再生能源越来越受到人们的关注[1]。然而菌体发酵周期长、耐受性差、酒精得率低以及生产成本高等问题阻碍了燃料酒精工业的迅速发展。围绕这些问题,人们开展了大量细致的研究工作,其中将固定化细胞技术应用于燃料酒精生产,已经引起了人们极大的兴趣[2]。
20世纪70年代后期,人们在固定化酶的基础上发展起来一种新兴生物技术——固定化细胞技术。它采用物理或化学方法将游离细胞闭锁于特定的空间使其保持活性并可以重复使用。目前固定化细胞技术广泛应用在食品、能源、环境保护以及发酵等工业中,尤其在酒精生产领域研究得最为深入和成熟。同传统的游离细胞酒精发酵相比,应用固定化细胞发酵具有增加细胞浓度,提高酒精得率,菌体能够反复使用以及提高设备利用率等优点[3]。
本文主要对酒精生产中常用细胞固定化方法、固定化细胞在酒精生产中特性及优势、固定化细胞技术在酒精生产中应用以及存在的问题及解决办法等进行综述,并提出固定化细胞技术在酒精生产中的未来研究方向。
1 酒精生产中常用的细胞固定化方法
目前用于酒精生产中细胞固定化的方法较多,任何限制细胞自由流动的技术,都能够用来固定化细胞。按照固定化模式与载体的不同,主要有吸附法、包埋法、膜隔离法和絮凝法等(见图1)[4]。
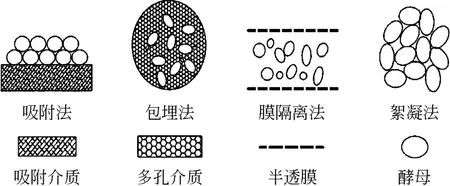
图1 细胞固定化方法
1.1 吸附法
吸附法是指载体和细胞通过离子键作用或物理吸附作用结合在一起,使细胞吸附在载体表面或内部的固定化方法。吸附法要求载体对于细胞应无毒害作用。载体吸附细胞数量多少往往受到温度、pH以及细胞和载体的特性等多种因素的影响。吸附法制备条件温和、操作简便易行、对细胞生长繁殖没有明显影响。但吸附力较弱、细胞容易脱落、酒精生产中使用受到限制。
泡沫陶瓷是常用的多孔网格状吸附材料,孔径比微生物细胞大,有利于吸附在载体表面及网格内部的微生物细胞与发酵液接触,细胞增殖培养效果较好。李丹等[5]利用泡沫多孔陶瓷为载体吸附酵母细胞,在温度20℃、菌体浓度108个/mL、摇床转速120r/min、吸附90min后固定化酵母细胞浓度达到107~108个/g。程江峰等[6]将用清水浸泡冲洗处理好的泡沫陶瓷,200℃灭菌后装入柱式反应装置中,14℃条件下充分吸附酵母细胞20min,吸附后细胞密度达到4.0×107~2.0×108个/mL料液,与包埋法几乎达到了等同的细胞密度。
1.2 包埋法
包埋法是采用物理方法将微生物细胞限制在各种载体形成的有限空间内。具有细胞容量大、操作简便、固定化后细胞强度高等优点。在众多包埋载体中,海藻酸钠包埋法在酒精生产中研究应用最为广泛。作为天然高分子多糖类包埋载体,包埋后细胞活性高,传质效果好。但海藻酸盐形成的凝胶机械强度低,在含钾钠等阳离子的高浓度溶液中易发生破碎。
海藻酸钠和氯化钙的浓度也会影响固定化细胞的机械强度及质量传递,进而影响酒精发酵微生物细胞的活性。尤业兵等[7]研究了海藻酸钠浓度、氯化钙浓度和固定化时间对抗冻酵母AFY-1活性的影响,发现海藻酸钠质量分数1.45%、氯化钙质量分数17.45%、固定化时间1.09h时,固定化酵母的生长繁殖能力明显高于游离酵母,固定化酵母与游离酵母的细胞总数从5.0×108个分别增加到11.2×108个和7.5×108个,因此最终固定化酵母的酒精得率比游离酵母高3.2%。
1.3 膜隔离法
膜隔离法是指利用渗析膜、超滤膜或中空纤维膜等半通透性膜,将细胞同发酵液隔离,底物和产物可透过此膜,而微生物细胞不能透过。膜隔离法简单、可选择性控制底物和产物扩散、基质与细胞接触充分。但容易造成半透膜堵塞以及增加生产成本等问题,所以限制了在燃料酒精领域的使用。
1.4 絮凝法
某些微生物在生长繁殖过程中,能够形成面积较大的菌胶团,这些菌胶团可以大量絮凝。利用细胞自身絮凝形成的颗粒作为一种固定化细胞的方法称为絮凝法,也称无载体固定法。絮凝法是新的细胞固定化技术,关于絮凝机理至今还没有完全弄清楚,它与诸多因素有关。STRATFORD[8]把絮凝看作是一个可逆的、无性的过程。VERSTREPEN等[9]认为细胞絮凝有两种原因:一是由于临近细胞表面的凝集素与甘露糖相结合导致絮凝;二是由于细胞表面的多肽吸引作用或者疏水作用导致絮凝。絮凝法简单、细胞具有较高的代谢活力、传质阻力小。白凤武[10]报道,在年产酒精3000t的10m3试验装置中,絮凝酵母的浓度达到30~40kg/m3,而采用载体固定及传统工艺的酵母浓度仅为10~20kg/m3和3~4kg/m3,表明絮凝酵母在适宜条件下生长繁殖的高效性,但絮凝微生物细胞机械强度较差、容易变形、不耐剪切力。
2 酒精生产中固定化细胞特性及优势
通过细胞固定化技术,高活性菌体细胞聚集于特定的空间内并快速地生长繁殖,能够形成高浓度的酒化酶系,从而加快了酒精发酵速度,提高了酒精得率。但固定化后的菌体细胞与游离细胞存在较大差异,主要体现在固定化方式对菌体细胞生理特性(如细胞形态、渗透压以及细胞膜通透性等)、代谢活性以及耐受性等方面会产生明显影响,从而导致菌体细胞内原有的生理平衡被破坏,细胞内相关酶活性发生变化[11]。通过固定化作用可以明显提高菌体细胞对恶劣环境的耐受性,对高糖高渗作用的应对能力也明显强于游离细胞。
秦晴[12]采用自絮凝酵母进行浓醪酒精发酵,发现固定化细胞内质膜ATPase活性、海藻糖含量以及细胞膜通透性均发生了明显变化,这些变化导致了酵母细胞能够抗高渗透压和抗胁迫能力。伍彦华等[13]实验发现,与其他三株酵母菌株相比,自絮凝酵母菌株FJY的酒精生产能力最高,86h发酵最终酒精体积分数达到15.7%,甘油产量却比其他三株酵母菌株低20%。而自絮凝酵母FJY 的死亡率最低,只有28%。甘油和海藻糖等物质能增强细胞抗性,经过固定化的自絮凝酵母产生的甘油却有所下降,表明固定化作用使菌体细胞产生了抗性,其耐高浓度、高酒精度的能力明显增强。
另外,固定化细胞内蛋白质种类与含量也与游离细胞明显不同。通过载体的保护作用,也可以避免pH、温度、有机溶剂以及有毒有害物质等外界环境的影响。
固定化技术更适合于酒精工业生产中的连续化和自动化操作。应用于酒精发酵工业,固定化细胞优势主要体现在以下几个方面[14]。
(1)在一定空间范围内生长繁殖,细胞密度增大,酒精形成速率加快。
(2)酒精生产中,节省了传统菌种扩培工序,节约非生产时间,设备利用率高。
(3)由于有固定化载体的保护作用,酒精生产中抗乳酸菌、醋酸菌等杂菌能力增强。
(4)提高淀粉质及糖质等原料出酒率,降低单位能耗,降低酒精生产成本。
固定化酵母和游离酵母酒精发酵主要技术指标对比见表2。

表2 固定化酵母和游离酵母酒精技术指标对比
3 固定化细胞技术在酒精生产中应用
固定化细胞技术应用于酒精工业生产是目前最活跃、最深入和最为成熟的领域,相关研究报道较多。
樊婧等[15]以甘蔗二压汁与原蜜的混合糖料作为发酵原料,采用海藻酸钙包埋酵母进行酒精发酵实验。温度为31℃时,酒精度达到11.4%(体积比,下同),残糖含量仅为0.89%。MARTINI等[16]采用稻壳吸附酿酒酵母进行酒精发酵,48h酒精得率达到0.59g/(L·h),是游离酵母细胞酒精得率0.26g/(L·h)的2.3倍。叶世超等[17]采用海藻酸钙凝胶包埋法固定化酿酒酵母发酵甘蔗汁生产酒精。52h酒精体积分数达到12.8%,糖的利用率90.27%,发酵效率达到86.7%。作者目前采用海藻酸钙凝胶包埋法固定酿酒酵母进行餐厨垃圾酒精发酵,酒精体积分数达到7.28%,与采用游离酵母发酵相比,发酵周期缩短了24h,酒精体积分数提高了近0.4%[18]。这些研究表明,与游离细胞相比,通过细胞固定化作用,增大了菌体细胞浓度,提高了酒精得率,降低了发酵残糖水平,缩短了发酵周期,发酵更为彻底。
熊亚[19]利用海藻酸钙包埋的活性酵母进行酒精发酵试验,发现固定化酵母不仅酒精得率比游离酵母高将近30%,而且酸度比游离酵母变化小,整个发酵过程酸度一直比较稳定。陈明等[20]采用海藻酸钙凝胶包埋法固定基因重组酵母进行酒精发酵试验,发现固定化酵母对乙酸的耐受浓度由0.5g/L提高到1.2g/L。可见酒精生产中由于有固定化载体的保护作用,固定化细胞的抗杂菌能力、耐酸性能明显增强。
总之,通过固定化细胞技术的应用,酒精生产过程中设备利用率、发酵周期、酒精得率、抗杂菌能力以及残糖等指标都有了明显的提高。
4 固定化酵母酒精发酵存在的问题及解决办法
酒精生产企业使用固定化细胞发酵后,由于生产原料、生产方式等不同,出现问题各不相同,要根据实际情况采取有效措施,才能保证固定化细胞的使用效果。在实际生产过程中,酒精生产企业主要存在着固定化载体易结垢以及杂菌污染问题。
4.1 固定化载体结垢
酒精生产中载体结垢成分以胶体、灰分、无机盐和悬浮物为主,主要由于糖质原料中杂质增多,产生过多的灰分,导致结垢。另外,糖蜜原料酸化不彻底、用酸过多也会导致胶体灰分等沉淀在载体表面结垢[21]。
为有效避免载体结垢,首先可以强化酸化处理工序,在酸化阶段使沉淀物尽可能除去。其次要合理控制发酵液中糖浓度,避免灰分与胶体的沉淀,必要时可适当加入阻垢剂,减少灰分物质聚集,使积垢变得疏松易除。另外固定化载体也可以通过适当保养避免结垢。通常可在pH 2.0~3.0下酸洗浸泡3~4h。但应避免多次长时间在强酸环境下处理固定化载体,容易导致菌体细胞活性下降以及杂菌的耐受性增强。
4.2 杂菌污染
固定化细胞酒精发酵工艺与游离细胞不同,发酵过程中容易出现杂菌感染的现象,及早快速发现染菌非常重要。挥发酸是发酵过程中菌体产生的有机酸类,是判断染菌的一个重要的指标。正常发酵液中挥发酸浓度一般在0.012%以下。杂菌感染必然会影响生产菌的生长繁殖,导致酒精产率下降,因此防治杂菌污染非常重要[22]。发酵过程出现杂菌感染的原因主要有以下几点。
(1)固定化细胞长时间反复使用,容易导致菌体衰老,酒化酶活力降低。而杂菌生长条件适宜,形成优势,造成染菌。
(2)酒精生产中所使用的固定化细胞载体存在死角,杀菌不彻底导致染菌。
(3)由于固定化载体结垢使酒精发酵受阻,为杂菌的生长繁殖创造了机会。
针对上述染菌现象,可以采用高温蒸汽对死角进行彻底灭菌,或者添加酒精专用杀菌剂、青霉素、漂白粉等进行杀菌。也可以先用清水清洗固定化载体,然后在酸性条件下浸泡1~2h。另外,可以通过保持酒母培养罐中酵母数在每毫升2.0亿个以上,形成群体优势,有效抑制杂菌繁殖。
5 共固定化技术的发展
近年来随着固定化细胞技术的不断发展,人们在此基础上又提出了共固定化技术的概念。共固定化就是将不同的细胞与细胞、酶与酶或细胞与酶同时闭锁于同一载体内形成的一种固定化技术。这种体系可将几种不同功能的酶或细胞在同一系统内进行协同作用,从而可以获得相应的酶活性以及较高的产物收率。
酒精生产中,多菌种混合发酵往往采用不同的菌种,但由于各菌种之间差异较大,难以实现共同生长。通过构建共固定化体系可以解决这一问题,多种微生物在生长过程中协调共生,通过发酵作用能够形成丰富的酶系和产物体系,能够有效地控制多种微生物之间的配比,保证酒精发酵过程平稳地进行,从而有效避免各菌种随发酵的进行而生理状态发生改变,影响产品质量。酒精生产中共固定化常采用吸附法和包埋法,有时也可以将这两种方法联合使用。王克明[23]采用共固定化的德氏根霉、酿酒酵母以及产香酵母对大米原料进行酒精发酵。发现根霉与酿酒酵母以及产香酵母3种共固定化细胞的最佳接种量为4∶3∶2,酒精发酵的最适温度为30~33℃,发酵时间为70h,最终酒精体积分数达到6%。LEE等[24]采用DEAE材料将酿酒酵母和树干毕赤酵母进行共固定化,利用海带水解物进行酒精发酵试验。结果表明,酒精生产速率为0.126g/(L·h),产量为0.37g/g,比单独使用酿酒酵母和树干毕赤酵母产量高出2.7倍。LEBEAU等[25]采用琼脂包埋法将酿酒酵母和休哈塔假丝酵母进行共固定化,利用混合糖浆(葡萄糖∶木糖=7∶3)进行酒精发酵实验。结果表明,发酵结束时,葡萄糖完全被消耗,而仅27%的木糖未被消耗,酒精得率为0.48g/g总糖。休哈塔假丝酵母能够发酵木糖,酿酒酵母能够发酵葡萄糖,通过共固定化作用,两种微生物协调共生,所以获得较高的酒精产率。
不仅细胞可以共固定化,酶与细胞也可以实现共固定化。有时酶与细胞很难实现对某一底物的共同作用,通过共固定技术则可以充分发挥酶和细胞的协同作用。李魁[26]利用木薯为原料,采用聚乙烯醇为载体,将酵母菌和糖化酶采用包埋共固定化进行酒精发酵试验。实验结果表明,pH 4.5,酵母菌与糖化酶共固定化凝胶颗粒填装量为50%。发酵醪酒精体积分数达到12.3%,残糖为0.6g/L,总糖利用率达96.91%。BANDARU等[27]采用海藻酸钙包埋法将运动发酵单胞菌与葡萄糖苷酶共固定化进行酒精发酵。在发酵温度32.4℃,pH 4.92,发酵周期17.24h条件下,最大酒精浓度达到55.3g/L。EVRIM GÜNES等[28]利用连续搅拌反应器,将葡萄糖苷酶和运动发酵单胞细胞进行共固定化,利用淀粉生产酒精。发现几乎98%的底物都转化为酒精,酒精生产速率为7.6g/(L·h),产量为0.45g/g。
吸附法和包埋法也可以联合使用进行共固定化。侯红萍等[29]采用吸附法(硅藻土为吸附剂)和包埋法(聚乙烯醇和海藻酸钠为包埋材料)相结合对糖化酶和酵母菌共固定化进行酒精发酵试验。硅藻土添加量为0.6g/20mL,聚乙烯醇和海藻酸钠两种材料的最佳配比为9∶1,发酵温度30℃,发酵周期7 天,最终酒精体积分数达到11%。
无论是细胞与细胞还是细胞与酶共固定化进行酒精发酵,都具有反应时间短、酒精得率高、可以连续自动化生产等优点。很大程度上可降低酒精生产成本,提高企业利润。共固定化技术用于酒精行业具有非常广阔的发展空间[30]。
6 结论
固定化细胞技术在酒精生产中的应用已经取得了巨大的成绩。众多的研究成果表明,利用固定化细胞代替游离细胞发酵有诸多的优势。但是,固定化载体选择、杂菌污染、占罐空间大以及生产成本高等问题一直制约着该项技术在酒精生产中的大规模应用[31-32]。今后应从以下几个方面继续深入开展研究工作。
(1)开展细胞与细胞、细胞与酶共固定化技术研究。建立细胞与细胞或细胞与酶复合反应体系,对共固定化方法以及工艺进一步研究,实现酒精连续糖化发酵,降低酒精生产成本。另外,也应关注多细胞及多酶共固定酒精发酵技术的研究。
(2)无载体自絮凝细胞固定化技术研究。探索细胞絮凝机制,开发适宜的生物反应器,筛选或构建具有优良酒精发酵性能的自絮凝菌株,对于酒精行业将是新的突破。
(3)新型酒精专用固定化载体材料。开发廉价耐用、对细胞无毒性或毒性小、易与糖及酒精等物质扩散的酒精生产专用固定化载体材料,也是未来研究的主要方向。
相信随着固定化细胞技术研究的不断深入和日渐成熟,必将推动燃料酒精工业快速发展。
[1]李振宇,李顶杰,黄格省,等. 燃料酒精发展现状及思考[J]. 化工进展,2013,32(7):1457-1467. LI Z Y,LI D J ,HUANG G S,et al. Insights on current development of fuel ethanol[J]. Chemical Industry and Engineering Progress,2013,32(7):1457-1467.
[2]毕生雷,张成明.固定化技术在生物能源及环境工程领域的研究和应用进展[J]. 酿酒科技,2015(1):102-105. BI S l,ZHANG C M. Research and application progress of immobilization technology in bio-energy and environmental engineering[J]. Liquor-making Science &Technology,2015(1):102-105.
[3]MA M G. Mechanisms of ethanol tolerance in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology,2010,87(3):829-845.
[4]高培培,胡纯铿,洪美,等. 酵母固定化技术在燃料乙醇生产中的应用[J]. 食品与发酵工业,2010,36(3):125-128. GAO P P,HU C K,HONG M,et al. Yeast immobilization technologies applied to fuel ethanol production[J]. Food and Fermentation Industries,2010,36(3):125-128.
[5]李丹,刘冬梅,于淑娟.泡沫多孔陶瓷固定酵母细胞条件研究[J].现代食品科技,2008,25(12):1400-1403. LI D,LIU D M,YU S J. Immobilization of yeast on porous foamed ceramics[J]. Modern Food Science & Technology,2008,25(12):1400-1403.
[6]程江峰,苏忠亮,梁成伟.泡沫陶瓷固定化啤酒酵母工艺[J]. 中国酿造,2009,20(3):109-111. CHENG J F,SU Z L,LIANG C W. Immobilization technology ofSaccharomyces cerevisiaein foam ceramics[J]. China Brewing,2009,28(3):109-111.
[7]尤业兵,缪冶炼,陈介余.海藻酸钙凝胶颗粒固定化抗冻酵母AFY-1的机制分析及条件优化[J].生物加工过程,2006(4):88-93. YOU Y B,MIAO Y L,CHEN J Y. Mechanism analysis and condition optimization for the immobilization of freeze-tolerant yeast AFY-1 within Ca-alginate gel particles[J].Bioprocessing Engineering,2006(4):88-93.
[8]STRATFORD M. Evidence for two mechanisms of flocculation inSaccharomyces cerevisiae[J].Yeast,1989(5):441 -445.
[9]VERSTREPEN K J,KLIS F M. Flocculation,adhesion and biofilm formation in yeasts [J].Mol. Microbiol.,2006(6):5 -15.
[10]白凤武.无载体固定化细胞的研究进展[J].生物工程进展,2000,20(2):431-435. BAI F W. Application of self- immobilization cell technology for biochemical engineering [J].Progress in Biotechnology,2000,20(2):431-435.
[11]张长利,王景晶,杨宏. 细胞固定化技术研究进展及其在水处理领域的应用[J].水处理技术,2013,39(6):1-3. ZHANG C L,WANG J J,YANG H. Review on immobilized cell technology and its application in water treatment [J].Technology of Water Treatment,2013,39(6):1-3.
[12]秦晴. 自絮凝酵母超高浓度乙醇发酵及其生理生化研究[D].厦门:华侨大学,2008. QIN Q. A study on very-high-gravity ethanol fermentation and its related physiological and biochemical aspects of self-flocculating yeast[D]. Xiamen:Huaqiao University ,2008.
[13]伍彦华,覃红梅.固定化酵母的选育及在木薯浓醪发酵生产燃料乙醇中的性能对比[J]. 酿酒科技,2010(7):31-33. WU Y H,QIN H M. Breeding of immobilized yeasts & comparison of their performance in high-gravity fermentation of cassava to produce fuel ethanol[J]. Liquor-making Science&Technology,2010(7):31-33.
[14]刘芳,于建生. 细胞固定化及其在酿酒工业中的应用研究进展[J].酿酒科技,2013(8):85-87. LIU F,YU J S. Research progress in cell immobilization and its application in liquor-making[J]. Liquor-making Science &Technology,2013(8):85-87.
[15]樊婧,刘慧霞.不同温度对甘蔗糖料固定化酒精发酵的影响[J]. 中国酿造,2010,215():114-116. FAN J,LIU H X. Effects of temperatures on alcohol production with immobilized fermentation of sugarcane feedstocks[J]. China Brewing,2010,29(2):114-115.
[16]MARTINI E,ANDRIANI D,GOBIKRISHNAN S. Immobilization ofSaccharomycescerevisiae in rice hulls for ethanol production [J]. Makara Seri Teknologi,2012,14(2):230-236.
[17]叶世超,薛婷.固定化酵母R36酒精发酵工艺研究[J].中国酿造,2013,25(8):65-68. YE S C,XUE T. Technology of immobilized yeast R36 alcoholic fermentation[J]. China Brewing,2013,25(8):65-68.
[18]张强.餐厨垃圾同步糖化发酵生产燃料酒精的工艺[J].化工进展,2015,34(1):91-94. ZHANG Q. Fuel ethanol production from kitchen garbage by simultaneousSaccharificationand fermentation[J]. Chemical Industry and Engineering Progress,2015,34(1):91-94,126.
[19]熊亚. 固定化酵母菌与游离酵母菌产酒精作用的比较研究[J].西昌学院学报,2008,22(2):45-48. XIONG Y. Study on comparison of alcohol fermentation by immobilized yeast and free yeast[J].Journal of Xichang College,2008,22(2):45-48.
[20]陈明,王周芳,夏黎明.固定化基因重组酵母发酵木糖产乙醇[J].浙江大学学报,2008,42(2):290-293. CHEN M,WANG Z F,XIA L M. Ethanol fermentation on xylose by immobilized recombinant yeast[J].Journal of Zhejiang University,2008,42(2):290-293.
[21]汪东武,王治业.固定化酵母在甘蔗糖蜜酒精发酵中的问题探讨[J].甘肃科学学报,2006,18(1):66-69. WANG D W,WANG Z Y. Discussion on problems of immobilized yeast in alcoholic fermentation from sugar molasses[J].Journal of Gansu Sciences,2006,18(1):66-69.
[22]李文.固定化酵母发酵性能调控及在制备燃料乙醇中的应用[D].西安:长安大学,2014. LI W. Production of bioethanol onto enhanced fermentation performance of immobilized yeast[D]. Xi’an:Changan University,2014.
[23]王克明. 共固定化多菌种酒精发酵条件的研究[J].中国调味品,2000,(12):10-12. WANG K M. Study on condition of alcoholic fermentation with co-immobilized multi-microoganisms[J]. China Condiment,2000(12):10-12.
[24]LEE S E,KIM Y O. Two-step process using immobilizedPichia stipitisfor ethanol production from Ulva kjellman hydrolysate[J]. Journal of Microbiology and Biotechnology,2013,23(10):1434-1444.
[25]LEBEAU T,JOUENNE T ,JUNTER G A. Continuous alcoholic fermentation of glucose/xylose mixtures byco-immobilizedSaccharomycescerevisiaeandCandida shehatae[J]. Appl. Microbiol. Biotechnol. ,1998(50):309-313.
[26]李魁.酵母菌与糖化酶共固定化木薯酒精连续发酵工艺研究[J].中国粮油学报,2005,20(1):36-40. LI K. Alcoholic continuous fermentation byco-immobilization of saccharifying enzymes and yeasts[J].Journal of Chinese Cereals and Oils Association,2005,20(1):36-40.
[27]BANDARU V V R,SOMALANKA S R,MENDU D R,et al. Optimization of fermentation conditions for the production of ethanol from sago starch byco-immobilized amyloglucosidase and cells ofZymomonas mobilisusing response surface methodology[J]. Enzyme and Microbial Technology,2006,38(1/2):209-214.
[28]EVRIM GÜNEŞ A. Ethanol production from starch byco-immobilized amyloglucosidase——ZymomonasMobiliscells in a continuously-stirred bioreactor[J].Biotechnology & Biotechnological Equipment,2013,27(1):3506-3512.
[29]侯红萍,闫跃文.吸附-包埋结合法共固定化糖化酶和酵母菌的研究[J]. 食品科学,2009,30(5):201-204. HOU H P,YAN Y W.Co-immobilization of glucoamylase and yeast by adsorption-embedment method[J]. Food Science,2009,30(5):201-204.
[30]薄涛,侯红萍.共固定化技术研究进展[J]. 酿酒科技,2010(7):77-79. BO T,HOU H P. Research progress inco-immobilization technology [J]. Liquor-making Science&Technology,2010(7):77-79
[31]李超敏,韩梅,张良,等.细胞固定化技术——海藻酸钠包埋法的研究进展[J]. 安徽农业科学,2006,34(7):1281-1284. LI C M,HAN M,ZHANG L,et al. Development of sodium aliginate immobilized cell technology[J]. Journal of Anhui Agricultural Science,2006,34(7):1281-1284.
[32]张秀霞,秦丽姣.微生物固定化载体的选择及其性能[J].化工进展 ,2011,30(12):2781-2784. ZHANG X X,QIN L J. Study on the selection of immobilized carrier and its performance[J]. Chemical Industry and Engineering Progress,2011,30(12):2781-2784.
Research progress on cell immobilization technology in ethanol production
ZHANG Qiang,JI Ye
(School of Life Science and Technology,Changchun University of Science and Technology,Changchun 130022,Jilin,China)
Cell immobilization technology was developed in 1970’s based on the enzyme immobilization. Recently,cell immobilization is widely used in research and production of fuel ethanol. It demonstrated great potential with advantages of repeated applications,continuous operations,and high ethanol yield. So researches on cell immobilization in ethanol production are very important for practical applications. This article reviewed research progresses on cell immobilization in ethanol production. The article discussed the common methods,characteristics and advantages and applications of cell immobilization,problems,and solutions. The keys for future ethanol productions are developingco-immobilization of cell-cell,cell-enzyme and self-immobilization cell technologies, and developing new immobilization support materials for ethanol production.
biological engineering;immobilization;ethanol;fermentation
TK6
A
1000–6613(2017)04–1404–06
10.16085/j.issn.1000-6613.2017.04.033
2016-09-08;修改稿日期:2016-11-16。
及联系人:张强(1969—),男,博士,副教授,主要从事生物质能源研究。E-mail:corn11@126.com。
