C-X3-C趋化因子配体1与新生儿中枢神经系统感染的相关性
2017-04-07李晓晓周文浩汪吉梅胡黎园
李晓晓 杨 旻 于 翔 周文浩 汪吉梅 胡黎园
·论著·
C-X3-C趋化因子配体1与新生儿中枢神经系统感染的相关性
李晓晓1,4杨 旻2,4于 翔3周文浩1汪吉梅2胡黎园1
目的 探讨血浆或脑脊液中的C-X3-C趋化因子配体1(CX3CL1)是否可作为判断中枢神经系统感染的指标。方法 以2015年12月至2016年5月复旦大学附属儿科医院新生儿病房中疑诊中枢神经系统感染行腰椎穿刺检查的新生儿为感染组,根据临床表现,脑脊液常规、生化和培养结果分为中枢感染亚组、败血症亚组和非败血症亚组。以同一时期复旦大学附属妇产科医院产科病房健康新生儿为对照组,根据出生体重分为<2 000 、 ~2 500 、~3 000 、~3 500 和>3 500 g亚组,根据孕周分为<33、~35、~37、~39和>39周亚组。对照组取新生儿在出生后的脐带血;感染组于急性期或稳定期行腰椎穿刺检查,24 h后取静脉血标本。采用Luminex技术检测血或脑脊液标本中的CX3CL1水平,比较各组及其亚组间的差异。结果 对照组69例,感染组24例。中枢感染(化脓性脑膜炎)亚组8例,败血症亚组10例,非败血症亚组6例(脑积水2例,泌尿系统感染1例,新生儿惊厥2例、高胆红素血症伴食管气管瘘1例)。对照组脐血CX3CL1水平为(97.8±13.3)pg·mL-1,脐血CX3CL1水平在不同体重亚组以及不同孕周亚组间差异无统计学意义,P均>0.05。 CX3CL1水平在感染组血浆 (95.1±8.2)pg·mL-1和对照组脐血比较差异无统计学意义(P=0.299)。CX3CL1水平感染组脑脊液中(210.0±11.9)pg·mL-1高于血浆,差异有统计学意义(P<0.001)。感染组中的中枢感染亚组、败血症亚组和非败血症亚组脑脊液CX3CL1水平分别为(243.1±13.3)、(208.2±20.1)和(168.7±20.6)pg·mL-1,3组间差异有统计学意义(P=0.046);中枢感染亚组与非败血症亚组比较,差异有统计学意义(P=0.016); 败血症亚组与非败血症亚组比较(P=0.180)、中枢感染亚组与败血症亚组比较(P=0.169),差异均无统计学意义。结论 健康新生儿脐带血和感染新生儿外周血CX3CL1表达水平相对稳定,不适宜作为判断是否存在感染的指标,CSF中CX3CL1作为辅助诊断中枢感染和判断感染严重程度的分子标志物还需进一步扩大样本量加以证实。
C-X3-C趋化因子配体1; 炎症; 胶质细胞; 中枢神经系统感染
新生儿化脓性脑膜炎是一种常见的严重危害儿童健康的中枢神经系统感染性疾病,往往中枢神经系统症状不典型,缺乏特异性的临床表现,病情进展迅速,病死率和后遗症发生率高[1,2]。目前,新生儿中枢神经系统感染的诊断手段有限,常通过脑脊液细胞数和培养等来判断,尚无明确的分子诊断指标。C-X3-C趋化因子配体1(CX3CL1)是一种在炎症反应中起重要作用的趋化因子[3]。在炎症发生后,组织中CX3CL1水平可显著升高,并诱导单核-巨噬细胞和T淋巴细胞等参与炎症反应[4]。成人研究结果显示[5],在中枢神经系统感染患者脑脊液中CX3CL水平显著升高。中枢神经系统感染的新生儿外周血和脑脊液CX3CL1水平是否也和成人研究结果相似,是否可作为新型分子标志物或判断感染严重程度?本研究拟对此进行探讨。
1 方法
1.1 研究设计 以病例对照研究为设计方案,比较新生儿病房中疑诊中枢神经系统感染行腰椎穿刺检查的新生儿(感染组)外周血与产院新出生的健康新生儿(对照组)脐血CX3CL1水平,比较感染组血和脑脊液的CX3CL1水平。
1.2 分组考虑 为比较感染组不同感染程度,根据临床表现,脑脊液常规、生化和培养结果将其分为中枢神经系统感染(中枢感染)亚组、败血症亚组和非败血症亚组。为考察对照组体重和孕周对CX3CL1水平是否有影响,根据出生体重分为<2 000、~2 500、~3 000、~3 500和>3 500 g亚组,根据孕周分为<33、~35、~37、~39和>39周亚组。
1.3 伦理和知情同意 本研究经过复旦大学附属儿科医院伦理委员会和复旦大学附属妇产科医院伦理委员会批准。感染组新生儿脑脊液的采集取得其监护人的知情同意,对照组新生儿脐血采集告知监护人并取得知情同意。
1.4 诊断标准
1.4.1 化脓性脑膜炎诊断标准[6]①体温异常,精神反应异常,拒奶、惊厥或脓毒症表现;②前囟饱满、颅缝增宽,脑膜刺激征;③脑脊液细胞数>20 ×106·L-1,多核细胞>0.6,蛋白增高,糖降低;④脑脊液培养有细菌生长或涂片革兰染色发现细菌。具备①~③项即可临床诊断,若符合④可确诊。
1.4.2 败血症诊断标准[7](1)体温改变、精神反应差、不吃、不哭、黄疸,严重者休克、DIC。(2)各系统表现:①皮肤黏膜:脓疱疹、皮下坏疽、硬肿症、瘀点、瘀斑;②呼吸系统:呼吸困难、发绀、呼吸不规则或呼吸暂停;③消化系统:吃奶减少、腹胀、呕吐、腹泻,严重者出现中毒性肠麻痹或NEC;④中枢神经系统:合并化脓性脑膜炎,表现嗜睡、激惹、惊厥、肌张力增高、前囟饱满等;⑤血液系统:PLT减少,出血倾向,甚至DIC。(3)非特异性检查:①WBC减少<5×109·L-1或>20×109·L-1;②中性粒细胞为主;③CRP≥8 μg·mL-1;④PLT≤100×109·L-1;⑤ESR≥15 mm·1 h-1。(4)特异性检查:①细菌培养可见致病菌;②病原菌抗原及DNA检测阳性。具有(1)、(2)的临床表现并符合(3)非特异性检查≥2条或(4)特异性检查②即可诊断,符合(4)特异性检查①可确诊。本研究中败血症组均除外化脓性脑膜炎。
1.4.3 非败血症标准 ①体温异常、黄疸、咳嗽、呕吐、抽搐等临床表现;②白细胞异常或CRP≥8μg·mL-1;非败血症组为除外中枢神经系统感染及败血症的其他类型感染患儿。
1.5 感染组纳入和排除标准 2015年12月至2016年5月复旦大学附属儿科医院新生儿病房中因疑诊中枢神经系统感染而行腰椎穿刺检查的病例;排除先天性免疫缺陷性疾病、先天性遗传代谢性疾病和染色体异常病例。

1.7 观察指标及检测方法
1.7.1 标本的收集 对照组取出生后的脐带血。感染组患儿入院后疾病急性期或稳定期行腰椎穿刺检查,获得脑脊液(1 mL),静脉血标本(2 mL)采集于腰椎穿刺后24 h内。
1.7.2 CX3CL1的检测 在中国科学院神经科学研究所采用德国默克密理博公司HCYTOMAG-60K-06试剂盒行CX3CL1检测,按照试剂盒说明书操作,原始吸光度数据采用5PL曲线拟合后得到绝对蛋白量。
1.8 统计学分析 用Excel建立数据库,采用Stata12.0软件进行统计分析。多组或两组间比较的计量资料行方差齐性及正态性检验,符合正态分布以均数±标准差表示,同组内两不同指标比较,采用配对t检验;两组独立样本比较采用t'检验;多组样本指标方差不齐,比较采用Kruskal-Wallis法秩和检验;不符合正态分布时,数据进行相应变换,以中位数(P25,P75)表示。检验水准取0.05。
2 结果
2.1 一般情况 符合本文感染组纳入和排除标准的患儿24例进入本文分析,男13例,女11例,平均(36.5±3.6)孕周,平均出生体重(2 706±865)g。符合本文对照组纳入标准的新生儿69例,<2 000 、~2 500 、~3 000、~3 500和>3 500 g亚组分别为14、14、17、17和7例;孕周为<33、~35、~37、~39和>39周亚组分别为8、14、21、9和17例。
感染组中,中枢感染亚组8例,均为化脓性脑膜炎,男女各4例,平均(42.3±1.4)孕周,平均出生体重(3 176±625)g;败血症亚组10例,男女各5例,平均(36.3±3.2)孕周,平均出生体重(2 561±736)g;非败血症亚组6例,男4例,女2例,平均(35.0±4.8)孕周,平均出生体重(2 354±753)g,包括脑积水2例,泌尿系统感染、新生儿惊厥伴肺炎、新生儿惊厥伴早产儿、高胆红素血症伴食管气管瘘各1例。
2.2 对照组不同出生体重及不同孕周亚组脐血CX3CL1水平比较 表1显示,不同体重亚组和孕周亚组脐血CX3CL1水平中位数差异均无统计学意义,P均>0.05。
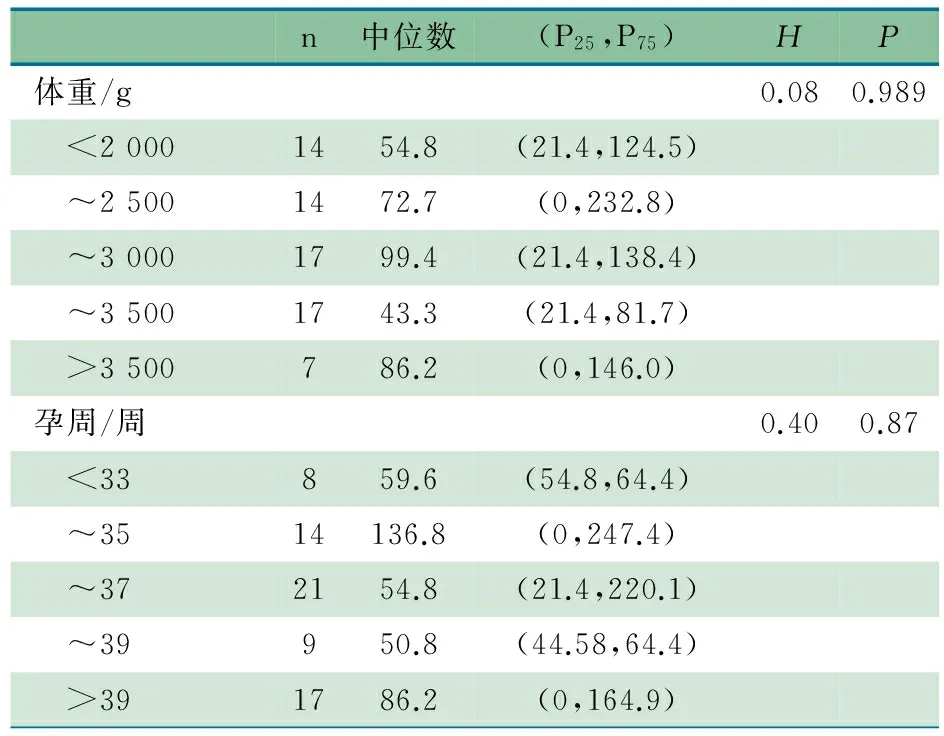
表1 不同出生体重、孕周亚组的CX3CL1水平比较(pg·mL-1)
2.3 感染组血浆CX3CL1水平和对照组脐血CX3CL1水平的比较 CX3CL1水平感染组血浆[(95.1±8.2)pg·mL-1] 与对照组脐血[(97.8±13.3) pg·mL-1] 比较,差异无统计学意义(t'=-1.045,P=0.299)。
2.4 感染组血浆和脑脊液CX3CL1水平比较 CX3CL1水平脑脊液(210.0±11.9)pg·mL-1高于血浆,差异有统计学意义(t'=10.287,P<0.001)。
2.5 感染组不同亚组脑脊液CX3CL1水平的比较 中枢感染亚组、败血症亚组和非败血症亚组脑脊液CX3CL1水平分别为(243.1±13.3)、(208.2±20.1)和(168.7±20.6)pg·mL-1,3组间差异有统计学意义(F=6.141,P=0.046);中枢感染亚组与非败血症亚组比较,差异有统计学意义(t'=3.029,P=0.016);败血症亚组与非败血症亚组比较(t'=1.370,P=0.180)、中枢感染亚组与败血症亚组比较(t'=1.450,P=0.169),差异均无统计学意义。
3 讨论
免疫趋化因子CX3CL1通过和受体CX3CR1结合,诱导细胞黏附和细胞迁移[3]。在外周系统CX3CL1主要由血管内皮细胞表达,CX3CR1多在单核巨噬细胞和T淋巴细胞等细胞表达[4];在中枢神经系统,CX3CL1在神经元和星形胶质细胞中表达,其受体CX3CR1只在小胶质细胞中表达[5]。有报道显示CX3CL1在炎症过程中可升高,并诱导单核巨噬细胞和小胶质细胞等参与炎症反应[4,5]。中枢神经系统炎症发生时,CX3CL1和CX3CR1结合,引起小胶质细胞短暂的钙内流,合成MMP2和MMP9,同时激活下游蛋白磷酸化和酶,在炎症反应中起重要作用,包括破坏血脑屏障[8]; CX3CL1升高可抑制小胶质细胞释放促炎症因子[9,10]。CX3CL1具有神经保护作用,促进过多的谷氨酸代谢,减轻神经毒性[11~13],也可减少Fas介导的小胶质细胞的凋亡,具有抗凋亡的作用[14]。目前关于CX3CL1在临床上的研究主要集中在成人相关疾病,在新生儿的临床研究尚无报道。
对成人HIV感染患者的临床研究显示, HIV感染组(9例明确HIV感染且已行抗病毒治疗患者)与无HIV感染对照组(16例,其中6例为干扰素治疗的丙肝患者,10例健康对照)比较,外周血中CX3CL1表达水平相似[15]。本研究显示,出生体重<2 000、~2 500、~3 000、~3 500和>3 500 g的健康新生儿,以及孕周<33、~35、~37、~39和>39周的健康新生儿,脐血CX3CL1水平差异均无统计学意义,说明出生体重和孕周对CX3CL1的表达没有影响;CX3CL1水平感染组新生儿外周血中与健康新生儿脐血差异也无统计学意义,说明外周血和脐带血中CX3CL1水平相对稳定,无法作为疾病感染的判断指标。胚胎时期血液中巨噬细胞来源于CX3CR1+的细胞, CX3CL1/CX3CR1在外周主要发挥维持巨噬细胞自我更新和恢复功能性稳态的作用[16]。
在Kastenbauer等[17]学者关于血清及脑脊液中的CX3CL1水平在成人不同类型的中枢神经系统疾病(化脓性脑膜炎14例、病毒性脑炎14例、多发性硬化15例、格林巴利综合症12例)的病例研究显示,中枢神经系统疾病患者脑脊液中CX3CL1水平显著高于对照组(14例,包括短偏头痛8例、紧张性头痛3例、短暂脑缺血发作1例、中毒1例),其中化脓性脑膜炎患者脑脊液中CX3CL1水平最高;而血清中CX3CL1水平只在多发性硬化患者有升高 。 本研究中感染组新生儿CX3CL1水平在脑脊液中高于外周血,差异有统计学意义,说明脑脊液中的CX3CL1水平对判断感染可能具有临床意义;而CX3CL1水平在非败血症亚组、败血症亚组和中枢感染亚组的脑脊液中梯次升高,差异有统计学意义,提示随着感染程度的加重,脑脊液中CX3CL1水平有升高趋势。诚然,也应当看到,本文非败血症亚组、败血症亚组和中枢感染亚组样本量仅为6、10和8例,统计学意义的差异并不能真实反映临床的真实差异,需要扩大样本量进一步认识脑脊液中CX3CL1水平对中枢神经系统感染的价值。本文中败血症亚组较非败血症亚组脑脊液中CX3CL1水平高[(208.2±20.1)vs(168.7±20.6)],但差异无统计学意义,可能与样本量小有关。
综上所述,健康新生儿脐带血和感染新生儿外周血CX3CL1水平相对稳定,不适合作为判断是否存在感染的指标,脑脊液中CX3CL1作为辅助诊断中枢感染和判断感染严重程度的分子标志物还需进一步扩大样本量加以证实。
[1]Furyk JS,Swann O,Molyneux E.Systematic review:neonatal meningitis in the developing world.Trop Med Int Health,2011,16(6):672-679
[2]van de Beek D.Progress and challenges in bacterial meningitis.Lancet,2012,380(9854):1623-1624
[3]Zlotnik A,Yoshie C.Chemokines:A new classification system and their role in immunity.Immunity,2000,12(2):121-127
[4]Imai T,Hieshima K,Haskell C,et al.Identification and molecular characterization of fractalkine receptor CX(3)CR1,which mediates both leukocyte migration and adhesion.Cell,1997,91(4):521-530
[5]Pan Y,Lloyd C,Zhou H,et al.Neurotactin,a membrane-anchored chemokine upregulated in brain inflammation.Nature,1997,387(6633):611-617
[6]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.第4版.2011:340-347
[7]中华医学会儿科学分会新生儿学组,《中华医学会中华儿科杂志》编辑委员会.新生儿败血症诊疗方案.中华儿科杂志,2003 41(12):897-899
[8]Cross AK,Woodroofe MN.Chemokine modulation of matrix metalloproteinase and TIMP production in adult rat brain microglia and a human microglial cell line in vitro.Glia,1999,28(3):183-189
[9]Prinz M,Tay TL,Wolf Y,et al.Microglia:unique and common features with other tissue macrophages.Acta Neuropathol,2014,128(3):319-331
[10]Nimmerjahn A,Kirchhoff F,Helmchen F.Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo.Science,2005,308(5726):1314-1318
[11]Limatola C,Lauro C,Catalano M,et al.Chemokine CX(3)CL1 protects rat hippocampal neurons against glutamate-mediated excitotoxicity.J Neuroimmunol,2005,166(1-2):19-28
[12]Lauro C,Di Angelantonio S,Cipriani R,et al.Activity of adenosine receptors type 1 is required for CX(3)CL1-mediated neuroprotection and neuromodulation in hippocampal neurons.J Immunol,2008,180(11):7590-7596
[13]Zujovic V,Benavides J,Vigé X,et al.Fractalkine modulates TNF-alpha secretion and neurotoxicity induced by microglial activation.Glia,2000,29(4):305-315
[14]Cardona AE1,Pioro EP,Sasse ME,et al.Control of microglial neurotoxicity by the fractalkine receptor.Nat Neurosci,2006,9(7):917-924
[15]Foussat A,Bouchet-Delbos L,Berrebi D,et al.Deregulation of the expression of the fractalkine/fractalkine receptor complex in HIV-1 infected patients.Blood,2001,98(6):1678-1686
[16]Ensan S1,Li A,Besla R,Degousee N,et al.Self-renewing resident arterial macrophages arise from embryonic CX3CR1(+) precursors and circulating monocytes immediately after birth.Nat Immunol,2016,17(2):159-168
[17]Kastenbauer S,Koedel U,Wick M,et al.CSF and serum levels of soluble fractalkine (CX(3)CL1) in inflammatory diseases of the nervous system.J Neuroimmunol,2003,137(1-2):210-217
(本文编辑:张崇凡,孙晋枫)
Study on the correlation between CX3CL1 and neonatal central nervous system infection
LIXiao-xiao1,4,YANGMin2,4,YUXiang3,ZHOUWen-hao1,WANGJi-mei2,HULi-yuan1
(1DepartmentofNeonatology,Children'sHospitalofFudanUniversity,KeyLaboratoryoftheMinistryofHealthNeonatalDiseases,Shanghai201102,China; 2DepartmentodNeonatology,ObstetricsandGynecologyHospitalofFudanUniversity,Shanghai200090,China; 3ShanghaiInstitutesforBiologicalScience,ChineseAcademyofSciences,Shanghai200031,China)
WANG Ji-mei,E-mail:m13817000825@163.com;HU Li-yuan,E-mail:nowadays921@126.com
Objective To study C-X3-C chemokine ligand 1 (CX3CL1) in plasma or cerebrospinal fluid whether could be used as an biomaker of central nervous system infection.MethodsThe plasma and CSF samples were collected from neonates who were suspected to have central nervous infection with lumbar puncture check admitted to Neonatal Ward of Children′s Hospital of Fudan University from December 2015 to May 2016,and they set for infection group,according to clinical manifestations,cerebrospinal fluid routine,biochemistry and culture results,they were divided into the central infection,sepsis and non-sepsis groups.At the same period healthy newborns cord blood samples were collected in the maternity ward of Obstetrics and Gynecology Hospital of Fudan University as a normal control group,and on the basis of birth weight group was divided into < 2 000 g,-2 500 g,-3 000 g,-3 500 g,>3 500 g groups; and according to gestational age divided into < 33 w,-35 w,-37 w,-39 w,>39 w groups.Using Luminex technology to detect CX3CL1 protein levels(Milliplex reagent kit HCYTOMAG-60K-06),the differences between groups and subgroups were compared.ResultsIn 69 cases of control group,there were 24 cases with infection.There were 8 cases in central infection group (meningitis),10 cases in sepsis group and 6 cases in non-sepsis subgroup (1 case with urinary tract infection,2 cases with neonatal convulsion,1 case with hyperbilirubinemia and esophageal tracheal fistula ).In the control group,CX3CL1 in cord blood was (97.8+.13.3) pg·mL-1,there was no significant difference in cord blood CX3CL1 level among different body weight subgroups and different gestational weeks subgroups (P>0.05).In infection group plasma CX3CL1 level [(95.1±8.2)pg·mL-1] had no significant difference from control group(t=-1.045,P=0.299).There was significant difference in CX3CL1 level between plasma and cerebrospinal fluid,CX3CL1 level was significantly higher in cerebrospinal fluid(210.0±11.9)pg·mL-1(P< 0.001).Among central infection group,sepsis group and non-sepsis group cerebrospinal fluid CX3CL1 levels (243.1±13.3)pg·mL-1,(208.2±20.1)pg·mL-1and(168.7±20.6)pg·mL-1,there were significant differences (P=0.046); There were also significant differences in CX3CL1 levels in cerebrospinal fluid between central infection group and non-sepsis group (P=0.016);There were no significant differences in CX3CL1 levels in cerebrospinal fluid between central infection group and sepsis group(P=0.180) or between sepsis group and non-sepsis group(P=0.169).ConclusionCX3CL1 level in plasma is relatively stable in the healthy newborns,CX3CL1 level in plasma can not be used to diagnose central nervous infection,CSF CX3CL1 levels may be an auxiliary biomarker for diagnosis of central nervous infection and its severity.
CX3CL1; Inflammation; Glial cells; Central nervous system infection
1复旦大学附属儿科医院新生儿科,卫生部新生儿重点实验室 上海,201102;2 复旦大学附属妇产科医院新生儿科 上海,200090;3 中国科学院神经科学研究所 上海,200031;4 共同第一作者
汪吉梅,E-mail:m13817000825@163.com;胡黎园,E-mail:nowadays921@126.com
10.3969/j.issn.1673-5501.2017.01.012
2017-01-07
2017-02-15)
