组蛋白去乙酰化酶7基因表达与儿童急性淋巴细胞白血病临床生物学特征及预后的相关性
2017-04-07刘曙光张瑞东陆继冉郑胡镛
侯 贝 高 超 刘曙光 张瑞东 陆继冉 郑胡镛
·论著·
组蛋白去乙酰化酶7基因表达与儿童急性淋巴细胞白血病临床生物学特征及预后的相关性
侯 贝 高 超 刘曙光 张瑞东 陆继冉 郑胡镛
目的 探讨组蛋白去乙酰化酶7(HDAC7)基因在急性淋巴细胞白血病(ALL)患儿骨髓标本中的表达及其与临床特征、早期治疗反应和长期预后的关系。方法 纳入2010年1月1日至2012年12月30日首都医科大学附属北京儿童医院(我院)血液肿瘤中心收治的ALL患儿,排除入院前曾不规则使用激素和初诊骨髓样本中幼稚细胞比例<70%的患儿。采用实时定量PCR(RT-qPCR)检测ALL患儿初诊骨髓标本中的HDAC7基因表达。以3例ALL患儿停药3年以上处于缓解状态的骨髓样本中的HDAC7表达水平作为对照,将ALL患儿分为高表达(≥1.0)组和低表达(<1.0)组,分析组间临床生物学特征、微小残留病和无事件生存率(EFS)。结果 共纳入236例ALL患儿,初诊骨髓标本中HDAC7基因表达水平为0.046~10.581,高表达组124例,低表达组112例。单因素分析显示HDAC7基因表达与初诊外周血WBC<50×109·L-1、免疫表型和融合基因类型相关,P均<0.05;多因素分析显示WBC<50×109·L-1和融合基因类型是HDAC7表达的影响因素,P均<0.05。中危ALL患儿中,HDAC7高表达组的预后好于低表达组,5年EFS分别为(91.0±3.5)%和(75.5±4.9)%,P=0.013,HDAC7表达是中危患儿的独立预后因素(P=0.013),OR值和95%置信区间为1.26(1.31~9.51)。结论 ALL患儿骨髓中HDAC7基因表达水平与临床和生物学特征相关;HDAC7基因低表达是中危患儿预后不良的独立危险因素。
急性淋巴细胞白血病; 儿童; 组蛋白去乙酰化酶7; 预后; 基因表达
白血病是儿童期最常见的恶性肿瘤,其中80%为急性淋巴细胞白血病(ALL)。近年研究发现,组蛋白去乙酰化酶(HDACs)在人类多种肿瘤中存在基因突变或异常表达,包括ALL[1~3]。HDACs能去除组蛋白上的乙酰基,使组蛋白与DNA的结合更加紧密,从而阻碍转录因子发挥作用,抑制基因转录[4],在表观遗传调控中具有重要作用,是目前研发抗肿瘤药物的靶向作用分子[5]。其中,HDACⅡa类亚家族是组织特异性基因表达的抑制分子,在组织发育和分化中具有重要作用。研究显示[6,7],HDACⅡa家族成员HDAC7在造血系统中具有淋巴组织特异性表达模式,可以抑制小鼠前B淋巴细胞中髓系和T系基因的表达。然而,HDAC7基因在ALL中的表达水平及其对临床预后的影响仍存在争议。一项成人B-ALL的研究显示,HDAC7表达水平在祖B-ALL中低于正常对照[8];而另一项研究则显示,HDAC7在儿童ALL中表达增高,其中高于中位表达水平的患者5年无事件生存率(EFS)显著降低[9]。本文旨在探讨中国ALL患儿中HDAC7的表达特点及其与临床生物学特征和预后的相关性。
1 方法
1.1 知情同意 本研究方案获得首都医科大学附属北京儿童医院(我院)伦理委员会的批准[伦理(研)审编号:2013-18],对ALL患儿行HDAC7基因检测征得了患儿监护人的知情同意。
1.2 纳入和排除标准 纳入2010年1月1日至2012年12月31日我院血液肿瘤中心收治的连续ALL患儿,我院儿童ALL的诊断和治疗参照儿童ALL的诊断分层标准及治疗方案CCLG ALL-2008[10]。排除入院前曾不规则使用激素和初诊骨髓样本中幼稚细胞比例<70%的ALL患儿。
1.3 分组依据 本文分析的ALL病例HDAC7表达水平以3例治疗后停药3年以上处于缓解状态的ALL患儿为对照。依据患儿HDAC7相对表达水平分为高表达(≥1)组和低表达(<1)组。
1.4 影响HDAC7表达水平的因素 本文采集可能影响HDAC7表达水平的以下因素:①初诊外周血WBC计数:≥50×109·L-1,<50×109·L-1;②性别;③年龄:1~10岁,<1岁或≥10岁;④累及中枢神经系统(CNS):CNS-1(CSF未见原始细胞),CNS-2(CSF原始细胞<5·μL-1),CNS-3(CSF原始细胞≥5·μL-1);⑤早期治疗反应,泼尼松诱导实验:如第8 d外周血幼稚淋巴细胞数≥1 000·μL-1为泼尼松反应不良,<1 000·μL-1为泼尼松反应良好,诱导结束时即治疗开始后第33 d的微小残留病(MRD)水平:<0.000 1、~0.01和≥0.01,巩固治疗开始前即开始治疗后第78 d的MRD水平:<0.001和≥0.001;⑥免疫表型 (祖B、前B、普通B和T细胞型);⑦融合基因分型 (BCR-ABL,TEL-AML1,E2A-PBX1,SIL-TAL和MLL基因重排,其他B-ALL,其他T-ALL)。
1.5 远期预后指标 随访时间定义为从诊断之日至发生事件之日或研究观察终止日(2016年1月)。远期预后指标:①不良事件发生率,不良事件定义为复发、诱导失败、第二肿瘤或任何原因引起的死亡;②5年EFS。
1.6 RNA提取和cDNA合成 患儿初诊骨髓样本中单个核细胞,冻存于-80度冰箱。根据Trizol试剂盒(美国Life Technology,公司)说明提取总RNA,用紫外分光光度计检测A260和A280,计算两者比值,当A260/ A280为1.8~2.0时,提示RNA质量较好,可用于后续实验。RNA浓度(μg·μL-1)=A260×40×稀释倍数/1 000。采用随机逆转录引物(美国Invitrogen公司),将2 μg RNA反转录为cDNA,冻存于-20℃冰箱,用于后续实验。
1.7HDAC7 mRNA表达水平的检测 采用实时荧光定量PCR(RT-qPCR)方法,使用Hs00248789-A1试剂盒(美国Life Technology公司)配制PCR反应体系,通过ViiA7荧光定量PCR仪(美国Life Technology公司)检测。PCR反应体系中含80 ng cDNA。反应条件为:50.0℃ 2 min;95.0℃ 10 min;95.0℃ 15 s,60℃ 1 min,共50个循环。以β葡萄糖苷酸酶(GUS)基因表达量为内参,对HDAC7表达水平进行归一化处理。每一样本的HDAC7和GUS分别重复检测3次,取均值。HDAC7基因相对表达水平采用2-ΔΔCt表示,ΔΔCt=(待测样本平均CTHDAC7-待测样本平均CTGUS)-(对照样本平均CTHDAC7-对照样本平均CTGUS)。
1.8 统计学方法 采用SPSS16.0进行统计学处理。One-Way ANOVA单因素方差分析方法检验不同融合基因和免疫表型分组间HDAC7的表达差异;Mann-WhitneyU检验或者χ2检验对HDAC7高表达组与低表达组间的临床和生物学特征及长期预后的差异进行单因素分析;Logistic回归多因素分析影响HDAC7表达的因素。生存分析采用Kaplan-Meier 法,组间差异的比较采用Log-Rank检验; Cox 回归逐步向前法进行多因素预后分析。统计分析均采用双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况 研究期间共收治ALL患儿465例,排除初诊骨髓样本中幼稚细胞比例<70%的患儿229例,符合本文纳入排除标准的236例ALL患儿进入本文分析。男161例,女75例;年龄0.6~14岁,中位年龄4岁;B-ALL 217例,T-ALL 19例;标危47例,中危150例,高危39例。随访时间0.5~72个月,中位随访时间47个月。6例患儿诱导失败;29例患儿复发,包括骨髓复发21例,单纯髓外复发8例;化疗相关感染死亡16例;移植相关死亡4例;其余患儿均处于完全缓解状态。
2.2HDAC7表达水平及其影响因素分析 236例ALL 初诊骨髓标本中HDAC7表达水平为0.046~10.581,高表达组124例,低表达组112例。
表1显示,单因素分析初诊WBC、免疫表型和融合基因型与HDAC7 表达相关。 图1显示,WBC≥50×109·L-1患儿HDAC7表达水平高于WBC<50×109·L-1患儿(F=5.65,P=0.018)。图2显示,祖B细胞型患儿HDAC7的表达水平显著低于前 B、普通 B和T细胞型患儿(F=2.821,P=0.04),前 B、普通 B和T细胞型患儿间差异无统计学意义(P>0.05)。图3显示,MLL基因重排阳性ALL患儿HDAC7的表达水平低于其他融合基因亚型者(F=2.831,P=0.011)。
将单因素分析有统计学意义的因素纳入Logistic回归分析,表2显示,初诊外周血WBC≥50×109·L-1(P=0.024)和融合基因类型(P=0.011)是HDAC7表达高低的影响因素。
2.3HDAC7表达水平与长期预后的相关性 236例ALL患儿5年EFS(78.1±2.7)%。表3显示,HDAC7高表达组和低表达组的5年EFS差异无统计学意义(P=0.306)。中危ALL患儿高表达组和低表达组不良事件发生率差异有统计学意义(P=0.008);5年EFS分别为(91.0±3.5)%和(75.5±4.9)%,差异有统计学意义(P=0.013)。
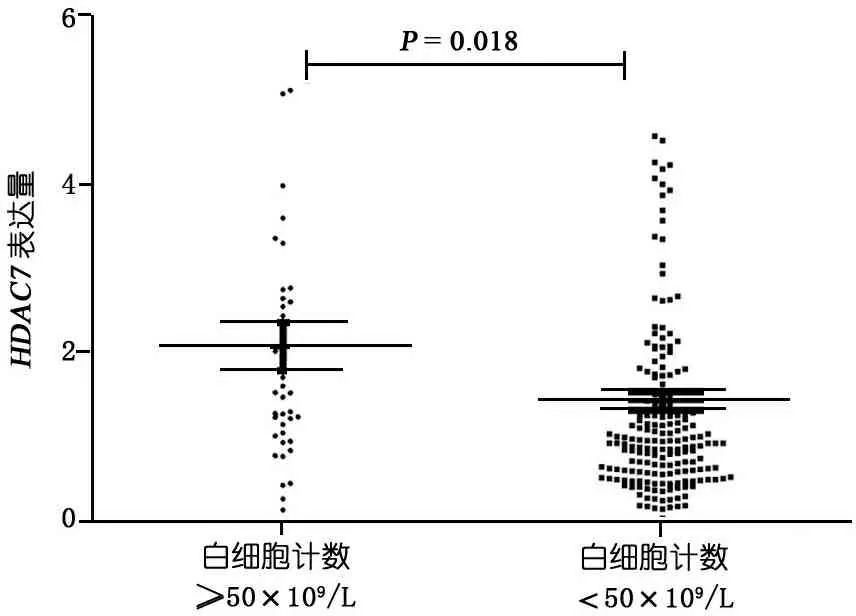

图1 不同外周血WBC计数ALL患儿HDAC7表达水平

图2 不同免疫分型ALL患儿HDAC7的表达水平


表1 影响HDAC7表达高低的单因素分析[n(%)]

表2 HDAC7表达水平影响因素的Logistic分析
将初诊WBC、年龄、免疫表型和融合基因类型纳入Cox回归模型,结果显示,HDAC7表达水平是影响中危组患儿5年EFS的独立预后因素(P=0.013),OR值为 1.26(95%CI :1.31~9.51)。

表3 HDAC7表达水平与长期预后的相关性
3 讨论
HDACs是多种生理和病理过程中重要的转录抑制因子。其中,Ⅱa类HDAC亚家族包括HDAC4、HDAC5、HDAC7和HDAC9[4],与其他HDAC成员相比,Ⅱa类具有独特的生物学功能,如与转录因子相互作用和组织特异性[11~14]。HDAC7基因位于12q13.1,编码991 个氨基酸的蛋白质,约109 kDa。既往研究显示,HDAC7是淋巴组织特异性转录抑制因子,在B和T淋巴细胞生物学中具有重要作用[15~17]。
本研究结果显示,不同临床生物学特征的ALL患儿中,HDAC7表达水平差异有统计学意义,并且中危组HDAC7低表达还是独立的预后不良因素。然而,HDAC7在ALL患儿中的表达水平及其对临床预后的影响仍存在争议。在Moreno等[9]进行的一项纳入94例儿童ALL的研究中,B-ALL 78例,其中祖B 细胞型4例,前B/普B 细胞型74例,T-细胞型16例,11例正常儿童骨髓标本作为对照,治疗方案为GBTLI细胞型ALL-99方案,ALL患儿中HDAC7表达量较对照增高。以ALL患儿中HDAC7中位表达为界分为低和高表达,HDAC7高表达者5年EFS低于低表达者。在Barneda-Zahonero等[8]对191例成人B-ALL研究中,祖B-ALL 28例,3例正常供者作对照,HDAC7在祖B-ALL患儿中表达水平降低,通过动物模型实验证明,HDAC7具有阻滞细胞周期、诱导肿瘤细胞凋亡的作用。在B淋巴细胞中,其作为转录抑制子,可下调肿瘤基因如c-Myc、TERT和AICDA的表达,并且通过激活P53通路诱导细胞凋亡,提示HDAC7在B-ALL中具有潜在的抗肿瘤功能。
本研究结果表明,祖B-ALL中HDAC7基因表达水降低。这与Barneda-Zahonero等[8]的研究结果相似,但与Moreno等[9]的结果存在分歧,后者并未发现祖B-ALL中HDAC7的异常表达,推测可能是由于Moreno等的研究仅包含了4例祖B-ALL,因此未能得出明确结论。此外,本研究还发现携带MLL基因重排的患儿HDAC7表达量显著低于其他融合基因类型。Logistic回归分析显示,初诊外周血WBC计数和融合基因类型是影响HDAC7表达水平的因素。既往研究表明[7],HDAC7是B淋巴细胞发育过程中重要的转录抑制因子,在B细胞正常的发育和成熟过程中起着重要作用,体外实验证实,HDAC7缺失可导致B细胞早期发育停滞,将B细胞发育进程阻滞在祖B阶段。本研究推测MLL基因易位可能通过影响HDAC7的表达,进而阻滞了B淋巴细胞的发育,导致MLL重排阳性患儿的免疫表型表现为祖B-ALL。本文结果显示,初诊WBC高者HDAC7的表达水平高,提示HDAC7的表达受肿瘤负荷的影响。
Moreno等[9]的研究显示,在CD10阴性的前B-ALL中,与HDAC7低表达者相比,高表达者中良好亚型TEL-AML1融合基因阳性者比例较高。值得注意的是,高表达患儿的MRD水平却较高,预后也较差,这与携带TEL-AML患儿普遍具有良好预后不符。本研究中未发现HDAC7的表达水平与MRD相关,并且在应用中危治疗方案的患儿中,还发现HDAC7基因低表达的患儿预后差于高表达患儿,5年EFS分别为(75.5±4.9)%和(91.0±3.5)%,且HDAC7低表达还是中危患儿预后不良的独立影响因素,这与Moreno等的研究结论相反,除可能与研究中所采用的对照人群不同及定义HDAC7表达水平高低所采用的统计学方法不同有关,此外,治疗方案的差异也可能是原因之一[9,10]。Moreno等的研究采用GBTLI-99方案,该方案仅有2种治疗危险度,并且在治疗的各个模块中的用药种类与剂量均与CCLG ALL-2008方案存在明显区别。
本文结果提示,MLL基因重排阳性ALL患儿中存在HDAC7基因低表达。HDAC7低表达与中危患儿预后不良相关,是中危长期预后的独立影响因素。引起ALL患儿中HDAC7异常表达的机制及HDAC7在不同治疗方案中对预后的影响,有待深入研究。
[1] Gruhn B,Naumann T,Gruner D,et al.The expression of histone deacetylase 4 is associated with prednisone poor-response in childhood acute lymphoblastic leukemia.Leuk Res,2013,37(10):1200-1207
[2] Wang H,Song C,Ding Y,et al.Transcriptional regulation of JARID1B/KDM5B histone demethylase by Ikaros,Histone Deacetylase 1 (HDAC1),and Casein Kinase 2 (CK2) in B-cell acute lymphoblastic leukemia.J Biol Chem,2016,291(8):4004-4018
[3] Zhang C,Zhong JF,Stucky A,et al.Histone acetylation:novel target for the treatment of acute lymphoblastic leukemia.Clin Epigenetics,2015 ,7:117
[4] Cantley MD,Zannettino AC,Bartold PM,et al.Histone deacetylases (HDAC) in physiological and pathological bone remodelling.Bone,2017,95:162-174
[5] Cheng K,Li S,Liao C.Progress in the discovery of macrocyclic histone deacetylase inhibitors for the treatment of cancer.Curr Med Chem,2017,doi:10.2174
[6] Barneda-Zahonero B,Román-González L,Collazo O,et al.HDAC7 is a repressor of myeloid genes whose down regulation is required for transdifferentiation of Pre-B cells into macrophages.PLoS Genet,2013,9(5):e1003503
[7] Azagra A,Román-González L,Collazo O,et al.In vivo conditional deletion of HDAC7 reveals its requirement to establish proper B lymphocyte identityand development.J Exp Med,2016,213(12):2591-2601
[8] Barneda-Zahonero B,Collazo O,Azagra A,et al.Thetranscriptional repressor HDAC7 promotes apoptosis and c-Myc down regulation in particular types of leukemia and lymphoma.Cell Death Dis,2015,6:e1635
[9] Moreno DA,Scrideli CA,Cortez MA,et al.Differential expression of HDAC3,HDAC7 and HDAC9 is associated with prognosis and survival in childhood acute lymphoblastic leukaemia.Br J Haematol,2010,150(6):665-673
[10] 中华医学会儿科学分会血液学组,《中华儿科杂志》编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第四次修订).中华儿科杂志,2014,52(9):641-644
[11] Meyners C,Mertens M,Wessig P,et al.A fluorescence-lifetime-based binding assay for class IIa histone deacetylases.Chemistry,2017,23(13).3107-3116
[12] Gaur V,Connor T,Sanigorski A,et al.Disruption of the class IIa HDAC corepressor complex increases energy expenditure and lipid oxidation.Cell Rep,2016,16(11):2802-2810
[13] Osada H,Tatematsu Y,Saito H,et al.Reduced expression of class II histone deacetylase genes is associated with poor prognosis in lung cancer patients.Int J Cancer.2004,112(1):26-32.
[14] Di Giorgio E,Brancolini C.Regulation of class IIa HDAC activities:it is not only matter of subcellular localization.Epigenomics,2016,8(2):251-269
[15] Shakespear MR,Hohenhaus DM,Kelly GM,et al.Histone deacetylase 7 promotes Toll-like receptor 4-dependent proinflammatory gene expression in macrophages.J Biol Chem,2013,288(35):25362-25374
[16] Gao C1,Cheng X,Lam M,et al.Signal-dependent regulation of transcription by histone deacetylase 7 involves recruitment to promyelocytic leukemia protein nuclear bodies.Mol Biol Cell,2008,19(7):3020-3027
[17] Ahn MY,Yoon JH.Histone deacetylase 7 silencing induces apoptosis and autophagy in salivary mucoepidermoid carcinoma cells.J Oral Pathol Med,2017,doi:10.1111
(本文编辑:张崇凡,孙晋枫)
Association of histone deacetylase 7 expression and the clinico-biological characteristics and outcome in childhood acute lymphoblastic leukemia
HOUBei,GAOChao,LIUShu-guang,ZHANGRui-dong,LUJi-ran,ZHENGHu-yong
(BeijingKeyLaboratoryofPediatricHematologyOncology;NationalKeyDisciplineofPediatrics,MinistryofEducation;MOEKeyLaboratoryofMajorDiseasesinChildren;HematologyOncologyCenter,BeijingChildren'sHospital,CapitalMedicalUniversity,Beijing100045,China)
ZHENG Hu-yong,E-mail:zhenghuyong@vip.sina.com; GAO Chao,E-mail:gaochaoconnie@live.cn
Objective To discuss the expression of histone deacetylase 7(HDAC7) in bone marrow samples of patients with newly diagnosed pediatric acute lymphoblastic leukemia (ALL) and the association with clinic-biological characteristics,early treatment responses and long-term outcome.MethodsTheHDAC7 expression level of pediatric patients with newly diagnosed ALL was determined by RT-qPCR method.Three samples from ALL patients in CCR for more than 3 years after treatment were used as control and patients were divided into high-expression(≥1.0) and low-expression (<1.0)groups.The differences of clinico-biological characteristics,minimal residual disease and event-free survival (EFS) were analyzed between high and low expression groups.ResultsHDAC7 expression of 236 pediatric patients with newly diagnosed ALL ranged from 0.046 to 10.581,with 124 and 112 patients in the high expression group and low expression group,respectively.Univariate analysis showed that the expression ofHDAC7 was associated with low peripheral white blood count (WBC) at diagnosis(<50×109·L-1),pro-B immunophenotype andMLLgene rearrangement(allP<0.05).Logistic multivariate regression analysis showed that WBC (<50×109·L-1)and fusion gene were influence factors ofHDAC7 expression(allP<0.05).Intermediate risk group patients with high-expression ofHDAC7 was associated with a favorable 5 year EFS compared with low-expression group,with(91.0±3.5)%vs.(75.5±4.9)%,P=0.013.Furthermore,HDAC7 expression was indentified as the independent prognostic factor for EFS in IR patients,with odd ratio and 95% confidence interval of 1.26(1.31~9.51).ConclusionIn pediatric ALL,expression ofHDAC7 was found to be related to clinical and biological characteristics.Low-HDAC7 was independent adverse prognostic factor for EFS in IR subgroup.
Acute lymphoblastic leukemia; Child; Histone deacetylase 7; Prognosis; Gene expression
国家自然科学基金项目:81300432,81300434;北京市医院管理局重点医学专业发展计划项目“扬帆计划”临床医学发展专项:ZY201404;北京市医院管理局“登峰”人才培养计划:DFL20151101;首都卫生发展科研专项-重点攻关项目:2016-1-2091
北京儿童血液病与肿瘤分子分型北京市重点实验室,儿科学国家重点学科,儿科重大疾病研究教育部重点实验室,首都医科大学附属北京儿童医院血液肿瘤中心 北京,100045
郑胡镛 ,E-mail:zhenghuyong@vip.sina.com;高超,E-mail:gaochaoconnie@live.cn
10.3969/j.issn.1673-5501.2017.01.002
2017-02-14
2017-02-21)
