清热利湿饮通过调控FBW7影响HaCaT细胞Cyclin E的表达
2017-04-07孙淑娜黄启腾魏海峰李广远张晓杰
孙淑娜 黄启腾 魏海峰 李广远 赵 颖 张晓杰
·论著·
清热利湿饮通过调控FBW7影响HaCaT细胞Cyclin E的表达
孙淑娜1黄启腾1魏海峰2李广远3赵 颖1张晓杰1
目的: 明确清热利湿饮调控HaCaT细胞内Cyclin E表达的机制。方法: Western blot检测HaCaT细胞蛋白半衰期;免疫沉淀及Western blot检测蛋白泛素化水平;Western blot及Real-time PCR检测清热利湿饮对E3泛素连接酶SCF-FBW7表达的影响。结果: 与对照组比较,清热利湿饮组Cyclin E蛋白的半衰期较对照组缩短,Cyclin E蛋白泛素化水平及蛋白降解速度显著增高,FBW7 mRNA与蛋白水平明显上调。结论: 清热利湿饮通过调控FBW7抑制Cyclin E的表达。
清热利湿饮; Cyclin E; 泛素化; FBW7
银屑病病理生理的重要特点之一是表皮基底层的角质形成细胞增殖加速,细胞周期缩短,组织病理呈现角质形成细胞过度增生[1]。清热利湿饮是针对银屑病证型的有效中药组方,经过临床观察疗效显著[2]。我们前期研究发现清热利湿饮能够抑制角质形成细胞HaCaT细胞增殖和Cyclin E蛋白表达下调,但机制不明[3]。为明确清热利湿饮影响细胞增殖的分子机制,我们对其调控Cyclin E的表达机制进行了探讨。
1 材料与方法
1.1 材料
1.1.1 人永生化表皮细胞HaCaT细胞株购于武汉大学中国典型培养物保藏中心;
1.1.2 主要试剂 DMEM培养基、胰蛋白酶与胎牛血清:Gibco公司。Western blot用一抗,siRNA,protein A珠子:Santa cruz公司, Light Cycler 480 SYBR Green I Master:ROCHE公司。MG132,CHX, RIPA裂解液:碧云天生物技术公司。Trizol,Lipofectamine2000:Invitrogen公司。cNDA逆转录试剂盒:天根生化科技有限公司。
1.2 主要方法
1.2.1 清热利湿饮药液制备 龙胆草6 g,黄芩9 g,柴胡9 g,山栀9 g, 生地黄15 g, 牡丹皮9 g,当归9 g,金银花30 g,土茯苓30 g,泽泻9 g,车前子15 g,甘草6 g,上述药材加10倍量水浸泡1 h,煎煮至沸,保持微沸45 min,过滤,滤渣加入8倍量水再煎煮,沸腾后保持微沸0.5 h,合并两次煎煮液,将上述中药液减压浓缩成200 mL,每毫升药液含0.78 g生药,过滤除菌,4℃冰箱保存备用。细胞培养时稀释到相应终浓度。
1.2.2 细胞培养 将HaCaT细胞株接种于含有10%胎牛血清的DMEM培养液中贴壁培养。隔天换液。清热利湿饮药物处理组使用终浓度80 μg/mL药液的DMEM培养细胞48 h。
1.2.3 Realtime PCR RNA提取与逆转录及实时定量PCR方法参照文献[4]。将药物处理的HaCaT细胞使用Trizol裂解提取RNA并参照说明书取2 μG逆转录。实时定量PCR检测,反应体系:每10 μL反应体系包括无菌去离子水4.2 μL、Light Cycler 480 SYBR Green I Master 5 μL、cDNA 0.5 μL、逆转录引物0.3 μL,反应条件:94℃预变性3 min,95℃变性30 s,60℃退火30 s,72度延伸30 s,共40个循环。,以GAPDH为内参,应用Roche LightCycler 480自带分析程序比较不同样本同一目的基因的表达变化情况,并进行分析。引物序列qGAPDH-F:5'-CCAGGTGGTCTCCTCTGACTT-3',qGAPDH-R:5'-GTTGCTGTAGCCAAATTCGTTGT-3';qFBW7-F:5′-CCTCCAGGAATGGCTAAAAA-3′,qFBW7-R:5′-AAGAGTTCATCTAAAGCAAGCAA-3′。
1.2.4 Western blot 方法参考文献[5]。将药物处理的HaCaT细胞使用RIPA裂解液冰上裂解提取蛋白,BCA蛋白定量,取40 μg样品变性后进行SDS-PAGE电泳,转膜,含5%脱脂奶粉TBS封闭,一抗4℃孵育过夜,TBST洗膜,二抗37℃孵育1 h,洗膜,化学发光,显影定影。胶片曝光。
1.2.5 泛素化水平检测 将细胞使用30 μM的MG132处理3 h,使用western及IP裂解液冰上裂解并超声,离心提取蛋白。蛋白上清中加入1 μg anti-Cyclin E抗体,4℃条件下孵育3 h再加入50 μL protein A的珠子,4℃条件下孵育过夜。使用IP裂解液洗涤珠子3遍,每遍10 min,弃上清。加入2×蛋白上样缓冲液至珠子中,99℃变性5~10 min,样品进行western blot。
1.2.6 Lipofectamine2000转染siRNA 将细胞铺到6孔板中, 24 h后细胞密度达到约30%。取1.5 mL无菌Ep管,参照说明,分别加入适量无血清无抗生素的培养基,lipofectamin2000转染试剂和siRNA,混匀,室温放置20 min。将配制好的转染复合物加入到细胞生长的培养板或培养皿中siRNA终浓度为50 nM。
2 结果
2.1 清热利湿饮缩短Cyclin E的蛋白半衰期,降低蛋白稳定性 我们前期发现清热利湿饮可在转录后水平调控Cyclin E的表达,因此我们首先分析了清热利湿饮对Cyclin E蛋白稳定性的影响。为了排除蛋白翻译效率的差异对结果的影响,我们使用了蛋白合成抑制剂放线菌酮CHX(50 μg/mL)处理细胞,然后在不同时间点收取细胞蛋白,检测细胞内Cyclin E的蛋白含量。结果显示不同时间点,药物处理组细胞内Cyclin E蛋白含量明显少于对照组细胞,提示清热利湿饮处理细胞内Cyclin E蛋白含量降低速度明显快于对照细胞,表明清热利湿饮能明显缩短Cyclin E的蛋白半衰期,降低其蛋白稳定性(图1)。

图1 清热利湿饮缩短Cyclin E蛋白的半衰期。药物处理组细胞使用含80 μg/mL清热利湿饮药液的DMEM培养基37℃培养48 h,对照组使用含与清热利湿饮等体积去离子水的DMEM培养基培养相同时间。收取细胞前使用放线菌酮CHX(50 μg/mL)处理各组细胞后在所示时间点收取细胞,提取总蛋白进行western blot检测
2.2 清热利湿饮促进Cyclin E的泛素化和蛋白降解 泛素-蛋白酶体降解途径是调控Cyclin E在细胞内表达的重要通路。因此,我们随后使用蛋白酶体抑制剂MG132处理细胞。结果显示与对照细胞(DMSO处理组)相比,MG132可有效抑制清热利湿饮导致的Cyclin E蛋白表达下调(图2a),提示清热利湿饮通过促进Cyclin E的蛋白酶体依赖的降解而降低其在细胞内的表达。
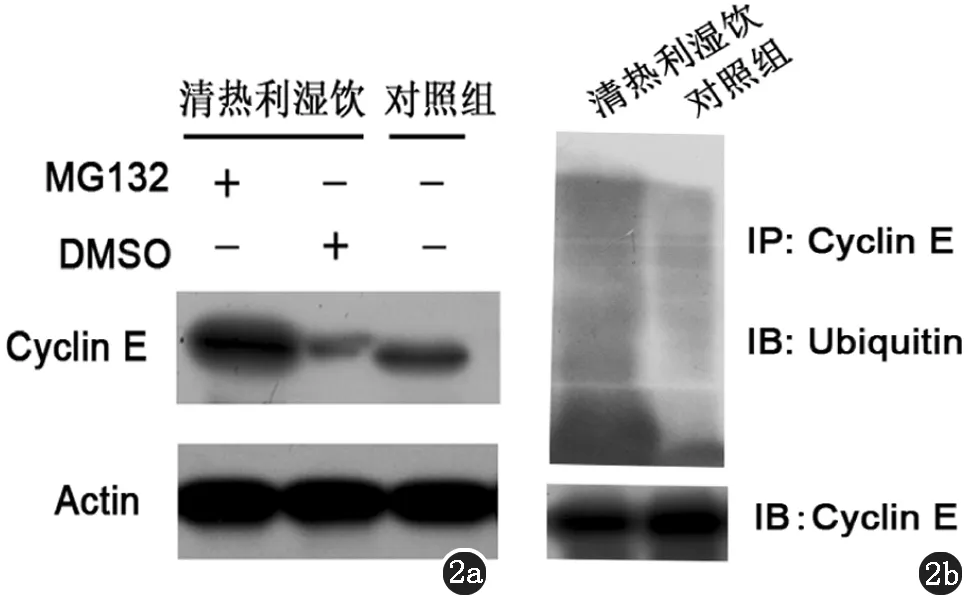
图2 清热利湿饮促进Cyclin E蛋白泛素化。a.清热利湿饮处理组和对照组细胞使用30 μM的MG132(DMSO为溶剂)或含等体积DMSO的DMEM培养基处理3 h后,收取细胞提取总蛋白进行western blot。b.提取清热利湿饮处理组和对照组细胞总蛋白,蛋白定量后取等量蛋白使用anti-Cyclin E抗体进行IP。IP的蛋白使用anti-Ubiquitin和anti-Cyclin E抗体进行western blot。
蛋白泛素化是促进蛋白被蛋白酶体识别而进一步被后者降解的重要信号。为了进一步明确清热利湿饮调控Cyclin E的机制,我们检测了清热利湿饮对Cyclin E泛素化的影响。我们使用Cyclin E的抗体进行IP并对利用抗泛素抗体检测Cyclin E的泛素化水平。结果显示与对照细胞相比,清热利湿饮处理细胞内Cylin E蛋白泛素化水平有明显上调(图2b)。这些结果显示清热利湿饮促进Cyclin E蛋白泛素化,从而导致其蛋白酶体依赖的降解加速。
2.3 清热利湿饮促进E3泛素连接酶(FBW7)的表达 E3泛素连接酶SCF-FBW7在调控Cyclin E泛素化中发挥着重要功能。因此,我们随后检测了FBW7的表达。结果显示与对照细胞相比,清热利湿饮处理细胞内FBW7的蛋白和mRNA水平均有明显上调(图3a、3b)。随后我们使用siRNA干扰FBW7的表达。结果显示抑制FBW7的表达可有效恢复因清热利湿饮处理导致的Cyclin E蛋白表达下调(图3c),提示清热利湿饮可通过上调FBW7的表达,促进Cylin E的泛素化和蛋白降解。

图3 通过促进FBW7的表达实现抑制Cyclin E的蛋白水平。a.利用western blot分析清热利湿饮处理组HaCaT细胞与对照组HaCaT细胞内FBW7蛋白的表达。b.含80 μg/mL清热利湿饮或对照的DMEM培养基培养HaCaT细胞48 h,收取细胞提取总RNA并逆转录得到cDNA,利用实时定量PCR分析FBW7的mRNA含量,以GAPDH mRNA为内参 (*,≤0.05,非配对t检验)。c.转染干扰FBW7的siRNA (80 nM)或等量的阴性对照siRNA入HaCaT细胞,转染8 h后换含80 μg/mL清热利湿饮或对照的DMEM培养基继续培养细胞48 h,收取细胞提取总蛋白进行western blot分析
3 讨论
角质形成细胞过度增生是银屑病皮损的重要特征之一[6]。因此,抑制角质形成细胞增殖是治疗银屑病的重要靶点之一[7]。我们前期研究结果显示清热利湿饮可导致角质形成细胞增殖减慢,DNA合成障碍并且在转录后水平抑制Cyclin E蛋白的表达[3]。在本研究中我们进一步对清热利湿饮转录后水平调控Cyclin E的机制进行了探讨。我们发现清热利湿饮可促进Cyclin E泛素化。泛素化是蛋白修饰的重要方式之一,存在于生长发育、细胞周期、信号转导等几乎所有生物学过程[8,9]。多泛素化可导致底物蛋白被26S蛋白酶体降解,是转录后调控蛋白表达的重要途径[10]。我们的研究也显示使用蛋白酶体抑制剂MG132可明显恢复清热利湿饮导致的Cyclin E蛋白减少,说明清热利湿饮可促进Cyclin E的泛素化从而导致其被蛋白酶体降解。Cyclin E在细胞G1/S期转换中扮演着重要的角色,其高表达可促进细胞增殖,并且Cyclin E在多种肿瘤中表达上调,被认为是重要的促癌基因[11,12]。此外有研究发现Cyclin E在银屑病皮损中高表达[13],提示Cyclin E表达失调可能是导致银屑病的原因之一,因此下调Cyclin E表达从而抑制角质形成细胞过度增殖是治疗银屑病的潜在有效途径。我们的结果则提示促进Cyclin E泛素化蛋白降解可能是清热利湿饮治疗银屑病的机制之一。
在泛素化这一过程中,E3泛素连接酶负责底物的特异性选择,因此被认为是调控的核心[14]。Cyclin E泛素化受到包括SCF-FBW7和CRL4等多种E3泛素酶的影响[15,16]。我们研究显示清热利湿饮导致FBW7蛋白和mRNA的增多,而利用siRNA干扰其表达可部分恢复清热利湿饮导致的Cyclin E表达下调,说明清热利湿饮通过调控FBW7的表达从而影响Cyclin E的泛素化。由于FBW7的mRNA也有明显上调,提示清热利湿饮对FBW7的调控是发生在转录水平。需要指出的是,在实验中我们利用siRNA 干扰FBW7的表达。尽管siRNA干扰后清热利湿饮处理细胞内FBW7的表达与对照细胞相比没有明显差异,但也只能部分恢复清热利湿饮导致的Cyclin E的蛋白减少,说明清热利湿饮转录后调控Cyclin E表达还有非依赖FBW7的生物学途径。总之,这些结果表明清热利湿饮治疗银屑病的部分疗效是通过抑制Cyclin E的表达而进一步对异常增生角质细胞的增殖进行抑制而实现的。此外,鉴于FBW7在Cyclin E表达调控以及细胞增殖中的重要作用,针对其开发相应的靶向药物也可能成为未来银屑病治疗的可选方法之一。
[1] Valdimarsson H, Bake BS, Jonsdotdr I, et al. Psoriasis: a disease of abnormal Keratinocyte proliferation induced by T lymphocytes[J]. Immunology Today,1986,7(9):256-259.
[2] 魏慧玲. 清热利湿饮治疗血热型银屑病疗效观察及对银屑病样动物模型的影响[D].山东中医药大学.
[3] 张晓杰,孙淑娜,鲁娟娟,等.清热利湿饮对HaCaT细胞增殖的影响[J]. 中国麻风皮肤病杂志,2013,29(1):3-5.
[4] Zou Y, Mi J, Wang W, et al. CUL4B promotes replication licensing by up-regulating the CDK2-CDC6 cascade[J]. J Cell Biology,2013,200(6):743-756.
[5] Hu H, Yang Y, Ji Q, et al. CRL4B catalyzes H2AK119 monoubiquitination and coordinates with PRC2 to promote tumorigenesis[J]. Cancer Cell,2012,22(6):781-795.
[6] Enerback C. Soluble biomarkers in psoriasis[J]. European J Dermatology,2011,21(6):844-850.
[7] Rahman M, Alam K, Ahmad MZ, et al. Classical to current approach for treatment of psoriasis: a review[J]. Endocr Metab Immune Disord Drug Targets,2012,12(3):287-302.
[8] Petroski MD, Deshaies RJ. Function and regulation of cullin-RING ubiquitin ligases[J]. Nature Reviews Molecular Cell Biology,2005,6(1):9-20.
[9] Pickart CM. Mechanisms underlying ubiquitination[J]. Annual Review of Biochemistry,2001,70:503-533.
[10] Liu J, Shaik S, Dai X, et al. Targeting the ubiquitin pathway for cancer treatment[J]. Biochimicaet Biophysica Acta,2014,1855(1):50-60.
[11] Zhang H. Life without kinase: cyclin E promotes DNA replication licensing and beyond[J]. Molecular Cell,2007,25(2):175-176.
[12] Welcker M, Clurman B. Cell cycle: how cyclin E got its groove back[J]. Current Biology: CB,2005,15(19):R810-812.
[13] Ichihara A, Jinnin M, Yamane K, et al. microRNA-mediated keratinocyte hyperproliferation in psoriasis vulgaris[J]. British J Dermatology,2011,165(5):1003-1010.
[14] Nakayama KI, Nakayama K. Ubiquitin ligases: cell-cycle control and cancer[J]. Nature Reviews Cancer,2006,6(5):369-381.
[15] Zou Y, Mi J, Cui J, et al. Characterization of nuclear localization signal in the N terminus of CUL4B and its essential role in cyclin E degradation and cell cycle progression[J]. J Biological Chemistry,2009,284(48):33320-33332.
[16] Davis RJ, Welcker M, Clurman BE. Tumor suppression by the Fbw7 ubiquitin ligase: mechanisms and opportunities[J]. Cancer Cell,2014,26(4):455-464.
(收稿:2016-09-29 修回:2016-11-16)
The expression of Cyclin E affected by Qingrelishi recipe through regulating FBW7 in HaCaT cells
SUNShuna1,HUANGQiteng1,WEIHaifeng2,LIGuangyuan3,ZHAOYing1,ZHANGXiaojie1.
1.DepartmentofDermatology,AffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250012,China; 2.ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China; 3.AgriculturalBankofChinaShandongBranch,Jinan250014,China
ZHANGXiaojie,E-mail:qlzxj@126.com
Objective: To determine the mechanism of the expression of Cyclin E affected by Qingrelishi recipe in HaCaT cells. Methods: Half-life of Cyclin E in HaCaT cells was detected by Western blot. The ubiquitination level of Cyclin E was detected through IP and Western blot. The level of ubiquitin ligase E3 SCF-FBW7 affected by Qingrelishi recipe was detected by Western blot and Real-time PCR. Results: Compared with control group, the Half-life of Cyclin E was shorter, the ubiquitination level and the degradation speed of Cyclin E were higher and the level of FBW7 mRNA and protein was higher in the Qingrelishi recipe group. Conclusion: Qingrelishi recipe can inhibit the Cyclin E expression through the regulation of FBW7.
Qingrelishi recipe; Cyclin E; ubiquitination; FBW7
山东省自然科学基金资助项目(编号:ZR2012HM075)
1山东中医药大学附属医院皮肤科,济南,250011 2山东中医药大学,济南,250355 3中国农业银行山东分行,济南,250014
