选择性白细胞吸附疗法治疗炎症性肠病疗效分析
2017-04-06姚玮艳陶凤来袁耀宗
姚玮艳 陈 英 陈 舒 陶凤来 沈 锐 袁耀宗 钟 捷
上海交通大学医学院附属瑞金医院消化内科(200025)
选择性白细胞吸附疗法治疗炎症性肠病疗效分析
姚玮艳*陈 英 陈 舒 陶凤来 沈 锐 袁耀宗 钟 捷#
上海交通大学医学院附属瑞金医院消化内科(200025)
背景:近年来我国炎症性肠病(IBD)就诊人数逐年增加,目前临床常用的治疗方法在疗效和安全性方面有其局限性。选择性白细胞吸附疗法(GMA)是国外治疗IBD的有效方法之一,国内则缺乏此类研究。目的:探讨GMA治疗IBD的疗效和安全性。方法:回顾性收集2013年5月—2014年7月在上海瑞金医院接受GMA治疗的21例IBD患者的临床资料,其中13例为溃疡性结肠炎(UC),8例为克罗恩病(CD)。入组患者均为5-氨基水杨酸(5-ASA)疗效不佳或激素抵抗者。分析GMA治疗前和治疗结束后第2周末疾病临床活动度指数(CAI)、内镜活动度指数(EAI)、实验室指标[血清白蛋白(Alb)、血红蛋白(Hb)、红细胞沉降率(ESR)、C-反应蛋白(CRP)、白细胞(WBC)计数、中性粒细胞百分率(N%)]以及不良反应情况。结果:GMA治疗后,UC和CD组CAI、EAI评分均较治疗前显著降低(P均<0.05);实验室指标中,UC组治疗后Alb显著升高(P<0.05),CRP显著降低(P<0.05),CD组仅CRP显著降低(P<0.05),其余指标治疗前后差异均无统计学意义(P均>0.05)。观察显示GMA治疗安全性良好,无严重不良反应发生。结论:GMA治疗可有效减轻5-ASA或激素治疗无效IBD患者的临床症状和肠道黏膜损伤、控制炎症反应活动且安全性良好,但该结论需更大样本的前瞻性研究证实。
炎症性肠病; 结肠炎,溃疡性; Crohn病; 白细胞去除术; 治疗结果; 安全
炎症性肠病(inflammatory bowel disease, IBD)是一组病因不明的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)。IBD为北美和欧洲国家的常见病,近十余年来我国就诊人数亦逐年增加,上升趋势十分明显,成为消化系统常见病之一[1]。目前临床上治疗IBD的药物主要有氨基水杨酸类、糖皮质激素、免疫抑制剂和生物单抗制剂,然而前两者对部分患者无效,免疫抑制剂存在肝肾、血液等多系统不良反应,生物单抗制剂价格昂贵,且存在感染、骨髓抑制不良反应。
尽管目前对IBD发生、发展的具体机制尚未明确,但此病可视为免疫系统异常激活以及中性粒细胞介导的组织损伤的最终结果[2-3]。有证据表明,IBD复发与黏膜通透性增加以及中性粒细胞、单核细胞、巨噬细胞在黏膜聚集密切相关[4]。基于中性粒细胞、单核/巨噬细胞及其分泌的炎症细胞因子在IBD疾病活动和临床复发中的重要作用,推测对于活动期IBD患者,减少其循环中的白细胞数量可能缓解病情。
日本众多研究证实选择性白细胞吸附疗法(granulocyte and monocyte adsorptive apheresis, GMA)是治疗IBD的有效方法之一[5-8],且已逐渐被欧美国家接受并开始其应用和疗效研究[9-11],国内则尚缺乏此类研究。上海交通大学医学院附属瑞金医院为国内首批开展GMA的单位之一,本研究通过回顾性分析该院21例采用较为成熟的GMA设备Adacolumn®进行治疗的IBD患者的临床资料,探讨GMA治疗IBD的疗效和安全性。
对象与方法
一、研究对象
回顾性收集2013年5月—2014年7月在上海交通大学医学院附属瑞金医院消化内科接受GMA(Adacolumn®, JIMRO Co,. Ltd.)治疗的21例IBD患者的临床资料。患者接受治疗前均签署知情同意书,临床资料完整,GMA治疗前和治疗结束后第2周末接受内镜和相关实验室检查。
二、GMA治疗
1. 纳入标准:①年龄16~70岁;②根据临床、影像学、内镜、病理表现明确诊断为IBD,符合我国IBD诊治共识[1];③5-氨基水杨酸(5-ASA)疗效不佳(口服美沙拉秦缓释片2~4 g/d×2~4周无效)或激素抵抗(口服甲基泼尼松龙30~40 mg/d至少2~3周或静脉使用1~1.5 mg·kg-1·d-1至少7~10 d无效),建议在激素治疗后4周内开始GMA治疗;④具有良好的血管条件;⑤患者同意配合治疗并签署知情同意书。

3. 治疗方法:对符合入组标准的患者行血常规、肝肾功能、电解质、凝血功能、红细胞沉降率(ESR)、C-反应蛋白(CRP)检查和结肠镜检查,并详细询问病史。入组后每周行2次GMA治疗,如有临床症状改善则继续治疗,共治疗10次。治疗期间不限制常规药物治疗。
三、评价指标
采集患者性别、年龄、病史、疾病行为、疾病活动性、药物使用情况、临床表现、实验室指标、内镜检查结果、不良反应情况等信息。根据相关资料评估GMA治疗前和10次治疗结束后第2周末的临床活动度指数(clinical activity index, CAI)和内镜活动度指数(endoscopic activity index, EAI), 记录相应时间点血清白蛋白(Alb)、Hb、ESR、CRP、白细胞(WBC)计数、中性粒细胞百分率(N%)。CAI的评估包括排便次数、粪便中血量、腹痛症状、有无发热、有无贫血、有无ESR改变和系统症状七个项目, EAI的评估包括结肠镜下反光颗粒、血管形态、黏膜脆性和黏膜损伤程度四个项目,两者总分分别为各项目评分之和[12]。
四、统计学分析
结 果
一、一般资料
21例IBD患者中UC 13例(男性6例,女性7例),CD 8例(男性3例,女性5例),年龄16~68岁,平均(40.5±13.7)岁,平均病程(53.8±40.1)月。入组患者均完成每周2次、连续10次GMA治疗。13例UC患者中,11例病变范围为E2型(左半结肠炎),2例为E3型(全结肠炎);8例CD患者病变部位均为L2型(结肠型)。
二、疗效评价
1. CAI和EAI:13例UC患者和8例CD患者GMA治疗后CAI、EAI评分均较治疗前明显降低,差异有统计学意义(P<0.05)(表1、表2)。

表1 UC患者GMA治疗前后CAI比较(±s)
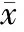
表2 CD患者GMA治疗前后EAI比较(±s)
2. 实验室指标:13例UC患者GMA治疗后Alb较治疗前明显升高,CRP较治疗前明显降低,差异均有统计学意义(P<0.05),Hb、ESR、WBC计数、N%与治疗前相比则无明显差异(P>0.05)(表3)。8例CD患者GMA治疗后除CRP显著降低(P<0.05)外,其余指标治疗前后差异均无统计学意义(P>0.05)(表4)。
三、不良反应
每次GMA治疗后患者均留院观察2 h,以保证治疗的安全性。GMA治疗初、治疗中和治疗后,患者血常规、肝肾功能等指标差异均无统计学意义(P>0.05),表明治疗安全性良好。GMA治疗相关不良反应主要为偏头痛,其次为低热、皮疹、恶心等。本组 2 例患者出现偏头痛,总体不良反应发生率为9.5%(2/21),明显低于激素治疗相关不良反应发生率(约50%)。疗程结束后经治疗患者偏头痛均缓解。
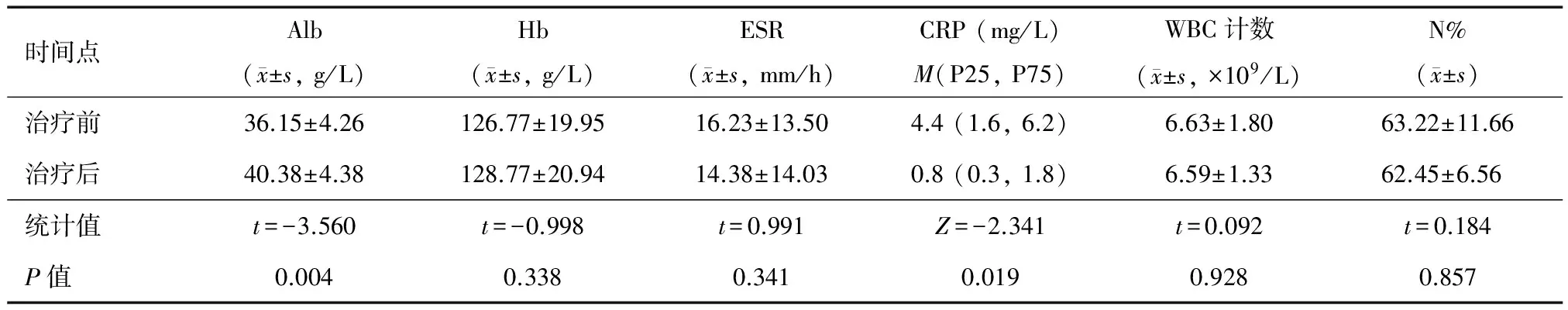
表3 UC患者GMA治疗前后实验室指标比较

表4 CD患者GMA治疗前后实验室指标比较
讨 论
众多研究提示中性粒细胞和单核/巨噬细胞在IBD临床活动和复发中起关键作用。首先, 已知的可造成IBD临床复发的诱因,如压力和感染,其共同之处在于能增加肠道通透性,并造成急性肠道炎症[13];其次,在IBD疾病活动期,循环血液中被激活的中性粒细胞和单核/巨噬细胞数量增加,存活时间延长[5,14];此外,这些炎症细胞在炎症黏膜中的浸润密度亦明显增加,尤其是中性粒细胞,不仅能在免疫病理学上代表疾病活动性,而且与肠道炎症的严重程度相关[3]。由此认为以中性粒细胞为主的炎症细胞激活增加且存活时间延长是导致IBD复发和活动的重要原因之一。然而目前我国IBD临床治疗方法中尚缺乏针对此因素的靶向治疗。
目前已有较多证据表明GMA是治疗IBD的有效方法之一,特别是对于激素抵抗或激素依赖性患者,可有效诱导并维持缓解,患者耐受性好[5-11]。本研究中患者所使用的白细胞体外吸附分离设备为Adacolumn®,其吸附柱内充满特制的乙酸纤维素粒作为吸附载体,能选择性吸附过多的中性粒细胞、单核细胞和巨噬细胞,但不吸附淋巴细胞,故称为选择性吸附疗法。GMA技术最早在日本开展应用,是日本活动性UC治疗指南中推荐的治疗方法之一[15],并已逐渐为欧美国家所接受,相关研究显示其具有一定临床效果[9-11]。本研究纳入的21例IBD患者入组时均处于疾病活动期, UC组和CD组入组时CAI分别为4.92±1.75和3.62±2.97,EAI分别为7.23±2.28和6.63±3.07,且经5-ASA或激素治疗无效。本研究旨在评估这些对基础治疗无应答的IBD患者能否通过GMA治疗获得缓解。
13例UC患者经GMA治疗后,CAI和EAI评分均较入组时显著降低。CAI是一种综合患者临床症状和实验室检查结果的评分方法,EAI则是专门用于反映内镜下黏膜损害的评分方法,这两项评分显著改善表明GMA对于UC患者的疾病缓解有效。在实验室指标中,仅Alb和CRP在GMA治疗前后有显著差异,Hb、ESR、WBC计数和N%均无明显变化。Alb在血清中的浓度反映了患者的营养状态和炎症活动水平,GMA治疗后其水平显著升高表明患者营养状况有所改善,结合EAI评分的改善,推测是由于黏膜损伤愈合导致营养吸收好转。CRP是一种急性期反应蛋白,能敏感地反映肠道炎症活动情况,可用于IBD疗效评估和随访监测。GMA治疗后患者CRP水平显著降低提示炎症活动度下降,病情较治疗前得到控制。Hb与患者的便血程度和营养状态有关,本组UC患者GMA治疗前后Hb水平无明显差异可能是因为患者入组时Hb水平并无明显降低(均>100 g/L)。ESR亦为反映炎症活动度的指标,ESR在GMA治疗前后未表现出明显差异的可能解释是该指标反映GMA治疗效果的敏感性不如CRP。GMA作为一种可选择性吸附中性粒细胞和单核/巨噬细胞的治疗手段,理论上治疗后WBC计数和N%应较治疗前降低,但本组UC患者这两项指标在GMA治疗前后并无明显差异,可能是由于治疗中被吸附的中性粒细胞在循环血液中性粒细胞总数中占比较低,亦可能为实验室指标的检测时间点为治疗结束后第2周末,由于机体存在代偿机制,下降的中性粒细胞已恢复至原有水平。
8例CD患者经GMA治疗后,CAI、EAI评分以及实验室指标中的CRP较入组时显著降低,表明GMA治疗对CD患者的临床症状缓解和肠道黏膜修复有效。然而目前对CD的GMA治疗疗效尚存争议。一项随机双盲对照试验显示,对于中重度活动期CD患者,尽管GMA治疗的耐受性良好,但其临床缓解率和应答率与伪治疗相比并无明显差异[16]。CD患者能否从GMA治疗中获益,需进一步开展大样本研究加以探索。
本组IBD患者GMA治疗后血常规以及肝肾功能等常规生化指标与治疗前相比均无明显变化,且偏头痛不良反应在治疗结束后经治疗缓解,无严重不良反应发生。
综上所述,作为国内首批GMA临床研究,本研究结果表明GMA治疗可有效减轻5-ASA或激素治疗无效IBD患者的临床症状和肠道黏膜损伤、控制炎症反应活动且安全性良好,为GMA在我国IBD治疗中的应用提供了初步研究结果。本研究纳入病例数较少,且所采用的评分系统CAI和EAI系由GMA设备研制者所制订,后续拟扩大样本量,并使用权威性和公认度更高、更为通用的临床和内镜评分 系统,如改良Mayo评分、简化CD活动指数(CDAI)以及Baron内镜分级、CD简化内镜评分(SES-CD)等作进一步探索,以提高研究结果的可靠性和临床价值。GMA治疗的远期疗效和安全性亦需更大样本的前瞻性研究证实。
1 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
2 McCarthy DA, Rampton DS, Liu YC. Peripheral blood neutrophils in inflammatory bowel disease: morphological evidence ofinvivoactivation in active disease[J]. Clin Exp Immunol, 1991, 86 (3): 489-493.
3 Grisham MB, Yamada T. Neutrophils, nitrogen oxides, and inflammatory bowel disease[J]. Ann N Y Acad Sci, 1992, 664: 103-115.
4 Tibble JA, Sigthorsson G, Bridger S, et al. Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease[J]. Gastroenterology, 2000, 119 (1): 15-22.
5 Hanai H, Watanabe F, Takeuchi K, et al. Leukocyte adsorptive apheresis for the treatment of active ulcerative colitis: a prospective, uncontrolled, pilot study[J]. Clin Gastroenterol Hepatol, 2003, 1 (1): 28-35.
6 Suzuki Y, Yoshimura N, Saniabadi AR, et al. Selective granulocyte and monocyte adsorptive apheresis as a first-line treatment for steroid naïve patients with active ulcerative colitis: a prospective uncontrolled study[J]. Dig Dis Sci, 2004, 49 (4): 565-571.
7 Hanai H, Watanabe F, Saniabadi AR, et al. Therapeutic efficacy of granulocyte and monocyte adsorption apheresis in severe active ulcerative colitis[J]. Dig Dis Sci, 2002, 47 (10): 2349-2353.
8 Naganuma M, Funakoshi S, Sakuraba A, et al. Granulocytapheresis is useful as an alternative therapy in patients with steroid-refractory or -dependent ulcerative colitis[J]. Inflamm Bowel Dis, 2004, 10 (3): 251-257.
9 Domènech E, Hinojosa J, Esteve-Comas M, et al; Spanish Group for the Study of Crohn’s Disease and Ulcerative Colitis (GETECCU). Granulocyteaphaeresis in steroid-dependent inflammatory bowel disease: a prospective, open, pilot study[J]. Aliment Pharmacol Ther, 2004, 20 (11-12): 1347-1352.
10 Passalacqua S, Ferraro PM, Bresci G, et al. The Italian Registry of Therapeutic Apheresis: granulocyte-monocyte apheresis in the treatment of inflammatory bowel disease. A multicentric study[J]. J Clin Apher, 2011, 26 (6): 332-337.
11 Cabriada JL, Domènech E, Ibargoyen N, et al. Leukocytapheresis for steroid-dependent ulcerative colitis in clinical practice: results of a nationwide Spanish registry[J]. J Gastroenterol, 2012, 47 (4): 359-365.
12 Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: a randomised trial[J]. BMJ, 1989, 298 (6666): 82-86.
13 Bjarnason I, MacPherson A, Hollander D. Intestinal permeability: an overview[J]. Gastroenterology, 1995, 108 (5): 1566-1581.
14 Brannigan AE, O’Connell PR, Hurley H, et al. Neutrophil apoptosis is delayed in patients with inflammatory bowel disease[J]. Shock, 2000, 13 (5): 361-366.
15 Tanaka T, Okanobu H, Kuga Y, et al. Clinical and endoscopic features of responders and non-responders to adsorptive leucocytapheresis: a report based on 120 patients with active ulcerative colitis[J]. Gastroenterol Clin Biol, 2010, 34 (12): 687-695.
16 Sands BE, Katz S, Wolf DC, et al. A randomised, double-blind, sham-controlled study of granulocyte/monocyte apheresis for moderate to severe Crohn’s disease[J]. Gut, 2013, 62 (9): 1288-1294.
(2016-08-04收稿;2016-10-15修回)
Efficacy of Granulocyte and Monocyte Adsorptive Apheresis for Treatment of Inflammatory Bowel Disease
YAOWeiyan,CHENYing,CHENShu,TAOFenglai,SHENRui,YUANYaozong,ZHONGJie.
DepartmentofGastroenterology,RuiJinHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai(200025)
ZHONG Jie, Email: jimmyzj64@medmail.com.cn
Inflammatory Bowel Disease; Colitis, Ulcerative; Crohn Disease; Leukapheresis; Treatment Outcome; Safety
10.3969/j.issn.1008-7125.2017.03.008
*Email: yaowymail@sina.com
#本文通信作者,Email: jimmyzj64@medmail.com.cn
Background: The prevalence of inflammatory bowel disease (IBD) in China is increasing year by year, however, the efficacy and safety of commonly used therapeutic methods are limited. Granulocyte and monocyte adsorptive apheresis (GMA) is one of the effective methods for treatment of IBD used abroad, however, there is still lacking of such research in China. Aims: To investigate the efficacy and safety of GMA in IBD patients. Methods: A retrospective study was conducted in 21 cases of IBD patients [13 cases with ulcerative colitis (UC) and 8 with Crohn’s disease (CD)] who accepted GMA treatment from May 2013 to July 2014 at the Shanghai Rui Jin Hospital. All the cases were poor responders to 5-aminosalycylic acid (5-ASA) or steroid-refractory. The clinical data were collected, and the clinical activity index (CAI), endoscopic activity index (EAI), laboratory parameters including serum albumin (Alb), hemoglobin (Hb), erythrocyte sedimentation rate (ESR), C-reactive protein (CRP), leukocyte count and percentage of neutrophils, as well as the adverse effects before and two weeks after the end of GMA treatment were analyzed. Results: After GMA treatment, both CAI and EAI were decreased significantly in UC and CD groups as compared with those before treatment (Pall <0.05). Among laboratory parameters, Alb was increased in UC group and CRP was decreased in both UC and CD groups after treatment (Pall <0.05). No significant differences were found in other laboratory parameters in both UC and CD groups before and after treatment (Pall >0.05). The treatment was well tolerated with no severe adverse effects. Conclusions: GMA is safe and effective for ameliorating clinical symptoms, attenuating intestinal mucosal injury and controlling active inflammation in IBD patient that has not responded to 5-ASA or steroid treatment. Prospective clinical studies with large samples are needed to confirm these findings.
