siRNA沉默Ran基因对结肠癌细胞株凋亡和Caspase-3、PARP表达的影响*
2017-04-06孙丽娜孙利慧卢瑗瑗
汪 鑫 耿 蕾 孙丽娜 孙利慧 卢瑗瑗 王 新
第四军医大学西京消化病医院 肿瘤生物学国家重点实验室(710032)
·论 著·
siRNA沉默Ran基因对结肠癌细胞株凋亡和Caspase-3、PARP表达的影响*
汪 鑫 耿 蕾 孙丽娜 孙利慧 卢瑗瑗 王 新
第四军医大学西京消化病医院 肿瘤生物学国家重点实验室(710032)
背景:结肠癌是常见的消化系统恶性肿瘤之一。本课题组前期研究发现结肠癌特异性抗原类硫氧还蛋白-2(Txl-2)的亚型之一Txl-2b可与Ras相关核蛋白(Ran)相互作用,但Ran在结肠癌发病过程中的作用和机制鲜有报道。目的:以RNA干扰技术靶向沉默结肠癌细胞株Ran基因,观察该方法对细胞凋亡和半胱天冬酶-3(caspase-3)、多聚二磷酸腺苷核糖聚合酶(PARP)表达的影响。方法:设置si-1、si-2、si-3以及阴性对照(NC)组,分别将终浓度为20、40、60 nmol/L的Ran小干扰RNA(siRNA)-1、siRNA-2、siRNA-3以及NC siRNA转染结肠癌细胞株HCT116、DLD-1。采用蛋白质印迹法检测siRNA干扰效率以及caspase-3、PARP表达的变化;采用流式细胞仪检测细胞凋亡情况。结果:20 nmol/L siRNA-1、siRNA-2抑制Ran表达的效果最佳。si-1组HCT116、DLD-1细胞的早期凋亡率较NC组显著增加(19.37%±7.57%对4.83%±1.72%;16.53%±3.38%对6.27%±3.13%;P均<0.05)。si-1组、si-2组HCT116、DLD-1细胞的晚期凋亡率较NC组显著增加(15.97%±3.31%、16.33%±5.40%对 6.40%±1.05%;22.93%±1.57%、11.50%±0.70%对6.20%±0.98%;P均<0.05)。si-1组、si-2组DLD-1细胞与NC组相比,被切割的caspase-3(活性形式)和被切割的PARP(非活性形式)表达水平显著升高。结论:沉默Ran基因能明显促进结肠癌细胞凋亡,其机制与调控caspase-3、PARP表达有关。
结肠肿瘤; Ras相关核蛋白; RNA,小分子干扰; 细胞凋亡; 半胱氨酸天冬氨酸蛋白酶3; 聚ADP核糖聚合酶类
结肠癌是常见的消化系统恶性肿瘤之一,发病机制尚未完全明确。本课题组前期研究[1]采用分离自结肠癌转移淋巴结的癌细胞免疫BALB/c小鼠,以淋巴细胞杂交瘤技术制备了一组抗结肠癌单克隆抗体,命名为结肠癌单克隆抗体(monoclonal antibodies, MCs)系列。其中,MC3所识别的抗原MC3-Ag在结肠癌组织中的阳性率达90%以上[2],且表达水平与结肠癌TNM分期、肿瘤转移密切相关[3]。其后本课题组进一步采用蛋白质组学研究方法鉴定并验证了MC3-Ag为硫氧还蛋白家族新成员类硫氧还蛋白-2(thioredoxin like-2, Txl-2)[4]。Txl-2b是 Txl-2的一种亚型[5],酵母双杂交和免疫共沉淀实验结果表明,Txl-2b可与Ras相关核蛋白(Ras-related nuclear protein, Ran)相互作用[6]。Ran为Ras超家族成员,是细胞中含量最丰富的小G蛋白,相对分子质量为25 kDa(1 Da=0.992 1 u)。Ran具有两种形式,即GDP状态下的非活性形式和GTP状态下的活性形式[7]。Ran在生物体基本生理过程中发挥重要作用,如在分裂间期调节大分子物质的核质转运[8]、在分裂前期促进纺锤体形成、在分裂末期参与核膜再组装[9]等。近年研究指出,Ran在诸多恶性肿瘤中呈高表达,包括结直肠癌[10]、胰腺癌[11]、胃癌[12]、乳腺癌[13]、卵巢癌[14]、神经母细胞瘤[15]、非小细胞肺癌[16]等,且与肿瘤的恶性表型和不良预后密切相关,可促进肿瘤细胞增殖[11]、侵袭和转移[17],抑制肿瘤细胞凋亡[13]等。然而,目前尚无研究证实Ran是否影响结肠癌细胞凋亡。本研究通过合成Ran特异性小干扰RNA(siRNA)抑制结肠癌细胞Ran表达,旨在探讨Ran对结肠癌细胞凋亡的影响。
材料与方法
一、细胞株和主要试剂
结肠癌细胞株HCT116、DLD-1(ATCC细胞库)。DMEM培养基、0.25% EDTA-胰蛋白酶、胎牛血清、Opti-MEMTM无血清培养基(Gibco公司);DharmaFECTTM1转染试剂(GE Healthcare公司);siRNA寡核苷酸(上海吉玛制药技术有限公司);RIPA细胞裂解液(碧云天生物技术研究所);BCA蛋白定量试剂盒(Thermo公司);Ran单克隆抗体、Annexin V-FITC/PI细胞凋亡检测试剂盒(BD Biosciences公司);半胱天冬酶-3(caspase-3)、多聚二磷酸腺苷核糖聚合酶(PARP)、GAPDH单克隆抗体(Cell Signaling Technology公司);β-actin单克隆抗体(Sigma公司);山羊抗鼠、抗兔HRP标记IgG抗体(北京中杉金桥生物技术有限公司)。
二、方法
1. 细胞培养:HCT116、DLD-1细胞培养于含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基中,置于37 ℃、5% CO2培养箱培养。
2. siRNA转染:取对数生长期HCT116、DLD-1细胞接种至6孔板,以含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基培养。第2 d待细胞贴壁且密度达到30%时,每孔更换为1 600 μL Opti-MEMTM无血清培养基。设置si-1、si-2、si-3以及阴性对照(NC)组,分别将终浓度为20、40、60 nmol/L的三种不同序列片段的Ran siRNA(siRNA-1、siRNA-2、siRNA-3)以及NC siRNA(表1)与200 μL Opti-MEMTM无血清培养基混合。将5 μL DharmaFECTTM1转染试剂与200 μL Opti-MEMTM无血清培养基混合,室温孵育5 min。将稀释后的siRNA与稀释后的DharmaFECTTM1转染试剂混合,室温孵育20 min。每孔加入400 μL siRNA与DharmaFECTTM1转染试剂混合液混匀,24 h后更换为完全培养基,72 h后收集细胞进行后续实验。

表1 3种Ran siRNA和NC siRNA序列信息
3. 蛋白质印迹法检测siRNA干扰效率:收集细胞,提取总蛋白行蛋白定量,变性,行SDS聚丙烯酰胺凝胶电泳,转膜,非特异封闭,加入Ran单克隆抗体(滴度 1∶2 000)4 ℃孵育过夜,洗膜后加入二抗(滴度 1∶4 000),室温孵育,ECL显影,灰度分析,筛选最佳siRNA干扰序列。实验重复3次。
4. 流式细胞仪检测细胞凋亡:将筛选出的siRNA序列按优化浓度再次转染HCT116、DLD-1细胞(实验步骤同前),72 h后离心消化,PBS清洗2遍,采用流式细胞仪检测细胞凋亡情况,操作步骤参照试剂盒说明书。实验重复3次。
5. 蛋白质印迹法检测caspase-3、PARP表达变化:将筛选出的siRNA序列按优化浓度再次转染DLD-1细胞(实验步骤同前),72 h后离心消化,收集细胞提取总蛋白,以蛋白质印迹法检测caspase-3、PARP表达(实验步骤同前)。
三、统计学分析
结 果
一、Ran siRNA对HCT116、DLD-1细胞Ran表达的抑制效率
siRNA转染HCT116、DLD-1细胞后,20、40、60 nmol/L si-1、si-2、si-3组的Ran蛋白表达水平均显著低于NC组(P<0.05 ),其中以20 nmol/L si-1、si-2组的抑制效果最佳,抑制率均>50%,显著高于其他浓度组以及si-3组(P均<0.01)(图1、图2)。故选择20 nmol/L siRNA-1、siRNA-2进行后续实验。
二、Ran siRNA对HCT116、DLD-1细胞凋亡的影响
NC组、si-1组、si-2组HCT116细胞早期凋亡率分 别为4.83%±1.72%、19.37%±7.57%和 21.10%±13.46%,si-1组早期凋亡率较NC组显著增加(P<0.05);三组晚期凋亡率分别为6.40%±1.05%、15.97%±3.31%和16.33%±5.40%,si-1组、si-2组晚期凋亡率均较NC组显著增加(P<0.05)(图3)。
NC组、si-1组、si-2组DLD-1细胞早期凋亡率分别为6.27%±3.13%、16.53%±3.38%和10.57%±0.85%,si-1组早期凋亡率较NC组显著增加(P<0.05);三组晚期凋亡率分别为6.20%±0.98%、22.93%±1.57%和11.50%±0.70%,si-1组、si-2组晚期凋亡率均较NC组显著增加(P<0.01)(图4)。
三、Ran siRNA对DLD-1细胞caspase-3、PARP表达的影响
si-1组、si-2组DLD-1细胞与NC组相比,未被切割的caspase-3(非活性形式,位于35 kDa处)表达无明显变化,被切割的caspase-3(活性形式, 位于17 kDa和19 kDa处)表达水平显著升高。si-1组、si-2组DLD-1细胞与NC组相比,未被切割的PARP(活性形式,位于116 kDa处)表达有所下降,被切割的PARP(非活性形式,位于89 kDa处)表达水平显著升高(图5)。

*P<0.05, **P<0.01
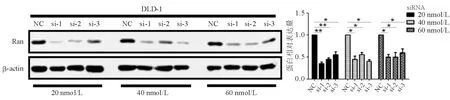
*P<0.05, **P<0.01

*P<0.05, **P<0.01
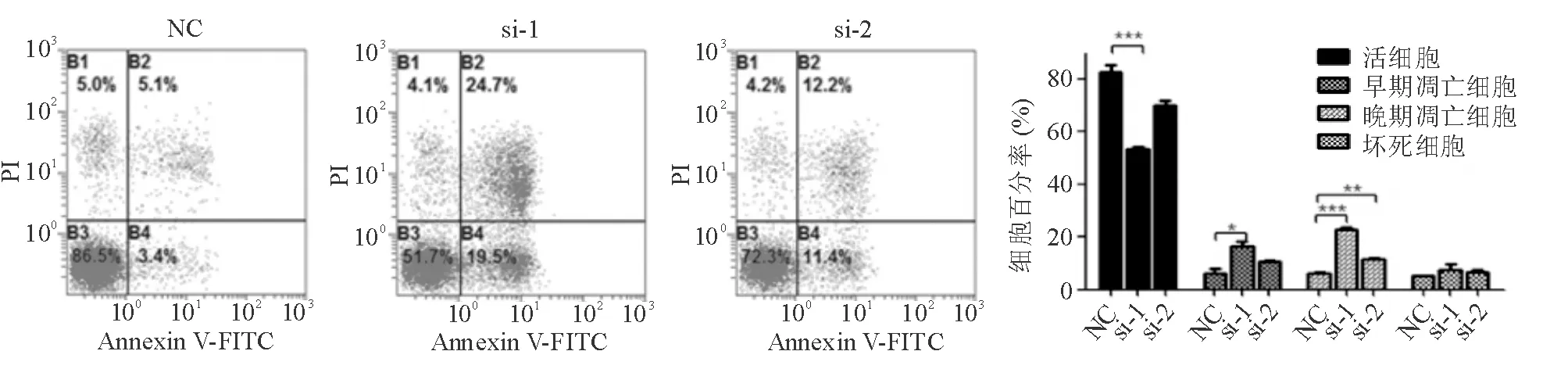
*P<0.05, **P<0.01,***P<0.001
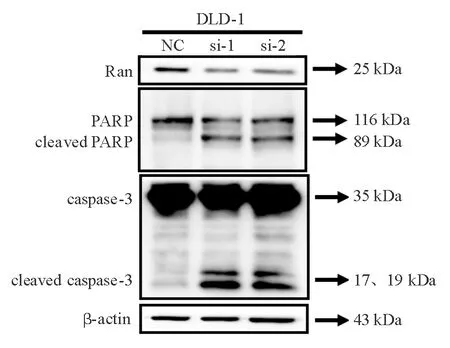
图5 Ran siRNA对DLD-1细胞caspase-3、PARP蛋白表达 的影响(蛋白质印迹法)
讨 论
细胞凋亡涉及一系列基因的激活和表达调控。Caspases家族是细胞凋亡过程中的关键元件,其激活和异常表达均可引起细胞凋亡。Caspases家族成员按其在凋亡中发挥的作用可分为启动型、效应型和炎症型三种类型。Caspase-3属于效应型,正常情况下,胞质中的caspase-3以无活性的酶原形式存在,当细胞发生凋亡时,caspase-3被启动型caspases切割成小片段,成为有活性的caspase-3,进而剪切细胞骨架蛋白和核蛋白,如PARP、DNA裂解因子(DNA fragmentation factor, DFF)、核纤层蛋白A(lamin A)等。PARP属于DNA修复酶,与DNA修复、基因完整性有关,是caspase-3最主要的切割底物。细胞凋亡发生时,PARP被剪切成小片段,不能发挥正常功能,导致DNA裂解,细胞凋亡[18]。本研究结果表明,以siRNA抑制Ran表达后,结肠癌细胞株HCT116、DLD-1细胞凋亡明显增多;进一步的研究发现,细胞中被切割的caspase-3和被切割的PARP表达水平均显著升高,提示抑制Ran表达可通过诱导caspase-3活化和PARP失活促进结肠癌细胞发生凋亡。
目前关于下调Ran引起细胞凋亡的机制尚未明确,相关研究数量有限。Yuen等[13]的研究发现,快速生长的肿瘤细胞在Ran下调后更易发生凋亡,可能与PI3K/Akt/mTORC1、Ras/MEK/ERK通路激活有关。Ran下调可影响细胞的核质转运过程,导致转录因子核质定位异常,进而影响特定基因的转录和表达,最终导致肿瘤细胞恶性表型发生。Schnepp等[15]的研究表明,LIN28B可作为Ran mRNA的结合蛋白促进Ran转录和翻译,进而引起肿瘤细胞功能改变。此外,Guvenc等[19]的研究发现,Ran对细胞凋亡的调控机制与存活素(survivin)表达下调有关,survivin 表达下调可导致凋亡抑制蛋白表达下调,促进caspase-3激活,从而引起细胞凋亡。
综上所述,本研究结果显示,沉默Ran基因可通过诱导caspase-3活化和PARP失活促进结肠癌细胞发生凋亡。这一发现为临床治疗结肠癌提供了新思路,但下调Ran引起肿瘤细胞凋亡的调控机制仍需进一步研究。
1 樊代明,张学庸,陈希陶,等. 结肠癌单克隆抗体MC3、5、7、10的制备及其相应抗原免疫组化定位的研究[J]. 细胞与分子免疫学杂志, 1986 (3): 19-24.
2 樊代明,张学庸,陈希陶,等. 抗结肠癌细胞单克隆抗体的制备及相应抗原免疫组化鉴定[J]. 第四军医大学学报, 1988, 9 (2): 74-77.
3 He FT, Nie YZ, Chen BJ, et al. Expression and identification of recombinant soluble single-chain variable fragment of monoclonal antibody MC3[J]. World J Gastroenterol, 2002, 8 (2): 258-262.
4 Lu Y, Wang X, Liu Z, et al. Identification and distribution of thioredoxin-like 2 as the antigen for the monoclonal antibody MC3 specific to colorectal cancer[J]. Proteomics, 2008, 8 (11): 2220-2229.
5 Sadek CM, Jiménez A, Damdimopoulos AE, et al. Characterization of human thioredoxin-like 2. A novel microtubule-binding thioredoxin expressed predominantly in the cilia of lung airway epithelium and spermatid manchette and axoneme[J]. J Biol Chem, 2003, 278 (15): 13133-13142.
6 Lu Y, Zhao X, Li K, et al. Thioredoxin-like protein 2 is overexpressed in colon cancer and promotes cancer cell metastasis by interaction with ran[J]. Antioxid Redox Signal, 2013, 19 (9): 899-911.
7 Matsuura Y. Mechanistic insights from structural analyses of Ran-GTPase-driven nuclear export of proteins and RNAs[J]. J Mol Biol, 2016, 428 (10 Pt A): 2025-2039.
8 Lui K, Huang Y. RanGTPase: A key regulator of nucleocytoplasmic trafficking[J]. Mol Cell Pharmacol, 2009, 1 (3): 148-156.
9 Kalab P, Heald R. The RanGTP gradient - a GPS for the mitotic spindle[J]. J Cell Sci, 2008, 121 (Pt 10): 1577-1586.
10 Fan H, Lu Y, Qin H, et al. High Ran level is correlated with poor prognosis in patients with colorectal cancer[J]. Int J Clin Oncol, 2013, 18 (5): 856-863.
11 Deng L, Lu Y, Zhao X, et al. Ran GTPase protein promotes human pancreatic cancer proliferation by deregulating the expression of Survivin and cell cycle proteins[J]. Biochem Biophys Res Commun, 2013, 440 (2): 322-329.
12 范红伟,卢瑗瑗,吴琼,等. Ran在胃癌中的表达及其临床意义[J]. 现代生物医学进展, 2012, 12 (8): 1490-1494.
13 Yuen HF, Chan KK, Grills C, et al. Ran is a potential therapeutic target for cancer cells with molecular changes associated with activation of the PI3K/Akt/mTORC1 and Ras/MEK/ERK pathways[J]. Clin Cancer Res, 2012, 18 (2): 380-391.
14 Cáceres-Gorriti KY, Carmona E, Barrès V, et al. RAN nucleo-cytoplasmic transport and mitotic spindle assembly partners XPO7 and TPX2 are new prognostic biomarkers in serous epithelial ovarian cancer[J]. PLoS One, 2014, 9 (3): e91000.
15 Schnepp RW, Khurana P, Attiyeh EF, et al. A LIN28B-RAN-AURKA Signaling Network Promotes Neuroblastoma Tumorigenesis[J]. Cancer Cell, 2015, 28 (5): 599-609.
16 Ning J, Liu W, Zhang J, et al. Ran GTPase induces EMT and enhances invasion in non-small cell lung cancer cells through activation of PI3K-AKT pathway[J]. Oncol Res, 2013, 21 (2): 67-72.
17 Deng L, Shang Y, Guo S, et al. Ran GTPase protein promotes metastasis and invasion in pancreatic cancer by deregulating the expression of AR and CXCR4[J]. Cancer Biol Ther, 2014, 15 (8): 1087-1093.
18 Budihardjo I, Oliver H, Lutter M, et al. Biochemical pathways of caspase activation during apoptosis[J]. Annu Rev Cell Dev Biol, 1999, 15: 269-290.
19 Guvenc H, Pavlyukov MS, Joshi K, et al. Impairment of glioma stem cell survival and growth by a novel inhibitor for Survivin-Ran protein complex[J]. Clin Cancer Res, 2013, 19 (3): 631-642.
(2016-11-08收稿;2016-12-14修回)
Effect of Silencing Ran Gene by siRNA on Apoptosis and Expressions of Caspase-3 and PARP in Colon Cancer Cell Lines
WANGXin,GENGLei,SUNLina,SUNLihui,LUYuanyuan,WANGXin.
XijingHospitalofDigestiveDiseases&StateKeyLaboratoryofCancerBiology,theFourthMilitaryMedicalUniversity,Xian(710032)
Background: Colon cancer is one of the common malignant tumors of digestive system. In our previous study, it has been demonstrated that colon cancer specific antigen thioredoxin like-2b (Txl-2b) can interact with Ras-related nuclear protein (Ran). However, there are few reports about the role and mechanism of Ran in tumorigenesis of colon cancer. Aims: To investigate the effect of Ran-targeting RNA interference on apoptosis and expressions of caspase-3 and poly(ADP-ribose) polymerase (PARP) in colon cancer cell lines.Methods: 20, 40 and 60 nmol/L siRNA-1 (si-1 group), siRNA-2 (si-2 group), siRNA-3 (si-3 group) targeting to Ran gene and normal control siRNA (NC group) were transfected into colon cancer cell line HCT116 and DLD-1, respectively. The interference efficiency of siRNAs and expressions of caspase-3 and PARP were detected by Western blotting. Cell apoptosis was determined by flow cytometry. Results: 20 nmol/L siRNA-1 and siRNA-2 had the best effect on inhibiting expression of Ran. Early apoptosis rates of HCT116 and DLD-1 cells in si-1 group were significantly higher than those in NC group (19.37%±7.57%vs. 4.83%±1.72%; 16.53%±3.38%vs. 6.27%±3.13%;Pall <0.05). Late apoptosis rates of HCT116 and DLD-1 cells in si-1 and si-2 groups were significantly higher than those in NC group (15.97%±3.31%, 16.33%±5.40%vs. 6.40%±1.05%; 22.93%±1.57%, 11.50%±0.70%vs. 6.20%±0.98%;Pall <0.05). Compared with NC group, expressions of cleaved caspase-3 (active form) and cleaved PARP (inactive form) were significantly increased in DLD-1 cells of si-1 and si-2 groups. Conclusions: Silencing Ran gene can significantly promote the apoptosis of colon cancer cells, and its mechanism is related to the regulation of caspase-3 and PARP expression.
Colonic Neoplasms; Ras-Related Nuclear Protein; RNA, Small Interfering; Apoptosis; Caspase 3; Poly(ADP-ribose) Polymerases
10.3969/j.issn.1008-7125.2017.03.003
国家自然科学基金(81272650、81472701、81572929)
