软枣猕猴桃与中华猕猴桃功能成分比较研究
2017-04-06祝儒刚孙艳頔范俊岗刘怡菲
祝儒刚,孙艳頔,陈 罡,范俊岗,刘怡菲
(1.辽宁大学 生命科学院,辽宁 沈阳 110036; 2.辽宁大学 轻型产业学院,辽宁 沈阳110036; 3.辽宁省林业科学研究院,辽宁 沈阳 110036)
软枣猕猴桃与中华猕猴桃功能成分比较研究
祝儒刚2,孙艳頔1,陈 罡3,范俊岗3,刘怡菲3
(1.辽宁大学 生命科学院,辽宁 沈阳 110036; 2.辽宁大学 轻型产业学院,辽宁 沈阳110036; 3.辽宁省林业科学研究院,辽宁 沈阳 110036)
为开发利用野生软枣猕猴桃资源,以吉林地区野生软枣猕猴桃和中华猕猴桃为材料,采用液相色谱法、紫外分光光度计法以及火焰原子吸收法对其功能成分进行了比较研究.结果表明,软枣猕猴桃多糖含量为8.85 mg·g-1,是中华猕猴桃的4倍;软枣猕猴桃黄酮含量为4.28 mg·g-1,是中华猕猴桃的7.6倍;软枣猕猴桃Vc含量为1.34 mg·g-1,略高于中华猕猴桃.软枣猕猴桃的Fe、Mn、Zn和Ca元素含量分别为3.45,0.26,0.85和24.7 μg/g,均远高于中华猕猴桃.
软枣猕猴桃;中华猕猴桃;功能成分;比较研究
0 引言
猕猴桃,又称奇异果,属猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl).猕猴桃分布广泛,我国是优势主产区,产地主要集中在秦岭以南和横断山脉以东的大陆地区,共有52种以上[1].猕猴桃被称为“水果之王”[2],质地柔软,口感酸甜,富含Vc、三萜类和黄酮类化合物、多糖、有机酸以及多种矿物元素,其生物活性成分具有抗肿瘤[3]、抗突变[4]、抗氧化[5]、免疫调节[6]以及保肝护肝[7]等生理功能,深受消费者喜爱.目前主要商业栽培的种类是中华猕猴桃(ActinidiachinensisPlanch),其果大,肉质细嫩、风味独特.软枣猕猴桃(ActinidiaargutaPlanch)又叫软枣子,是中国特有的、分布最广泛的野生水果之一,其果实甜美可口,具有滋补强身、生津润肺、抗衰老,抗病毒,抗艾滋病和调节免疫机能的功效,因此对软枣猕猴桃产后的加工利用越来越受到人们极大的关注[8].猕猴桃果实可以酿酒[9]、可以制作果脯、果醋[10],其根部具有医药价值[11].本研究以软枣猕猴桃和中华猕猴桃为材料,比较研究了其果实中多糖、黄酮、Vc和微量元素Fe、Mn、Zn、Ca的含量,意在为猕猴桃的开发利用提供有价值的理论依据.
1 仪器与试剂
1.1 材料
野生软枣猕猴桃(产地:吉林磐石);中华猕猴桃(市售)
1.2 试剂
无水乙醇、苯酚、浓硫酸、亚硝酸钠、硝酸铝、氢氧化钠和草酸等为分析纯,甲醇为色谱纯,硝酸为优级纯,均购于沈阳国药集团.葡萄糖标准品和芦丁标准品购于沈阳森宇生物科技有限公司.
1.3 仪器
旋转蒸发仪(郑州长城科工贸有限公司);UV2550紫外分光光度计(日本岛津);1525高效液相色谱仪(美国WATERS); Z-2000原子吸收分光光度计(日本日立高科技贸易有限公司);DK-S26恒温水浴锅(上海精宏).
2 方法
2.1 多糖的提取与测定
软枣猕猴桃和中华猕猴桃果实中多糖的提取采用水提醇沉法,并用苯酚硫酸法在490 nm处进行多糖含量的测定[12].
2.1.1 标准曲线制作
精确称取葡萄糖标准品20 g,100 mL容量瓶定容,既得到浓度为0.20 mg/mL的标准品溶液.精确吸取标准品溶液0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mL于试管中,分别用蒸馏水补至1 mL,加入6%的苯酚溶液2.0 mL,混匀,加入浓硫酸10 mL,静置10分钟,摇匀,80 ℃水浴20分钟,冷却至室温.另取蒸馏水1mL,同法制备空白对照,在490 nm处测量吸光度,制作标准曲线.
2.1.2 样品含量的测定
将软枣猕猴桃和中华猕猴桃制成果浆,分别称取2 g,按1∶15的料液比在70 ℃水浴中提取4小时,过滤,用旋转蒸发仪浓缩至原体积五分之一,加无水乙醇至80%进行醇沉.取滤渣,干燥,加蒸馏水溶解,定容于100 mL容量瓶,既得供试品溶液.取1 mL提取液按2.1.1方法在490 nm处测吸光度.通过标准曲线,计算样品中多糖含量[13].
2.2 总黄酮含量的测定
利用醇提法提取黄酮类化合物,用分光光度法,建立芦丁浓度-吸光度关系的回归方程.通过查标准曲线,计算猕猴桃中总黄酮的含量[14].
2.2.1 标准曲线制作
称取芦丁标准品20 g, 50 mL容量瓶定容,既得到浓度为0.20 mg/mL的芦丁标准品溶液.分别取0、1、2、3、4、5 mL芦丁标准品溶液置于比色管中,加70%乙醇至10 mL,加入1 mL质量浓度为5%的NaNO2,摇匀,静置6分钟,加入1 mL10%的Al(NO3)·6H2O,摇匀,静置6分钟,加入4%的NaOH 10 mL,以70%乙醇定容至25 mL,静置15分钟,在510 nm处测定吸光度,绘制标准曲线.
2.2.2 样品含量的测定
软枣猕猴桃和中华猕猴桃鲜果洗净,吸干表面水分,软枣猕猴桃直接匀浆,中华猕猴桃去皮后匀浆.分别取10 g于100 mL烧杯中,加入4倍体积70%乙醇混合均匀,270 W功率超声6分钟,60 ℃水浴40分钟.提取物混合液在4 ℃条件下10 000 r/min离心15分钟,上清液即为软枣猕猴桃和中华猕猴桃黄酮的粗提液.取1 mL黄酮粗提液置于比色管中,按照2.2.1的方法测定510 nm处的吸光度.通过标准曲线,计算出样品中总黄酮的含量.
2.3 Vc含量的测定
2.3.1 Vc标准液的制备
甲醇使用前经0.45 μm滤膜过滤.配制0.1%的草酸溶液,用0.45 μm滤膜过滤.称取Vc标准品100 mg 于小烧杯中,用0.1%的草酸溶解, 转移至100 mL棕色容量瓶中,得到1 000 μg/mL的标准液.
2.3.2 样品处理
将软枣猕猴桃和中华猕猴桃榨汁,分别取鲜果汁5 g,用0.1%的草酸定容至25 mL容量瓶,过0.45 μm滤膜,待分析测定.
2.3.3 标准曲线和样品含量测定
色谱条件:色谱柱(C18);流动相(0.1%的草酸),流速为1.0 mL/min;检测波长为254 nm;进样量为5 μL;柱箱温度为30 ℃[15].
将Vc标准液稀释为100、200、300、400、500 μg/mL的系列标准工作液,按上诉色谱条件测定吸收峰面积,样品同法.以峰面积为纵坐标,浓度为横坐标绘制标准曲线,并从曲线上查出待测样品的实际浓度[16-17].
2.4 微量元素含量的测定
2.4.1 样品处理
分别取软枣猕猴桃和中华猕猴桃去皮果浆5 g,置于250 mL的锥形瓶中,加入15 mL浓硝酸,静置,冷消解过夜.次日在电热板上依次使用低温、中温加热消解1小时,高温加热至无棕红色气体产生.取下样品,待冷却后加入5 mL超纯水,继续加热至无色,静置冷却,用5%硝酸将消解液定容于50 mL容量瓶.用5%硝酸作为空白对照溶液.
2.4.2 标准溶液配制
按照表1配制各元素的标准溶液.

表1 待测元素标准系列溶液
2.4.3 猕猴桃中待测元素含量的测定

表2 测试条件
按表2设置仪器最佳工作条件,用5% 稀硝酸溶液校零,分别将试剂空白、待测元素标准系列溶液、猕猴桃空白溶液和猕猴桃消解液直接导入火焰,测量其吸光度及猕猴桃消解液中待测元素的实际浓度,计算猕猴桃中Fe,Mn,Zn,Ca的含量[18].
3 结果与分析
3.1 多糖标准曲线回归方程及样品中多糖含量
按照方法2.1,以葡萄糖浓度为横坐标,以样品吸光度为纵坐标,绘制标准曲线如图1.回归方程为:y=6.300 3x+0.013 2,相关系数R2=0.999 0.
按照2.1所述方法,根据样品吸光度和样品稀释倍数计算出软枣猕猴桃多糖含量见表3,中华猕猴桃和软枣猕猴桃多糖含量分别为2.20 mg·g-1,8.85 mg·g-1.
3.2 黄酮标准曲线回归方程及样品中总黄酮含量
按照方法2.2,以芦丁浓度为横坐标,样品吸光度为纵坐标,绘制标准曲线如图2,求得标准曲线回归方程为:y=6.300 3x+0.013 2相关系数R2=0.999.
按照2.2 所述方法根据样品吸光度计算出软枣猕猴桃总黄酮含量见表4,中华猕猴桃黄酮含量为0.56 mg·g-1,软枣猕猴桃黄铜含量为4.28 mg·g-1.

图1 多糖标准曲线

图2 黄酮标准曲线

品种OD值多糖含量/(mg·g-1)中华猕猴桃0290220软枣猕猴桃1128885
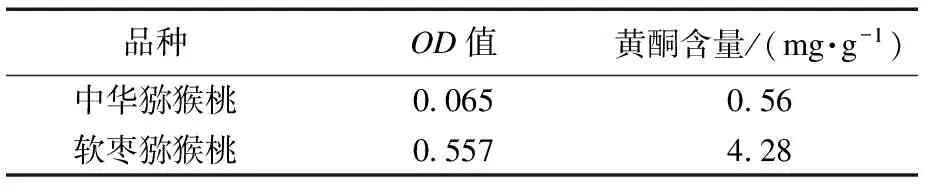
表4 猕猴桃黄酮含量
3.3 Vc标准曲线回归方程及样品中Vc含量
按照方法2.3,以Vc浓度为横坐标,样品吸光度为纵坐标,绘制标准曲线如图3,求得标准曲线回归方程为:y=10 200x+39 222相关系数R2=0.998 3.
按2.3色谱条件测定Vc标准液和软枣猕猴桃的色谱图见图4,图5.
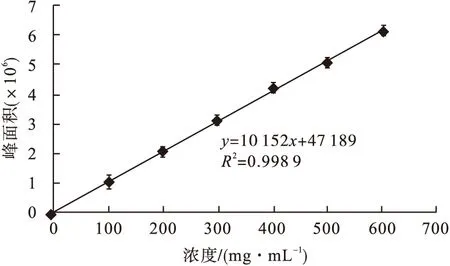
图3 Vc标准曲线

图4 Vc标准液高效液相色谱图
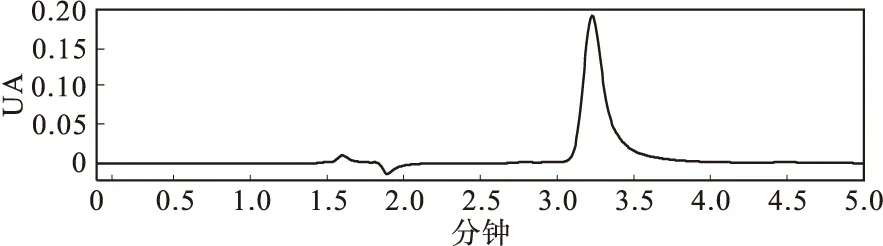
图5 软枣猕猴桃高效液相色谱图
按照2.3 所述方法根据样品吸收峰面积计算出软枣猕猴桃和中华猕猴桃Vc含量如表5:
3.4 样品中微量元素的含量
用火焰原子吸收光谱法测定软枣猕猴桃和中华猕猴桃中Fe,Mn,Zn,Ca元素的浓度,并计算出含量如表6.

表5 样品Vc含量

表6 样品中微量元素测定结果 单位:μg·g-1
4 结论与讨论
通过分析比较可知,软枣猕猴桃多糖含量为8.85 mg·g-1,中华猕猴桃多糖含量为2.2 mg·g-1,是中华猕猴桃的4倍.软枣猕猴桃总黄酮含量为4.28 mg·g-1,中华猕猴桃总黄酮含量为0.56 mg·g-1,是中华猕猴桃的7倍多.软枣猕猴桃总Vc含量为1.340 mg·g-1,中华猕猴桃总Vc含量为1.200 mg·g-1,软枣猕猴桃Vc含量略高于中华猕猴桃.软枣猕猴桃的Fe、Mn、Zn、Ca元素含量分别是5.256、1.507、1.143、127.615 μg·g-1,中华猕猴桃的Fe、Mn、Zn、Ca元素含量分别为3.452、0.259、0.845、24.701 μg·g-1,比较可知软枣猕猴桃的Fe含量显著高于中华猕猴桃,其Mn、Zn、Ca含量均在中华猕猴桃的5倍以上.所以软枣猕猴桃比中华猕猴桃的功能和营养成分含量更高,有广阔的市场前景和市场竞争能力.
在测定总黄酮的过程中本实验也尝试了丙酮提取法,但是经过多次试验都发现黄酮粗提液中存在一定量的棕绿色油性物质,影响最终的实验结果,经查阅文献表明其可能是猕猴桃籽油[19],具体还需要经过进一步的理化分析确定其成分.
虽然软枣猕猴桃的主要营养成分和微量元素均显著高于中华猕猴桃,但是还需对野生软枣猕猴桃的其他成分进行分析,与中华猕猴桃进行比较,才能确定软枣猕猴桃的营养价值是否高于中华猕猴桃.所以对野生软枣猕猴桃的其他成分有待进一步研究.
[1] 中国科学院中国植物志编辑委员会,中国植物志[M].北京:科学出版社,1984:261-263.
[2] Zuo L L,Wang Z Y,Fan Z L,et al.Evaluation of Antioxidant and Antiproliferative Properties of Three Actinidia(Actinidia kolomikta,Actinidiaarguta,Actinidiachinensis) Extracts in Vitro [J].International Journal of Molecular Sciences,2012,13(5):5506-5518.
[3] 钟振国,张凤芬,甄汉深,等.美味猕猴桃根提取物抗肿瘤作用的实验研究[J].中医药学刊,2004,22(9):1705-1707.
[4] Du G R.,Li M J,Ma F W,et al.Antioxidant capacity and relationship with polyphenol and Vitamin C in Actinidia fruits[J].Food Chemistry,2009,113:557-562.
[5] 刘长江,潘松,梁爽.软枣猕猴桃多糖的体外抗氧化活性[J].食品科学,2012,33(23):79-82.
[6] 李香华,王鸿翔,赵爱明,等.补充猕猴桃饮料对大强度运动后机体免疫机能影响的观察[J].中国运动医学杂志,2003,22(2):187-188.
[7] 李丽,钟振国,梁洁,等.美味猕猴桃根提取物对小鼠急性肝损伤的保护作用[J].时珍国医国药,2007,18(3):封3.
[8] Lee J,Sownd K,Kim M,et al.Antioxidant,inhibition of α-glucosidase and suppression of nitric oxide production in LPS-induced murine macrophages by different fractions ofActinidiaargutastem[J].Saudi Journal of Biological Sciences,2014,21(6):532-538.
[9] 徐清萍,朱广存.野生猕猴桃干酒酿造工艺[J].食品科学,2010,37(24):484-487.
[10] 徐清萍,朱广存.野生猕猴桃醋发酵工艺的研究[J].中国调味品,2012,37(10):60-63.
[11] 饶敏,吴宁,李红梅,等.野生猕猴桃根水煎液对人胃癌细胞的抑制作用及机制[J].山东医药,2012,52(1):37-38.
[12] 潘松,刘长江,梁爽.软枣猕猴桃多糖的分离与纯化及其分子质量的测定[J].食品科学,2012,33(15):66-70.
[13] 单云岗,陈锡林,傅跃青.野生猕猴桃多糖提取工艺研究[J].浙江中医杂志,2015,50(2):146-147.
[14] 孙宁宁.长白山野生软枣拂猴桃的成分分析及保鲜研究[D].长春:吉林农业大学,2007.
[15] Guo X B,Liu R H,Fu X Q,et al.Over-expression of l-galactono-c-lactone dehydrogenase increasesvitamin C,total phenolics and antioxidant activity in lettucethrough bio-fortification[J].Plant Cell Tiss Organ Cult,2013,114:225-236.
[16] 董珊,姜波,刘长建,等.猕猴桃中维生素C的高效液相色谱分析[J].中央民族大学学报,2010,19(3):21-24.
[17] 杨巍,王柏松,刘晶,等.液相色谱法测定猕猴桃果实中抗坏血酸含量的前处理技术优化[J].食品科学,2015,36(20):163-167.
[18] 蒋天智,柴东方.野生猕猴桃的微量元素研究[J].凯里学院学报,2014,32(6):53-55.
[19] 姚茂君.猕猴桃籽油不同提取方法的比较研究[J].食品科学,2006,27(10):242-244.
(责任编辑 李 超)
Comparative Study of Functional Ingredients inActinidiaargutaand Chinese Gooseberry
ZHU Ru-gang2,SUN Yan-di1,CHEN Gang3,FAN Jun-gang3,LIU Yi-fei3
(1.SchoolofLifeScience,LiaoningUniversity,Shenyang110036,China;2.SchoolofLightIndustry,LiaoningUniversity,Shenyang110036,China;3.Forestryscienceresearchinstituteofliaoningprovince,Shenyang110036,China)
For the development and utilization of wildActinidiaargutaPlanch resource,this paper taked wildActinidiaargutain Jilin andActinidiachinensisas raw materials,using liquid chromatography(HPLC),ultraviolet spectrophotometer,and the method of flame atomic absorption functional component carried on the comparative study.The results showed that the polysaccharide content ofActinidiaargutawas 8.85 mg·g-1,four times that of Actinidia Chinensis Planch,and flavonoids content was 4.28 mg·g-1,7.6 times of theActinidiachinensisPlanch.VC content inActinidiaargutawas 1.34 mg·g-1,higher than that ofActinidiachinensisPlanc.ActinidiaargutaPlanch of Fe,Mn,Zn,Ca element content was 3.45,0.26,0.85 and 24.7 μg/g,was much higher than theActinidiachinensisPlanch.
actinidia chinensis planch;actinidia arguta planch;functional components;comparative study
2016-07-18
国家自然科学基金青年项目(31301424);辽宁省教育厅科学研究一般项目(L2013008);辽宁大学博士启动基金
祝儒刚(1980-),男,博士,副教授,从事食品科学与分子营养学研究,E-mail:276284386@qq.com.
Q 949.91
A
1000-5846(2017)01-0059-06
