注射白斑综合征病毒对克氏原螯虾酚氧化酶活力的影响
2017-04-06李贺水
李贺水,曾 勇,栾 青
(烟台大学生命科学学院,山东烟台 264005)
注射白斑综合征病毒对克氏原螯虾酚氧化酶活力的影响
李贺水,曾 勇,栾 青
(烟台大学生命科学学院,山东烟台 264005)
将白斑综合征病毒(white spot syndrome virus, WSSV)、嗜水气单胞菌(Aeromonashydrophila, Ah)、大肠杆菌(Escherichiacoli)(DH5α)用注射法接种克氏原螯虾(Procambarusclarkii),在0~72 h之间定时检测克氏原螯虾血细胞和肝胰脏中酚氧化酶(Phenoloxidase, PO)活力变化。结果显示:(1)0.1 mg/mL和1 mg/mL胰蛋白酶处理样品后,样品间差异不显著。(2)加胰蛋白酶处理与未加胰蛋白酶相比,供试克氏原螯虾PO活力均升高。(3)未加胰蛋白酶与加胰蛋白酶表现出相似的特征,WSSV和Ah注射组与对照组相比均表现为,12~48 h PO活力显著高于对照组,并且在48 h达到最大值,72 h时基本恢复正常;注射DH5α组与对照组相比没有显著性变化。可见感染WSSV后,克氏原螯虾体内酚氧化酶活力发生了变化,由此推测,PO参与了螯虾体内抵御病毒的免疫反应。
白斑综合征病毒;嗜水气单胞菌(Aeromonashydrophila);大肠杆菌(Escherichiacoli);克氏原螯虾(Procambarusclarkii);酚氧化酶活力
克氏原螯虾(简称螯虾),又称小龙虾,其养殖方式多样,为人们带来的经济、社会和生态效益日渐明显,已成为我国的重要水产经济养殖品种。但是,近年来病毒、细菌、真菌等微生物引起的传染性疾病,影响螯虾的养殖产业[1]。甲壳动物不具备特异性免疫的B细胞和T细胞,缺乏获得性免疫,具有抵抗病原微生物的天然免疫系统,包括免疫器官细胞性防御系统和体液性防御系统,免疫机制包括表皮上抗菌肽的大量表达、吞噬作用、包囊作用、结节形成、外源凝集素的分泌及酚氧化酶原系统产生的黑化作用等[2]。其中酚氧化酶原激活系统(prophenoloxidase activating system, proPO-AS)是一个由酚氧化酶原(prophenoloxidase, proPO)、酚氧化酶(phenoloxidase, PO)、丝氨酸蛋白酶[3]、模式识别受体和蛋白酶抑制剂等构成的一个复杂的级联反应,类似于脊椎动物补体激活系统,在甲壳动物的防御和识别功能中起重要作用。现有研究表明,proPO系统中的免疫因子以非活化的状态存在于血细胞中,当受到病原刺激后被释放到血淋巴中,在酚氧化酶原激活酶(prophenoloxidase activating enzyme, ppA)作用下成为能产生黑化作用的PO,通过血细胞吞噬作用、包裹作用和结节形成等多种方式参与抵御病原的反应中[4-6]。因此,PO活力的变化可作为衡量甲壳动物机体免疫功能强弱的常用指标[7]。
proPO系统在抵抗细菌性疾病中的作用已有直接报道[8]。然而,白斑综合征病毒(white spot syndrome virus, WSSV)对甲壳动物PO活力的影响有不同的报道[9-12]。Seajeng等[9]研究印度谷螟(Plodiainterpunctella)感染印度谷螟颗粒体病毒(Plodiainterpunctellagranulosis virus, PiGV)后,通过实时监测血细胞中PO的活力,发现实验组与对照组均无明显差异。Sarathia等[10]用WSSV感染印度明对虾(Penaeusindicus),发现实验组血细胞中的PO活力明显高于对照组。何建国的研究团队和Lai等在基因水平上诠释了WSSV感染南美白对虾(Penaeusvannamei)后,抑制了酚氧化酶原基因的表达[11,12]。同时,著名甲壳动物免疫学家Söderhäll 的团队多次撰文阐述proPO系统在无脊椎动物免疫防御中的功能[13, 14],指出该系统在无脊椎动物防御细菌及真菌的感染中具有重要功能。但是,该团队在综述甲壳动物的抗病毒免疫机制中并未提及proPO系统的作用[15]。因此,甲壳动物感染WSSV后,其体内PO活力的变化以及proPO系统的作用仍需进一步研究。
螯虾的ppA以非活力形式(酚氧化酶原激活酶原,proppA)存在于血细胞中,Ca2+和其他诱导物能激活proppA使之成为有活力的ppA,随后可以通过蛋白水解作用将76 ku的proPO裂解为60与62 ku的两个PO,实验中商品化的胰蛋白酶裂解proPO生成60 ku具有PO活力的酶分子[5]。因此,本实验选用胰蛋白酶诱导激活proPO。
本文以螯虾为实验材料,选用WSSV为研究对象,以嗜水气单胞菌(Aeromonashydrophila, Ah)和大肠杆菌(DH5α)为参照物,对螯虾进行免疫注射。初步研究螯虾在注射以上微生物0~72 h之间PO活力的变化规律,PO活力测定时分别用两种方法,第一种方法,不加胰蛋白酶,检测样品中原有PO活力;第二种方法,加胰蛋白酶处理,激活酚氧化酶原,检测样品中总的酚氧化酶活力。
1 材料与方法
1.1 实验材料
本实验螯虾(17.3±1.8)g采购于烟台市九佃水产市场,无伤残且有活力。在24 ℃的水族箱里暂养7 d后,选取健康存活的螯虾用于本实验。实验用致病性嗜水气单胞菌是本实验室于螯虾中分离鉴定并保存的菌株,菌株号AH-3。WSSV是本实验室从螯虾中分离鉴定并保存的毒株08HB[12]。大肠杆菌DH5α购于上海生工生物工程有限公司,该菌株是非致病菌株。
1.2 实验方法
WSSV的感染:分别取经检测不携带毒株的螯虾和实验室保存的携带WSSV的螯虾腮部0.2 g,研磨后用PBS缓冲液稀释到1 mL,离心(6 000 r/min, 4 ℃, 5 min),保留上清。取60只健康存活的螯虾,平均分成两组,对照组腹部注射0.1 mL健康螯虾的腮组织研磨后制取的上清;实验组腹部注射0.1 mL含WSSV的上清。水族箱饲养,定时采样。
细菌感染:取90只健康存活的螯虾,平均分成三组,一个对照组,两个实验组。对照组注射0.1 mL PBS缓冲液,实验组注射0.1 mL含细菌(嗜水气单胞菌或大肠杆菌)2.8×106CFU的PBS缓冲液。水族箱饲养,定时采样。
自注射攻毒液的0、6、12、24、48、72 h,每个时间点取5尾虾,用含有500 μL抗凝剂(抗凝剂组成0.14 mol/L NaCl; 0.1 mol/L 葡萄糖;30 mmol/L 柠檬酸;20 mmol/L 柠檬酸钠;10 mmol/L EDTA;pH 4.6)的5 mL无菌注射器自虾头胸甲后插入围心腔吸取血淋巴至1 mL,置于1.5 mL的Eppendorf中,摇匀,离心(6 000 r/min, 4 ℃, 10 min),上清液即为血浆,底部即为血细胞,沉淀中加200 μL PBS缓冲液,清洗血细胞表面余留的抗凝剂和血浆,离心(6 000 r/min, 4 ℃, 5 min),去除上清液,加入40 μL超纯水(4 ℃),冰上操作,用研磨棒破碎细胞,离心(6 000 r/min, 4 ℃, 2 min),上清液即为血细胞内容物,-80 ℃保存用于PO活力的测定。同时取近尾端的肝胰脏,用灭过菌的研磨棒充分研磨后,加入500 μL PBS,离心(8 000 r/min, 4 ℃, 10 min),中间层即为肝胰脏提取液,-80 ℃保存用于PO活力的测定。
1.3 蛋白浓度的标定
用改良型Bradford法蛋白浓度测定试剂盒,稀释样品后,Bradford试剂和BSA标准蛋白结合使用,用酶标仪(680, Bio-Rad)测定在570 nm处的吸光度值,根据标准蛋白曲线计算血细胞和肝胰脏中蛋白质浓度。用超纯水稀释蛋白质浓度到同一水平,即1 mg/mL,-80 ℃保存用于PO活力的测定。
1.4 酚氧化酶(PO)活力测定
以L-多巴为底物,采用改进的Ashida等的方法,在96孔酶标板中进行PO活力测定,温度为20 ℃,pH为7.0。实验中PO的测定有三个处理,胰蛋白酶浓度分别为0 mg/mL、0.1 mg/mL、1 mg/mL。不加胰蛋白酶时,在96孔酶标板中加100 μL样品,100 μL PBS缓冲液和100 μL 0.01 mol/L的L-多巴溶液。加0.1 mg/mL的胰蛋白酶和加1 mg/mL的胰蛋白酶时,在96孔酶标板中加入10 μL样品,90 μL胰蛋白酶(0.1 mg/mL或1 mg/mL),100 μL PBS缓冲液,100 μL 0.01 mol/L的L-多巴溶液。在酶标仪(680, Bio-Rad)中震荡4次,20 ℃孵育,每隔2 min读取490 nm处的吸光值。酶的活力以实验条件下,D490 nm每分钟增加0.001为1个酶活力单位。
1.5 数据处理
实验数据用SPSS 13.0软件进行分析,采用One-Way ANOVA方法,组间差异都用LSD’s多重比较,最终以柱形图的形式表示,显著水平为0.05,极显著水平为0.01。
2 结果
2.1 不同的胰蛋白酶浓度对螯虾PO活力的影响
如图1所示,随机抽取同一时间段(每个时间段都含有5个平行实验)的实验组和对照组,提取肝胰脏和血细胞PO样品,在相同实验条件下,用胰蛋白酶浓度分别为0 mg/mL、0.1 mg/mL和1 mg/mL处理肝胰脏和血细胞。结果显示,与未加胰蛋白酶相比,加入胰蛋白酶后,肝胰脏和血细胞的PO活力均显著升高。胰蛋白酶浓度分别为0.1 mg/mL和1 mg/mL处理的PO活力变化不显著(P>0.05)。因此,本实验选用的胰蛋白酶浓度为0.1 mg/mL。
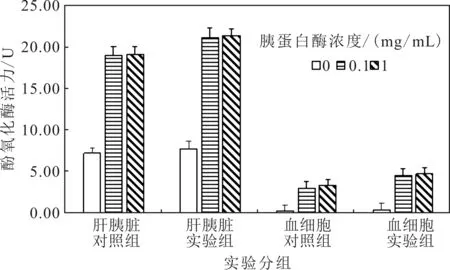
图1 胰蛋白酶对酚氧化酶活性的影响Fig.1 Effects of trypsin on the phenoloxidase activity
2.2 嗜水气单胞菌(Ah)和大肠杆菌(DH5α)注射对螯虾肝胰脏和血细胞中酚氧化酶(PO)活力的影响
如图2、图3所示,分别表示Ah和DH5ɑ注射时螯虾肝胰脏和血细胞中PO活力的变化。未加胰蛋白酶时,大肠杆菌(DH5α)注射组与对照组相比变化不显著(P>0.05);Ah实验组和对照组在0~6 h PO活力变化不显著(P>0.05),实验组在12~24 h PO活力显著(P<0.05)高于对照组,并在48 h极显著(P<0.01)高于对照组,72 h基本恢复对照组水平。胰蛋白酶(0.1 mg/mL)处理后,上述两组实验的对照组和实验组PO活力均升高,PO活力的变化趋势与未加胰蛋白酶处理时的相同。
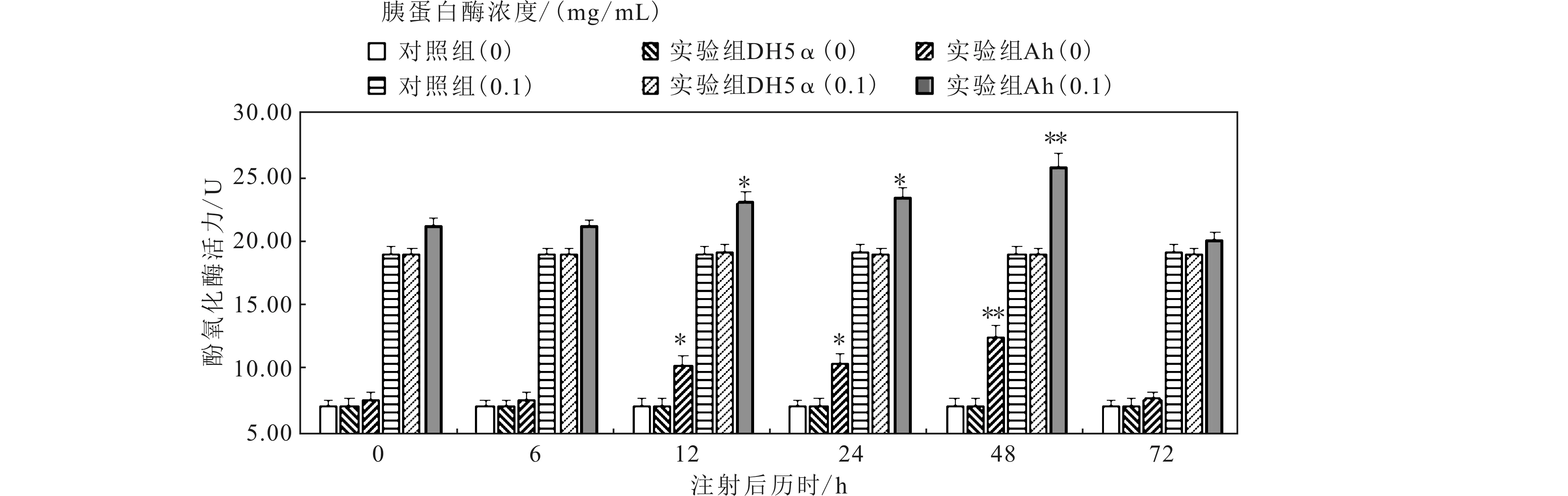
图2 Ah、DH5α 对肝胰脏酚氧化酶的影响Fig.2 Effects of Ah、DH5α on phenoloxidase activity of hepatopancreas*表示P<0.05即显著水平,**表示P<0.01即极显著水平,以下图中的表示方法与此相同。

图3 Ah、DH5α对血细胞酚氧化酶的影响Fig.3 Effects of Ah、DH5α on phenoloxidase activity of hemocyte
2.3 WSSV注射对螯虾PO活力的影响
如图4、图5所示,分别表示WSSV攻毒实验中螯虾肝胰脏和血细胞的PO活力的变化。WSSV实验组与Ah实验组PO活力的变化有类似的特征,未加胰蛋白酶时,对照组和实验组在0~6 h PO活力变化不显著(P>0.05),实验组在12~24 h PO活力显著(P<0.05)高于对照组,并在48 h极显著(P<0.01)高于对照组,72 h基本恢复对照组水平。胰蛋白酶(0.1 mg/mL)处理后,对照组和实验组PO活力均升高,PO活力的变化规律与未加胰蛋白酶处理时的相同。
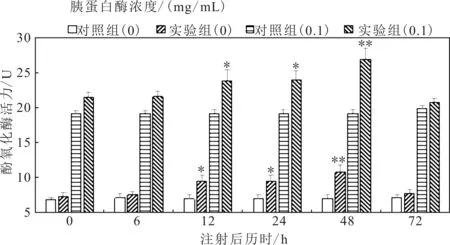
图4 WSSV对肝胰脏酚氧化酶的影响Fig.4 Effects of WSSV on phenoloxidase activity of hepatopancreas

图5 WSSV对血细胞酚氧化酶的影响Fig.5 Effects of WSSV on phenoloxidase activity of hemocyte
3 讨论
朱毅菲等[16]研究了螯虾体内PO活力的最适温度和pH,提出PO活力的最适温度为20 ℃,最适pH 7.0,该酶在20~40 ℃,pH 6.0~7.0时有较强的稳定性。参照以上实验结论,本实验测定PO活力时,温度为20 ℃,pH为7.0。
近年来,已有文章报道胰蛋白酶作为诱导剂,激活proPO发挥PO活力。Hopkins[17]的报道中用0.1 mg/mL的胰蛋白酶可以显著提高斑节对虾血细胞溶解产物的PO活力。李义[18]在研究中华绒螯蟹PO的性质时,发现1 mg/mL胰蛋白酶可将中华绒螯蟹血细胞的proPO全部转变成PO。可能不同的物种中proPO的含量不同,胰蛋白酶作为诱导剂时所需要的浓度不同。本实验分别用0.1 mg/mL和1 mg/mL胰蛋白酶处理实验样品,肝胰脏PO活力均由7.2 U/mL左右升高到22.2 U/mL左右;血细胞均由0.60 U/mL左右升高到3.35 U/mL左右。两种浓度处理组之间对PO活力变化不显著(P>0.05),本实验最终选择浓度为0.1 mg/mL的胰蛋白酶作为诱导剂,充分激活proPO,检测样品中总的PO活力。
大肠杆菌注射实验中,无论是否加胰蛋白酶处理,实验组与对照组的肝胰脏和血细胞的PO活力均无明显差异;Ah注射实验中,无论是否加胰蛋白酶处理,实验组的肝胰脏和血细胞的PO活力在12 h、24 h、48 h明显高于对照组,可见螯虾针对致病菌与非致病菌的免疫应答机制可能存在差异。Roos等[19]在研究淡水小龙虾(P.leniusculus)感染致病菌嗜水气单胞菌和非致病菌大肠杆菌时与本实验有相似的结论,文章显示实验虾针对两种外源细菌的免疫作用机制有差别。其感染非致病菌大肠杆菌后,许多扁平的血细胞组成结节结构,结节内部含有大量死细胞。在一些组织如虾腮、心脏、肝胰脏以及血窦中有类似的反应,从而能阻挡病原侵入机体;当感染致病菌嗜水气单胞菌后,实验虾体内并不产生以上免疫反应,致病菌在宿主体内产生细胞毒素并侵入宿主其他组织内,最终导致其死亡率增加。刘振兴等[20]在研究嗜水气单胞菌对螯虾免疫相关因子活力的影响时,不加胰蛋白酶处理,检测血细胞中PO活力,结果显示0 h样品的PO活力为0.27 U/mL左右,实验组样品在48 h达到最高值0.37 U/mL左右。本实验血细胞样品在不加胰蛋白酶时,0 h PO活力0.30 U/mL左右,最高值在48 h的实验组达到4.2 U/mL左右,数据上有差别,最高点的时间点是一致的,且表现出的变化趋势与本实验的结果相符。
在螯虾注射WSSV实验中,无论是否加胰蛋白酶处理,实验组的肝胰脏和血细胞的PO活力在12、24、48 h明显高于对照组,可见螯虾感染WSSV后,在一定时间内既能提高现有PO活力,又能提高proPO基因的表达,增加proPO的含量。在淡水小龙虾(P.leniusculus)中,通过注射dsRNA诱导RNAi抑制proPO的表达,实验虾明显易感染嗜水气单胞菌(A.hydrophila),死亡率上升[8]。可见螯虾感染Ah后,PO参与了螯虾抵抗病菌的免疫反应。本实验WSSV感染螯虾和Ah感染螯虾后,其体内PO活力的变化规律相同。由此推测螯虾感染WSSV后,其体内PO也参与了抗病毒的免疫反应。至今,甲壳动物感染WSSV后,PO活力测定的实验结果不同,可能与物种差异等因素有关。WSSV感染甲壳动物后,具体的免疫作用方式仍需进一步探索。
总之,本实验结果显示,嗜水气单胞菌和大肠杆菌感染螯虾后,PO变化规律不同,可见螯虾抵御致病菌和非致病菌的免疫机制不同。螯虾感染WSSV后,无论是否加胰蛋白酶处理,在一定时间内肝胰脏和血细胞的PO活力均显著高于对照组,且变化规律与感染Ah的相同,由此推测WSSV感染螯虾后,其体内PO活力发生变化,参与了抗病毒免疫防御过程。
[1] 相建海, 刘保忠. 重要海水养殖动物病害发生和免疫防治的基础研究[J]. 生命科学, 2007, (4): 396-398.
[2] Sritunyalucksana K, Söderhäll K. The proPO and clotting system in crustacean[J]. Aquaculture, 2000, 191(1-3): 53-69.
[3] 曾 勇, 王文超. 克氏原螯虾丝氨酸蛋白酶类似物部分基因的克隆与鉴定[J]. 淡水渔业, 2008, 38(5): 22-25.
[4] Jorge H L, Teresa G G, Silvia G J, et al. In the spiny lobster (Panulirusinterruptus) the prophenoloxidase is located in plasma not in haemocytes[J]. Fish Shellfish Immunol, 2003, 14(14): 105-14.
[5] Aspán A, Söderhäll K. Purification of prophenoloxidase from crayfish blood cells, and its activation by an endogenous serine proteinase[J]. Insect Biochem, 1991, 21(4): 363-373.
[6] Cerenius L, Söderhäll K. The prophenoloxidase-activating system in invertebrates[J]. Immunol Rev, 2004, 198: 116-126.
[7] Masuda T, Otomo R, Kuyama H, et al. A novel type of prophenoloxidase from the kuruma prawnMarsupenaeusjaponicuscontributes to the melanization of plasma in crustaceans[J]. Fish Shellfish Immunol, 2011, 32(1): 61-68.
[8] Liu H P, Jiravanichpaisal P, Cerenius L, et al. Phenoloxidase is an important component of the defense againstAeromonashydrophilainfection in a crustacean,Pacifastacusleniusculus[J] J Biol Chem, 2007, 282(46): 33593-33598.
[9] Saejeng A, Tidbury H, Siva-Jothy M T, et al. Examining the relationship between hemolymph phenoloxidase and resistance to a DNA virus,Plodiainterpunctellagranulosis virus (PiGV)[J]. J Insect Physiol, 2010, 56: 1232-1236.
[10] Sarathia M, Ishaq A V P, Venkatesana C, et al. Comparative study on immune response ofFenneropenaeusindicustoVibrioalginolyticusand white spot syndrome virus[J]. Aquaculture, 2007, 271: 8-20.
[11] Ai H S, Huang Y C, Li S D, et al. Characterization of a prophenoloxidase from hemocytes of the shrimpLitopenaeusvannameithat is down-regulated by white spot syndrome virus[J]. Fish Shellfish Immunol, 2008, 25:28-39.
[12] Lai C Y, Cheng W, Kuo C M. Molecular cloning and characterisation of prophenoloxidase from haemocytes of the white shrimp,Litopenaeusvannamei[J]. Fish Shellfish Immunol, 2005, 18: 417-430.
[13] Söderhäll K, Cerenius L. Role of the prophenoloxidase-activating system in invertebrate immunity[J]. Curr Opin Immunol, 1998, 10(1): 23-28.
[14] Cerenius L, Lee B L, Söderhäll K. The proPO-system: pros and cons for its role in invertebrate immunity[J]. Trends Immunol, 2008, 29(6): 263-271.
[15] Liu H, Söderhäll K, Jiravanichpaisal P. Antiviral immunity in crustaceans[J]. Fish Shellfish Immunol, 2009, 27(2): 79-88.
[16] 朱毅菲, 熊传喜, 王良发. 温度、pH对克氏原螯虾血清酚氧化酶活力及稳定性的影响[J]. 淡水渔业, 2006, 36(5): 16-19.
[17] Hopkins C. Phenoloxidase Activity of Hemocytes Derived fromPenaeusmonodonandMacrobrachiumrosenbergii[J]. J Invertebrate Pathol, 1998, 71(1): 26-33.
[18] 李 义. 中华绒螯蟹新型免疫调节剂及其酚氧化酶的纯化和性质研究[D]. 南京:南京农业大学, 2007.
[19] Jiravanichpaisal P, Roos S, Edsman L, et al. A highly virulent pathogen,Aeromonashydrophila, from the freshwater crayfishPacifastacusleniusculus[J]. J Invertebrate Pathol, 2011, 101(1): 56-66.
[20] 刘振兴, 陈昌福, 高 宇, 等. 嗜水气单胞菌对克氏原螯虾免疫相关因子活力的影响[J]. 华中农业大学学报, 2011, 30(3): 358-363.
(责任编辑:张红林)
Phenoloxidase activity ofProcambarusclarkiiinfected by white spot syndrome virus
LI He-shui, ZENG Yong, LUAN Qing
(CollegeofLifeScience,YantaiUniversity,Yantai264005,Shandong,China)
Healthy red swamp crayfish,Procambarusclarkiiwere infected by white spot syndrome virus(WSSV),Aeromonashydrophila, andEscherichiacoli(DH5ɑ) respectively. Phenoloxidase activity in crayfish hemocytes and hepatopancreas were examined from 0~72 h post infection at regular time. The results showed as follows: (1) The difference of PO activity was not significant after treated with trypsin at 0.1 mg/mL and 1 mg/mL. (2) Compared with none trypsin, PO activity ofP.clarkiiwas increased via the trypsin pathway. (3) Whether added trypsin or not, it had the similar characteristics, that the PO activity in WSSV and Ah injection groups were significantly higher than that of the control group after 12~48 h and reached to the top level at 48 h respectively. It finally returned to original level after 72 h; The changes of PO activity were not significant between DH5ɑ experimental and control groups. PO activity ofP.clarkiiwas changed after WSSV infection. We can speculated that PO involved in antiviral immune response ofP.clarkiiin vivo.
White spot syndrome virus;Aeromonashydrophila;Escherichiacoli;Procambarusclarkii; phenoloxidase activity
2016-11-29;
2017-01-18
山东省自然科学基金(ZR2009DM005)
李贺水(1989- ),女,硕士研究生,专业方向为水产微生物学。E-mail: shl2014yd@163.com 通讯作者:曾 勇。E-mail:zy110cn@aliyun.com
S917.4
A
1000-6907-(2017)02-0030-06
