缩骨鲫MSTN基因的克隆与组织表达分析
2017-04-06许炎坤蓝召军
杨 扬,许炎坤,舒 琥,李 强,蓝召军,刘 丽
(1.广州大学生命科学学院,广州 510006;2.韶关市水产研究所,广东韶关 512006;3.华南农业大学海洋学院,广州 510642)
缩骨鲫MSTN基因的克隆与组织表达分析
杨 扬1,许炎坤1,舒 琥1,李 强1,蓝召军2,刘 丽3
(1.广州大学生命科学学院,广州 510006;2.韶关市水产研究所,广东韶关 512006;3.华南农业大学海洋学院,广州 510642)
采用同源克隆、生物信息学方法及荧光定量PCR(Real-time PCR)对缩骨鲫(Carassiusauratussogu var.)肌肉生长抑制素(myostatin,MSTN)基因进行克隆,分析和组织表达状况研究。结果显示:缩骨鲫基因组MSTN基因全长4 737 bp,含有两个内含子和三个外显子;编码区长度为1 128 bp,编码375个氨基酸,包括信号肽(1aa~23aa),TGF-β前肽保守区域(34aa~256aa),TGF-β功能区(281aa~375aa),保守的RXXR蛋白酶酶切位点以及C-端活性区域9个保守的半胱氨酸残基,这与其他物种MSTN相似。此外,缩骨鲫与鲫鱼(Carassiusauratus)的MSTN氨基酸序列同源性最高,达到96.1%。以β-actin为内参基因,荧光定量PCR分析表明,MSTN在肌肉中表达量最高;脑、眼、心脏中次之;在肝胰脏、卵巢、肠和肾脏中微量表达。
缩骨鲫(Carassiusauratussogu var.);克隆;肌肉生长抑制素基因;组织表达分布
肌肉生长抑制素(myostatin,MSTN)基因,又被称为生长/分化因子8(growth/differentiation factor,GDF-8),是Mcpherron于1997年发现的一种属于分泌蛋白转化生长因子β(TGF-β)超家族的新的生长因子[1]。它的结构具有TGF-β超家族的典型特征:N-端疏水的信号肽序列;氨基酸序列上有4个氨基酸(RXXR)组成的蛋白酶酶切位点;C-端包含9个保守半胱氨酸的活性区;通过C-端二硫键形成二聚体[2]。其主要通过TGF-β/smads通路[3]对生肌决定因子(Myogenic determining factor,MyoD)家族成员转录活性进行调控,进而控制肌细胞分裂周期中由G1期到S期的转变,它的表达量与肌肉的质量呈负相关[4]。
MSTN基因敲除后能使骨骼肌质量显著增加,而且不会导致致命缺陷[5]。MSTN突变的小鼠体型显著大于野生型,主要是由于肌细胞的过度生长和增殖引起的[6],MSTN的缺失以及敲除可以引起猪或者牛的双肌性状[7,8]。迄今为止,在鱼类中,MSTN基因研究已经相对普遍,在黄颡鱼(Pelteobagrusfulvidraco)[9]、罗非鱼(Oreochromismossambicus)[10]、舌齿鲈(DicentrarchuslabraxL.)[11]、鲈(Moronechrysops)[10]、斑点叉尾(Ictaluruspunctatus)[12]、真鲷(Pagrosomusmajor)[13]、鲤(Cyprinuscarpio)[14]、鲫[15]等中已经克隆出MSTN基因。
MSTN的表达在不同的鱼类中存在差异,但是普遍在肌肉中有着较高的表达,而在其他的组织中表达谱有所不同。在金头鲷(Sparusaurata)中,MSTN在肠、肾脏、脑、眼和肌肉中都有较高的表达,在其他组织中则没有检测到[16];在斑马鱼中,所检测的10种组织骨骼肌、肝、心脏、胃、鳃、卵巢、精巢、肾、眼和脑中均有表达[17];在鲤鱼中,只能在肌肉和脑中检测到MSTN mRNA[14];在虹鳟(Oncorhynchusmykiss)中,脑、心脏、肝、鳃、肠、精巢、卵巢、肾脏、快肌和慢肌中均能检测到MSTN的存在,其中在肠、精巢、卵巢和肌肉中表达量较高[18]。
缩骨鲫(Carassiusauratussogu var.)是分布在湖南省绥宁县的一个特殊的鲫地方种群。其躯体较高,体长约为体高的1.6倍。距背鳍前基部三分之一处的后部脊椎骨呈萎缩状,尾柄长远小于尾柄高。背鳍后基部的两侧肌肉发达,微隆起。这种体型并非病态,而是纯粹的遗传所致[19]。缩骨鲫的研究主要集中在生物学、雌核发育[20]等方面,分子水平的研究甚少,尤其对生长相关基因研究资料十分匮乏,鉴于MSTN对肌肉生长的调控功能及其在鱼类育种中具有潜在的应用价值,本研究对缩骨鲫MSTN基因及其在不同组织的表达进行了分析,可以丰富缩骨鲫的基因信息,并为缩骨鲫肌肉生长和发育的分子机制研究以及遗传育种提供基础资料。
1 材料与方法
1.1 实验用鱼
实验用缩骨鲫4尾,体质量为(100±10) g,均取自广东韶关水产研究所。
1.2 实验试剂
Ezup柱式动物基因组DNA抽提试剂盒和SanPrep柱式DNA胶回收试剂盒购自生物工程(上海)股份有限公司; Taq酶和RNA keeper购自Vazyme Biotech公司。PMD19-T、大肠杆菌DH5α感受态、RNAiso、PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)和SYBR® Premix Ex TaqTMII (Tli RNaseH Plus)、ROX plus 均购自Takara公司。
1.3 引物
本次实验使用的引物见表1,以鲤鱼的MSTN基因组基因为模板共设计7对引物对缩骨鲫MSTN基因组基因序列进行扩增。

表1 用于缩骨鲫MSTN基因克隆和表达分析的9对引物
1.4 扩增与测序
剪取25 mg缩骨鲫肌肉,使用生工DNA提取试剂盒抽提基因组DNA。使用上述的引物以缩骨鲫基因组DNA为模板进行扩增,然后将产物纯化,转入大肠杆菌中,送至上海美吉生物医药科技有限公司测序。
1.5 序列拼接及MSTN基因的生物信息学分析
将测序获得的7条MSTN基因片段利用DNAstar软件中的Seqman对序列进行拼接、比对,获得缩骨鲫MSTN基因组基因全序列。通过NCBI的Spidey对缩骨鲫MSTN基因组基因进行内含子与外显子的分析并进行拼接,得到CDs区域,利用ExPASy - ProtParam tool在线分析工具分析缩骨鲫MSTN基因编码蛋白的理化性质。使用在线的SignalP 4.1 service对缩骨鲫MSTN蛋白的信号序列进行预测。使用Mega 5.0软件对缩骨鲫、鲫、鲤、斑马鱼(Daniorerio)、草鱼(Ctenopharyngodonidellus)、鳙(Aristichthysnobilis)、南亚黑鲮 (Labeorohita)、喀拉鲃(Catlacatla)、大西洋鲱(Clupeaharengus)、大西洋鲑(Salmosalar)、溪红点鲑(Salvelinusfontinalis)、网纹鳉(Poeciliareticulate)、青鳉(Oryziaslatipes)、鳡(Elopichthysbambusa)、蓝点马鲛(Scomberomorusniphonius)、白斑狗鱼(Esoxlucius)、美洲狼鲈(MoroneAmericana)、大黄鱼(Larimichthyscrocea)、罗非鱼、红鳍东方鲀(Takifugurubripes)、鳝(Monopterusalbus)、美国短吻鳄(Alligatormississippiensis)、西部锦龟(Chrysemyspictabellii)、海龟(Cheloniamydas)、原鸡(Gallusgallus)、绿头鸭(Anasplatyrhynchos)、灰雁(Anseranser)、猪(Susscrofa)、小鼠(Musmusculus)和人(Homosapiens)的MSTN氨基酸序列进行同源性分析并使用 Neighbor-Joining法构建分子系统发育树。
1.6 缩骨鲫MSTN 在不同组织的转录表达分布
取3尾缩骨鲫的9个组织:脑、眼、心脏、卵巢、肝胰脏、肠、肾脏、鳃和肌肉迅速放入RNA keeper中,总RNA提取方法如下,将100 mg 组织加入到 1 mL 的RNAiso中并剪碎,置于冰上裂解;加0.2 mL氯仿静置片刻离心;取500 μL上清液,用0.5 mL异丙醇沉降RNA,再用1 mL 75% 乙醇洗涤沉淀;用DEPC水溶 解RNA;使用1%琼脂糖电泳检测RNA质量。按照PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)说明书进行反转录。使用ABI7000荧光定量PCR仪,按照 SYBR® Premix Ex TaqTMII (Tli RNaseH Plus) 试剂盒要求进行 Real-time PCR对9种组织的mRNA表达量进行检测,每一个样品设置三个重复。对PCR产物进行溶解曲线检测,并送至上海美吉生物医药科技有限公司测序,以确定扩增基因为目的基因。本实验使用β-actin作为内参基因,引物β-actinF 和β-actinR(表1),扩增 157 bp的目的片段,MSTN 特异性引物MSTNQPCRF和MSTNQPCRR,扩增133 bp的目的片段, 以上引物均为跨内含子引物,以保证引物对cDNA的特异性。使用2-△△ct法对不同组织的相对表达量进行计算并作图。使用SPSS19.0的ANOVA进行不同组织内的差异显著性分析。
2 结果与分析
2.1 缩骨鲫的MSTN基因组基因的扩增与拼接
以缩骨鲫的基因组DNA为模板,Primer1~7为引物,分别成功扩增出特异的DNA片段(图1),得到完整的缩骨鲫MSTN基因组基因序列,其长度为4 737 bp。该基因含有两个内含子和三个外显子,并且全部遵循GU-AG剪切规则,蛋白质编码区长度为1 128 bp,可以编码375个氨基酸,存在RXXR保守结构和含有9个保守的半胱氨酸残基的活性区,具体序列分析如图2所示。该序列的GenBank登录号为KX150705。

图1 缩骨鲫MSTN基因组序列扩增结果Fig.1 PCR result of MSTN of C.auratus sogu var. 1~7为表1中引物PCR扩增产物,M为DL2000 DNA Marker。
2.2 缩骨鲫MSTN基因序列及其氨基酸序列的生物信息学分析
2.2.1 缩骨鲫MSTN基因编码蛋白的理化性质
将缩骨鲫MSTN编码的氨基酸序列提交至ExPASy-ProtParam tool在线分析工具,对缩骨鲫MSTN蛋白进行蛋白质理化性质分析,该蛋白预计相对分子质量为42 069.1,等电点为6.17。其氨基酸组成中以亮氨酸(Leu)的含量最高(8.0%),含量最低的是色氨酸(Trp),为1.6%,其他氨基酸含量在2.4%~7.2%之间。此蛋白不稳定系数为50.85,是一种不稳定的蛋白。此外,蛋白质氨基酸残基亲疏水性总平均数(GRAVY)为-0.351,说明此蛋白为亲水蛋白。

图2 缩骨鲫MSTN核苷酸序列与推测的氨基酸序列Fig.2 MSTN nucleotide sequence and predicted amino acid sequence of C.auratus sogu var. 加框表示保守的酶切位点,下划线表示启动子原件,加粗表示加尾信号,阴影部分表示加尾信号和polyA之间的保守区域, 双直线表示保守的半胱氨酸残基,星号表示终止密码子。
2.2.2 缩骨鲫MSTN基因编码蛋白的预测分析
使用SignalP 4.1 Server在线信号肽预测软件,对缩骨鲫的MSTN基因编码的蛋白的信号肽进行预测,结果显示,该基因1aa~23aa为信号肽区域,其作用是介导蛋白质分泌和转运,并对其正确折叠有一定的作用。通过NCBI功能软件Conserved domains分析缩骨鲫MSTN氨基酸序列保守区域。 结果显示,34aa~256aa氨基酸残基是TGF-β前肽(propeptide)保守区域,281aa~375aa氨基酸残基是TGF-β功能区。
2.2.3 缩骨鲫MSTN的同源性分析
对比29个GenBank中已经公布的一些物种的MSTN氨基酸序列发现,缩骨鲫MSTN与鲫鱼和鲤鱼的同源度分别为96.1%和95.8%,在分子系统发育树上聚为一支,亲缘关系最近;与鲤科鱼类的同源度为94.4%~96.1%,相对保守;与其他硬骨鱼类的同源度为74.3%~85.6%;与陆生动物的同源度仅为58.2%~61.5%。使用neighbor-joining方法对缩骨鲫以及进行系统发育分析,Bootstrap检验重复1 000次,构建了缩骨鲫MSTN氨基酸序列的分子系统发育树(图3),MSTN分子系统发育树与形态学的系统发育树吻合。
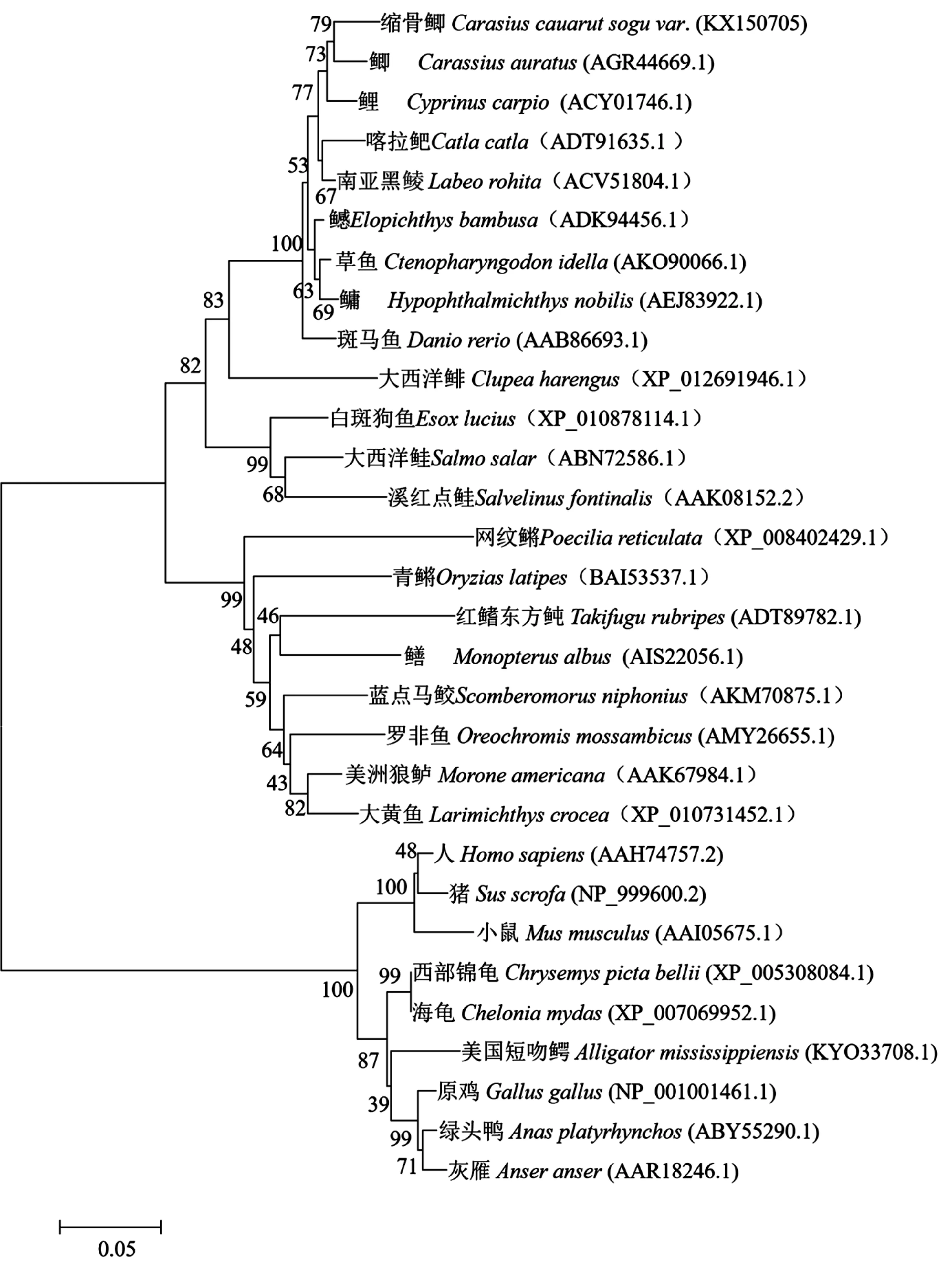
图3 缩骨鲫与其他物种的MSTN氨基酸序列的系统发育树Fig.3 Phylogenetic tree of MSTN of C.auratus sogu var.and other species
2.3 缩骨鲫 MSTN 在不同组织的转录表达分布
以缩骨鲫的脑、眼、心脏、卵巢、肝胰脏、肠、肾脏、鳃和肌肉9个组织的cDNA为模板,通过Real-time PCR研究MSTN在不同组织内的表达量。Real-time PCR的扩增产物溶解曲线为单峰,测序结果表明扩增产物为目的片段。结果表明,在缩骨鲫肌肉中MSTN含量最高,脑、眼、心脏中次之,肝胰脏、卵巢、肠、肾脏和鳃中微量表达,其中肝胰脏表达略高(图4)。

图4 缩骨鲫MSTN mRNA在不同组织内的表达Fig.4 Relative expression of MSTN mRNA in tissues ofC.auratus sogu var. 图中字母不同表示差异显著(P<0.05)
3 讨论
缩骨鲫作为华南地区特有物种,有着良好的经济价值和重要的研究价值。缩骨鲫的背鳍后基部的两侧肌肉发达,约距背鳍前基三分之一处的后部脊椎骨开始呈萎缩状,这并非病态,而是自然选择的结果,本研究克隆以及初步分析了与肌肉生长分化密切相关的MSTN基因,并对推测的缩骨鲫MSTN氨基酸序列与其他物种进行了对比。结果显示,缩骨鲫与鲫鱼的同源性最高,达到了96.1%,这与刘良国等[21]使用RAPD方法分析鲫品系所得出的结果相符,证实缩骨鲫是由普通鲫进化而来,至于缩骨鲫背部肌肉较为发达是否是因为缩骨鲫与鲫鱼之间MSTN的差异导致,还需要使用基因敲除技术或者大幅降低MSTN活性的单核苷酸多态(Single Nucleotide Polymorphisms,SNPs)做进一步的研究。缩骨鲫MSTN基因的克隆,为缩骨鲫MSTN基因SNPs的筛选和缩骨鲫MSTN基因SNPs与生长性状的关联分析[22]奠定了基础。 至于是否存在大幅降低缩骨鲫MSTN活性的SNPs仍需要做进一步的研究。
本实验显示,缩骨鲫与爬行类、鸟类、哺乳类的MSTN基因有着较高的同源性,均编码375或376个氨基酸,并且MSTN基因组基因都由三个外显子两个内含子组成。比对多种鱼类的MSTN氨基酸序列的结果表明,该蛋白序列在鱼类中具有高度的保守性,尤其是在C末端的功能活性区域,其保守性几乎达到99%,而且鱼类的MSTN蛋白上均有两个保守区域:TGF-β前肽(propeptide)保守区域和TGF-β功能区。通过多物种的MSTN氨基酸序列构建的分子进化树与形态学的进化树基本吻合。
使用实时荧光定量 PCR 分析缩骨鲫MSTN在9种组织内表达,结果显示MSTN在肌肉中的表达量显著高于其他组织,与在鲤[14]、大西洋鲑[23]、异育银鲫(Allogyogeneticscruciancarp)[24]和泥鳅(Misgurnusanguillicaudatus)[25]等鱼中研究结果相符。缩骨鲫MSTN在脑,眼和心脏中有着较为显著的表达,这与在大西洋鲑,草鱼(Ctenopharyngodonidellus)[26]中的研究相符,值得注意的是,在异育银鲫中的研究显示在脑和心脏也有明显的表达,但是脑和肌肉的表达量没有显著差异,这可能是因为实验用鱼的年龄不同[27],也可能是因为物种差异的结果。MSTN的广泛表达,在异育银鲫、草鱼、斑马鱼[17]以及金头鲷[27]等鱼的研究中均有体现。不同于哺乳动物中MSTN的表达只局限于肌肉和少数组织中[6],在鱼类中MSTN的表达非常广泛,表达模式也十分多样。由于MSTN对肌肉生长的调控作用[5],已经被广泛研究并应用于畜牧业和渔业以满足消费者的需求,其研究对于经济鱼类育种有着重要的意义。
[1]Mcpherron A C,Lee S J.Double muscling in cattle due to mutations in the myostatin gene [J].Proc Natl Acad Sci,1997,94(23):12457-12461.
[2]Cheifetz S,Weatherbee J A,Tsang M L S,et al.The transforming growth factor-β system,a complex pattern of cross-reactive ligands and receptors [J].Cell,1987,48(3):409-415.
[3]张 勇,秦 娜,于 斌.TGF-β/Smads信号转导通路的研究进展[J].广西医科大学学报,2009(1):155-157.
[4]Langley B,Thomas M,Bishop A,et al.Myostatin inhibits myoblast differentiation by down-regulating MyoD expression [J].J Biol Chem,2002,277(51):49831-49840.
[5]Dominique J E,Gérard C.Myostatin regulation of muscle development:molecular basis,natural mutations,physiopathological aspects [J].Exp Cell Res,2006,312(13):2401-2414.
[6]McPherron A C,Lawler A M,Lee S J.Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member[J].Nature,1997,(1):83-90.
[7]Sonstegard T S,Rohrer G A,Smith T P L. Myostatin maps to porcine chromosome 15 by linkage and physical analysis [J].Anim Genet,1998,29(1):19-22.
[8]Charlier C,Coppieters W,Farnir F,et al.The mh gene causing double-muscling in cattle maps to bovine chromosome 2[J].Mamm Genome,1995,6(11):788-792.
[9]朱媛媛,梁宏伟,李 忠,等.黄颡鱼MSTN基因多态性及其与生长性状的相关性分析[J].遗传,2012,34(1):72-78.
[10]Rodgers B D,Weber G M,Sullivan C V,et al.Isolation and characterization of myostatin complementary deoxyribonucleic acid clones from two commercially important fish:OreochromismossambicusandMoronechrysops[J].Endocrinology,2001,142(4):1412-1428.
[11]Terova G,Bernardini G,Binelli G,et al.cDNA encoding sequences for myostatin and FGF6 in sea bass (DicentrarchuslabraxL.) and the effect of fasting and refeeding on their abundance levels [J].Domest Anim Endocrinol,2006,30(4):304-319.
[12]Weber T E,Small B C,Bosworth B G.Lipopolysaccharide regulates myostatin and MyoD independently of an increase in plasma cortisol in channel catfish (Ictaluruspunctatus) [J].Domest Anim Endocrinol,2005,28(1):64-73.
[13]叶寒青,陈松林.真鲷肌肉生长抑素MSTN基因的克隆及表达分析[J].高技术通讯,2006,16(7):718-724.
[14]李兴美,范 巍,张 彬,等.鲤鱼肌肉生长抑制素基因(MSTN)的克隆及其组织表达特征[J].水生生物学报,2007,(5):643-648.
[15]刘洋洋.淇河鲫MSTN基因与相关形态学的研究[D].河南新乡:河南师范大学,2014.
[16]Maccatrozzo L,Bargelloni L,Radaelli G,et al.Characterization of the myostatin gene in the gilthead seabream (Sparusaurata):sequence,genomic structure,and expression pattern[J].Mar Biotechnol,2001,3(3):224-230.
[17]Amali A A,Lin C J F,Chen Y H,et al.Up-regulation of muscle-specific transcription factors during embryonic somitogenesis of zebrafish (Daniorerio) by knock-down of myostatin-1[J].Dev Dyn,2004,229(4):847-856.
[18]Rescan P Y,Jutel I,Rallière C.Two myostatin genes are differentially expressed in myotomal muscles of the trout (Oncorhynchusmykiss)[J].J Exp Biol,2001,204(20):3523.
[19]俞豪祥,张海明.“缩骨鲫”的生物学及养殖试验初报[J].水产科技情报,1986,(3):21.
[20]蒋一珪,俞豪祥,陈本德,等.鲫鱼的人工和天然雌核发育[J].水生生物学集刊,1982,(4):471-477,479-480.
[21]刘良国,赵 俊,陈湘粦.彭泽鲫两个雌核发育克隆与三个鲫鱼品系的RAPD分析[J].淡水渔业,2005,35(2):13-16.
[22]虎永彪,张艳萍,杜岩岩,等.甘肃金鳟生长激素基因多态性与生长性状的相关分析[J].淡水渔业,2014,44(5):100-103.
[23]Østbye T K,Galloway T F,Nielsen C,et al.The two myostatin genes of Atlantic salmon (Salmosalar) are expressed in a variety of tissues[J].Eur J Biochem,2001,268(20):5249-5257.
[24]张 颖,李 冰,朱 健,等.异育银鲫中科3号MSTN基因的克隆与序列分析[J].江苏农业科学,2014,(11):40-44.
[25]彭 扣,陈伟伟,胡 炜,等.泥鳅肌肉生长抑制素基因片断的克隆及其表达[J].水产学报,2007,31(2):145-151.
[26]濮剑威,孙成飞,蒋霞云,等.草鱼两个肌肉生长抑制素cDNA克隆、表达及过量表达对胚胎发育的影响[J].生物技术通报,2011,(8):153-160,166.
[27]Radaelli G,Rowlerson A F,Patruno M,et al.Myostatin precursor is present in several tissues in teleost fish:a comparative immunolocalization study[J].Cell Tissue Res,2003,311(2):239-250.
(责任编辑:张潇峮)
Cloning and tissues expression analysis of MSTN gene inCarassiusauratussogu var.
YANG Yang1,XU Yan-kun1,SHU Hu1,LI Qiang1,LAN Zhao-jun2,LIU Li3
(1.SchoolofLifeScience,GuangzhouUniversity,Guangzhou510006,China;2.ShaoguanFisheriesResearchInstitute,Shaoguan,Guangzhou,512006,China;3.SchoolofMarineScience,AgriculturalUniversityofSouthChina,Guangzhou510642,Guangdong,China)
The myostatin (MSTN) gene inCarassiusauratussogu var.was cloned and analyzed through homology-based cloning,bioinformatics technology and Real-time PCR.The result revealed that the length of MSTN ofC.auratussogu var.is 4737bp.It includes 3 exons and 2 introns.The length of coding sequence (CDS) is 1128bp,the gene code 375 amino acids which contain a signal peptide (1aa~23aa),a conserved propeptide domain (34aa~256aa),a functional domain (281aa~375aa),a RXXR proteolysis site and nine conserved cysteine residues of C-terminal functional domain;As other species,the protein of MSTN have a TGF-β superfamily domain inC.auratussogu var.;Compared with other species,the homology of MSTN amino acid sequences betweenC.auratussogu var.andC.auratusis closer.Using Real-Time PCR detected MSTN mRNA expression of 9 tissues,the result suggested that the MSTN gene was highly expressed in muscle,second highly expressed in brain,eyes,heart and weakly expressed in ovary,hepatopancreas and kidneys.
Carassiusauratussogu var;clone;myostatin (MSTN);tissues expression
2016-08-13;
2016-10-11资助项目:国家公益性行业(农业)重大专项(201303048);广东省科技计划项目(2012A020602063,2014A020208145)。
杨 扬(1992- ),男,硕士研究生,专业方向为鱼类生理与分子生物学。E-mail:214453598@qq.com 通讯作者:舒 琥。E-mail:shuhu001@126.com
S917.4
A
1000-6907-(2017)01-0023-07
