大鲵虹彩病毒贵州分离株MCP基因的克隆与原核表达
2017-04-06李永霞周思旋
余 波,王 芳,康 超,李永霞,周思旋
(1.贵州省畜牧兽医研究所,贵阳 550005;2.贵州省生物研究所,贵阳 550009)
大鲵虹彩病毒贵州分离株MCP基因的克隆与原核表达
余 波,王 芳2,康 超2,李永霞2,周思旋1
(1.贵州省畜牧兽医研究所,贵阳 550005;2.贵州省生物研究所,贵阳 550009)
根据GenBank中大鲵虹彩病毒主衣壳蛋白MCP(major capsid protein,MCP)基因序列(序列号:KF512820),设计一对特异性引物,以大鲵虹彩病毒贵州分离株基因组DNA为模板,PCR扩增大鲵虹彩病毒MCP基因并测序,与GenBank中大鲵虹彩病毒MCP基因进行比对,然后将其亚克隆到原核表达载体pET-32a(+)中,转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导后进行Western blot分析。结果显示:PCR扩增出长度为1 392 bp的片段,与GenBank中大鲵虹彩病毒MCP基因核苷酸序列相似性为99.7%~99.9%,SDS-PAGE电泳显示该重组蛋白的相对分子质量约为67×103。免疫原性检测结果表明,该重组蛋白可与兔抗大鲵虹彩病毒阳性血清特异性反应,具有免疫原性。
大鲵虹彩病毒;MCP基因;原核表达;免疫原性
大鲵虹彩病毒(Giantsalamanderiridovirus,GSIV),属虹彩病毒科(Iridoviridae)蛙病毒属(Ranavirus),为双链DNA病毒,主要感染鱼类、两栖类和爬行类,是水产养殖中一种危害较大的病毒,可引起大鲵大面积死亡[1-3]。大鲵虹彩病毒主要衣壳蛋白(MCP)基因编码463个氨基酸,该蛋白相对分子质量约49×103,占病毒总蛋白的45%,具有良好的免疫原性,在病毒的装配和感染过程中发挥重要作用[4]。周勇等[5]根据大鲵虹彩病毒MCP基因设计引物,建立了大鲵虹彩病毒TaqMan实时荧光定量PCR检测方法。刘星星等[6]据大鲵蛙病毒MCP基因设计合成4条特异性引物建立了大鲵蛙病毒环介导等温扩增检测方法。目前,有关大鲵虹彩病毒MCP基因的原核表达研究尚未见报道。本研究克隆了大鲵虹彩病毒贵州分离株MCP基因,构建重组载体并在大肠杆菌中进行表达与免疫原性分析,旨在为今后进一步开展大鲵虹彩病毒基因工程疫苗和分子快速诊断方法奠定基础。
1 材料与方法
1.1 毒株、菌株和细胞
大鲵虹彩病毒贵州分离株由贵州重大疫病监测防治重点实验室保存。鲤上皮瘤细胞购自上海拜力生物科技有限公司。pET32a(+)表达载体、大肠杆菌BL21(DE3)、DH5α均为生工生物工程(上海)有限公司生产。
1.2 主要试剂
TaqPCR Mastermix酶、核酸染料、1×TAE电泳缓冲液、DL2000、λDNA、IPTG、X-gal、考马斯亮蓝R250、限制性内切酶EocRI和HindⅢ、蛋白Marker、HRP标记的羊抗兔IgG、PCR产物回收纯化试剂盒、质粒DNA小量提取试剂盒、病毒基因组DNA提取试剂盒购自北京天根生物科技有限公司。兔抗GSIV阳性血清由本研究室制备。蛋白质纯化试剂盒His-Tagged Purification Miniprep Kit购自宝生物工程(大连)有限公司。
1.3 引物设计
根据GenBank中的大鲵虹彩病毒MCP基因序列,设计1对引物,上游引物:5′-GAATTCATGTCTTCTGTAACTGGT-3′,下游引物:5′-GTGCGGTTACAAGATTGGGAATCC-3′,下划线部分分别为添加的EcoRI和HindⅢ酶切位点。
1.4 病毒核酸的抽提
将大鲵虹彩病毒液接种于鲤上皮瘤细胞,待细胞出现病变后收集细胞毒液,将其放入-70 ℃冰箱反复冻融3次,5 000 r/min离心10 min,取上清液200 μL用病毒基因组DNA试剂盒提取基因组。
1.5 大鲵虹彩病毒MCP基因的扩增
在100 μL体系中进行PCR反应:上下游引物各4 μL(浓度10 μmol/L)、TaqPCR Mastermix酶50 μL、模板4 μL、ddH2O 加至100 μL。反应条件为:94 ℃ 5 min;94 ℃ 30 s, 55 ℃ 1 min、72 ℃ 1 min 30个循环,最后72 ℃延伸10 min。取5 μL PCR扩增产物于1%琼脂糖凝胶中电泳。
1.6 大鲵虹彩病毒MCP基因的克隆和鉴定
将扩增的PCR产物用PCR产物回收纯化试剂盒进行DNA回收,与pMD18-T克隆载体连接,转化入感受态细胞DH5α,重组T载体命名为pMD18T-MCP。用质粒DNA小量提取试剂盒提取pMD18T-MCP菌体质粒,然后进行酶切和PCR鉴定,并将质粒送生工生物工程(上海)有限公司进行序列测定。
1.7 大鲵虹彩病毒MCP基因序列分析
将测序正确的序列提交至GenBank中,并利用CLUSTAL X和MEGA软件,将该序列与GenBank中其他大鲵虹彩病毒MCP基因序列进行比对分析。
1.8 大鲵虹彩病毒MCP基因原核表达载体的构建
用EcoRⅠ和HindⅢ双酶切重组T载体pMD18T-MCP和表达载体pET32a(+),经1%琼脂糖凝胶电泳,用PCR产物回收纯化试剂盒切胶回收目的基因MCP和线性化pET32a(+),16 ℃连接过夜,将连接的产物转化感受态细胞DH5α,涂布含Amp(100 μg/mL) 的LB琼脂平板,37 ℃培养16 h后,挑取单个菌落抽提质粒,进行PCR和EcoRⅠ、HindⅢ双酶切鉴定,重组载体质粒命名为pET32a-MCP,并将质粒送生工生物工程(上海)有限公司进行序列测定。
1.9 大鲵虹彩病毒MCP基因的表达
将重组表达载体质粒pET32a-MCP转化感受态细胞BL21(DE3),挑取单个菌落接种10 mL LB液体培养基(含Amp100 μg/mL),37 ℃培养12~16 h后,取出50 μL培养的菌液接种于5 mL LB液体培养基(含Amp100 μg/mL)中培养至OD600 nm达0.5左右时,加入IPTG至终浓度0.1 mmol/L,继续剧烈振荡培养4 h。菌体浓度OD600 nm达1.5取出5 mL离心加入320 μL PBS悬浊后进行超声波破碎,对菌体破碎液进行离心分离。分别取5 μL上清和沉淀,加入2×SDS上样缓冲液混匀,100 ℃加热10 min,进行 SDS-PAGE电泳。
1.10 兔抗GSIV血清的制备
将收集的细胞毒液参照文献[7]通过差速和蔗糖密度梯度离心进行纯化。将纯化的病毒蛋白与等体积弗氏完全佐剂充分乳化,每只家兔免疫病毒蛋白5 mg,首次免疫后14 d进行二免。二免后28 d,兔耳静脉采血并分离血清。应用琼扩法进行兔抗GSIV血清抗体效价测定,抗体效价达1∶64的血清于-70 ℃保存备用。
1.11 Western-blot分析
将PVDF膜、滤纸分别剪切成与凝胶相同大小,使用转膜缓冲液处理后,按滤纸、PVDF膜、凝胶、滤纸的顺序依次放在转膜仪电极板之间,进行转膜。将PVDF膜置于含1.5% BSA 缓冲液中,4 ℃平放过夜封闭。
以兔抗GSIV血清作为一抗,37 ℃反应1 h,TBST缓冲液洗涤3次,以辣根过氧化物酶标记的羊抗兔IgG作为二抗,37 ℃反应2 h,充分洗膜后,显色观察结果。
2 结果
2.1 大鲵虹彩病毒MCP基因的克隆和鉴定
大鲵虹彩病毒贵州分离株经PCR扩增得到约1 392 bp特异性的DNA条带,克隆到pMD18T载体上,经EcoRⅠ和HindⅢ双酶切鉴定表明pMD18T-MCP成功插入目的片段,与预期的相符(图1)。

图1 大鲵虹彩病毒MCP基因的克隆和鉴定Fig.1 Cloning and identification of MCP gene of GSIV
M:DL2000;1:重组质粒EcoRI和HindⅢ双酶切;2:重组质粒EcoRI单酶切;3:重组质粒 PCR产物
2.2 大鲵虹彩病毒MCP基因序列分析
对阳性重组质粒pMD18T-MCP测序结果表明,大鲵虹彩病毒贵州株MCP基因由1 392 bp组成的完整开放性阅读框。序列提交至GenBank中获得登录号为KC816423。通过CLUSTAL X和MEGA软件将该序列与GenBank中其他大鲵虹彩病毒分离株进行比对(图2,见下页),仅存在2个位点的碱基突变,核苷酸相似性为99.7%~99.9%。
2.3 大鲵虹彩病毒MCP基因原核表达载体的构建
将阳性质粒经EcoRⅠ和HindⅢ双酶切鉴定,EcoRⅠ单酶切,HindⅢ单酶切,电泳后表明该阳性质粒含有1 392 bp目的基因,与预期大小相符(图3)。

图3 大鲵虹彩病毒MCP基因原核表达质粒的构建及鉴定Fig.3 Construction and identification of prokaryotic expressionplasmid pMD18T-MCP
M1:λDNA;1:pET32a空载体;2:重组质粒EcoRI单酶切;3:重组质粒HindⅢ单酶切;4:EcoRI和HindⅢ双酶切; M2:DL2000
2.4 大鲵虹彩病毒MCP基因在大肠杆菌中的表达
SDS-PAGE电泳表明重组载体转化入BL21(DE3)诱导菌株经IPTG诱导后,表达了相对分子质量约67×103的特异性蛋白,与目的基因MCP基因编码的重组表达蛋白大小相一致(MCP蛋白编码蛋白49×103左右+载体的硫氧还蛋白相对分子质量18×103);未诱导表达菌株的全菌、上清、沉淀均未出现目的蛋白条带;对诱导后的表达菌体和空载体进行超声波破碎,离心后,分别对沉淀及上清进行SDS-PAGE电泳,结果表明,表达蛋白以包涵体形式存在,诱导后的表达空载体未见目的蛋白,只见相对分子质量18×103硫氧还蛋白(图4)。
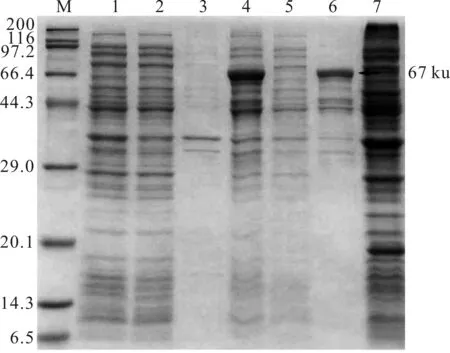
图4 大鲵虹彩病毒MCP基因在大肠杆菌中的 表达产物SDS-PAGEFig.4 The expression of recombinant MCP protein of GSIV in BL21(DE3)
M:蛋白分子Markers;1:未诱导表达菌全菌;2:未诱导表达菌上清;3:未诱导表达菌沉淀;4:诱导表达菌全菌;5:诱导表达菌上清;6:诱导表达菌沉淀;7:空载体诱导菌全菌

图2 大鲵虹彩病毒MCP基因序列比对分析图Fig.2 Comparison and analysis of MCP gene of GSIV
2.5 Western-blot分析
Western-blotting结果显示,相对分子质量约67×103处出现目的反应带(图5),表明重组蛋白可与兔抗GSIV血清发生免疫反应。
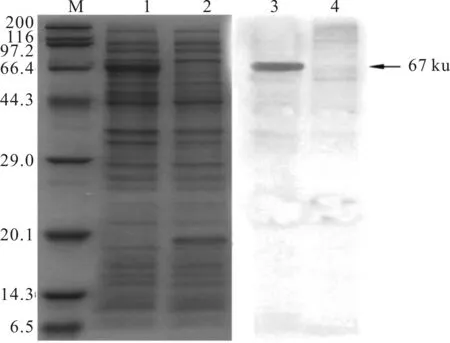
图5 表达蛋白的Western-blotting鉴定Fig.5 The western blotting of the recombinant protein
M:蛋白分子Markers;1:诱导表达菌全菌;2:诱导表达空载体;3:诱导表达菌全菌Western-blotting;4:诱导表达空载体Western-blotting
3 讨论
目前报道的GSIV MCP基因表达多采用真核表达系统。曾宪辉等[8]将GSIV MCP基因克隆到真核表达载体pcDNA3.1(+)中,实现GSIV MCP的真核表达,DNA疫苗免疫大鲵后,可诱导免疫大鲵产生细胞免疫和刺激机体产生特异性抗体,免疫保护率可达73.3%。原核表达系统较真核表达具有耗时短,表达量高的特点。本研究克隆了大鲵虹彩病毒贵州分离株MCP基因,构建重组载体,实现了大鲵虹彩病毒MCP基因的原核表达。Western blot分析结果表明,该重组蛋白具备免疫原性。
大鲵虹彩病毒MCP蛋白是虹彩病毒二十面体衣壳蛋白,蛋白质疏水性高,具有一定的稳定性,含有较多的抗原决定簇,具有良好的免疫原性,而MCP基因序列及其编码氨基酸序列的同源性可以反映不同虹彩病毒毒株之间的遗传亲缘关系[9]。本研究克隆的全长1 392 bp的大鲵虹彩病毒MCP基因,与GenBank中大鲵虹彩病毒MCP基因进行比对,核苷酸序列相似性为99.7%~99.9%,这和周小愿等[10]和徐进等[11]研究结果一致,表明中国GSIV多个流行毒株是同一种GSIV病毒,且不同GSIV毒株的MCP基因的分子特征和结构基本一致。
[1]Mao J,Hedrick R P,Chinchar V G,et al.Molecular characterization sequence analysis,and taxonomic position of newly isolated fishiridoviruses[J].Virology,1997,229(1):212-220.
[2]王 芳,余 波,史开志,等.虹彩病毒和柱状黄杆菌混合感染大鲵的诊治[J].湖北农业科学,2013,52(13):3102-3104.
[3]周小愿,张星朗,吉 红,等.大鲵虹彩病毒的形态结构及其包涵体特征[J].淡水渔业,2015,45(1):62-66.
[4]萧 枫,张奇亚.水生动物虹彩病毒的分子生物学[J].水生生物学报,2004,28(2):202-206.
[5]周 勇,曾令兵,孟 彦,等.大鲵虹彩病毒TaqMan实时荧光定量PCR检测方法的建立[J].水产学报,2012,36(5):772-778.
[6]刘星星,耿 毅,汪开毓,等.大鲵蛙病毒LAMP检测方法的建立[J].中国兽医学报,2015,35(4):558-564.
[7]张星朗,周小愿,张 辉.大鲵虹彩病毒的分离纯化及其MCP基因序列分析[J].西北农林科技大学学报:自然科学版,2014,42(12):23-28.
[8]曾宪辉,曾令兵,周 勇,等.大鲵虹彩病毒主衣壳蛋白MCP基因DNA疫苗的构建及其免疫效果[J].中国水产科学,2015,22(5):1055-1067.
[9]张奇亚,桂建芳.水产动物的病毒基因组及其病毒与宿主的相互作用[J].中国科学:生命科学,2014,44(12):1236- 1252.
[10]周小愿,张星朗,韩亚慧,等.大鲵虹彩病毒-LY株主要衣壳蛋白基因克隆和分子特征研究[J].中国农学通报,2015,31(5):45-54.
[11]徐 进,张 辉,肖汉兵,等.大鲵虹彩病毒流行株的分离及其主衣壳蛋白编码基因序列比较分析[J].中国水产科学,2014,21(4):655-660.
(责任编辑:邓 薇)
Cloning and prokaryotic expression of MCP gene ofGiantsalamanderiridovirusfrom Guizhou strain
YU Bo1,WANG Fang2,KANG Chao2,LI Yong-xia2,ZHOU Si-xuan1
(1.GuizhouInstituteofAnimalHusbandryandVeterinaryMedicine,Guiyang550005,China;2.GuizhouInstituteofBiology,Guiyang550009,China)
According to the MCP (major capsid protein,MCP) gene sequence ofGiantsalamanderiridovirus(GenBank Accession No.KF512820)in GenBank,a pair of specific primer was designed for amplifying the specific fragments of MCP gene.The MCP gene was amplified from the Guizhou isolate ofgiantsalamanderiridovirusby PCR,and then was subcloned into the prokaryotic expression vector pET-32a(+).The recombinant plasmid pET-32a-MCP was transformed intoE.coliBL21(DE3) and expressed under the induction of IPTG and SDS-PAGE.The results show that the MCP gene was 1392bp in length,the homology comparison between the MCP gene sequence and GenBank of MCP gene sequence showed 99.7%~99.9% identities at nucleotide level.The result of SDS-PAGE showed the expressed protein was about 67 KD.Western-blot analysis indicated that the expressed protein could react with rabbit anti- GSIV serum,which had immunological activity.
Giantsalamanderiridovirus;MCP gene;prokaryotic expression;immunological activity
2016-06-14;
2016-10-08资助项目:贵州省科学技术基金计划项目(黔科合J字[2014]2115号);贵州省科技厅农业攻关项目(黔科合NZ字[2012]3023号);2014年省级财政渔业发展(大鲵产业)专项资金
余 波(1981- ),男,副研究员,主要从事预防兽医研究。E-mail:yubonky@163.com
S917.4
A
1000-6907-(2017)02-0018-05
