激素替代-冻融胚胎移植周期子宫内膜的最佳容受时间研究
2017-04-06张昀熊芳徐洪燕肖潇肖菊霞周萍
张昀,熊芳,徐洪燕,肖潇,肖菊霞,周萍
(南京医科大学附属无锡市妇幼保健院,江苏 无锡 214000)
激素替代-冻融胚胎移植周期子宫内膜的最佳容受时间研究
张昀,熊芳,徐洪燕,肖潇,肖菊霞,周萍
(南京医科大学附属无锡市妇幼保健院,江苏 无锡 214000)
目的探讨激素替代-冻融胚胎移植(HRT-FET)周期子宫内膜的最佳容受时间。方法 根据子宫内膜暴露于黄体酮天数的不同(3、4、5、6和7 d),将52例行HRT-FET的患者依次定义为P3组、P4组、P5组、P6组及P7组,分别观察各组胞饮突形态及覆盖面积,并检测整合素αvβ3、同源框基因A10(HOXA10)及LIF 3种蛋白的相对表达量。结果 多数患者在黄体酮补充6 d时,其子宫内膜胞饮突发育程度与αvβ3、HOXA10及LIF 3种蛋白表达水平一致性达到最高。结论 将胞饮突发育程度检测作为冻融胚胎移植时间评估的参考依据是可行,于黄体酮补充3 d时对胚胎进行移植,可能是实现子宫内膜与胚胎同步化的理想选择。
激素替代-冻融胚胎移植;子宫内膜;容受
辅助生殖技术虽然提高激素替代-冻融胚胎移植(hormone replacement therapy-frozen embryo transfer,HRT-FET)的妊娠率,但是胚胎种植失败仍时有发生[1]。受雌、孕激素影响,子宫内膜发生形态改变以利于胚胎黏附与着床,即种植窗。过早或过晚都将导致胚胎种植不接纳。种植窗开放于黄体中期,各时间子宫内膜容受性取决于胞饮突完全发育成熟及整合素αvβ3(integrin alpha v beta 3,αvβ3)、同源框基因A10(homebox A10 gene,HOXA10)蛋白和白血病抑制因子(leukemia inhibitory factor,LIF)[2-3]表达。关于黄体酮在HRT周期内补充多长时间最有利于胚胎移植,尚未见报道。
1 资料与方法
1.1 研究对象
选取2015年7月-2015年9月在本院因输卵管性不孕或男性因素不育而接受辅助生殖技术治疗,并即将行HRT-FET周期的52例女性患者作为研究对象。年龄22~35岁,平均(27.6±3.7)岁。所有纳入患者有规律月经周期、正常的基础内分泌水平,并未使用任何宫内节育器;同时将合并有子宫畸形、排卵障碍、子宫内膜异位、盆腔粘连的患者,以及反复发生种植失败的患者排除在外。所有受试者签署知情同意书,经本院伦理委员会同意。
1.2 实验方法
52例患者接受激素替代治疗,自月经周期第3天开始连续7 d给予戊酸雌二醇,3 mg/次,2次/d,7 d后将服药剂量调整至4 mg/次,连续服用6 d。在患者服药过程中采用阴道超声对其子宫内膜厚度(2个外强回声线间的最大距离)进行实时监测,若经上述给药后厚度<8 mm,再按调整后的剂量继续用药3 d左右;当厚度≥8 mm后应用黄体酮(Progesterone,P)阴道缓释凝胶,90 mg/d。根据子宫内膜暴露于P的天数(3、4、5、6和7 d)将52例患者全部入组,共5组,依次定义为P3组(9例)、P4组(11例)、P5组(12例)、P6组(11例)及P7组(9例)。各组患者的年龄、不孕年限及子宫内膜厚度比较,差异无统计学意义(P>0.05)。所有患者在P完成给药的次日采用pipelle内膜导管进行子宫内膜活检标本的采集,取得样本后立即采用生理盐水进行清洗,随后将各组样本分作2份,其中一份采用2.5%戊二醛固定处理后于4℃条件下保存,制成电镜标本后即采用扫描电子显微镜进行胞饮突形态及覆盖面积的观察。其中,胞饮突形态主要依据其发育状态的分级情况进行判定,分为5级,分别为发育前、发育中、发育完全、衰退期及发育后。覆盖面积即胞饮突占子宫内膜表面面积的百分比,每份样本随机选取10个区域,放大2 000倍进行观察,完全未覆盖(0%)计0分,少量覆盖(≤20%)计1分,中等覆盖(21~50%)计2分,大量覆盖(>50%)计3分,最后计算每份样本的平均得分。另一份在清洗后立即用液态氮冷冻,并放置于-80℃冰箱冷冻储存待检,参考文献[4]完成蛋白样品制备,以甘油醛-3-磷酸脱氢酶为标准内参,采用Western blot检测αvβ3、HOXA10及LIF 3种蛋白的相对表达量。见图1。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均值±标准差(±s)表示,多组间比较用方差分析,方差齐则两两比较用SNK-q检验,P<0.05为差异有统计学意义。
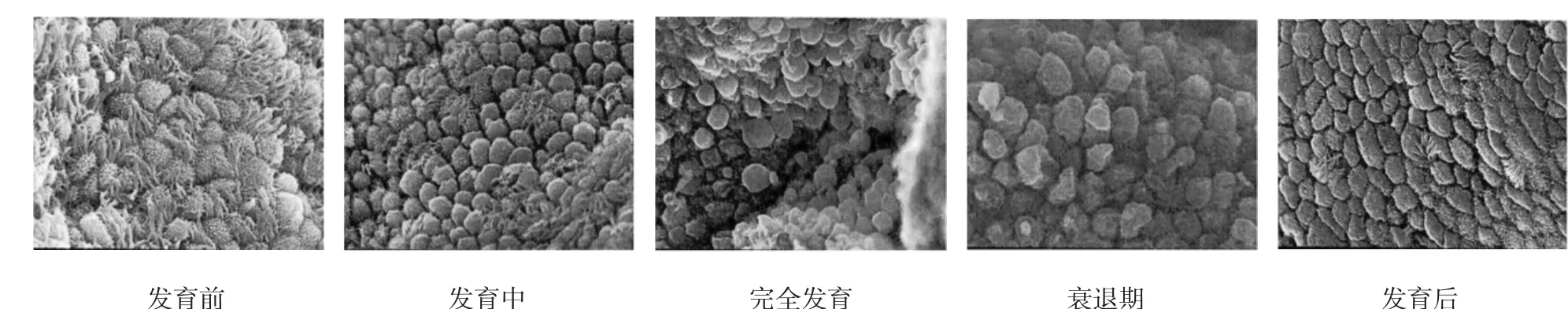
图1 胞饮突发育状态分级 (×2 000)
2 结果
2.1 5组子宫内膜标本的胞饮突形态分级
P3组与P4组基本全处于发育前或发育中状态,随着子宫内膜暴露于黄体酮时间的延长,处于衰退期和发育后的例数逐渐增加,P5组7例(58.3330%)发育中,4例(33.3330%)完全发育,1例(8.3333%)衰退期;P6组1例(9.0910%)发育中,8例(72.7270%)完全发育,2例(18.1820%)衰退期;P7组1例(11.1110%)完全发育,5例(55.5560%)衰退期,3例(33.3330%)发育后。见表1。
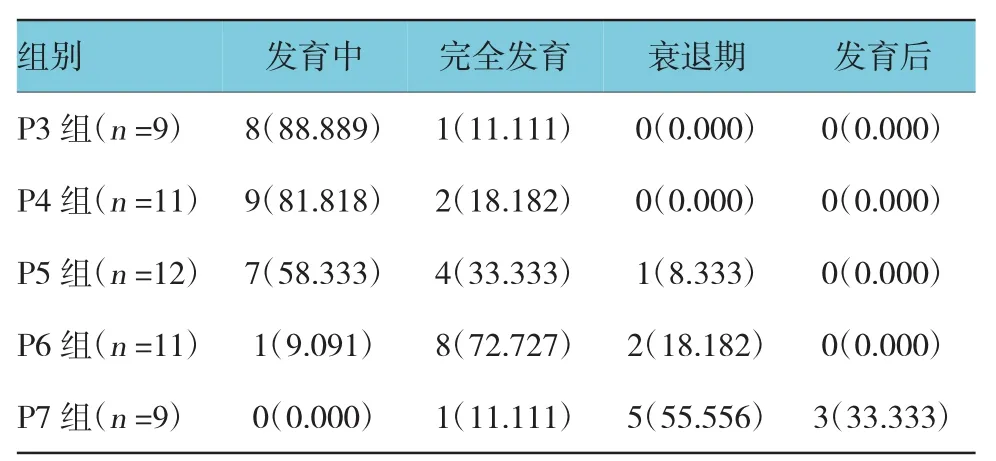
表1 5组子宫内膜标本的胞饮突形态分级 例(%)
2.2 5组子宫内膜标本的胞饮突覆盖面积评分比较
电镜显示,P3组、P4组、P5组、P6组及P7组子宫内膜标本的胞饮突覆盖面积评分分别为(0.88± 0.09)、(0.97±0.11)、(2.38±0.16)、(2.74±0.15)和(2.41±0.14),经方差分析,差异有统计学意义(F= 439.230,P=0.000),胞饮突在子宫内膜表面达大量覆盖程度只存在于P5组、P6组及P7组中;P5组、P6组、P7组与P3组和P4组比较,差异有统计学意义(P=0.000),P6组与P5组、P7组比较,差异有统计学意义(P=0.000),P5组与P7组比较,差异无统计学意义(P>0.05)。
2.3 5组子宫内膜αvβ3、HOXA10及LIF 3种蛋白的表达水平比较
5组子宫内膜αvβ3、HOXA10、LIF 3种蛋白的表达水平比较,经方差分析,差异有统计学意义(F= 40.142、30.423和11.883,P=0.000);P6组3种蛋白的相对表达量最高(P<0.05)。见表2和图2。
表25组子宫内膜αvβ3、HOXA10及LIF 3种蛋白的表达水平比较 (±s)
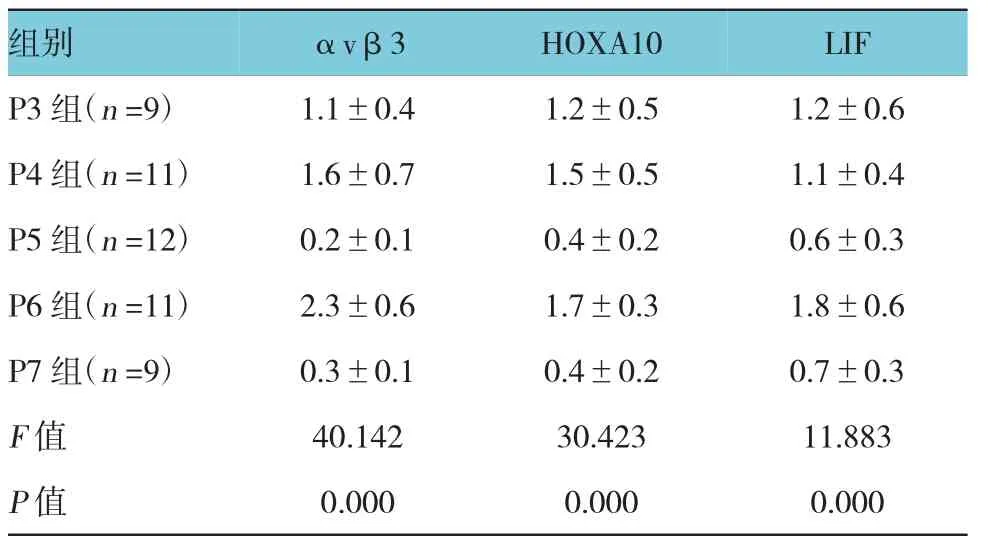
表25组子宫内膜αvβ3、HOXA10及LIF 3种蛋白的表达水平比较 (±s)
?
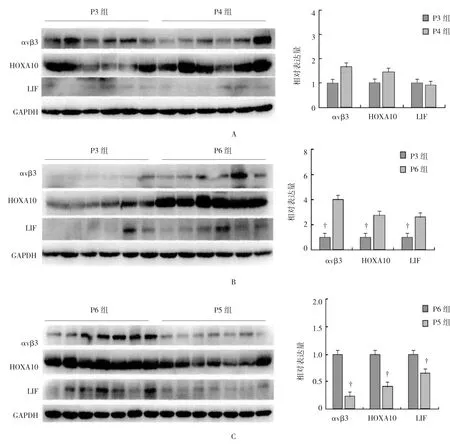
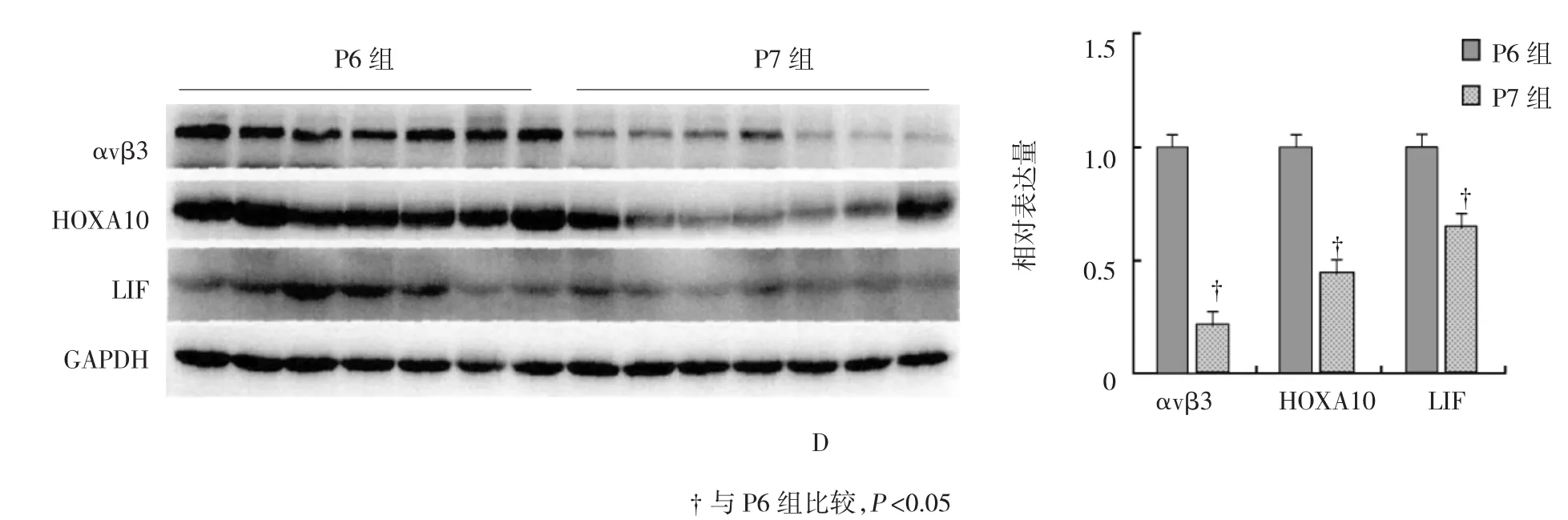
图2 5组子宫内膜αvβ3、HOXA10及LIF 3种蛋白的表达水平
3 讨论
就当前体外受精-胚胎移植在临床开展的情况来看,FET愈发变得常规化,但某些环节仍需进一步完善。在自然周期中,成熟的子宫内膜与胚胎发育存在良好地同步性,这是确保其在接触时均能处于最理想状态的生理性基础。HRT-FET周期则往往不具备这样的条件,目前关于在FET前最佳的黄体酮持续给予时同尚未达成共识。在HRT周期中,如果子宫内膜与胚胎未能较好同步,则可能发生种植窗口提前关闭、种植率降低或胚胎发育延迟等多种情况。如何更为满意地实现同步化是当前生殖医学领域的重点研究方向之一[5-6]。
有研究认为,呈完全发育状态胞饮突的大面积出现与消失分别对应着种植窗开放与关闭的两种状态,并建议将胞饮突的该特征作为评估子宫内膜容受性及把握种植窗时间的形态学标志物[7]。但新近有个别学者对该观点提出质疑,尤其在胞饮突持续时间方面争议颇大。有研究者认为,胞饮突于月经周期的黄体中期所持续的时间<48 h[8];另有研究者则提出,胞饮突的一般出现于排卵后的一小段时间内,而持续时间则可能至黄体末期乃至妊娠11周左右[9]。基于多方研究存在较大的不一致性,故有学者得出通过胞饮突并不能对人类种植窗做出精确描述的结论。在本研究中,笔者发现偶尔也能在P3与P4组中观察到呈完全发育状态的胞饮突,虽然非常少量,但是由此推测,在黄体酮补充第8天内同样也可能存在少量的呈完全发育状态的胞饮突。其原因可能为子宫内膜胞饮突实为发育后的微绒毛细胞,且该发育过程受孕激素调节[10-12]。而在持续高水平孕激素的环境条件下,微绒毛细胞可能会表现有一个动态的变化周期,即微绒毛细胞→发育中胞饮突→完全发育胞饮突→衰退期胞饮突→微绒毛细胞。同时本研究中,P6组有8例(72.7%)处于完全发育状态,且该组胞饮突覆盖面积评分也最高。故推断尽管胞饮突会以较少数量的形式零散存在于其他黄体期时间,但呈完全发育状态胞饮突的数量可在某一时间达峰值,该时间可能为最佳容受性时间点。因此,或许除对胞饮突持续时间进行评估外,考察成熟胞饮突的数量也非常重要。
不同个体其成熟胞饮突数量达峰值的时间不完全相同。以28 d为常规周期,正常情况下的峰值出现时间为19~21 d(参照本研究为P5~P7),而大多数不孕女性则为第20天。在卵巢刺激周期,正常峰值时间为18~22 d,而大多数不孕女性则为第19天(第14天排卵),亦即是说较自然周期提前1~2d。在HRT周期中,不同女性峰值时间通常为周期第20~22天(参照本研究为P6~P8),黄体酮首次补充时间(即本研究的P1)为第15天。但未接受卵巢抑制治疗患者其胞饮突出现的时间变化为P6~P10[13]。激素的应用及患者个体差异可能是导致峰值时间不同的重要原因[14]。在本研究中,多数患者在黄体酮补充第5天开始有观察到胞饮突形成,在P6日达峰值,P7日开始衰退,而P5~P7对应自然周期的19~21d,该结果提示本研究方案中成熟胞饮突的形成时间与自然周期相似。
另一方面,本研究还发现一个非常有趣的现象,即是αvβ3、HOXA10及LIF 3种子宫内膜容受性分子标志物的蛋白表达水平同样也在黄体酮补充6 d时达最高,这与胞饮突在HRT周期中的发育情况一致。该结果提示,αvβ3、HOXA10及LIF可能与胞饮突潜存着某种关联,并通过一定的相互作用来共同影响子宫内膜容受性[15-16]。同时在本研究所开展的HRT方案中,黄体酮补充6 d子宫内膜具最佳容受性的时间点。然而相关研究发现,根据第3天体外冻融胚胎的发育情况及HRT周期方案,于黄体酮补充3 d时对第3天胚胎进行移植,胚泡植入正好发生在胞饮突呈完全发育状态的时间[17]。故就本研究所实施的HRT方案而言,多数患者的最佳移植时间应该在黄体酮刚好补充3 d。根据本实验结果,对种植反复失败的患者,可以进行HRT周期模拟,于P5 或P6后采集内膜样本,如样本显示绝大多数(>50%)的胞饮突呈完全发育状态,那么当天即为是最佳容受时间,即当天可移植。如样本显示胞饮突呈发展中状态或衰退期状态,则将最佳容受时间对应延迟或提前1 d,即延迟1 d移植或下一周期再行移植。
综上所述,鉴于在本研究所开展的HRT方案中,多数患者于黄体酮补充6 d时,其子宫内膜胞饮突发育程度与αvβ3、HOXA10及LIF 3种子宫内膜容受性分子标志物的蛋白表达水平一致性达最高,故从操作便捷性角度出发,将胞饮突发育程度检测作为FET时间评估的参考依据是可行的,同时在本研究HRT-FET周期中,于黄体酮补充3 d时对胚胎进行移植可能是实现同步化的理想选择。
[1]TEVKIN S,LOKSHIN V,SHISHIMOROVA M,et al.The frequency of clinical pregnancy and implantation rate after cultivation of embryos in a medium with granulocyte macrophage colony-stimulating factor(GM-CSF)in patients with preceding failed attempts of ART[J].Gynecological Endocrinology,2014,30(S1):9-12.
[2]XU C K,TANG S B.Alteration of endometrial receptivity in rats with ovarian hyperstimulation syndrome[J].J Obstet Gynaecol, 2014,34(2):146-152.
[3]SHAH C A,BEI L,WANG H,et al.Cooperation between Alphav Beta 3 integrin and the fibroblast growth factor receptor enhances proliferation of Hox-overexpressing acute myeloid leukemia cells[J].Oncotarget,2016,7(34):DOI:10.18632/oncotarget.10189.
[4]冯苗,李素春,潘萍,等.子宫内膜着床窗期血管生成状态及胞饮突表达对胚胎着床的影响[J].中国实用妇科与产科杂志,2010,26(7):525-529.
[5]TADROS T,TARASCONI B,NASSAR J,et al.New automated antimüllerian hormone assays are more reliable than the manual assay in patients with reduced antral follicle count[J].Fertil Steril, 2016,106(7):1800-1806.
[6]YU N,ZHANG B,XU M,et al.Intrauterine administration of autologous peripheral blood mononuclear cells (PBMCs)activated by HCG improves the implantation and pregnancy rates in patients with repeated implantation failure:a prospective randomized study[J].Am J Reprod Immunol,2016,76(3):212-216.
[7]SUDOMA I,GONCHAROVA Y,ZUKIN V.Optimization of cryocycles by using pinopode detection in patients with multiple implantation failure:preliminary report[J].Reprod Biomed Online, 2011,22(6):590-596.
[8]NIKAS G,MAKRIGIANNAKIS A,HOVATTA O,et al.Surface morphology of the human endometrium.Basic and clinical aspects[J]. Aim N Y Acad Sci,2000,900:316-324.
[9]QUINN C E,CASPER R F.Pinopodes:a questionable role in endometrial receptivity[J].Hum Reprod Update,2009,15(2):229-236.
[10]XU H,DENG K,LUO Q,et al.High serum FSH is associated with brown oocyte formation and a lower pregnacy rate in hu man IVF parctice[J].Cell Physiol Biochem,2016,39(2):677-684.
[11]GUAN Y,FAN H,STYER A K,et al.A modified natural cycle resultsin higherlivebirth ratein vitrified-thawed embryo transfer for women with regular menstruation[J].Syst Biol Reprod Med,2016,62(5):335-342.
[12]YU N,ZHANG B,XU M,et al.Intrauterine administration of autologous peripheral blood mononuclear cells(PBMCs)activated by HCG improves the implantation and pregnancy rates in patients with repeated implantation failure:a prospective randomized study[J].Am J Reprod Immunol,2016,76(3):212-216.
[13]RASHIDI B,RAD JAFAR S,ROSHANGAR L,et al.Progesterone and ovarian stimulation control endometrial pinopode expression before implantation in mice[J].Pathophysiology,2012, 19(2):131-135.
[14]GARCIA-VELASCO J A,NIKAS Q,REMOHI J,et al.Endometrial receptivity in terms of pinopode expression is not impaired in women with endometriosis in artificially prepared cycles[J].Fertil Steril,2001,75(6):1231-1233.
[15]SUBRAMANI E,MADOGWE E,RAY C D,et al.Dysregulated leukemia inhibitory factorand itsreceptorregulated signal transducers and activators of transcription 3 pathway:a possible cause for repeated implantation failure in women with dormant genital tuberculosis[J].Fertil Steril,2016,105(4):1076-1084.
[16]XU C K,TANG S B.Alteration of endometrial receptivity in rats with ovarian hyperstimulation syndrome[J].J Obstet Gynaecol, 2014,34(2):146-152.
[17]CREUS M,ORDI J,F?BREGUES F,et al.The effect of different hormone therapies on integrin expression and pinopode formation in the human endometrium:a controlled study[J].Human Reproduction,2003,18(4):683-693.
(童颖丹 编辑)
Optimal time of endometrial receptivity in hormone replacement therapy-frozen embryo transfer cycles
Yun Zhang,Fang Xiong,Hong-yan Xu,Xiao Xiao,Ju-xia Xiao,Ping Zhou
(Wuxi Maternal and Child Health Hospital Affiliated to Nanjing Medical University,Wuxi,Jiangsu 214000,China)
ObjectiveTo investigate the optimal time of endometrial receptivity in hormone replacement therapy-frozen embryo transfer(HRT-FET)cycles.Methods According to days of exposure to progesterone,52 cases undergoing HRT-FET were divided into P3 group,P4 group,P5 group,P6 group and P7 group. Pinopode morphology,coverage area,integrin alpha v beta 3 (αvβ3),homeobox gene A10 (HOXA10)and leukemia inhibitory factor(LIF)were detected and compared among the groups.Results Most of the cases had the highest expression of αvβ3,HOXA10 and LIF after 6-day exposure to progesterone.Conclusions It is feasible to evaluate the degree of sporadic development of embryos as embryo transfer time.The transplantation of the embryo on the 3rd day of progesterone supplementation may be an ideal choice for the synchronization of endometrium and embryo.
hormone replacement therapy-frozen embryo transfer;endometrium;endometrial receptivity
R<714.8 class="emphasis_bold">714.8 文献标识码:A714.8
A
10.3969/j.issn.1005-8982.2017.06.011
1005-8982(2017)06-0054-05
2016-05-26
