右美托咪定对神经病理性痛大鼠脊髓P2X3 和P2X4受体表达的影响*
2017-04-06陈桂玲张加强
陈桂玲,张加强
(1.河南省义马市义煤总医院,河南 义马 472300;2.河南省人民医院,河南 郑州 450003)
右美托咪定对神经病理性痛大鼠脊髓P2X3 和P2X4受体表达的影响*
陈桂玲1,张加强2
(1.河南省义马市义煤总医院,河南 义马 472300;2.河南省人民医院,河南 郑州 450003)
目的探讨右美托咪定对神经病理性痛大鼠脊髓P2X3和P2X4受体表达的影响。方法 60只健康雄性SD大鼠随机分为假手术组(Sham组)、神经病理性痛组(NP组)和右美托咪定干预组(DI组),复制神经病理性痛大鼠模型。于模型复制即刻,DI组大鼠腹腔注射40μg/kg右美托咪定,间隔24 h给药1次,连续进行至模型复制成功后14 d,Sham组和NP组给予等量生理盐水腹腔注射。分别于复制模型前(T0)、复制模型后24 h (T1)、72 h(T2)、7 d(T3)和14 d(T4),对大鼠机械缩足阈值(MWT)和热缩足潜伏期(TWL)进行测定。Western blot检测大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白的表达。结果 与Sham组比较,NP组和DI组大鼠T1、T2、T3、T4时MWT和TWL降低;与NP组比较,DI组大鼠T2、T3、T4时MWT和TWL升高,差异有统计学意义(P<0.05)。与Sham组比较,NP组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白升高;与NP组相比,DI组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白降低,差异有统计学意义(P<0.05)。结论 右美托咪定可有效改善神经病理性痛大鼠痛觉过敏症状,可能与抑制脊髓中P2X3和P2X4受体蛋白的表达有关。
右美托咪定;神经病理性痛;P2X3受体;P2X4受体
神经病理性痛作为临床上常见的疼痛类型,发病机制较为复杂,患者常表现为自发痛、痛觉过敏等,尚无特效治疗手段,且发病率较高,给患者身心带来巨大痛苦[1]。三磷酸腺苷(adenosine triphosphate,ATP)作为机体能量供应物质,亦具有神经递质功能。研究表明,ATP参与神经病理性痛发病过程[2]。P2X受体是配体门控阳离子通道受体,是ATP主要受体。研究表明,神经病理性痛大鼠背根神经节中P2X3和P2X4受体表达上调[3-4]。右美托咪定是临床上常用的α2肾上腺素能受体激动剂,具有高度选择性,是常用的镇静、镇痛药物[5],但其具体的镇痛机制尚未明确,本研究尝试利用右美托咪定对神经病理性痛大鼠进行镇痛,观察其镇痛效果,探讨其可能的作用机制,以期为临床实践提供基础资料。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠60只,购自河南省实验动物中心[合格证号:SCXK(豫)2011-0003],体重180~220 g,饲养于标准条件下,自由摄食、进水。利用随机数字表随机分为假手术组(Sham组)、神经病理性痛组(NP组)和右美托咪定干预组(DI组),每组20只。所有大鼠实验前在独立环境中适应1周。
1.2 实验方法
1.2.1 神经病理性痛大鼠模型的复制 参照文献[6]中的方法复制大鼠神经病理性痛模型。腹腔注射80 mg/kg巴比妥钠麻醉后,对右后肢大腿进行备皮,消毒后,将皮肤沿右股骨下缘切开,对肌肉进行钝性分离使坐骨神经充分暴露,于坐骨神经分叉前,用4号铬制羊肠线连打4个松结,结与结间隔1 mm,让神经外膜轻微受压,力度以足指轻微抽动为准。将肌肉、筋膜及皮肤进行缝合后,将鼠重新放回笼子进行饲养,大鼠出现跛行、舔舐及悬空后肢等说明模型复制成功。Sham组大鼠将将坐骨神经暴露3~4 min,不进行打结。
1.2.2 干预措施 于神经病理性痛模型复制即刻,DI组大鼠腹腔注射40 μg/kg右美托咪定(江苏恒瑞医药股份有限公司,国药准字:H20090251),间隔24h给药1次,连续进行至建模后14 d,Sham组和NP组给予等量生理盐水腹腔注射,实验过程中各组大鼠未出现死亡。
1.2.3 机械缩足阈值 (mechanicalwithdrawal threshold,MWT)和热缩足潜伏期(thermal withdrawal latency,TWL)测定 分别于复制模型前(T0)、复制模型后24 h(T1)、72 h(T2)、7 d(T3)和14 d (T4),对大鼠MWT和TWL进行测定。将大鼠置于有机玻璃罩中,待其适应、安静后,用美国Stoelting公司生产的Von Frey纤维丝,由小到大施加不同垂直压力刺激大鼠左后脚掌第3、4趾间皮肤,直到出现抬足或舔足行为,重复测3次,每次间隔5 min,取均值作为MWT。大鼠在有机玻璃箱内适应20 min后,用北京凯辉盛达科技发展有限公司生产的热痛刺激仪照射大鼠足底,记录大鼠从开始照射到出现抬腿回避的时间,连续测3次,每次间隔5 min,取均值作为TWL。
1.2.4 Western blot检测大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白的表达 于复制模型后14 d测定MWT和TWL,将大鼠进行麻醉,处死后留取脊髓L4~6节段,10只大鼠的脊髓样品用于总蛋白提取。样品充分研磨后加入细胞裂解液(上海瑞齐生物科技有限公司)和蛋白酶抑制剂,4℃、12 000 r/min离心15 min,取上清液,用二喹啉甲酸(bicinchoninic acid,BCA)法对获得的总蛋白定量。另外10只大鼠的脊髓样品用于膜蛋白提取。脊髓样品用磷酸盐缓冲溶液冲洗3次后,用膜蛋白抽提试剂盒(上海劢瑞生物科技有限公司)提取细胞膜蛋白,用BCA法对获得的细胞膜蛋白定量。分别取30μg总蛋白和膜蛋白,用聚丙烯酰胺凝胶电泳后,电转移至聚偏氟乙烯膜上,用3%胎牛血清封闭2 h,分别将兔抗大鼠P2X3受体、P2X4R多克隆抗体(美国Sigma公司,1∶500稀释)加入,4℃过夜孵育,用三羟基甲胺-盐酸缓冲盐溶液(Tris-HCl buffer saline,TBS)缓冲液冲洗3次,将辣根过氧化物酶标记的二抗(1∶2000稀释)加入,室温下孵育60 min,用TBS缓冲液冲洗3次,用增强化学发光试剂盒(上海通善生物科技有限公司)发光显像,用Quantity One图像分析软件进行分析,分别获得脊髓P2X3和P2X4受体总蛋白及膜蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用单因素分析或重复测量设计的方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠的行为表现
3组大鼠在复制模型中和复制模型后均未出现死亡及术侧后肢感染、自噬、运动功能丧失等。Sham组大鼠复制模型前后术侧后肢运动未表现出现明显异常,NP组和DI组大鼠复制模型后出现术侧后抓内收、外翻及跛行,DI组大鼠在给予干预3 d后运动症状改善。
2.2 3组大鼠不同时间MWT和TWL的变化
2.2.1 3组大鼠MWT比较 Sham组、NP组和DI 组T1、T2、T3、T4的MWT比较,采用重复测量数据的方差分析,结果:①不同时间的MWT有差异(F=43.857,P=0.000)。②Sham组、NP组及DI组的MWT有差异(F=109.642,P=0.000),NP组、DI组较Sham组的MWT低,DI组较NP组的MWT高,右美托咪定可改善机械缩足阈值。③Sham组、NP组及DI组的MWT变化趋势有差异(F=22.943,P=0.000)。见表1和图1。
表1 3组大鼠不同时间MWT比较 (n=20,g,±s)

表1 3组大鼠不同时间MWT比较 (n=20,g,±s)
?
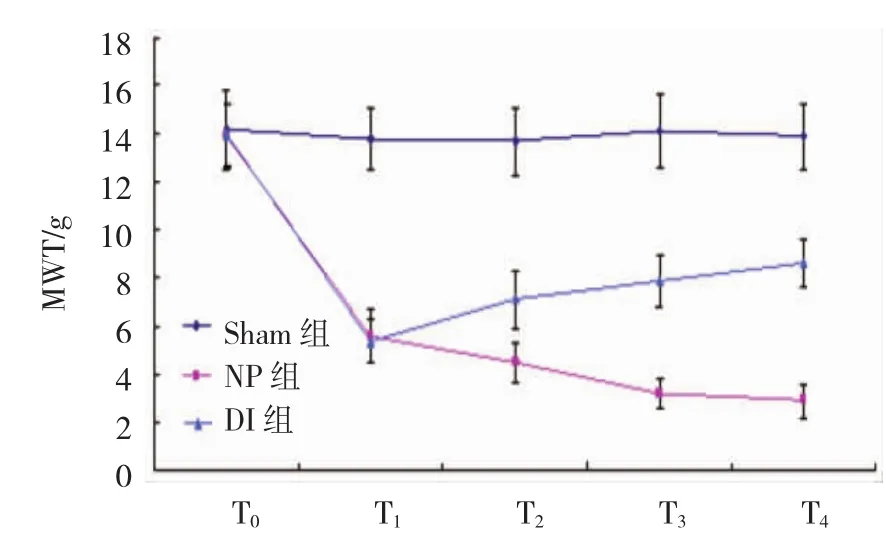
图13组大鼠MWT不同时间变化趋势
2.2.2 3组大鼠TWL比较 Sham组、NP组和DI 组T1、T2、T3、T4的TWL比较,采用重复测量数据的方差分析,结果:①不同时间点的TWL有差异(F= 39.672,P=0.000)。②Sham组、NP组及DI组的TWL有差异(F=91.628,P=0.000),NP组、DI组较Sham组的TWL低,DI组较NP组的TWL高,右美托咪定可改善热缩足潜伏期。③Sham组、NP组及DI组的TWL变化趋势有差异(F=22.943,P=0.000)。见表2和图2。
表2 3组大鼠不同时间TWL比较 (n=20,s,±s)
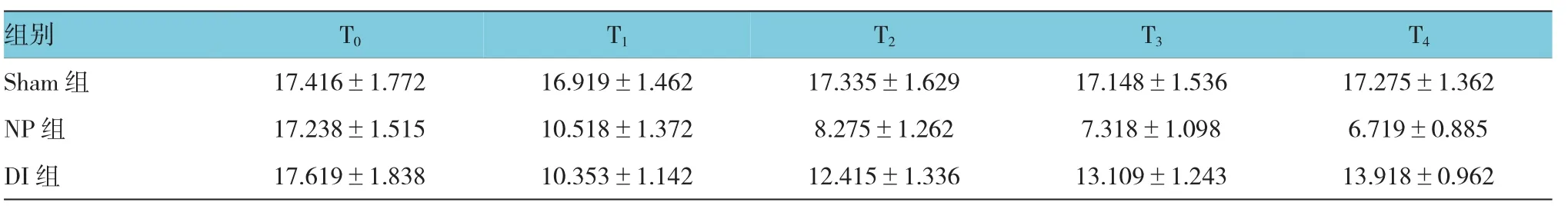
表2 3组大鼠不同时间TWL比较 (n=20,s,±s)
?
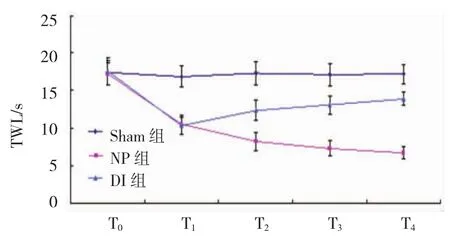
图23组大鼠TWL不同时间变化趋势
2.3 3组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白表达
NP组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白与Sham组比较,差异有统计学意义(P<0.05),NP组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白升高。DI组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白与NP组比较,差异有统计学意义(P<0.05),DI组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白降低。见表3。
表3 3组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白的表达 (n=20,±s)
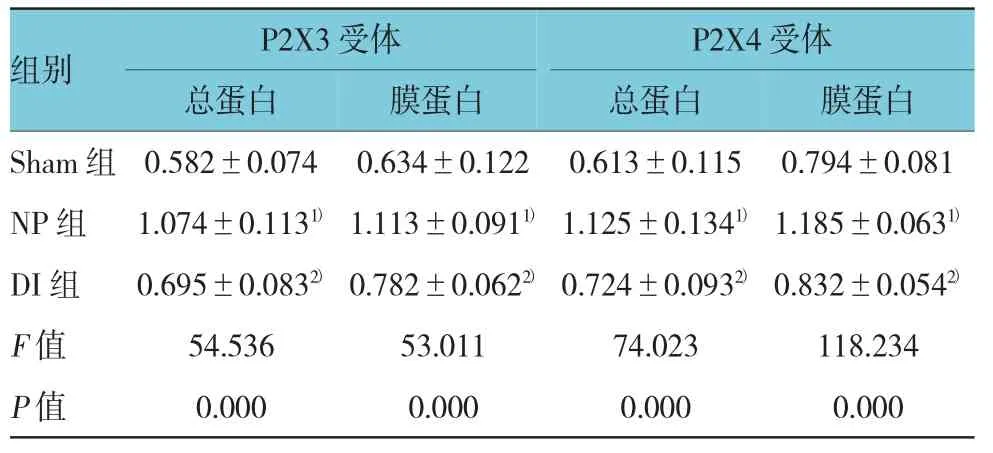
表3 3组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白的表达 (n=20,±s)
注:1)与Sham组比较,P<0.05;2)与NP组比较,P<0.05
?
3 讨论
神经病理性痛作为临床上常见的慢性顽固性疼痛,病情迁延反复,目前尚无有效的治疗手段,给患者生活质量造成严重影响。坐骨神经挤压伤模型作为经典的神经病理性痛动物模型,可模拟人类神经病理性痛表现,应用较为广泛。本研究显示,NP组和DI组大鼠模型复制成功后出现术侧后抓内收、外翻及跛行;与复制模型时比较,NP组和DI组大鼠复制模型后MWT和TWL均降低,说明大鼠出现机械痛敏及热痛敏,表现出神经病理性痛症状,提示成功复制神经病理性痛大鼠模型。
右美托咪定作为新型的高选择性α2肾上腺素能受体激动剂,可作用于神经元α2A受体而发挥镇痛功能[7]。本研究显示,DI组大鼠在给予干预3 d后运动症状改善,与NP组比较,DI组大鼠T1、T2、T3、T4时MWT和TWL升高,说明右美托咪定可有效改善神经病理性痛大鼠疼痛症状。ATP作为重要的能力供应物质,亦可与细胞表面受体结合而发挥信号传导的功能,在疼痛产生过程中发挥重要调控作用[8]。P2X受体是ATP主要的受体类型,P2X3受体在与伤害性信息传递相关的中枢及外周神经细胞中分布广泛,在疼痛信息传递及调控中发挥重要作用[9]。有研究指出,P2X3受体在坐骨神经结扎引起的神经性痛大鼠背根神经节中表达上调[10]。特异性抑制P2X3受体表达对大鼠的镇痛功能[11]。P2X4受体作为ATP受体类型之一,主要在脊髓小胶质细胞中表达,参与神经病理性疼痛发生过程[12]。本研究显示,与Sham组比较,NP组大鼠脊髓P2X3和P2X4受体总蛋白均升高,说明P2X3和P2X4受体均参与神经病理性痛发生过程。分析其原因,可能是在外周神经受损后,炎症介质或损伤通过一系列级联反应而使胞核中转录因子被激活,使P2X3和P2X4受体被大量转录及翻译而参与痛觉过敏的发生[13]。而且在生物功能发挥中,只有位于细胞膜上的受体与配体结合才能发挥相应的生物学功能。本研究显示,与Sham组比较,NP组大鼠脊髓P2X3和P2X4受体膜蛋白均升高,说明在外周神经发生损伤后,大量的炎症介质在促使胞核转录的同时,亦诱导溶酶体的胞吐功能,使产生的P2X3和P2X4受体被转移到细胞膜,从而加速与ATP结合而参与痛觉过敏的产生[14]。本研究显示,与NP组比较,DI组大鼠脊髓P2X3和P2X4受体总蛋白及膜蛋白均降低,说明右美托咪定干预可降低脊髓P2X3和P2X4受体总蛋白及膜蛋白表达,从而患者疼痛的发生。分析其原因,右美托咪定可特异性与脊髓背角突触前膜α2A受体结合,使突触前抑制,减少钙离子内流,从而减少ATP释放,通过一系列级联反应而使胞核中P2X3和P2X4受体表达减少,从而影响其在疼痛发生中的作用[15]。
综上所述,右美托咪定可有效改善神经病理性痛大鼠痛觉过敏症状,可能与抑制脊髓细胞中P2X3 和P2X4受体蛋白的表达,并抑制其向胞膜转运减少与配体结合有关。
[1]FINNERUP N B,ATTAL N,HAROUTOUNIAN S,et al.Pharmacotherapy for neuropathic pain in adults:a systematic review and meta-analysis[J].Lancet Neurol,2015,14(2):162-173.
[2]KAWANO T.Potentiation of neuronal ATP-sensitive potassium channels as a novel target for neuropathic pain[J].Nihon Yakurigaku Zasshi,2015,146(1):10-15.
[3]ZHOU Y L,JIANG G Q,WEI J,et al.Enhanced binding capability of nuclear factor-κB with demethylated P2X3 receptor gene contributes to cancer pain in rats[J].Pain,2015,156(10):1892-1905.
[4]CHEN X M,XU J,SONG J G,et al.Electroacupuncture inhibits excessive interferon-γ evoked up-regulation of P2X4 receptor in spinal microglia in a CCI rat model for neuropathic pain[J].Br J Anaesth,2015,114(1):150-157.
[5]PENG K,WU S R,JI F H,et al.Premedication with dexmedetomidine in pediatric patients:a systematic review and meta-analysis[J].Clinics(Sao Paulo),2014,69(11):777-786.
[6]AMIN B,HAJHASHEMI V,HOSSEINZADEH H.Minocycline potentiates the anti-hyperalgesic effect of ceftriaxone in CCI-induced neuropathic pain in rats[J].Res Pharm Sci,2015,10(1):34-42.
[7]GELEGEN C,GENT T C,FERRETTI V,et al.Staying awake-agenetic region that hinders α2 adrenergic receptor agonist-induced sleep[J].Eur J Neurosci,2014,40(1):2311-2319.
[8]肖智,文松.右美托咪啶对糖尿病神经病理性疼痛大鼠的镇痛作用[J].中国疼痛医学杂志,2015,21(5):341-350.
[9]DI VIRGILIO F.P2X receptors and inflammation[J].Curr Med Chem,2015,22(7):866-877.
[10]HARHUNM I,SUKHANOVAK,GORDIENKOD,etal. Molecular identification of P2X receptors in vascular smooth muscle cells from rat anterior,posterior,and basilar arteries[J]. Pharmacol Rep,2015,67(6):1055-1060.
[11]SUNDUKOVA M,VILOTTI S,ABBATE R,et al.Functional differences between ATP-gated human and rat P2X3 receptors are caused by critical residues of the intracellular C-terminal domain[J].J Neurochem,2012,122(3):557-567.
[12]CAO Q,ZHONG X Z,ZOU Y,et al.Calcium release through P2X4 activates calmodulin to promote endolysosomal membrane fusion[J].J Cell Biol,2015,209(6):879-894.
[13]BURNSTOCK G.Physiopathological roles of P2X receptors in the central nervous system[J].Curr Med Chem,2015,22(7):819-844.
[14]BELE T,FABBRETTI E.P2X receptors,sensory neurons and pain[J].Curr Med Chem,2015,22(7):845-850.
[15]FARGHALY H S,ABD-ELLATIEF R B,MOFTAH M Z,et al. The effects of dexmedetomidine alone and in combination with tramadol or amitriptyline in a neuropathic pain model[J].Pain Physician,2014,17(2):187-195.
(童颖丹 编辑)
Effects of Dexmedetomidine on expressions of P2X3 and P2X4 receptors in spinal cord of rats with neuropathic pain*
Gui-ling Chen1,Jia-qiang Zhang2
(1.General Hospital of Yima Coal Industry Group,Yima,Henan 472300,China;2.People's Hospital of Henan Province,Zhengzhou,Henan 450003,China)
ObjectiveTo investigate the effects of Dexmedetomidine on the expressions of P2X3 receptor and P2X4 receptor in the spinal cord of rats with neuropathic pain.Methods Sixty healthy male SD rats were randomly divided into sham operation group (sham group),neuropathic pain group (NP group)and Dexmedetomidine intervention group (DI group).The neuropathic-pain rat models were constructed.At the start of model construction,the rats in the DI group were intraperitoneally injected with 40 μg/kg Dexmedetomidine, which was repeated at 24-h intervals till 14 d after the models were successfully constructed.The rats in the sham group and the NP group were given intraperitoneal injection of normal saline.Mechanical withdraw threshold (MWT)and thermal withdrawal latency (TWL)of the rats were detected before model construction (T0)and 24 h(T1),72 h(T2),7 d(T3)and 14 d(T4)after model construction.The expressions of total proteins and membrane proteins of P2X3 receptor and P2X4 receptor in the spinal cord of the rats were detected using Western blot.Results Compared with the sham group,the MWT and TWL in the NP group and the DI group were decreased at T1-4;compared with the NP group,the MWT and TWL in the DI group were increased at T2-4,the differences were statistically significant (P<0.05).Compared with the sham group,the expressions of total proteins and membrane proteins of P2X3 receptor and P2X4 receptor in the spinal cord of the rats in the NP group were increased;compared with the NP group,the expressions of total proteins andmembrane proteins of P2X3 receptor and P2X4 receptor in the spinal cord of the rats in the DI group were decreased,the differences were statistically significant(P<0.05).Conclusions Dexmedetomidine could effectively improve the symptoms of neuropathic hyperalgesia in the neuropathic-pain rats.It might be related with the inhibition of the expressions of P2X3 receptor and P2X4 receptor proteins in the spinal cord.
Dexmedetomidine;neuropathic pain;P2X3 receptor;P2X4 receptor
R741
A
10.3969/j.issn.1005-8982.2017.06.006
1005-8982(2017)06-0027-05
2016-08-01
河南省2015科技发展计划项目(No:152300410163)
