基于microRNA和mtDNA的相关性阐述活血化痰中药防御心肌缺血再灌注损伤的分子机制
2017-04-06林飞陈恒文石卓林赵国安孙业喜
林飞+陈恒文+石卓林+赵国安+孙业喜
[摘要]大量基础和临床研究显示活血化痰中药通过调节脂质代谢防治心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI),然其机制尚不十分清晰。经研究线粒体DNA,microRNAs以及脂质代谢参与MIRI整个过程且影响预后,线粒体DNA mtDNA突变是引起心肌缺血和再灌注心肌细胞损伤的首要因素,microRNAs通过表达下降或过表达调控相关基因加重或减轻MIRI损伤,而作为胆固醇转运关键调节器的miR-33通过位于线粒体上CROT,PGC-1α,AMPK等相关基因而调控脂质代谢,然同mtDNA和microRNAs的相关性研究却较之为少。因此深入研究miR-33同mtDNA,MIRI的相关性,探析活血化痰中药是否靶标miR-33调节脂质代谢,引起mtDNA突变或缺失对于防治MIRI有着重要意义。
[关键词] 冠心病; 线粒体; microRNA; 脂质代谢
[Abstract] A large number of basic and clinical studies have shown that the Chinese herbs with promoting blood circulation and resolving phlegm effects could prevent and treat myocardial ischemia-reperfusion injury(MIRI) by regulating lipid metabolism. But its mechanism is not yet clear. The studies show that mitochondrial DNA (mtDNA), microRNAs and lipid metabolism participate in the whole process of MIRI and affect the prognosis. mtDNA mutation is the primary factor to cause myocardial ischemia and reperfusion myocardial cell damage. microRNAs aggravate or reduce MIRI injury by down-regulating or up-regulating related genes expression, while miR-33, as a key regulator of cholesterol transport, regulates lipid metabolism through CROT, PGC-1α, AMPK and other genes located in the mitochondria. There are less studies on correlation between miR-33 and mtDNA, microRNAs. Therefore, further studies on the correlation between miR-33 and mtDNA, microRNAs, as well as the discussions on whether the traditional Chinese medicine (TCM) with promoting blood circulation and resolving phlegm effects could target miR-33 to regulate lipid metabolism and inducemt DNA mutations or deletions, would have important significance for the prevention and treatment of MIRI.
[Key words] coronary heart disease; mitochondria; microRNA; lipid metabolism
心肌缺血再灌注損伤(myocardial ischemia reperfution injury,MIRI)是引起静脉溶栓、经皮冠状动脉介入术、冠状动脉旁路移植术后心律失常、心肌舒缩功能降低、能量代谢障碍、细胞凋亡的首要病理因素之一[1]。近些年,中药以其独特多途径多靶点的协同疗效广泛应用于MIRI的防治,大量研究表明中药通过减少氧化应激、改善能量代谢、防止细胞凋亡、抑制钙超载、调节炎性介质、抑制线粒体膜通透孔、增加线粒体DNA拷贝数[2-8]等多个途径防御心肌缺血再灌注损伤,然迄今为止,其保护机制尚未完全清晰。经研究线粒体DNA,microDNA以及脂质代谢的异常是决定MIRI的重要因素之一,中药是否通过上述作用防御MIRI,则是本研究主要内容。
1 线粒体DNA突变对MIRI造成双重损伤
心肌缺血-再灌注损伤包括缺血和含氧血流恢复后的再灌注损伤,二者叠加对心肌细胞造成双重的损伤,在这双重损伤之中mtDNA突变扮演了重要的角色。mtDNA存在线粒体内是机体唯一的核外遗传物质,同电子呼吸链毗邻,为裸露的环状单螺旋结构,缺乏蛋白质保护,容易受到线粒体本身氧化磷酸化过程中的氧自由基以及疾病、遗传和环境等因素影响而发生突变,突变率比核DNA高,具有母系遗传、半自主复制、异质性、随机分配、高突变率、高利用率、阈值效应和协同效应等特性[9-10]。
1.1 缺血损伤 心肌缺血与mtDNA突变互为因果是造成冠心病发生发展的主要因素。心肌缺血引起mtDNA损伤,当冠脉狭窄、心肌细胞缺血和反复出现低血氧时导致线粒体ATP合成和氧化磷酸化抑制,细胞难以维持正常的ATP含量,造成能量生成障碍、细胞内外离子稳态失衡、乳酸酸中毒、心肌舒缩功能障碍严重影响心脏功能,此外缺血的心肌细胞产生大量的氧自由基能则增加mtDNA损伤和氧化磷酸化不足,大范围mtDNA突变或缺失涉及多个mtDNA的基因编码区域,造成氧化磷酸化基因转录水平异常,可导致氧化磷酸化障碍,ATP产生不足,引起组织器官损伤。心肌缺血的程度与心肌细胞mtDNA缺失突变率相关,mtDNA突变是加重心肌缺血,导致线粒体功能障碍,促进炎症反应,细胞凋亡和细胞衰老[11]的重要因子,影响氧化磷酸化,使线粒体功能紊乱,加速细胞凋亡。现代研究显示mtDNA损伤存在于动脉粥样硬化病变的各个时期,即在动脉粥样发展早期即有mtDNA损害的发生并促进易损斑块的发生发展,如在动脉粥样硬化早期即发现mtDNA 4 977 bp显著突变,而在冠心病患者中发现mtDNA 4 977,7 436,10 422 bp[9],tRNAThr15927G>A[12]均不同程度升高。
1.2 再灌注损伤 缺血对心肌细胞mtDNA造成的损伤是一个漫长的量变到质变的积累过程,受到疾病、遗传、地理以及环境等多因素的影响,而再灌注引起的大量氧自由基、钙超载、炎症反应使原本突变的mtDNA更是雪上加霜不堪一击。研究报道突变的mtDNA在MIRI时,导致线粒体内酶失活、呼吸链传递或氧化磷酸化功能缺陷,从而出现ATP合成障碍,产生过多氧自由基加重mtDNA损伤减少或mtDNA拷贝数,引起mtDNA数量转录水平下降、mtDNA片段缺失和线粒体结构损伤和线粒体功能下降[9,13-19],如MIRI釋放的大量ROS可迅速引起呼吸链酶活性下降和mtDNA 4 834 bp片段缺失,导致该线粒体电子呼吸链不可逆的氧化磷酸化障碍[20],造成缺血组织在恢复血液灌注后,缺血和再灌注二者叠加引起线粒体的损伤,启动心肌细胞凋亡或坏死[21],使得心肌损伤反而加重,造成可逆性缺血损伤加重,亦可能促进可逆性缺血损伤转化为不可逆损伤。
2 microRNAs参与调控MIRI
高等真核生物基因组编码microRNAs(miRNAs),miRNA广泛参与心脏发育和心血管疾病的发生发展[22],参与并调控MIRI整个过程[23],miRNAs是一种大小约21~23个碱基的单链小分子RNA,由核基因组编码,miRNAs作为基因组的调控开关通过和靶基因miRNAs碱基配对构成基因沉默复合体降解miRNAs或阻碍其靶基因的翻译。
2.1 miRNAs与MIRI miRNAs调控线粒体形态、参与线粒体自嗜、影响线粒体代谢、参与线粒体介导的细胞凋亡而调控线粒体的功能、结构和代谢,在心肌MIRI中miRNAs通过影响能量代谢、细胞凋亡、ROS生成、钙超载、离子通道等因素调控线粒体[24-25]。研究显示诸多[23]miRNAs参与MIRI,如保护性miRNAs有miR-2,miR-125b,miR-133a,miR-146a,miR-494,在MIRI之后具有过表达的miR-2促进心脏纤维化、加重心功能障碍;miR-125b减弱促凋亡因子p53,Bak-1和Bax表达;miR-146a引起NF-κB的活性和炎症因子产物;miR-494调节凋亡蛋白。损伤性miRNA有miR-1,miR-15a/15b,miR-29a/29c,miR-320,作用机制分别为miR-1抑制蛋白激酶和热休克蛋白加重心肌缺血再灌注损伤;miR-15a/15b,miR-29a/29c,miR-320作用不同的靶基因促进细胞凋亡[23]。此外,miRNAs也通过影响Bcl-10,ATG9,Cx43蛋白,beclin-1进而影响自噬小体的形成,对自噬起到抑制或激活,从而影响心肌I/R损伤的结局[26]。同时在MIRI中miR-92a和miR-126的表达与氧自由基和心肌细胞凋亡有关联,可能为早期诊断和预测无复流现象提前干预提供思路,并且他汀类药物的干预可以改变miR-92a和miR-126的表达[27]。
2.2 microRNA与动脉粥样硬化 现代研究提示miRNAs可能预测急性心血管事件的发生,实现疾病的诊断、鉴别诊断、危险分层及预后的判断成为动脉粥样硬化疾病生物标志物[28-30],其原因主要是血液循环中miRNAs具有稳定性、细胞间具有交流功能、序列进化保守,调控靶基因,组织和疾病特异性,且检测高度敏感性和特异性。miRNAs参与动脉粥样硬化的发生发展整个过程的多个途径调节多个基因,基础研究显示涉及miR-1,miR-74,miR-126,miR-145,miR-155,miR-146a/b,miR-135b-5b,miR-499a-3p[31-37]等多个miRNAs,其中miR-1可能通过介导靶基因TGF-β2调控巨噬细胞凋亡参与动脉粥样硬化,miR-74可能在DNA转录、心脏发育、投射神经元发育、B细胞活化、血管生成等生物过程发挥重要作用[32]。临床研究显示冠心病患者外周循环血中miR-19b,miR-21,miR-133a,miR-208a,miR-499a等miRNAs参与冠心病的形成发生发展,其中miR-19b抑制内皮增殖miR-21通过调控炎性递质sCD40L而稳定斑块,miR-133a,miR-208a和miR-499a则与冠状动脉狭窄程度成正比[38-40]。再者,学者研究MicroRNAs对冠心病的证候有着一定的影响,如冠心病血瘀证的miR-146b-5p,miR-199a-5p,CALR和TP53,痰浊证miR-363-5p,miR-668,RIPK2和STK4,不稳定心绞痛中miR-146b-5p,miR-199a-3p,IL2RB和FASLG均有不同程度上调下调[41]。
3 miRNAs与mtDNA[42-46]
作为生命过程重要参与者的miRNAs由核基因和线粒体基因编码与mtDNA一起对生命体有着重要的影响,二者相互作用具有紧密的联系,核基因编码的miRNAs通过调控核基因编码或线粒体编码的相关蛋白的表达影响线粒体结构和功能,线粒体基因编码miRNA直接调控线粒体基因表达或转运至胞质调控核基因的表达影响疾病的发生发展。
3.1 miRNAs直接或间接影响mtDNA miRNAs涉及线粒体代谢、线粒体氧化磷酸化、电子传递链组件、脂质代谢等多个代谢过程[47],通过多种途径调节线粒体代谢、形态和生物合成从而影响线粒体功能,进一步影响mtDNA,如癌症、代谢综合征、肌病、心血管等疾病中均提示miRNAs参与调节[48]。2011年,Barrey等对miRBase 中742 miRNAs进行研究,结果显示在人类肌小管的线粒体 RNA片段中有243 miRNAs显著表达,在人线粒体基因组中发现25种pre-miRNA和33种miRNA的潜在编码序列,并首次证实人类肌细胞线粒体中存在miRNA前体(pre-mir-302a,prelet-7b)和成熟miRNA(mir-365)[49]。
学者研究在心血管疾病伴糖尿病患者中加重MIRI的原因可能是同miRNA-200c与miRNA-141的过表达引起线粒体超氧化物歧化酶降低导致ROS升高所致[50]。低氧下表达变化最显著的miR-210通过靶标三羧酸循环和抑制呼吸链活力抑制线粒体代谢,或直接作用于COX10影响线粒体呼吸链[48]。在MIRI中,缺氧通过激活p53抑制miR-499的转录,促进发动蛋白相关蛋白1(dynamin-related protein 1,Drp1)去磷酸化,导致Drp1在线粒体中积累并激活Drp1介导的線粒体裂解,最终促进心肌细胞凋亡[51],而心肌细胞凋亡时与氧化应激密切相关,最终影响线粒体结构、功能以及mtDNA。据报道影响ROS的miRNAs主要有充当抗氧化作用的miR-145,miR-23b,miR-210,充当促氧化作用的miR-335,miR-34a,miR-338,miR-210,miR-181[48],而氧化应激则是冠心病患者mtDNA损伤的首要原因,其机制主要是细胞色素c氧化酶是线粒体呼吸链的关键酶,细胞色素c氧化酶亚基Ⅱ是其活性中心,其活性的改变导致线粒体呼吸链的电子传递受阻,并直接将电子泄露于线粒体基质内,使超氧阴离子产生增多,使线粒体内的氧化应激水平增高,导致mtDNA损伤[ 9]。
3.2 线粒体基因编码miRNAs调控mtDNA 线粒体基因可能编码miRNA,直接或间接调控mtDNA或核基因的表达。mtDNA仅有37个基因,编码13种线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)复合体亚基,22种tRNA和2种rRNA[9],线粒体有自身的转录和翻译体系,线粒体DNA的复制、转录以及线粒体mRNA翻译都是在线粒体内膜内进行的。线粒体基因编码miRNA称为mitomiRs,“mitomiRs”可以作为“载体”,核基因组和线粒体基因组均存在mitomiR靶基因位点,并在细胞水平感知和响应动态变化的线粒体微环境[48],如线粒体lncRNA ASncmtRNA-2i 可能通过hsa-miR-4485和hsa-miR-1973影响内皮细胞衰老和老化[52],mitomiRs作用方式可能有以下几个方面[42,48,53-54]:①Mitomirs 可能具有线粒体调控分子的效力;②Mitomirs可能靶标线粒体表面的核编码基因;③线粒体可以被看作是涉及到Ago2和miRNA的细胞信号传导的平台;④mtDNA的转录、复制可能受mitomiRS的调控。如mitomiRs (mir-146a,-133b,-106a,-19b,-20a,-34a,-181a,-221) 也在miRs中主要涉及到细胞衰老以及炎症衰老,甚至具有转录后调节或线粒体基因组精细调节的作用[53-54]。上述机制可能同多核苷酸磷酸化酶(polynucleotide phosphorylase,PNPase)介导细胞核编码的miRNAs输入线粒体相关,PNPase存在于线粒体膜间隙,PNPase可能通过调控线粒体mitomiRS参与线粒体DNA氧化损伤的调节,线粒体PNPase的表达减少会引起mitomiRS表达谱的改变,MitomiRS表达变化可能导致线粒体结构及功能的改变。
4 miR-33参与调节脂质代谢
线粒体功能的正常发挥离不开核基因组和线粒体基因组的相互作用,miRNAs可能参与细胞核和线粒体间的信息交流,参与能量代谢,脂质代谢、细胞凋亡和线粒体动力学多个过程,介导基因转录后调控,调节生理病理条件下线粒体结构和功能[43,47-48]。
4.1 miR-33 miRNAs被认为是胆固醇逆向转运、HDL生物合成、细胞内胆固醇流出、胆汁分泌的关键调节器,且与动脉粥样硬化发生发展密切相关,并可诊断疾病,判断预后[55],其中沉默miR-33能够影响脂质代谢,促使胆固醇逆向转运,降低线粒体氧化损伤,修复mtDNA突变,保护线粒体的结构和功能,防御缺血性冠心病的发生发展。其中miR-33修复mtDNA的机制主要是能够直接抑制人类8-羟基鸟嘌呤DNA糖苷酶(OGG1)的表达或者通过AMPK间接抑制大鼠或者人类OGG1的表达,在人类冠状动脉和颈动脉斑块中OGG1呈显著减少,OGG1的减少引起mtDNA的损害胜于对核DNA的损害,进而增加巨噬细胞NLRP3炎性体的活化,增加IL-1β,导致动脉斑块中更多的凋亡加速动脉斑块的形成,此外,mtDNA的关键调节因子核因子2和核转录Y亚基α也调节OGG1的表达,同时OGG1的过表达则改善线粒体功能,可能在动脉粥样硬化中起着保护作用[56]。其中Karunakaran D和Price N L的报道[57-58]指出miR-33通过靶基因(CROT,HADHB,CPT1,PGC-1α,AMPK,NRF1/2 PDK4,SLC25A25)导致线粒体呼吸链和ATP的生成和维持正常线粒体生物合成,同时提出沈默miR-33在线粒体功能紊乱疾病(冠心病)的发生发展中可能扮演着重要的角色。因此,miR-33作为防御缺血性心脏病的靶基因,其重要作用可能是通过调节位于线粒体上相关基因而执行。
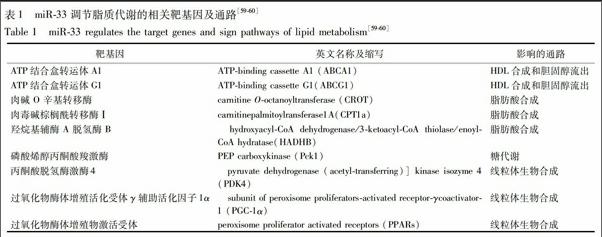
4.2 miR-33相关靶基因及通路 在miR-33的调节基因中,与线粒体有着密切的联系,涉及到下述相关基因及通路,见表1。
首先,CPT1a位于线粒体外膜,CROT耦合短链脂肪酸将其转运到线粒体内,CPT1a将长链脂肪酸转运到线粒体内,HADHB是在线粒体内进行β氧化的关键酶,miR-33可以下调CPT1a,CROT,HADHB,抑制SREBP1抑制脂肪酸氧化使极低密度脂蛋白急剧上升。其次miR-33促进PDK4,PGC-1α,PPARs上调增加线粒体生物合成,前期研究证实活血化痰方促进PGC-1α,PPARs的表达,再者miR-33沉默腺苷酸活化蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]影响能量代谢,也有学者认为miR-33能够调节吞噬细胞炎症反应和抗动脉粥样硬化[61]。此外,高脂饮食能够使肥胖miR-33处于上调状态,通过沉默miR-33能够调节整个身体的氧化代谢但不影响代谢紊乱[62],还能靶向参与脂肪酸β氧化相关基因CPT1A,CROT和HADHB,从而减少脂肪酸的降解。此外,除miR-33外,miR-122,miR-370,miR-378/378,miR-302a,miR-106b等也被报道参与调控胆固醇稳态和脂肪酸代谢[63]。
5 展望
mtDNA和miRNAs均参与心肌缺血再灌注的整个过程,线粒体作为脂质代谢的场所,在调节脂质代谢防御MIRI尤为重要。学者研究miR-144-3p的上调增加维持线粒体功能的关键基因PGC-1α,mtTFA的表达,同样也增加细胞ATP、细胞活力以及mtDNA的拷贝数[64],前期研究结果显示活血化痰中药通过影响脂质代谢,影响脂肪酸β氧化PGC-1α-PPARα通路,进而影响能量代谢;通过抗氧化应激,促进线粒体生物合成通路PGC-1α-NRF1-mtTFA,增加mtDNA合成,2條通路以PGC-1α为交点共同防御心肌I/R损伤,促进心功能的恢复[8],此外番茄红素可通过保护线粒体DNA减轻大鼠MIRI,其保护线粒体DNA的作用可能与其减轻线粒体氧化应激以及稳定线粒体中的Tfam有关[65]。在针灸防治MIRI的研究中,“标本配穴”法电针通过激活抗氧化酶,抑制氧自由基,减轻心肌mtDNA氧化损伤,同时通过上调内源性SIRT1途径,激活其下游PGC-1α/NRF-1/mt TFA信号通路,保护心肌mt DNA而抗心肌缺血损伤[66]。
然而,尽管miR-33作为调节脂质代谢的靶基因对线粒体有着重要的影响,但是机制尚不清晰,面对我国日益增多的冠心病人群,且仅是在我国2015年仅冠心病介入治疗术共计567 583例[67],挽救了数千万患者的生命,但是治疗后的溶栓失败、心力衰竭、冠脉再狭窄、无复流、心律失常、支架内血栓等问题一直以来影响临床救治。并且学者研究活血药植物多酚、阿魏酸均能够干预异常脂质代谢,其中阿魏酸可能通过增加巨噬细胞源性泡沫细胞表面ABCA1和ABCG1的表达水平,促进胆固醇流出,从而发挥抗动脉粥样硬化的作用[68-69],并且上文已述ABCA1和ABCG1则同miR-33密切相关。因此深入研究活血化痰中药是否通过靶标基因miR-33调节脂质代谢,调控线粒体的功能、结构,维护线粒体DNA正常复制转录,保护心肌组织对于阐明活血化痰中药防治冠心病的机制有着重要的意义。
[参考文献]
[1] 吴立玲,张幼仪.心血管病理生理学[M].北京:北京大学医学出版社,2009:19.
[2] 唐昱,黄清,刘燕锋,等.参附注射液对老年大鼠心肌缺血再灌注损伤的保护作用[J].中华老年心脑血管病杂志,2016,18(8):852.
[3] 占海思,潘涛.红景天在心肌缺血再灌注损伤中保护机制的研究进展[J].中国实验方剂学杂志, 2016,22(8):231.
[4] 章春艳,曹政,凡孝琴,等.丹参多酚酸盐保护家兔心肌缺血再灌注损伤的机制研究[J].中国中医急症,2016,25(5):804.
[5] 李俊平,郭丽丽,陈中,等.钙超载与心肌缺血再灌注损伤及中药干预策略[J].中国中药杂志,2016,41(11):2168.
[6] 郑显杰,庞力智,韩玉潇,等.注射用益气复脉(冻干)改善小鼠心肌缺血再灌注损伤的作用[J].中成药,2016,38(3):473.
[7] 李玉红,李妍妍,樊官伟,等.益气养阴活血中药减轻大鼠离体心脏缺血再灌注损伤作用研究[J].中草药,2016,47(2):281.
[8] 林飞.基于《伤寒论》调和气血法研究活血化痰方对高脂血症大鼠心肌I/R损伤的作用及机制[D].武汉:湖北中医药大学,2015.
[9] 刘建康,王学敏.线粒体医学与健康[M].北京:科学出版社,2012:25,103.
[10] 李志强,郑兴.线粒体DNA损伤在冠心病诊断中的意义[J].中国心血管病研究,2006,4(10):787.
[11] Yu E, Calvert P A, Mercer J R, et al. Mitochondrial DNA damage can promote atherosclerosis independently of reactive oxygen species and correlates with higher risk plaques in humans[J]. Atherosclerosis, 2014, 232(2): 702.
[12] 贾子冬.冠心病相关线粒体tRNA~(Thr)15927G>A突变致病机制的研究[D].杭州:浙江大学,2015.
[13] 钟宁,张翼,朱海峰,等.间歇性低氧防止缺血再灌注损伤引起的线粒体结构损伤和mtDNA片段缺失[J].生理学报,2000,52(5):375.
[14] Qiao S, Olson J M, Paterson M, et al. MicroRNA-21 mediates isoflurane-induced cardioprotection against ischemia-reperfusion injury via Akt/Nitric oxide synthase/mitochondrial permeability transition pore pathway[J]. J Am Soc Anesthesiol, 2015, 123(4): 786.
[15] Corral-Debrinski M, Shoffner J M, Lott M T, et al. Association of mitochondrial DNA damage with aging and coronary atherosclerotic heart disease[J]. Mut Res/DNAging, 1992, 275(3): 169.
[16] Ballinger S W. Mitochondrial dysfunction in cardiovascular disease[J]. Free Rad Biol Med, 2005, 38(10): 1278.
[17] Botto N, Berti S, Manfredi S, et al. Detection of mtDNA with 4977 bp deletion in blood cells and atherosclerotic lesions of patients with coronary artery disease[J]. Mutat Res, 2005, 570(1): 81.
[18] Ashar F N, Zhang Y, Moes A, et al. Mitochondrial DNA copy number as a predictor of cardiovascular disease[J]. Circulation, 2014, 130(Suppl 2): A19318.
[19] Yue R, Xia X, Jiang J, et al. Mitochondrial DNA oxidative damage contributes to cardiomyocyte ischemia/reperfusion-injury in rats: cardioprotective role of lycopene[J]. J Cell Physiol, 2015, 230(9): 2128.
[20] Chen Y R, Zweier J L. Cardiac mitochondria and reactive oxygen species generation[J]. Circul Res, 2014,114(3): 524.
[21] Muravyeva M, Baotic I, Bienengraeber M, et al. Cardioprotection during diabetes[J]. Anesthesiology, 2014,120(4): 870.
[22] 杨丽,胡慧媛,郝丽英. MicroRNA与心血管疾病关系的研究[J].生理科学进展,2015,46(5):365.
[23] 单冬凯,宋晓伟,安丽娜,等. MicroRNA:心肌缺血-再灌注损伤的调控者[J].国际心血管病杂志, 2013, 40(5): 269.
[24] 汪丽娜,叶华山. microRNA在心肌缺血再灌注损伤机制中的研究进展[J].湖北科技学院学报:医学版,2016,30(2):180.
[25] 王国芹,万征.微小RNA在心肌缺血再灌注损伤中的作用及机制[J].中国心血管杂志,2013,18(5):387.
[26] 胡丽华,王路乔,程晓曙. microRNA调控自噬在心肌缺血再灌注中作用的研究[J].生命的化学,2015,35(2):230.
[27] 方石虎.微小RNA在心肌缺血再灌注中的临床和基础研究[D].广州:南方医科大学,2013.
[28] 孙启玉.冠状动脉粥样硬化血液生化指标及新microRNA的挖掘[D].北京:中国人民解放军医学院,2015.
[29] 陈和明, 周新民. MicroRNA对动脉粥样硬化相关因素的调节作用[J].微循环学杂志,2016, 26(3):58.
[30] 谭明,颜红兵.血液中微小RNA:冠状动脉粥样硬化疾病的新型生物标志物[J].中国分子心脏病学杂志,2015,15(3):1365.
[31] 郑华峰,陶晶,张斌,等. MicroRNA-1在小鼠动脉粥样硬化斑块中的表达及通过TGF-β2调控巨噬细胞凋亡功能的研究[J].中国临床研究,2015,28(11):1409.
[32] 杨彩娥.动脉粥样硬化和急性冠脉综合征的血清标志物的筛选与临床应用[D].北京:中国人民解放军总医院,解放军医学院,2015.
[33] 王婷,潘旭东,马爱军,等. miR-126在ApoE-/-小鼠颈动脉粥样硬化斑块中的表达[J].中风与神经疾病杂志,2016,33(4):296.
[34] 唐義信,孙权,朱灵萍,等.冠心病患者血浆中 microRNA-145表达与冠状动脉侧支循环形成的相关性研究[J].中国心血管杂志, 2015,20(4):262.
[35] 杨洋. MicroRNA-155对动脉粥样硬化炎症的调控作用及机制研究[D]. 重庆:第三军医大学,2015.
[36] 王文俏,刘露,许馨,等. miR-146a/b在动脉粥样硬化疾病中的研究进展[J].生命科学,2015,27(4):471.
[37] Xu Z, Han Y, Liu J, et al. MiR-135b-5p and MiR-499a-3p promote cell proliferation and migration in atherosclerosis by directly targeting MEF2C[J]. Scientific Rep,2015,5:12276.
[38] 李素芳,陈红,任景怡,等.不稳定冠心病循环microRNA表达谱特点及功能分析[J].中华老年多器官疾病杂志,2015,14(3):196.
[39] 宁明安,刘立鹏,陈书影,等.外周循环血微小RNA表达水平与冠心病发病风险的关联分析[J].中国心血管杂志, 2016, 21(2):108.
[40] 李韶南,刘震,陈平安,等.循环microRNA-21及可溶性CD40L与不稳定斑块的关系[J].临床心血管病杂志, 2015,31(12):1283.
[41] 虞桂.冠心病不稳定性心绞痛血瘀证的 microRNA生物标志物研究[D].北京:中国中医科学院,2013.
[42] 李力力,游扬,周源,等. PNPase调控线粒体microRNA对线粒体DNA的保护作用[J].第三军医大学学报, 2014, 36(8):780.
[43] 王学翔,宋艳瑞,李施施,等. MicroRNA:线粒体功能调控的新机制[J].中国细胞生物学学报, 2013(1):92.
[44] 李力力,颜婧,陈代兴,等. miRNAs对线粒体功能的调控作用[J].生命科学,2013(6):609.
[45] Das S K, Bhutia S K, Sokhi U K, et al. Human polynucleotide phosphorylase(hPNPase(old-35)): an evolutionary conserved gene withan expanding repertoire of RNA degradation functions[J].Oncogene,2011,30(15): 1733.
[46] 李力力. PNPase调控MitomiRs对线粒体DNA氧化损伤的影响[D]. 重庆:第三军医大学, 2014.
[47] Duarte F V, Palmeira C M, Rolo A P. The emerging role of MitomiRs in the pathophysiology of human disease[J]. Adv Exp Med Biol, 2015, 888:123.
[48] Bandiera S, Matégot R, Girard M, et al. MitomiRs delineating the intracellular localization of microRNAs at mitochondria.[J]. Free Rad Biol Med, 2013, 64(5):12.
[49] Barrey E, Saint-Auret G, Bonnamy B, et al. Pre-microRNA and mature microRNA in human mitochondria[J]. PLoS ONE, 2011, 6(5): e20220.
[50] Saito S, Thuc L C, Teshima Y, et al. Glucose fluctuations aggravate cardiac susceptibility to ischemia/reperfusion injury by modulating microRNAs expression.[J]. Circ J Off J Jap Circul Soc, 2016,80(1):186.
[51] Wang J X, Jiao J Q, Li Q, et al. miR-499 regulates mitochondrial dynamics by targeting calcineurin and dynamin-related protein-1[J]. Nat Med, 2011, 17(1): 71.
[52] Bianchessi V, Badi I, Bertolotti M, et al. The mitochondrial lncRNA ASncmtRNA-2 is induced in aging and replicative senescence in Endothelial cells[J]. J Mol Cell Cardiol, 2015, 81: 62.
[53] Rippo M R, Olivieri F, Monsurrò V, et al. MitomiRs in human inflamm-aging: a hypothesis involving miR-181a, miR-34a and miR-146a.[J]. Exp Gerontol, 2014, 56(4):154.
[54] Borralho P M, Rodrigues C M P, Steer C J. Mitochondrial microRNAs and their potential role in cell function[J]. Curr Pathobiol Rep, 2014, 2(3): 123.
[55] 白瑞娜,史大卓,李立志,等. 非編码RNA在动脉粥样硬化性心脏病中的研究进展[J]. 医学研究杂志, 2015, 44(9):159.
[56] Tumurkhuu G, Shimada K, Dagvadorj J, et al. Ogg1-dependent DNA repair regulates NLRP3 inflammasome and prevents atherosclerosis.[J]. Circul Res, 2016,doi: 10.1161/CIRCRESAHA.116.3083622.
[57] Karunakaran D, Thrush A B, Nguyen M A, et al. Macrophage mitochondrial energy status regulates cholesterol efflux and is enhanced by anti-miR33 in atherosclerosis[J]. Circul Res, 2015, 117(3): 266.
[58] Price N L, Fernández-Hernando C. Novel role of miR-33 in regulating of mitochondrial function: figure[J]. Circul Res, 2015, 117(3): 225.
[59] Rotllan N, Price N, Pati P, et al. microRNAs in lipoprotein metabolism and cardiometabolic disorders[J]. Atherosclerosis, 246(2016):352.
[60] 陈五军,尹凯,赵国军,等. microRNAs—脂质代谢调控新机制[J].生物化学与生物物理进展, 2011,38(9):781.
[61] Ouimet M, Ediriweera H N, Gundra U M, et al. MicroRNA-33-dependent regulation of macrophage metabolism directs immune cell polarization in atherosclerosis[J]. J Clin Invest, 2015, 125(12): 4334.
[62] Karunakaran D, Richards L, Geoffrion M, et al. Therapeutic inhibition of miR-33 promotes fatty acid oxidation but does not ameliorate metabolic dysfunction in diet-induced obesity[J]. Arterioscler Thromb Vasc Biol, 2015, 35(12): 2536.
[63] 邵芳,朱斌,顾志良.microRNA在脂类代谢中的功能研究进展[J].生命科学, 2013,25(7):676.
[64] Li K, Zhang J, Ji C, et al. MiR-144-3p and its target gene β-amyloid precursor protein regulate 1-methyl-4-phenyl-1,2-3,6-tetrahydropyridine-induced mitochondrial dysfunction[J]. Mol Cell, 2016, 39(7): 543.
[65] 岳荣川.番茄红素保护线粒体DNA减轻心肌缺血再灌注损伤的作用及机制研究[D].重庆:第三军医大学,2015.
[66] 谢俊.“标本配穴”法电针防治大鼠心肌缺血损伤及其线粒体信号通路调控机制[D].武汉:湖北中医药大学,2016.
[67] 傅向华.2015年中国大陆冠心病介入数据发布[J].中国介入心脏病学杂志,2016,24(5):276.
[68] 代燕丽,邹宇晓,刘凡,等.植物多酚干预脂质代谢紊亂作用机制研究进展[J].中国中药杂志,2015,40(21):4136.
[69] 陈阜新,汪莲开.阿魏酸对巨噬细胞泡沫样化过程中胆固醇流出的影响及可能机制[J].中国中药杂志, 2015, 40(3):533.
[责任编辑 张宁宁]
