穿心莲转录因子ApNAC1的克隆、亚细胞定位及原核表达
2017-04-06王健齐梦蝶郭娟申业林慧馨黄璐琦
王健+齐梦蝶+郭娟+申业+林慧馨+黄璐琦
[摘要]从穿心莲叶片中克隆了1个NAC家族的转录因子,命名为ApNAC1,GenBank注册号为KY196416。生物信息学分析表明该基因的完整编码区包含972 bp,编码1个323个氨基酸的多肽,预测蛋白相对分子质量为35.9 kDa,等电点为6.14。原生质体瞬时表达研究证实了ApNAC1-GFP融合蛋白特异定位在穿心莲叶肉细胞的细胞核中,是一个核定位蛋白。实时定量PCR结果表明ApNAC1基因表达与穿心莲内酯的积累模式一致:主要在穿心莲的叶片里表达,而且茉莉酸甲酯处理能急剧上调其表达水平。ApNAC1基因在大肠杆菌中进行异源表达,并且被成功纯化。该研究为进一步探索ApNAC1蛋白参与穿心莲内酯生物合成的研究奠定了基础。
[关键词] 穿心莲; NAC转录因子; 亚细胞定位; 表达模式; 原核表达
[Abstract] Andrographis paniculata is widely used as medicinal herb in China for a long time and andrographolide is its main medicinal constituent. To investigate the underlying andrographolide biosynthesis mechanisms, RNA-seq for A. paniculata leaves with MeJA treatment was performed. In A. paniculata transcriptomic data, the expression pattern of one member of NAC transcription factor family (ApNAC1) matched with andrographolide accumulation. The coding sequence of ApNAC1 was cloned by RT-PCR, and GenBank accession number was KY196416. The analysis of bioinformatics showed that the gene encodes a peptide of 323 amino acids, with a predicted relative molecular weight of 35.9 kDa and isoelectric point of 6.14. To confirm the subcellular localization, ApNAC1-GFP was transiently expressed in A. paniculata protoplast. The results indicated that ApNAC1 is a nucleus-localized protein. The analysis of real-time quantitative PCR revealed that ApNAC1 gene predominantly expresses in leaves. Compared with control sample, its expression abundance sharply increased with methyl jasmonate treatment. Based on its expression pattern, ApNAC1 gene might involve in andrographolide biosynthesis. ApNAC1 was heterologously expressed in Escherichia coli and recombinant protein was purified by Ni-NTA agarose. Further study will help us to understand the function of ApNAC1 in andrographolide biosynthesis.
[Key words] Andrographis paniculata; NAC transcription factor; subcellular localization; expression pattern; heterologous expression
穿心莲为爵床科Acanthaceae植物穿心莲Andrographis paniculata的干燥地上部分,味苦、性寒,具有清热解毒、消肿止痛、抗菌及抗癌作用[1-3],临床应用于心血管系统疾病、呼吸系统疾病、胃肠道系统疾病等[4]。其抗炎抗感染的主要活性物质是二萜内酯类, 如穿心莲内酯、脱水穿心莲内酯等[5]。
研究表明包括茉莉酸甲酯(MeJA)在内的多种诱导子可以刺激穿心莲内酯及其相关萜类化合物在穿心莲体内的积累[6-7]。为了阐明穿心莲体内合成机制,作者对MeJA不同诱导时间的穿心莲叶片进行了转录组测序。在转录组数据中,一个NAC转录因子家族成员的表达模式与穿心莲内酯的积累模式较为吻合:在MeJA处理12 h后急剧上升,在随后的24,48 h里都维持一个较高的表达水平。NAC转录因子超家族是植物中特有的转录因子家族,包含了众多成员。其N-端有一个高度保守的 NAC 结构域,具有DNA结合或蛋白质和二聚体结合功能;而其C-端无论是在氨基酸序列还是长度方面都具有高度的多样性,具有转录激活、抑制或者与蛋白质结合等功能[8]。NAC家族的转录因子参与了植物的发育、衰老、次生壁形成以及对外界生物和非生物胁迫的各种应答反应[9]。然而,NAC转录因子参与植物次生代謝却鲜见报道。为了探索新的调控萜类代谢的转录因子并增加对NAC转录因子调控功能的理解,本研究首次克隆得到了穿心莲NAC家族中的1个成员,命名为ApNAC1。
本研究首先对ApNAC1基因进行了生物信息学分析,并对其亚细胞定位、表达模式进行研究。最后ApNAC1在大肠杆菌进行异源表达,并被成功纯化。以上工作为后续进一步研究ApNAC1的体内功能奠定了基础。
1 材料
穿心莲采自福建漳州,中国中医科学院中药资源中心郝近大研究员鉴定为穿心莲A. paniculata。所有的大肠杆菌菌株均购自全式金生物科技公司。SYBR Green PCR Master Mix购自大连宝生物技术有限公司,KOD聚合酶购自日本TOYOBO公司,RNA提取试剂、反转录试剂盒购自美国Invitrogen公司,琼脂糖胶回收试剂盒购自Thermo Fisher公司,质粒提取试剂盒购自Omega公司,pEASY-Blunt Zero Cloning Kit,pEASY-Uni Seamless Cloning and Assembly Kit,DNA marker购自全式金生物科技公司,其他试剂为国产分析纯。引物合成和测序由上海生工生物工程技术服务有限公司完成。
2 方法
2.1 穿心莲叶片RNA 提取
取100 mg穿心莲叶片,液氮速冻后研磨成粉,加入plant RNA Reagent提取总RNA,利用NanoDrop 2000分光光度计测定RNA浓度。以总RNA为模板,以oligo(dT)为引物,利用反转录试剂盒合成cDNA。
2.2 穿心莲ApNAC1编码序列的克隆和测序
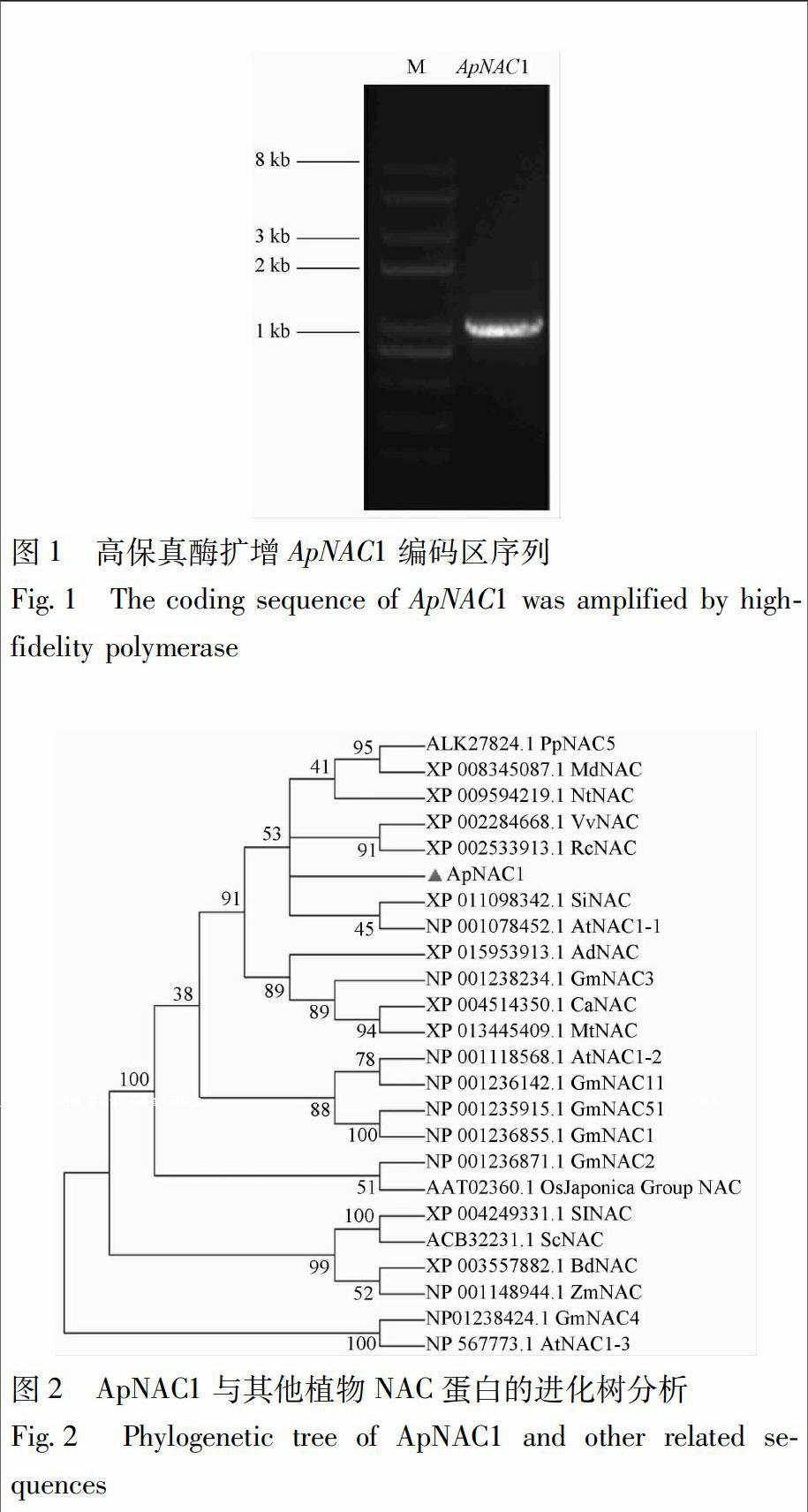
根据穿心莲转录组注释结果,ApNAC1的序列为全长cDNA。为了扩增该基因完整的编码序列(coding sequence,CDS),设计上游引物ApNAC-F1,5′-ATGGGTGTCCGAGAAACCG-3′,下游引物ApNAC-R1,5′-TCACAGCATGAACCCGGAC-3′,以叶片RNA反转录得到的cDNA为模板进行扩增。将回收的特异性片段克隆到pEASY-Blunt Zero载体上,转化到大肠杆菌 Trans1 T1中,菌落PCR鉴定阳性克隆,并提取质粒进行测序分析。
2.3 穿心莲ApNAC1基因序列的生物信息学分析
将测序所得的CDS序列翻译成氨基酸序列,在National Center for Biotechnology Services (NCBI) 数据库中应用BLAST程序 (https://blast.ncbi.nlm.nih.gov) 进行同源性检索,并应用MEGA 7.0,使用NJ 法(bootstrap 1000) 构建系统进化树。
2.4 穿心莲ApNAC1 蛋白的亚细胞定位分析
2.4.1 构建ApNAC1亚细胞定位载体 利用引物ApNAC-F2,5′-CTTCTGCGGGGCCCGGGGATGGGTG- TCCGAGAAACCG-3′和ApNAC-R2:5′-TCCACTAGTATTTAAATGCAGCATATGAACCCGGACCCA-3′,以已测序正确的pEASY-Blunt-Zero-ApNAC1质粒为模板进行扩增,利用pEASY-Uni Seamless Cloning and Assembly Kit将ApNAC1克隆入双元载体pCAMBIA1300-GFP,并测序验证,命名为p1300-ApNAC1-GFP。
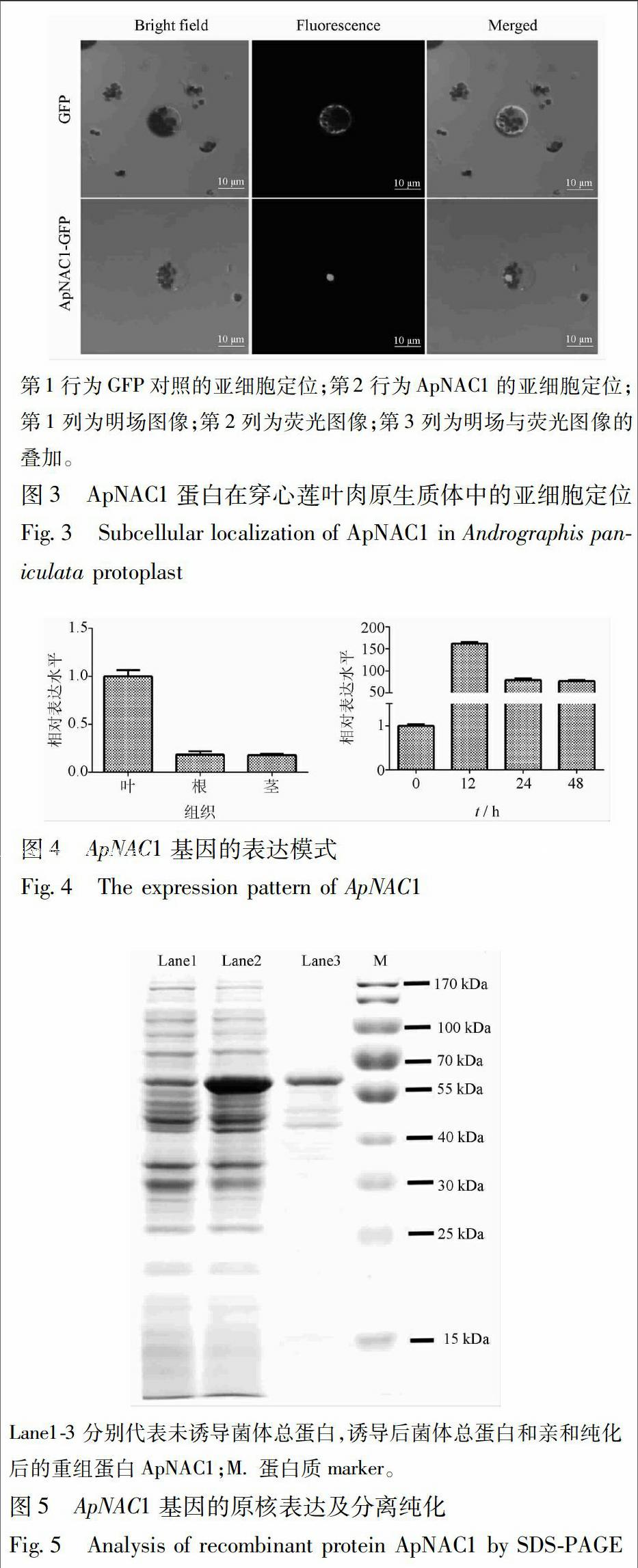
2.4.2 定位分析 取用生长4周的穿心莲的幼嫩叶片,根据文献的方法[10]游离叶片原生质体,并将p1300-ApNAC1-GFP和不含插入片段的pCAMBIA1300-GFP质粒作为对照,分别转化入穿心莲原生质体。室温孵育24 h,用激光共聚焦显微镜观察结果。
2.5 穿心莲ApNAC1基因的表达谱分析
采用SYBR Green Premix染料进行实时定量PCR(real-time qPCR)分析,分别用上游引物ApNAC-F3,5′-GGGAATTTCGATTGGCCTAC-3′,和下游引物 ApNAC-R3,5′-TCAGGCTGAATCGGGTACCG-3′,检测ApNAC1在MeJA处理穿心莲水培苗0,12,24,48 h时的基因表达变化。PCR体系为SYBR Premix 5 μL,正反引物各0.2 μL,ROX Reference Dye Ⅱ 0.2 μL,稀释10倍的cDNA模板1.0 μL,加ddH2O至10 μL。PCR程序为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。每个样品设立3个生物学重复。
2.6 穿心莲ApNAC1原核表达载体的构建
构建原核表达载体上pET-32a(+)-ApNAC1,首先使用限制性内切酶BamH I和Sal I对载体pET-32a(+)进行双酶切线性化。利用引物ApNAC-F4,5′-AGGCCATGGCTGATATCGGAATGGGTG- TCCGAGAAACCG-3′和ApNAC-R4,5′-GTCGACGGAGCTCGAATTCGTCACAGCATGAACCCGGAC-3′,以测序正确的pEASY-Blunt-Zero-ApNAC1质粒为模板进行扩增。利用pEASY-Uni Seamless Cloning and Assembly Kit同源重组试剂盒进行克隆,将重组质粒转化Trans1 T1大肠杆菌感受态细胞,并利用含有氨苄青霉素的LB平板进行筛选,挑选阳性克隆进行PCR鉴定,并送测序。将测序正确的重组质粒pET-32a-ApNAC1转化入Transetta(DE3)原核表达菌株感受态细胞中。
2.7 穿心莲ApNAC1蛋白的原核表达及分离纯化
挑取阳性重组菌的单菌落,接种于2 mL含氨苄青霉素的LB液体培养基中,37 ℃活化过夜后,按照1∶50接种200 mL,250 r·min-1振摇至生长对数期(A600约为1.0),加入终浓度为1 mmol·L-1的IPTG于16 ℃诱导表达16 h(留取未加IPTG菌液于相同条件下培养)。诱导表达结束后,取200 μL菌液,8 000 r·min-1离心5 min,收集菌体,用去离子水洗涤2次,加入50 μL PBS緩冲液重悬菌体,加入50 μL 2×SDS上样缓冲液煮沸10 min,至于4 ℃备用。将剩余菌液于4 ℃,8 000 r·min-1离心5 min收集菌体,加入5 mL Buffer A (20 mmol·L-1 NaH2PO4,500 mmol·L-1 NaCl,20 mmol·L-1 Imidazole)重悬菌体,超声破碎7 min,4 ℃,12 000 r·min-1离心10 min,去除沉淀,加入Ni-NTA agarose 200 μL 于4 ℃摇晃45 min,充分结合后,4 ℃,1 400 r·min-1离心10 min,并使用Buffer A 清洗2次后,使用250 μL Buffer B(20 mmol·L-1 NaH2PO4,500 mmol·L-1 NaCl,500 mmol·L-1 Imidazole)洗脱蛋白2次。取2 μL洗脱液加入198 μL PBS稀释,加入200 μL 2×SDS上样缓冲液煮沸10 min。4 ℃,12 000 r·min-1离心10 min后取10 μL上样,用100 g·L-1的聚丙酰胺凝胶进行SDS-PAGE分析。
3 结果与分析
3.1 穿心莲ApNAC1基因的克隆及序列分析
根据转录组测序结果,设计特异引物,以穿心莲叶片的cDNA做为模板,扩增该基因从起始密码子到终止密码子的完整编码区,得到1条大约1 000 碱基对的特异条带。切胶回收该片段,连接pEASY-Blunt Zero载体,鉴定出阳性克隆后,送往公司测序。测序结果表明载体中插入了目的片段(图1)。序列分析表明该片段包含972个碱基对,编码1个包含323个氨基酸的多肽,相对分子质量为35.9 kDa,预测等电点为6.14。利用NCBI网站的Smart Blast软件进行同源比对,发现该蛋白与模式植物拟南芥NAC家族RD26和大豆NAC4的同源性分别为70%和59%,而在所有物种中与之同源性最高的是芝麻中的NAC蛋白,同源性高达72%。该多肽的N端包含了高度保守的NAM结构域。因此,该基因被命名为ApNAC1, GenBank注册号为KY196416。将ApNAC1与Genbank中17个物种的23种蛋白的氨基酸序列对比,利用MEGA 7.0,使用NJ(boot-strap 1000)构建系统进化树。ApNAC1与巴旦木Prunus persica NAC5 (PpNAC5, ALK27824.1),苹果Malus domestica NAC (MdNAC, XP_008345087.1),烟草Nicotiana tomentosiformis NAC (NtNAC, XP_009594219.1),葡萄Vitis vinifera NAC (VvNAC, XP_002284668.1),蓖麻Ricinus communis NAC (RcNAC, XP_002533913.1),芝麻Sesamum indicum NAC (SiNAC, XP_011098342.1),拟南芥Arabidopsis thaliana NAC1-1 (AtNAC1-1, NP_001078452.1)构成一支,亲缘关系较近。然而,同一植物内不同的NAC成员则具有较大差异。如拟南芥中的NAC1-1,NAC1-2,NAC1-3都分布在不同的分支里,说明尽管NAC家族成员都具有类似的保守结构域,但不同亚家族成员间序列变异显著(图2)。
3.2 穿心莲ApNAC1蛋白的亚细胞定位
由于预测ApNAC1蛋白是一个转录因子,而转录因子通常为核定位蛋白。为了验证ApNAC1的亚细胞定位,通过同源重组技术ApNAC1基因被克隆到了绿色荧光蛋白(GFP)的N末端。通过原生质体转化,ApNAC1基因被瞬时表达在叶肉细胞中。培养24 h后,在荧光显微镜下观察ApNAC1蛋白的亚细胞定位,以未融合其他基因的空载体作为对照。空载体对照中,GFP的荧光广泛地分布于细胞的各个亚细胞结构。而融合了ApNAC1的GFP蛋白集中地分布在细胞核中,细胞的其他部位观察不到GFP荧光。该结果验证了生物信息学的预测结果,证实了ApNAC1定位于细胞核中,是一个核蛋白(图3)。
3.3 穿心莲ApNAC1基因的表达模式
穿心莲中最重要的药效成分穿心莲内酯主要分布在穿心莲的叶片中,而且它的含量受到茉莉酸甲酯(MeJA)的诱导[6, 11]。为了探讨ApNAC1参与穿心莲内酯积累的可能性,对该基因的表达模式进行了分析。首先,检测了该基因的组织特异性表达。实时定量PCR的结果表明ApNAC1主要分布叶片中,而在根和茎中的分布远低于叶片中的分布。在MeJA处理后,该基因表达水平急剧增加,在12 h时表达量达到最高。在24,48 h时尽管表达水平略有下降,但依然远高于未处理对照组(图4)。该qPCR的结果与转录组测序的结果吻合。因此,不论是从组织特异性还是MeJA处理后的mRNA积累,ApNAC1基因都呈现出与穿心莲内酯一致的表达模式。这个结果表明ApNAC1有可能参与穿心莲内酯生物合成途径的调节。
3.4 穿心莲ApNAC1基因原核蛋白的表达
电泳迁移率变动分析(electrophoretic mobility shift assay,EMSA)是研究转录因子功能的重要手段。获取有活性的转录因子蛋白是进行该研究的前提条件。为了获得可溶ApNAC1蛋白,重组质粒pET32a-ApNAC1被转化到大肠杆菌菌株Transetta (DE3)中,在IPTG诱导表达后,进行 SDS-PAGE 凝胶电泳分析(图5)。第1泳道为未加入IPTG诱导的阴性对照,第2泳道为诱导后的菌体蛋白。比较这2道菌体蛋白,发现诱导后比诱导前的蛋白在55 kDa附近之间明显增加了1个蛋白条带。ApNAC1蛋白预期相对分子质量为35.9 kDa,而原核表达载体pET-32a的表达标签约为20 kDa,所以该重组蛋白大小约为56 kDa。因此表达出来的蛋白大小符合预期。采用亲和色谱法,用 Ni-NTA Agarose对ApNAC1进行纯化。第3泳道为纯化后的蛋白,结果显示已经获得了纯度较高的重组蛋白。
4 讨论
逆境(包括生物和非生物胁迫环境)是导致植物体内次生代谢物增加的重要原因[12]。在各种逆境下,植物能够产生茉莉酸及其衍生物,诱导编码次生代谢物合成酶及转录因子的基因表達,以适应胁迫环境[13]。穿心莲生物合成途径的研究表明,在MeJA处理24 h后,穿心莲内酯含量增加了5.25倍[7]。目前已知AP2/ERF,bHLH,MYB 以及 WRKY等多种转录因子都参与了茉莉酸相关的次生代谢物积累途径的调控[14]。但植物中特有的转录因子家族——NAC家族成员直接参与次生代谢的报道却甚为少见。最近研究显示AaNAC2,AaNAC3,AaNAC4蛋白能够与AaTPS1基因启动子结合,参与调控猕猴桃果实成熟过程中单萜的合成。该结果首次表明NAC转录因子直接参与萜类代谢[15]。在前期转录组测序结果中,尽管多种转录因子的表达都随着MeJA处理时间的延长而增加,但是ApNAC1的表达增加得最为明显:在MeJA处理12 h时,ApNAC1的表达量增加了100倍以上。本研究的qPCR数据验证了转录组测序的结果,并进一步证明了该基因的叶片组织特异性分布。穿心莲内酯和ApNAC1的积累模式的一致性暗示了ApNAC1可能参与了穿心莲内酯合成的调控。但要确定ApNAC1基因在穿心莲体内的功能还需要通过RNAi或过表达等手段,观察相应的表型,最后才能阐明其确切的生物学功能。
用基因枪瞬时转化洋葱表皮细胞是研究蛋白亚细胞定位的常用方法,但是它也存在需要特定设备、价格昂贵、操作较为繁琐等缺点。本研究借鉴拟南芥的原生质体转化技术,用穿心莲叶肉细胞的原生质体进行瞬时表达研究,不仅比基因枪法方便快捷,而且能够更加真实地反映ApNAC1蛋白的亚细胞定位。穿心莲叶肉细胞原生质体瞬时转化技术不仅能用于研究穿心莲蛋白的亚细胞定位,还可以通过共转化报告基因的方法用于鉴定转录因子的生物学功能。由于穿心莲尚未建立稳定的遗传转化体系,所以这项技术对鉴定转录因子的功能显得尤为重要。
电泳迁移率实验(electrophoretic mobility shift assay, EMSA)是检测转录因子与体内特定基因启动子结合的重要手段。获得可溶的转录因子蛋白质是进行EMSA实验的关键步骤。本文通过原核表达获得了高纯度的重组蛋白。在后续的实验中我们将利用纯化的ApNAC1蛋白,通过EMSA实验,验证其能否与穿心莲内酯相关合成酶的启动子的特定区段结合,阐明其是否直接参与穿心莲内酯生物合成的调控。本研究為进一步探索ApNAC1在穿心莲内酯生物合成中的功能奠定了基础。
[参考文献]
[1] 何恩其,赵烽. 穿心莲的药理作用及研究进展[J]. 中医药导报, 2007(5): 107.
[2] Mishra S K, Tripathi S, Shukla A, et al. Andrographolide and analogues in cancer prevention[J]. Front Biosci (Elite Ed), 2015,7: 255.
[3] Mir H, Kapur N, Singh R, et al. Andrographolide inhibits prostate cancer by targeting cell cycle regulators, CXCR3 and CXCR7 chemokine receptors[J]. Cell Cycle, 2016,15(6): 819.
[4] 朱艳玲.穿心莲化学成分和药理作用的研究进展[J]. 中国现代药物应用, 2013(14):238.
[5] Hossain M S, Urbi Z. Andrographis paniculata (Burm. f.) Wall. ex Nees: a review of ethnobotany,
phytochemistry, and pharmacology[J]. Scientific World J, 2014,2014: 28.
[6] Sharma S N, Jha Z, Sinha R K, et al. Jasmonate-induced biosynthesis of andrographolide in Andrographis paniculata[J]. Physiol Plant, 2015,153(2): 221.
[7] Gandi S, Rao K, Chodisetti B, et al. Elicitation of andrographolide in the suspension cultures of Andrographis paniculata[J]. Appl Biochem Biotechnol, 2012,168(7): 1729.
[8] Olsen A N, Ernst H A, Leggio L L, et al. NAC transcription factors: structurally distinct, functionally diverse[J]. Trends Plant Sci, 2005,10(2): 79.
[9] Puranik S, Sahu P P, Srivastava P S, et al. NAC proteins: regulation and role in stress tolerance[J]. Trends Plant Sci, 2012,17(6): 369.
[10] Yoo S D, Cho Y H, and Sheen J. Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis[J]. Nat Protoc, 2007,2(7): 1565.
[11] Garg A, Agrawal L, Misra R C, et al. Andrographis paniculata transcriptome provides molecular insights into tissue-specific accumulation of medicinal diterpenes[J]. BMC Genomics, 2015,16: 659.
[12] 黄璐琦,郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志, 2007, 32(4):277.
[13] De Geyter N, Gholami A, Goormachtig S, et al. Transcriptional machineries in jasmonate-elicited plant secondary metabolism[J]. Trends Plant Sci, 2012,17(6): 349.
[14] Zhou M, Memelink J. Jasmonate-responsive transcription factors regulating plant secondary metabolism[J]. Biotechnol Adv, 2016,34(4):441.
[15] Nieuwenhuizen N J, Chen X, Wang M, et al. Natural variation in monoterpene synthesis in kiwifruit: transcriptional regulation of terpene synthases by NAC and ethylene-insensitive3-like transcription factors[J]. Plant Physiol, 2015,167(4):1243.
[责任编辑 吕冬梅]
