知母皂苷AⅢ抑制人脑胶质瘤增殖生长的机制研究
2017-04-05谭希潘会君吴伟达章丹丹
谭希+潘会君+吴伟达+章丹丹

[摘要]考察知母皂苷AⅢ抑制人脑胶质瘤U87MG细胞增殖的作用及机制分析。在裸鼠皮下荷瘤模型中,知母皂苷AⅢ组与模型组相比,显著降低瘤重。知母皂苷AⅢ呈剂量依赖性抑制U87MG细胞的体外增殖;呈剂量依赖性降低βCatenin,Cyclin D1,Bcl2的蛋白表达,同时升高p21在蛋白和基因水平的表达;降低ERK磷酸化水平,抑制βCatenin的核转移,同时提高p38和JNK蛋白的磷酸化水平。联用JNK抑制剂SP600125和p38抑制剂SB203580后可逆转知母皂苷AⅢ处理而提高的p21和降低的βCatenin的蛋白表达。知母皂苷AⅢ部分通过干预MAPK及Wnt/βCatenin信号通路而抑制脑胶质瘤U87MG的增殖。
[关键词]知母皂苷AⅢ;人脑胶质瘤U87MG;细胞增殖;MAPK信号通路;Wnt/βCatenin信号通路
[Abstract]To explore the inhibitory effect of timosaponin AⅢ on the proliferation of human glioblastoma cell line U87MG and investigate its related mechanism As compared with the model group, the tumor weight was significantly reduced in timosaponin AⅢtreated group Timosaponin AⅢinhibited the proliferation of U87MG cell line in a dosedependent manner It upregulated the gene and protein expression levels of p21, meanwhile inhibited the protein expression levels of βCatenin, Cyclin D1 and Bcl2 It also inhibited the translocation of βCatenin into nucleus, suppressed the phosphorylation expression of ERK, but increased the phosphorylation expression of p38 and JNK Combined use of JNK inhibitor SP600125 and p38 inhibitor SB203580 could decrease p21 and increase βCatenin protein expressions Timosaponin AⅢ inhibited the proliferation of human glioblastoma cell line U87MG partly by intervening MAPK and Wnt/βCatenin signal pathways
[Key words]timosaponin AⅢ; human glioblastoma cell U87MG; cell proliferation; MAPK signal pathway; Wnt/βCatenin signal pathway
中藥知母是百合科植物知母Anemarrhena asphodeloides Bge的干燥根茎,具有滋阴润燥、清热泻火等功效。其性寒,味苦,归肺、胃、肾经,临床用于外感热病、骨蒸潮热、肺热燥咳、高热烦渴等症状[1]。其主要药理活性成分知母皂苷在知母根茎中的质量分数约为6% [2]。国内外研究人员发现知母皂苷AⅢ能抑制ADP诱导的血小板聚集、诱导肿瘤细胞自噬等[34],近年来对于知母皂苷AⅢ抗肿瘤活性的研究日益深入[57],有希望将其开发成一种新的抗癌类药物。
脑胶质瘤(脑胶质细胞瘤)约占颅内肿瘤的70%。恶性脑胶质瘤是34岁以下肿瘤患者的第二位死亡原因,患者平均存活的中位时间是14个月。脑胶质瘤多呈侵袭性生长,总体疗效不佳,是神经外科治疗中最棘手的难治性肿瘤之一[810]。目前尚未有知母皂苷AⅢ抑制脑胶质瘤增殖生长的相关报道。该文考察知母皂苷AⅢ体内外抑制脑胶质瘤增殖生长的作用并基于MAPK信号通路和Wnt/βCatenin信号通路考察其机制。
1材料
11药物与试剂知母皂苷AⅢ、淫羊藿苷Ⅱ、红景天苷、原薯蓣皂苷元均购自上海同田生物技术股份有限公司;人脑恶性胶质瘤细胞株U87MG购自美国ATCC公司;DMEM干粉培养基、胎牛血清购自Gibco公司;二甲基亚砜、噻唑蓝购自西格玛奥德里奇(SigmaAldrich)公司;cDNA逆转录试剂盒、Trizol试剂购自赛默飞世尔科技(Thermo Fisher Scientific)公司;RealMasterMix(SYBR Green)试剂盒、蛋白酶抑制剂和磷酸酶抑制剂PhosSTOP均购自美国Roche公司;引物均由生工生物工程(上海)有限公司合成。Marker预染蛋白购自Progema公司;NC膜购自英国沃特曼Whatman公司;一抗βactin,pERK,TERK,pp38,Tp38,pJNK,TJNK,βCatenin购自美国细胞生物技术(Cell Signaling Technology)公司;p21、Cyclin D1抗体、二抗山羊抗鼠、二抗山羊抗兔均购自美国abCAM公司。ECL化学发光试剂盒购自美国通用公司生命技术科学部门(GE);BCA蛋白浓度测定试剂盒、RIPA蛋白强裂解液、Bcl2抗体、HDAC1抗体、细胞核蛋白细胞浆蛋白抽提试剂盒购自碧云天生物技术有限公司;其他试剂均为分析纯。
12仪器生物安全柜(Delta series,Labconco,美国);CO2培养箱(HEPA CLASS100,Thermo,美国);细胞计数仪(XDS500C,上海蔡康光学仪器有限公司);倒置显微镜(IX 71,Olympus,日本);QB9006 恒温微孔板快速振荡器(海门市其林贝尔仪器有限公司);荧光定量PCR仪(7500 Fast System,Applied Biosystems公司,美国);超声波细胞粉碎机(JY922D,宁波新芝生物股份有限公司);低温高速离心机(Eppendorf Centrifuge 5810R,德国);电泳仪(PowerPacTMHC,BIORAD公司,美国);脱色摇床(TS8,Kylinbell Lab Instruments,中国);凝胶成像系统(Tanon NIM2045,上海天能公司);Spectra MAX190酶标仪(MD公司,美国)。
2方法
21细胞培养U87MG细胞培养于添加了10%胎牛血清的DMEM培养基中,置于37 ℃恒温、5%CO2培养箱中饱和湿度的条件下培养。稳定传2~3代后,选择处于对数生长期细胞用于后续实验。
22建立裸鼠皮下移植瘤模型在裸鼠左上肢腋下缓慢推注注射02 mL U87MG细胞混悬液,含2×106个细胞。定期观测裸鼠成瘤的时间和瘤体积大小。肿瘤的体积用游标卡尺测量肿瘤的最长径(a)及最短径(b),并根据公式V= ab2/2进行计算。成瘤后,给予中药单体1 mg·kg-1腹腔注射14 d,取瘤称重,免疫组化检测Ki67。
23MTT法考察知母皂苷AⅢ对U87MG脑胶质瘤细胞增殖能力的影响U87MG细胞悬液调节成密度为5×104个/mL,每孔接种100 μL于96孔板中,在CO2培养箱中过夜。为考察知母皂苷AⅢ对U87MG细胞增殖能力的影响,预试验中设置24,48,72 h时间点,数据差异不大(未显示),最终选择24 h为MTT检测时间。知母皂苷AⅢ于125,25,5,10 μmol·L-1剂量处理U87细胞,孵育24 h后,每孔加入 5 g·L-1 MTT(1×PBS为溶剂)溶液20 μL,继续避光培养 4 h,弃上清,每孔加入 150 μL DMSO,37 ℃摇床振摇5~10 min至其充分溶解,于酶标仪测得在490 nm波长下的吸光度A,计算用知母皂苷AⅢ不同浓度处理的各组细胞的细胞活性。细胞活性率=(A给药组-A空白对照组) / (A对照组-A空白对照组) ×100%。每组独立实验重复3次。
24QRTPCR考察知母皂苷A Ⅲ对细胞凋亡信号通路中p21 mRNA表达的影响为考察知母皂苷AⅢ对细胞周期的影响,检测其对细胞周期阻滞蛋白p21的表达的影响,文献报道知母皂苷AⅢ诱导白血病细胞凋亡时间为4 h[11],预实验中比较了4,6,24 h知母皂苷AⅢ诱导p21基因和蛋白表达变化(数据未显示),最終确定4 h检测p21基因表达变化,6 h检测蛋白表达变化。U87MG细胞贴壁过夜培养后,更换为新鲜的无血清DMEM培养液,给药处理组加入知母皂苷AⅢ(5,10 μmol·L-1)继续培养4 h,每组加1 mL Trizol按照Trizol说明书提取步骤收集各组细胞的总RNA,读取和计算各组RNA浓度,加DEPC水将全部样品的RNA调整至同一质量浓度500 mg·L-1。A260/A280在18~20的样品进行逆转录。按照HighCapacity逆转录试剂盒说明书,20 μL逆转录体系的反应条件为:25 ℃ 10 min,37 ℃ 120 min,85 ℃ 5 min,产物置于4 ℃备用。按照RealMasterMix(SYBR Green) 说明书,以20 μL反应体系合成模板cDNA,进行定量反转录聚合酶链式反应(QRTPCR)。引物序列如下:p21 Forward 5′TGAGCCGCGACTGTGATG3′;Reverse 5′GTCTCGGTGACAAAGTCGAAGTT3′; βactin Forward 5′CTCCTCCTGAGCGCAAGTACTC3′;Reverse 5′CGGACTCGTCATACTCCTGCT3′,由生工生物工程(上海)有限公司合成。反应条件为: 95 ℃ 10 min,50 ℃ 2 min,95 ℃预变性15 s,53 ℃ 1 min,扩增40个循环。每组样品均做3个复孔。知母皂苷AⅢ处理组的相对含量用2ΔΔCt计算得出。每组独立实验重复3次。
25Western blot考察知母皂苷AⅢ及抑制剂联用对信号通路中关键蛋白表达含量的影响为考察知母皂苷AⅢ对MAPK信号通路的影响,而蛋白磷酸化水平随时间变化而变化,最终确定知母皂苷AⅢ(5,10 μmol·L-1) 处理30 min后,收集蛋白检测MAPK主要蛋白的磷酸化水平。细胞分为空白对照组、抑制剂联用组为抑制剂联用预处理1 h后加入知母皂苷AⅢ(5,10 μmol·L-1)、抑制剂联用单独处理组、知母皂苷AⅢ(5,10 μmol·L-1)单用组处理6 h,冰镇1×PBS清洗,加入磷酸酶抑制剂、蛋白酶抑制剂和RIPA强细胞裂解液后收集细胞,超声细胞粉碎机超声破碎(3次,3 s/次),离心机在4 ℃以12 000 r·min-1离心15 min后取上清。根据细胞核蛋白细胞浆蛋白抽提试剂盒说明书,对细胞核蛋白和浆蛋白进行分离。各组蛋白均用BCA试剂盒测定总蛋白浓度。电泳前将每组15 μg的蛋白以4∶1的比例加入5×loading buffer,金属浴95 ℃ 2 min后即用10%或12%的SDSPAGE聚丙烯酰胺凝胶电泳,用湿转法将蛋白转到NC膜上后,用5%脱脂牛奶或5%BSA溶液封闭1 h,分别用一抗βactin,βCatenin,Cyclin D1,p21,Bcl2,pERK,TERK,pp38,Tp38,pJNK,TJNK,4 ℃孵育过夜,用TBST洗膜5 min,6次后加入相应二抗(1∶1万)孵育,TBST洗膜5 min,6次后,ECL显影液显影。每组独立实验重复3次。
26统计分析本实验所有计量资料均以±s表示,两样本组间比较采用t检验,P<005为差异具有统计学意义。
3结果
31知母皂苷AⅢ对裸鼠皮下荷瘤模型的影响与模型组比较,知母皂苷AⅢ处理组的瘤重呈显著性降低(P<005)。而淫羊藿苷Ⅱ、红景天苷、原薯蓣皂苷元处理组的瘤重有一定的下降趋势,但无显著性差异(图1)。Ki67的表达与肿瘤细胞增殖密切相关,临床上Ki67作为评价恶性肿瘤细胞生长的重要指标。与模型组比较,知母皂苷AⅢ处理组的Ki67阳性细胞数显著减少(P<005)。其余组与模型组比较,无显著性差异(图1)。
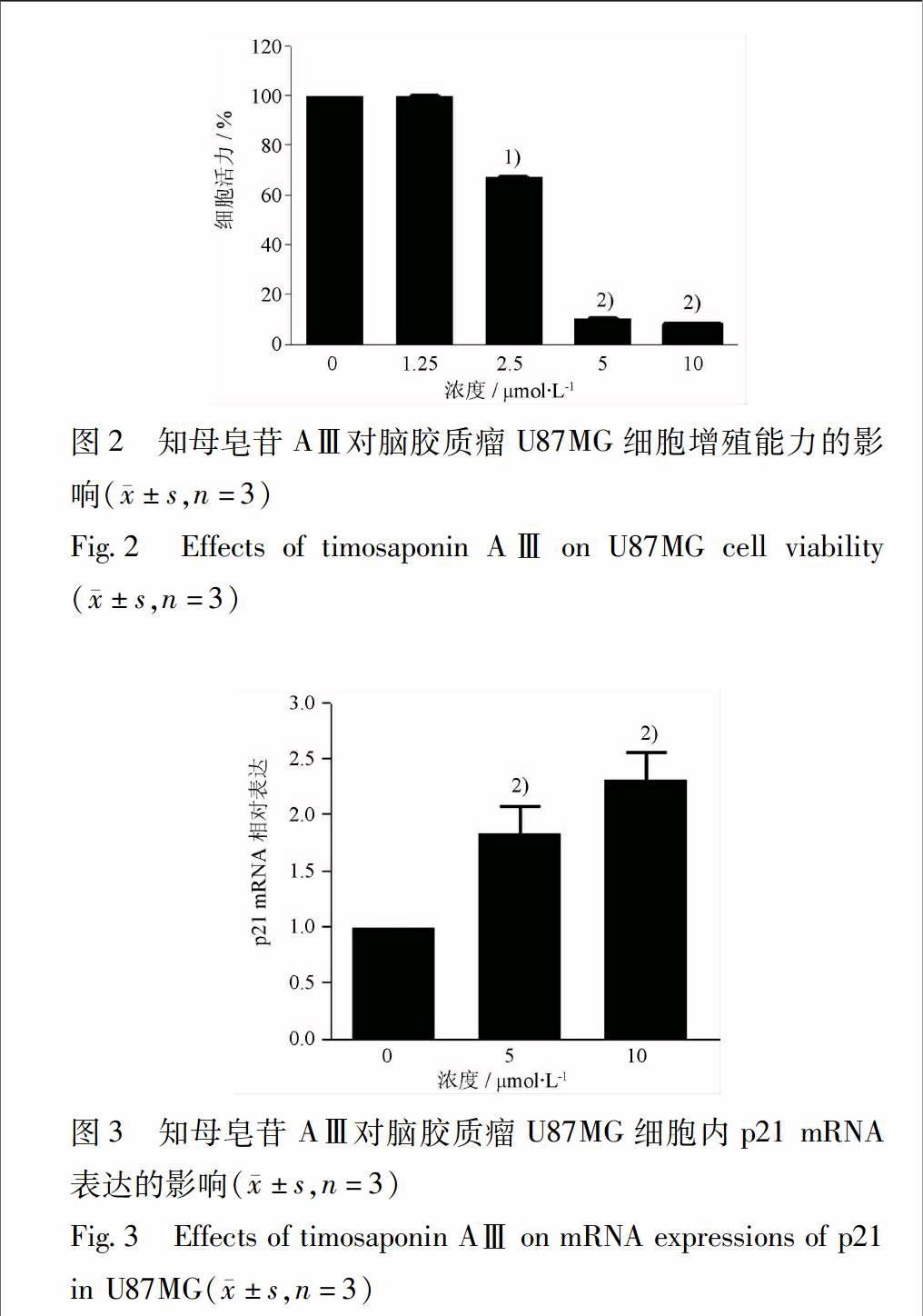
32知母皂苷AⅢ对U87MG细胞增殖能力的影响不同剂量的知母皂苷AⅢ(125~10 μmol·L-1)和人脑胶质瘤细胞共孵育24 h,知母皂苷AⅢ在25~10 μmol·L-1呈剂量依赖性抑制人脑胶质瘤细胞U87MG的细胞增殖(P<005)(图2)。
33知母皂苷AⅢ对U87MG细胞中 p21 mRNA的影响经知母皂苷AⅢ处理4 h后,p21基因水平的表达呈剂量依赖性提高 (P<001)(图3)。
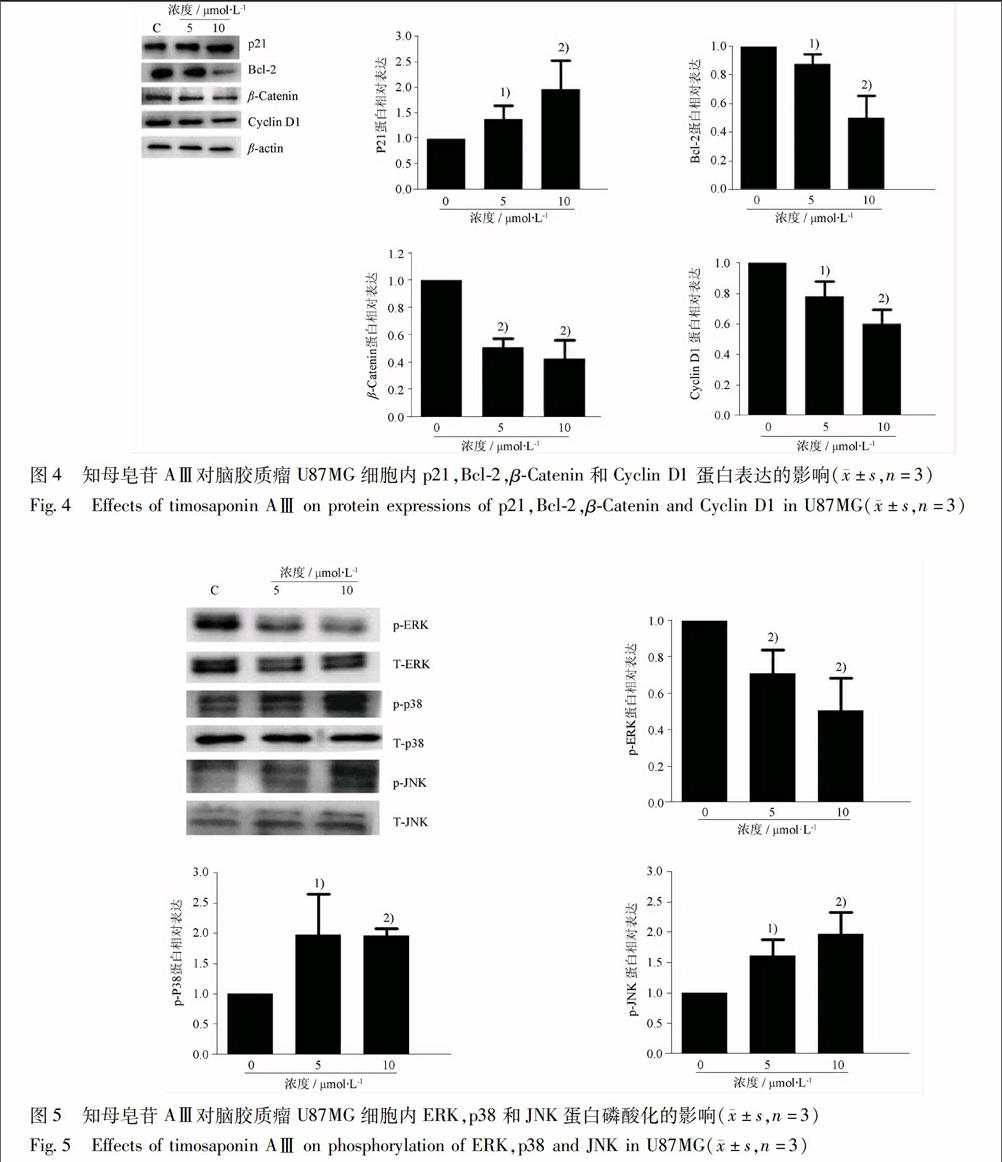
34Western blot法检测知母皂苷AⅢ对U87MG细胞中βCatenin,Cyclin D1,p21,Bcl2,pERK,TERK,pp38,Tp38,pJNK,TJNK蛋白水平的影响经知母皂苷AⅢ处理6 h 后,p21的蛋白表達上调(P<001),与其基因水平的变化一致。而βCatenin,Bcl2,Cyclin D1经干预后下调(P<001)(图4)。经知母皂苷AⅢ处理30 min后,ERK蛋白磷酸化水平显著降低(P<001),而p38和JNK蛋白的磷酸化水平显著升高(P<001)(图5)。
35Western blot法检测联用SP600125和SB203580对知母皂苷AⅢ干预p21和βCatenin蛋白水平的影响细胞分为空白对照组、知母皂苷AⅢ处理组(5,10 μmol·L-1)、JNK抑制剂SP600125(2 μmol·L-1)和p38抑制剂SB203580(20 μmol·L-1) 联用组、抑制剂联用组和知母皂苷AⅢ共同处理组。抑制剂联用组,与空白对照组相比,不影响p21和βCatenin在U87中的蛋白表达;抑制剂联用预处理细胞1 h 后,知母皂苷AⅢ继续处理6 h,抑
与对照组比较1)P<005,2)P<001;与抑制剂联用组比较3)P<005,4)P<001(图2~7同)。
制剂联用和AⅢ 10 μmol·L-1共同处理组与AⅢ 10 μmol·L-1剂量单独使用组相比,p21的蛋白表达显著下调,βCatenin显著上调,逆转了AⅢ处理后提高p21和降低βCatenin的蛋白变化趋势(图6)。
36Western blot法检测细胞核和细胞质中对知母皂苷AⅢ干预βCatenin蛋白水平的影响经知母皂苷AⅢ处理6 h后,知母皂苷AⅢ处理组与空白对照组共同进行细胞核和细胞质蛋白的分离,检测核质内βCatenin蛋白的表达变化。U87MG细胞经AⅢ干预后,βCatenin的核蛋白表达显著降低(图7)。在AⅢ 10 μmolL-1剂量处理组中,该组的细胞核内βCatenin的蛋白表达相比于空白对照组有显著下降(P<005)。而细胞质中的βCatenin蛋白表达与空白对照组相比无显著变化。
4结果与讨论
Wnt/βCatenin信号通路与肿瘤发生等多种疾病的病理过程相关,在多个细胞过程(分化、迁移、极性和增殖)中发挥重要作用。在胶质瘤组织中,WNT1表达比正常脑组织显著提高,并与Cyclin D1的表达显著相关。Kailiang等基于UCSC癌症基因数据库分析发现βCatenin和Cyclin D1在人脑胶质瘤细胞中呈高表达状态[12]。βCatenin作为核转运受体,通过与黏附分子相互作用,获得协调核功能和细胞黏附的属性[13]。熊果酸可通过降低βCatenin的核转移干预Wnt/βCatenin信号通路而抑制骨肉瘤的生长[14]。在本研究中,经知母皂苷AⅢ处理后,
U87MG细胞中βCatenin,Cyclin D1和Bcl2的蛋白表达水平均呈剂量依赖性降低,且AⅢ 10 μmol·L-1能显著降低βCatenin的核转移。
周期蛋白依赖性激酶(CDK)抑制剂p21(也称为p21WAF1/CIP1蛋白)是响应于各种刺激促进细胞周期阻滞的一个因素,在转录调控调节、抑制细胞凋亡、DNA修复中发挥作用[15]。p21由p53依赖性和p53非依赖性的机制来诱导。在p53非依赖性机制中,在有些情况下,p21具有促进细胞凋亡的作用[16]。结果显示,知母皂苷AⅢ处理后,可于体外显著提高U87细胞中p21在基因和蛋白水平的表达。
丝裂原活化蛋白激酶家族(mitogenactivated protein kinase,MAPK)是一种广泛存在于真核生物胞浆中高度保守的丝氨酸/苏氨酸蛋白激酶,由细胞外信号引发细胞核内反应的一条经典通路,影响着细胞形成、分化、生长、增殖及凋亡等多个生命过程。研究表明有4条信号通路存在于MAPK家族中:ERK(extracellular signalregulated kinase)即细胞外信号调节激酶、JNK (cJun Nterminal kinase)即cJun N端激酶、MAPKp38和ERK5/BMK1通路。在哺乳动物中,MKK4(MAP2K4)和MKK7(MAP2K7)磷酸化并激活JNK,而MKK3(MAP2K3),MKK4,MKK6和(MAP2K6)激活p38[17]。ERK是肿瘤细胞成瘾性基因,ERK信号通路与细胞增殖生长密切相关[18]。JNK和p38调节细胞存活(如Bcl2和Bax),细胞周期(如P53和Cyclin D1)和细胞增殖(如JUN和MYC)众多基因的表达[17]。JNK通路参与知母皂苷AⅢ对人黑色素瘤A375细胞[19]和白血病HL60[11]诱导凋亡作用。本实验结果表明,知母皂苷AⅢ呈剂量依赖性降低U87MG细胞中ERK蛋白的磷酸化,同时呈剂量依赖性提高p38和JNK的磷酸化水平。联用JNK抑制剂SP600125(2 μmol·L-1)和p38抑制剂SB203580(20 μmol·L-1)可逆转知母皂苷AⅢ在10 μmol·L-1剂量对p21蛋白的提升作用和对βCatenin的抑制作用,而抑制剂联用组对p21和βCatenin的蛋白表达的影响,与对照组相比无统计学差异,结果提示JNK和p38信号通路参与知母皂苷AⅢ抑制U87MG细胞增殖的进程。
综上所述,知母皂苷AⅢ部分通过MAPK和Wnt/βCatenin信号通路,提高p38和JNK蛋白的磷酸化水平,抑制ERK蛋白的磷酸化水平,抑制βCatenin的核转移,提高p21和抑制Bcl2,Cyclin D1等抗凋亡蛋白的表达,从而抑制人脑胶质瘤细胞U87MG的体外增殖和体内生长。
[参考文献]
[1]中国药典一部[S]2010:197
[2]王迪,姜艳艳,石任兵中药知母质量控制方法研究[J]北京中医药大学学报,2011,34(4):263
[3]Kang L, Zhang J, Cong Y, et al Steroidal glycosides from the rhizomes of Anemarrhena asphodeloides and their antiplatelet aggregation activity[J] Planta Med, 2012, 78(6): 611
[4]Lok C N, Sy L K, Liu F, et al Activation of autophagy of aggregationprone ubiquitinated proteins by timosaponin AⅢ[J] J Biol Chem, 2011, 286(36): 31684
[5]潘会君,聂绪强,刘朵,等4种中药单体对人胰腺癌PANC1细胞移植瘤生长的影响及分子机制探讨[J] 中国中药杂志, 2013, 38(2): 245
[6]Kang Y J, Chung H J, Nam J W, et al Cytotoxic and antineoplastic activity of timosaponin AⅢ for human colon cancer cells[J] J Nat Prod, 2011, 74(4): 701
[7]Sy L K, Yan S C, Lok C N, et al Timosaponin AⅢ induces autophagy preceding mitochondriamediated apoptosis in HeLa cancer cells[J] Cancer Res, 2008, 68(24): 10229
[8]Paw I, Carpenter R C, Watabe K, et al Mechanisms regulating glioma invasion[J] Cancer Lett, 2015, 362(1): 1
[9]Lee P, Murphy B, Miller R, et al Mechanisms and clinical significance of histone deacetylase inhibitors: epigenetic glioblastoma therapy[J] Anticancer Res, 2015, 35(2): 615
[10]De Bonis P, Marziali G, Vigo V, et al Antiangiogenic therapy for highgrade gliomas: current concepts and limitations[J] Exp Rev Neurotherap, 2013, 13(11): 1263
[11]Huang H L, Chiang W L, Hsiao P C, et al Timosaponin AⅢ mediates caspase activation and induces apoptosis through JNK1/2 pathway in human promyelocytic leukemia cells[J] Tumor Biol, 2015, 36(5): 3489
[12]Zhang K, Zhang J, Han L, et al Wnt/betacatenin signaling in glioma[J] J NeuroIm Pharm, 2012, 7(4): 740
[13]Fagotto F Looking beyond the Wnt pathway for the deep nature of βcatenin[J] EMBO Rep, 2013, 14(5): 422
[14]Zhang R X, Li Y, Tian D D, et al Ursolic acid inhibits proliferation and induces apoptosis by inactivating Wnt/βcatenin signaling in human osteosarcoma cells[J] Int J Oncol, 2016, 49(5): 1973
[15]Karimian A, Ahmadi Y, Yousefi B Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J] DNA Repair, 2016, 42: 63
[16]Kang M R, Park K H, Yang J O, et al miR6734 upregulates p21 gene expression and induces cell cycle arrest and apoptosis in colon cancer cells[J] PLoS ONE, 2016, 11(8): e0160961
[17]Kamiyama M, Naguro I, Ichijo H In vivo gene manipulation reveals the impact of stressresponsive MAPK pathways on tumor progression[J] Cancer Sci, 2015, 106(7): 785
[18]Chen W L, Turlova E, Sun C L F, et al Xyloketal B suppresses glioblastoma cell proliferation and migration in vitro through inhibiting TRPM7regulated PI3K/Akt and MEK/ERK signaling pathways[J] Marine Drugs, 2015, 13(4): 2505
[19]Wang Y, Xu L, Lou L L, et al Timosaponin AⅢ induces apoptosis and autophagy in human melanoma A375S2 cells[J] Arch Pharm Res, 2016, doi: 101007/S1227201607633[責任编辑张宁宁]
