超声靶向微泡破坏联合脂质体介导pSilencer 3.1-SATB1基因转染前列腺癌细胞效果观察
2017-04-04张娟娟陈英红林旭红
张娟娟,陈英红,林旭红
(河南大学淮河医院,河南开封475000)
超声靶向微泡破坏联合脂质体介导pSilencer 3.1-SATB1基因转染前列腺癌细胞效果观察
张娟娟,陈英红,林旭红
(河南大学淮河医院,河南开封475000)
目的 探讨超声靶向微泡破坏(UTMD)联合脂质体介导的沉默特异性核基质蛋白1基因(pSilencer3.1-SATB1)对人前列腺癌细胞转染的效果。方法 体外培养人前列腺癌雄激素非依赖型细胞株DU145,分为对照组、微泡组、超声组、超声+微泡组、脂质体组、超声+微泡+脂质体组。微泡组加入适量微泡,超声组仅给予超声辐照,超声+微泡组加入微泡后予以超声辐照,脂质体组加入脂质体,超声+微泡+脂质体组加入微泡、脂质体后予以超声辐照,对照组不做任何处理。24 h后采用流式细胞仪观察各组增强型绿色荧光蛋白(EGFP)表达,并检测EGFP荧光细胞的比例,计算基因转染率以评价转染效果。结果 荧光显微镜下,超声+微泡+脂质体组可见大量EGFP表达,明显多于其他各组。对照组、微泡组、超声组、超声+微泡组、脂质体组、超声+微泡+脂质体组基因转染率分别为0.18%±0.09%、0.25%±0.11%、1.14%±0.13%、2.96%±0.16%、3.99%±0.12%、7.16%±0.17%,超声+微泡+脂质体组的基因转染率高于其他各组(P均<0.05)。结论 UTMD可增强脂质体介导质粒pSilencer3.1-SATB1对DU145细胞的转染效果,提高转染率,为前列腺癌治疗的研究提供了一个新的途径。
超声靶向微泡破坏;基因转染;脂质体;质粒;特异性核基质蛋白1基因;前列腺癌
近年来,恶性肿瘤的基因治疗成为研究的热点,如何安全、高效地将目的基因靶向载入肿瘤细胞,是目前基因治疗领域研究的关键问题。脂质体作为目前最常用的非病毒性载体,虽克服了病毒性载体具有的免疫原性和致突变性,但因具有转染率较低及无靶向性等缺点,使其应用一定程度的受限[1]。超声靶向微泡破坏(UTMD)是一种新型、安全的靶向基因转染方法,能提高裸DNA及重组基因载体对细胞的转染效果[2,3]。目前,对于UTMD联合脂质体对前列腺癌细胞转染的效果尚未见报道。2016年 6~12月,我们将UTMD与脂质体联合,应用于沉默特异性核基质蛋白1基因(pSilencer3.1-SATB1)在前列腺癌DUl45细胞的转染,旨在构建一种安全、高效、特异的基因治疗导入系统,为前列腺癌的治疗研究提供新的思路和方法。
1 材料与方法
1.1 细胞、试剂与仪器 人前列腺癌雄激素非依赖型细胞株DU145(上海中科院生物研究所细胞库)。RPMI1640培养液(Gibco公司);无噬菌体、低内毒素胎牛血清(杭州四季青生物技术有限公司);0.25%胰蛋白酶(Gibco公司);SonoVue微泡(Bracco公司);脂质体Lipofectamine2000(Invitrogen);pEGFP-C1-pSilencer3.1-SATB1质粒、pSilencer3.1-SATB1引物(上海生物工程股份有限公司);质粒小量提取试剂盒(北京天根生物科技有限公司)。超声治疗仪(深圳威尔德电子有限公司)。
1.2 细胞培养 DU145细胞在37 ℃、5%CO2条件下,于培养瓶内常规培养,细胞培养液为含 10%胎牛血清的 RPMI1640培养液。
1.3 质粒提取和微泡制备 通过大肠杆菌DH5α感受态细胞,转化可表达增强型绿色荧光蛋白(EGFP)的质粒pEGFP-C1-pSilencer3.1-SATB1,按质粒小量提取试剂盒(TIAN prep Mini Plasmid Kit)说明书的要求提取、纯化质粒;测量质粒浓度和纯度,待A260∶A280≥1.8时用于实验。根据说明书制备声诺维微泡,反复振荡使之成为悬浮液。将质粒与微泡混合(每分钟震荡1次),于4 ℃恒温冰箱中保存15 min,备用。
1.4 细胞分组及转染处理 将生长良好的DU145细胞用0.25%胰酶消化计数后,以无血清的RPMI1640制成单细胞悬液,调节细胞悬液密度在1×105~3×105/mL。将细胞分为6组,分别为对照组、微泡组、超声组、超声+微泡组、脂质体组、超声+微泡+脂质体组。每组设3孔,实验重复5次。将各组细胞悬液分别缓慢加入无菌聚乙烯管内,各组中均加入等量的细胞悬液及质粒,试剂加入均在无菌超净台里完成。微泡组加入20%的微泡;超声组予以适宜强度的超声辐照;超声+微泡组加入20%的微泡浓度后予以适宜强度的超声辐照;脂质体组按照lipofectamin2000转染的步骤加入脂质体;超声+微泡+脂质体组加入相应量的脂质体及20%的微泡浓度后,予以适宜强度的超声辐照;对照组不做任何处理。试剂加入完毕后,聚乙烯管采用无菌封口膜封口,室温下静置30 min,于超声辐照前将细胞悬液轻柔摇匀。超声辐照时,探头固定于不锈钢支架上,使辐射面垂直朝上,然后将装有细胞悬液的聚乙烯管倒置于超声探头表面,为避免两者之间留有气泡,用超声耦合剂予以填充。超声辐照参数设置为频率1 MHz、辐照功率1.0 W/cm2、持续时间30 s、占空比20%。整个实验过程避光操作。
1.5 基因转染率测算 细胞辐照完成后去除封口膜,立即将细胞悬液转移于6孔培养板,置于37 ℃、5%CO2的培养箱中孵育4 h,换液后继续培养24 h,于荧光显微镜下观察细胞内EGFP的表达情况并摄片保存。因重组基因可表达EGFP,故采用流式细胞仪检测荧光细胞的比例,以EGFP的表达反映DU145细胞中pSilencer3.1-SATB1的表达量,计算基因转染率以评价转染效果。
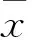
2 结果
荧光显微镜下,对照组、微泡组均未观察到绿色荧光;超声组可见极少绿色荧光;超声+微泡组、脂质体组均可见较多绿色荧光,但后者较前者绿色荧光明显;超声+微泡+脂质体组绿色荧光最强,可见大量EGFP表达,明显多于其他各组。对照组、微泡组、超声组、超声+微泡组、脂质体组、超声+微泡+脂质体组基因转染率分别为0.18%±0.09%、0.25%±0.11%、1.14%±0.13%、2.96%±0.16%、3.99%±0.12%、7.16%±0.17%,超声组、超声+微泡组、脂质体组、超声+微泡+脂质体组基因转染率均高于对照组,超声+微泡组、脂质体组、超声+微泡+脂质体组基因转染率均高于超声组,脂质体组、超声+微泡+脂质体组基因转染率均高于超声+微泡组,超声+微泡+脂质体组基因转染率高于脂质体组(P均<0.05)。
3 讨论
前列腺癌作为老年男性泌尿系统常见的恶性肿瘤之一,其发病率逐年升高,尤其是在欧美地区高居男性恶性肿瘤的首位,其病死率仅次于肺癌[4]。在我国,随着人口的老龄化、饮食结构和生活方式的改变以及诊断水平的提高,前列腺癌的发生亦越来越常见,已成为影响50岁以上男性人群健康的重要因素之一。近年来,随着分子生物学的发展以及相关生物技术的应用,对前列腺癌发生发展分子机制的认识逐步深入,对前列腺癌尤其是激素非依赖性前列腺癌的基因治疗研究已成为热点。
SATB1是一种组织特异性表达的核基质结合蛋白,在免疫调节、肿瘤转移和凋亡等方面起着重要作用,其主要机制是参与染色质高级结构的形成和调控组织特异性基因的表达。国内外研究[5,6]发现,SATB1基因不仅在前列腺癌组织中高表达,同时其表达水平与前列腺癌的临床分期及预后密切相关。Mao等[7]研究显示,体外沉默SATB1基因后可抑制前列腺癌DU145细胞株的增殖。因此,SATB1对于前列腺癌是一个良好的生物标志物和治疗靶点。如何将治疗性重组基因pSilencer3.1-SATB1成功转入DU145细胞,是发挥基因沉默SATB1治疗前列腺癌的前提,该转染过程需依次克服细胞外传输、细胞摄取和细胞内传输的3个障碍。脂质体作为目前最常用的非病毒载体,可与DNA形成脂质体-基因复合物,经胞饮作用将基因导入细胞内,易于制备及大量生产,但具有一定的细胞毒性,在活体内转染率较低。虽然脂质体转染的安全性、可控性较高,但由于其克服上述3个障碍的能力有限,且在血清和组织中不稳定,从而导致体内转染基因效率较低;除此之外,脂质体转染还具有基因传输无靶向性的缺陷。因此,寻找一种既能增强脂质体转染,又能提高其转染靶向性的递送系统,对于扩展脂质体转染的应用具有重要意义。
UTMD是一种新型的安全、易控的转染方式,在一定强度的超声辐照下,微泡在指定的靶向部位发生“爆破”,其间产生的冲击波、微射流等可使细胞膜通透性增高,有利于DNA分子穿透;此外,超声波的能量以及微泡破裂时向细胞内传送的震荡波还可促进DNA从细胞的内吞泡逸出并进入细胞核,上述效应叠加在一起,可以提高基因在不同细胞中的转染[10~13]。但就目前而言,与脂质体转染相比较,其转染率明显偏低。本研究发现,超声+微泡组的转染率低于脂质体组,与大多数研究结果类似,提示虽然UTMD具有较高的安全性、靶向性,但其转染效率与传统的脂质体转染相比仍有一定的差距,因此如何做到安全、高效、靶向地转染目的基因,一直是基因治疗研究的热点与难点。
近年研究发现,脂质体与UTMD联合应用时,不仅能降低脂质体的用量,减小其细胞毒性,还能提高其转染功效及靶向性。UTMD在增强脂质体转染方面,有其独特的优势,既对人体不产生不良反应,又易于调控,能针对不同细胞类型采取适宜的超声强度及微泡浓度。此外,还能使声束聚焦于特定范围,减少对非病变组织的损伤,为未来临床应用中疾病的针对化、个性化治疗提供了理论基础。近年研究[8~10]证实,UTMD不仅能提高脂质体转染的效率,而且还可以提高其转染的靶向性。Feril等[11]研究发现,单纯超声辐照就能增强脂质体转染,可能是通过提高脂质体转染克服上述基因转入过程3个障碍的能力,即增强了细胞对复合物及细胞核对DNA的摄取能力,抑制了细胞对DNA的胞吐作用。而加入微泡造影剂后,其作为一种人为空化核[12],能够使超声产生空化效应的能量阈值明显降低,从而达到增强空化效应,导致基因更易通过高通透性的细胞膜进入靶细胞,进而促进脂质体转染的目的。但是,目前大多数实验研究的是两者对报告基因pEGFP-C1/pEGFP-N1的联合增效作用,对治疗性重组基因的研究较少,且研究靶细胞多为肝癌细胞、乳腺癌细胞等,关于前列腺癌细胞的报道较少。本研究将UTMD联合脂质体应用于增强pSilencer3.1-SATB1基因在前列腺癌DU145细胞中的转染能力,发现超声+微泡+脂质体组基因转染率最高,明显高于脂质体组及超声+微泡组,进一步证实UTMD可以显著增强脂质体转染重组质粒的效率。
[1] Check E. Second cancer case halts gene-therapy trials[J]. Nature, 2003,421(6921):305.
[2] Sirsi SR, Borden MA. Advances in ultrasound mediated gene therapy using microbubble contrast agents[J]. Theranostics, 2012,2(12):1208-1222..
[3] Duvshani EM, Baruch L, Kesselman E, et al. Therapeutic ultrasound-mediated DNA to cell and nucleus: bioeffects revealed by confocal and atomic force microscopy[J]. Gene Therapy, 2005,13(2):163-172.
[4] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015,63(1):11-30.
[5] Shukla S, Sharma H, Abbas A, et al. Upregulation of SATB1 is associated with prostate cancer aggressiveness and disease progression[J]. PLoS One, 2013,8(1):e53527.
[6] 曹成松,毛立军,王军起,等.前列腺癌转移与特异性核基质结合区结合蛋白-1[J].中华实验外科杂志,2013,30(6):1174-1176.
[7] Mao L, Yang C, Li L, et al. Replication-competent adenovirus expressing TRAIL synergistically potentiates the antitumor effect of gemcitabine in bladder cancer cells[J]. Tumor Biology, 2014,35(6):5937-5944.
[8] Suzuki R, Takizawa T, Negishi Y, et al. Gene delivery by combination of novel liposomal bubbles with perfluoropropane and ultrasound[J]. J Control Release, 2007,117(1):130-136.
[9] Un K, Kawakami S, Suzuki R, et al. Enhanced transfection efficiency into macrophages and dendritic cells by a combination method using mannosylated lipoplexes and bubble liposomes with ultrasound exposure[J]. Hum Gene Ther, 2009,21(1):65-74.
[10] 丁璐,陈云超,刘晓玲,等.超声微泡破裂法联合阳离子脂质体介导基因转染的实验研究[J].中华超声影像学杂志,2013,22(8):691-695.
[11] Feril LB Jr, Ogawa R, Kobayashi H, et al. Ultrasound enhances liposome-mediated gene transfection[J]. Ultrason Sonochem, 2005,12(6):489-493.
[12] Geis NA, Katus HA, Bekeredjian R. Microbubbles as a vehicle for gene and drug delivery: current clinical implications and future perspectives[J]. Curr Pharm Des, 2012,18(15):2166-2183.
[13] 丁尚伟,张艳容,吴文谦,等.不同转染方式介导基因转染效果的评价[J].中华超声影像学杂志,2014,23(4):349-352.
Ultrasound-targeted microbubble destruction enhances transfection efficiency of liposome-mediated plasmid pSilencer3.1-SATB1 to DU145 cells
ZHANGJuanjuan,CHENYinghong,LINXuhong
(HuaiheHospitalofHenanUniversity,Kaifeng475000,China)
Objective To investigate the effects of ultrasound-targeted microbubble destruction (UTMD) combined with liposome-mediated silencing specific nuclear matrix protein 1 gene (pSilencer3.1-SATB1) on transfection of human prostate cancer DU145 cells.Methods The DU145 cells were cultured in vitro and divided into 6 groups: the control group, microbubble group, ultrasound group, ultrasound+microbubble group, liposome group, and ultrasound+microbubble+liposome group. The control group did not do any treatment, the microbubble group was added with the appropriate amount of microbubbles, the ultrasound group only
ultrasonic irradiation, the ultrasound+microbubble group was added with microbubbles, followed by ultrasonic irradiation, the liposome group was added with liposome, and the ultrasound+microbubble+liposome group was added with microbubbles and liposomes, followed by ultrasonic irradiation. After 24-hour treatment, the expression of enhanced green fluorescent protein (EGFP) was observed by flow cytometry, the percentage of EGFP fluorescent cells was detected, and the transfection efficiency was evaluated.Results Fluorescence microscopy showed that the expression of green fluorescent protein in the ultrasound+microbubble+liposome group was numerous, which was significantly higher than that of the other groups. The transfection efficiencies of the control group, microbubble group, ultrasound group, ultrasound+microbubble group, liposome group, and ultrasound+microbubble+liposome group were 0.18%±0.09%, 0.25%±0.11%, 1.14%±0.13%, 2.96%±0.16%, 3.99%±0.12%, and 7.16%±0.17%, respectively, and the transfection efficiency of the ultrasound+microbubble+liposome group was higher than that of the other groups (allP<0.05). Conclusion UTMD can enhance the transfection efficiency of liposome-mediated plasmid pSilencer3.1-SATB1 to DUl45 cells, and improve the transfection efficiency, so it provides a new way for the treatment of prostate cancer.
ultrasound-targeted microbubble destruction; gene transfection; liposome; plasmid; specific nuclear matrix protein 1 gene; prostate carcinoma
张娟娟(1982-),女,硕士,主治医师,主要研究方向为腹部及小器官的超声诊断。E-mail: 542145312@qq.com。
陈英红(1968-),女,本科,副主任医师,主要研究方向为腹部及小器官的超声诊断及超声介入诊治。E-mail: 17344743@qq.com
10.3969/j.issn.1002-266X.2017.30.006
R737.25
A
1002-266X(2017)30-0022-04
2017-03-04)
