CD80、CD86抗体对耗竭性T细胞效应功能的影响
2017-04-04孙斌杨晓珍郭向华周育森孙世惠王延军
孙斌,杨晓珍,郭向华,2,周育森,孙世惠,王延军,2
(1首都医科大学附属北京佑安医院,北京100069;2北京市肝病研究所;3中国军事医学科学院微生物流行病研究所)
CD80、CD86抗体对耗竭性T细胞效应功能的影响
孙斌1,杨晓珍1,郭向华1,2,周育森3,孙世惠3,王延军1,2
(1首都医科大学附属北京佑安医院,北京100069;2北京市肝病研究所;3中国军事医学科学院微生物流行病研究所)
目的以CD80、CD86抗体作为激动剂、脾细胞为研究对象,观察CD80、CD86抗体对耗竭性T细胞效应功能的影响。方法将42只8周龄雌性 HLA-A11DR1转基因小鼠随机分为7组各6只,分别在8、11、14周龄时,A~F组臀部皮下接种磷脂酰肌醇蛋白聚糖3(GPC3)多肽,G组接种等体积无热源PBS;A~E组在24周龄和F、G组在17周龄时脱颈处死,取脾脏并制成脾细胞悬液;A、B组分别滴加20、40 μg/mL 抗鼠CD80抗体和10 μg/mL GPC3多肽,C、D组分别滴加20、40 μg/mL 抗鼠CD86抗体和10 μg/mL GPC3多肽,E、F、G组仅滴加10 μg/mL GPC3多肽。孵育18 h后,采用酶联斑点分析仪检测干扰素γ(IFN-γ),以此判断T细胞效应功能。结果A~G组脾细胞IFN-γ阳性斑点数分别为(80.61±48.91)、(207.67±60.41)、(1.67±0.97)、(1.33±0.49)、(2.33±1.53)、(38.17±5.18)、(2.33±1.53)个。其中,F组高于E、G组(P均<0.01),E、G组间比较无统计学差异;A组>B组>C、D、E组(P均<0.01),C、D、E组间比较差异无统计学意义;而且,IFN-γ阳性斑点数随着CD80抗体浓度升高而增加,二者呈正相关(r=0.760 5,P<0.01)。结论CD80抗体能够刺激耗竭性T细胞恢复产生细胞因子,且呈剂量依赖的动力效应;而CD86抗体未能检测到该功能。
CD80抗体;CD86抗体;磷脂酰肌醇蛋白聚糖3;多肽疫苗;T细胞耗竭;干扰素γ
脾细胞主要成分为T细胞和B细胞,T细胞受到肽刺激会产生干扰素γ(IFN-γ),而B细胞则不能。因此,动物免疫实验中常用肽刺激小鼠脾细胞并检测IFN-γ的分泌情况,以分析T细胞功能。刺激CD8+T细胞活化并分化为效应性T细胞,是免疫系统保护宿主、清除病原微生物或肿瘤抗原的关键。然而,在肿瘤微环境中,常由于T细胞疲劳耗竭,而致抗肿瘤应答能力弱、效率低下,不能有效识别和清除肿瘤细胞[1];T细胞耗竭的形成通常是由于抗原持续性存在,缺乏辅助性“帮助”信号引起,从而抑制有效免疫应答的形成。通过治疗性疫苗来增强原本微弱的抗肿瘤反应,一直是科学家长期以来所寻求的治疗癌症目标[2~4]。磷脂酰肌醇蛋白聚糖3(GPC3)是在肝癌组织中高表达的癌胚抗原(72%~81%)[5, 6],组织特异性强,且与预后不良相关[5],是肝癌免疫治疗的理想靶抗原[5,7~9]。2016年1~12月,我们以CD80、CD86抗体作为激动剂,刺激GPC3疫苗接种后期的耗竭性T细胞,观察其恢复效应性功能的效果。
1 材料与方法
1.1 材料 8周龄雌性 HLA-A11DR1转基因小鼠48只,由军事医学科学院周育森教授研究组构建,购自军事医学科学院实验动物中心;抗鼠 CD80、CD86抗体均购自eBioscience公司,GPC3多肽由上海强耀生物公司合成;弗氏完全佐剂、不完全佐剂和植物凝集素(PHA)均购自Sigma 公司;Elispot小鼠IFN-γ检测试剂盒、ACE显色底物和Falcon细胞筛网均购自BD公司;细胞培养用RPMI 1640培养基、胎牛血清和无热源PBS缓冲液均购自Gibco公司;酶联斑点分析仪购自美国CTL公司。
1.2 动物分组与免疫接种 将42只小鼠随机分为7组各6只,A~F组接种GPC3多肽,G组接种等体积无热源PBS,免疫途径和方法相同。具体方法:将100 μg GPC3多肽与50 μL弗氏完全佐剂按照1∶1的体积比混合(总体积100 μL),并用组织匀浆机乳化,使之达到油包水的效果;分别在8、11、14周龄时,于小鼠臀部皮下注射GPC3多肽100 μL/只。
1.3 脾细胞制备与刺激处理 A~E组在24周龄和F、G组在17周龄时,将小鼠颈椎脱臼处死并取脾脏,经细胞筛网组织碾磨后获得脾细胞悬液,调整细胞密度至2×106/mL。将各组细接种在96孔板,2×105/孔。A、B组分别滴加20、40 μg/mL 抗鼠CD80抗体和10 μg/mL GPC3多肽,C、D组分别滴加20、40 μg/mL 抗鼠CD86抗体和10 μg/mL GPC3,E、F、G组仅滴加10 μg/mL GPC3多肽。每孔总体积100 μL,阳性对照孔中加入5 μg/mL PHA。
1.4 T细胞效应功能观察 采用酶联斑点分析法。取各组孵育18 h的细胞,加入辣根过氧化物酶标记的IFN-γ二抗,室温放置3 h;每孔加入100 μL TMB底物溶液,室温显色10~15 min,阳性对照孔出现深紫色斑点即可停止显色。采用酶联斑点分析仪读取IFN-γ阳性免疫斑点数,斑点数越多表明T细胞效应功能越强。
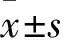
2 结果
孵育18 h后,A~G组脾细胞IFN-γ阳性免疫斑点数分别为(80.61±48.91)、(207.67±60.41)、(1.67±0.97)、(1.33±0.49)、(2.33±1.53)、(38.17±5.18)、(2.33±1.53)个。其中F组高于E、G组(P均<0.01),E、G组间比较无统计学差异,表明免疫接种小鼠在免疫应答后期可能出现了T细胞耗竭。A组>B组>C、D、E组(P均<0.01),C、D、E组间比较差异无统计学意义;而且,IFN-γ阳性免疫斑点数随着CD80抗体浓度升高而增加,二者呈正相关(r=0.760 5,P<0.01)。
3 讨论
诱导产生持续性肿瘤抗原特异性CD8+T细胞应答,是保障治疗性癌症疫苗效应的基本要素。大量研究表明,CD8+T细胞必须受到活化的专职抗原提呈细胞(pAPCs)所产生的辅助信号刺激,才能激活并分化为效应性T细胞[9]。GPC3是肝癌免疫治疗的理想靶抗原,其多肽疫苗在HLA-A11阳性人群中具有良好的免疫反应性。本研究将GPC3多肽疫苗免疫接种HLA-A11DR1转基因小鼠,在17周龄时可诱导产生显著的GPC3特异性T细胞应答,而在24周龄时特异性T细胞应答明显减弱,表现为特征性的T 细胞耗竭状态,可能是由于辅助信号缺失引起。
B7家族分子CD80和CD86均是T细胞表面协同刺激分子CD28的配体,二者具有高度同源性,与CD28结合后产生T细胞活化所需的辅助信号,刺激T细胞增殖分化并发挥效应功能。CTLA-4分子是T细胞表面协同刺激分子CD28的结构同源体,二者均能与B7家族分子CD80和CD86功能性结合,但CTLA-4是T细胞表面的抑制性受体;CTLA-4与B7分子的亲合力大大强于CD28,故一旦CTLA-4表达在活化T细胞表面,它将降低T细胞活性,抑制细胞增殖和细胞因子分泌[14]。肿瘤微环境中的特异性效应T细胞功能耗竭[14],往往与T细胞表面抑制性受体过度表达有关[15]。本研究中将CD80抗体与功能耗竭的T细胞共孵育后,细胞因子分泌显著增加,而且呈剂量依赖的动力效应。这表明CD80抗体阻断CD80分子与抑制性受体CTLA-4结合,抑制性信号减少,T细胞功能得以恢复。因此,CD80抗体可作为激动剂,刺激耗竭性T细胞恢复效应性功能。然而,CD86虽同为B7家族分子,其抗体与功能耗竭的T细胞共孵育后,未检测到细胞因子分泌功能的变化,其机制尚需进一步研究。
迄今,已有足够多的研究表明肝癌患者的肿瘤特异性T细胞功能低下[10~12],而近95%的成年急性乙肝病毒(HBV)感染者则表现出强劲的HBV特异性CD8+T细胞应答。肿瘤患者T细胞功能损害与内源性免疫抑制调节机制,即免疫检查点(IC)活化[11, 13]有关;由于CTLA-4是免疫检查点的关键分子,它已成为克服免疫应答抑制性调节的理想靶点[15]。然而,CTLA-4组织分布广泛,其表达无肿瘤特异性(除某些骨髓瘤和淋巴瘤外)。阻断CTLA-4可能导致机体免疫抑制机制缺失,免疫失衡紊乱,继而引发剧烈致死性自身免疫病;CTLA-4敲除鼠的超免疫表型也表明,阻断该受体易导致强烈的免疫毒性副作用,此类研究结果使得封闭CTLA-4的治疗策略不断受到质疑[13,15]。
在我们的研究中,CD80抗体能够使耗竭性T细胞恢复产生细胞因子,而且呈剂量依赖性。相较于CTLA-4抗体,CD80抗体仅部分阻断CTLA-4信号;CD86分子仍然可以与CTLA-4受体相结合,产生抑制性信号,维持免疫系统平衡稳定,从避免了完全阻断该受体引起的剧烈自身免疫病。这些突出显示了选择性靶向CD80分子,部分阻断CTLA-4抑制性信号,恢复T细胞功能,在肿瘤免疫治疗中的潜在优势。
[1] Bauer CA, Kim EY, Marangoni F, et al. Dynamic Treg interactions with intratumoral APCs promote local CTL dysfunction[J]. J Clin Invest, 2014,124(6):2425-2440.
[2] Lakshminarayanan V, Supekar NT, Wei J, et al. MUC1 vaccines, comprised of glycosylated or non-glycosylated peptides or tumor-derived MUC1, can circumvent immunoediting to control tumor growth in MUC1 transgenic mice[J]. PLoS One, 2016,11(1):e145920.
[3] Derouazi M, Di Berardino BW, Belnoue E, et al. Novel cell-penetrating peptide-based vaccine induces robust CD4+and CD8+T cell-mediated antitumor immunity[J]. Cancer Res, 2015,75(15):3020-3031.
[4] Matsuo K, Machida H, Ragab OM, et al. Extent of pelvic lymphadenectomy and use of adjuvant vaginal brachytherapy for early-stage endometrial cancer[J]. Gynecol Oncol, 2017,144(3):515-523.
[5] Yu J, Ma Q, Zhang B, et al. Clinical application of specific antibody against glypican-3 for hepatocellular carcinoma diagnosis[J]. Sci China Life Sci, 2013,56(3):234-239.
[6] Fu SJ, Qi CY, Xiao WK, et al. Glypican-3 is a potential prognostic biomarker for hepatocellular carcinoma after curative resection[J]. Surgery, 2013,154(3):536-544.
[7] Behboudi S, Boswell S, Williams R. Cell-mediated immune responses to alpha-fetoprotein and other antigens in hepatocellular carcinoma[J]. Liver Int, 2010,30(4):521-526.
[8] 易达委,孙斌,刘晓霓,等. GPC3在癌症免疫治疗及诊断中的意义[J].中国免疫学杂志,2014,30(6):858-861.
[9] 孙斌,李雯,计云霞,等. GPC3特异性HLA-A11限制的T淋巴细胞表位肽免疫活性检测[J]. 北京医学,2014,36(9):752-755.
[10] Sen DR, Kaminski J, Barnitz RA, et al. The epigenetic landscape of T cell exhaustion[J]. Science, 2016,354(6316):1165-1169.
[11] Ngiow SF, Young A, Blake SJ, et al. Agonistic CD40 mAb-Driven IL12 reverses resistance to anti-PD1 in a T-cell-rich tumor[J]. Cancer Res, 2016,76(21):6266-6277.
[12] Isogawa M, Chung J, Murata Y, et al. CD40 activation rescues antiviral CD8(+) T cells from PD-1-mediated exhaustion[J]. PLoS Pathog, 2013,9(7):e1003490.
[13] Bhadra R, Cobb DA, Khan IA. CD40 signaling to the rescue: A CD8 exhaustion perspective in chronic infectious diseases[J]. Crit Rev Immunol, 2013,33(4):361-378.
[14] Pauken KE, Sammons MA, Odorizzi PM, et al. Epigenetic stability of exhausted T cells limits durability of reinvigoration by PD-1 blockade[J]. Science, 2016,354(6316):1160-1165.
[15] Ford ML, Larsen CP. Translating costimulation blockade to the clinic: lessons learned from three pathways[J]. Immunol Rev, 2009,229(1):294-306.
Influence of CD80 and CD86 antibody on effector function of exhausted T cells
SUNBin1,YANGXiaozhen,GUOXianghua,ZHOUYusen,SUNShihui,WANGYanjun1,2*
(1BeijingYouanHospital,CapitalMedicalUniversity,Beijing100069,China)
ObjectiveTo investigate the effects of CD80 and CD86 antibody on the effector function of exhausted T cells.MethodsForty-two female HLA-A11DR1 transgenic mice were randomly divided into 7 groups (n=6). The mice in groups A-F were subcutaneously inoculated with phosphatidylinositol 3 (GPC3) at the age of 8 weeks (week 8), at week 11 and week 14, respectively. Mice in the group G were inoculated with the same volume of heat-free PBS as controls. Mice in the groups A-E were sacrificed at week 24, and groups F and G at week 17. Splenocytes suspension was made. Then, 20 or 40 μg/mL CD80 antibody and 10 μg/mL GPC3 peptide were pipetted in the splenocytes of groups A and B; 20 or 40 μg/mL CD86 antibody and 10 μg/mL GPC3 were pipetted in the groups C and D, respectively; 10 μg/mL GPC3 peptide was pipetted in the groups E, F, and G. After incubation for 18 h, interferon-γ (IFN-γ) was measured by enzyme-linked spot analyzer for analysis of T cell function.ResultsIFN-γ positive spots in the groups A-G were 80.61±48.91, 207.67±60.41, 1.67±0.97, 1.33±0.49, 2.33±1.53, 38.17±5.18 and 2.33±1.53, respectively. Among them, group F was significantly higher than groups E and G (bothP<0.01). There was no significant difference between groups E and G (bothP<0.01). Group A was more than group B, and group B was significantly more than group C, D and E (allP<0.01). There was no significant difference among groups C, D and E. In addition, the number of IFN-γ positive spots was positively correlated with CD80 antibody concentration (r=0.7605,P<0.01).ConclusionsAnti-CD80 could restore the exhausted T cells to secret IFN-γ with a dose-dependent manner, while anti-CD86 could not be detected for the same effect.
CD80 antibody; CD86 antibody; phosphatidylinositol 3; peptide vaccine; T cell exhaustion; interferon-γ
10.3969/j.issn.1002-266X.2017.34.007
R392.5;R575.1
A
1002-266X(2017)34-0024-03
2017-08-04)
北京市科学技术委员会首都市民健康项目(Z141100002114002);北京市卫生系统高层次卫生技术人才项目(2014-3-092)。
孙斌(1971-),男,博士,主任医师,主要研究方向肿瘤及肝病的介入治疗。E-mail: sb5368@hotmail.com
王延军(1971-),女,博士,研究员,主要研究方向为肝病的免疫机制及免疫治疗。E-mail: yjunwang@ccmu.edu.cn
孙世惠(1968-),女,副研究员,主要研究方向为转基因动物模型及病原感染免疫致病机制。E-mail: sunsh01@163.com
