微生态制剂联合胸腺肽α1在腹膜透析相关性腹膜炎治疗中的应用
2017-10-10何华妮吴伟黄开存张曼青王克坤
何华妮,吴伟,黄开存,张曼青,王克坤
(琼海市人民医院,海南琼海 571400)
微生态制剂联合胸腺肽α1在腹膜透析相关性腹膜炎治疗中的应用
何华妮,吴伟,黄开存,张曼青,王克坤
(琼海市人民医院,海南琼海 571400)
目的观察微生态制剂联合胸腺肽α1在腹膜透析相关性腹膜炎患者治疗中的效果,并探讨其机制。方法将50例持续非卧床腹膜透析(CAPD)相关性腹膜炎患者随机分为A、B组各25例,选择同期20例无腹膜炎的腹膜透析患者作为C组。A、B组在得到药敏结果前给予万古霉素、第三代头孢菌素等经验性治疗,得到药敏结果后调整用药方案;A组另予微生态制剂联合胸腺肽α1治疗,疗程为2周。比较A、B组病原菌分布情况,记录痊愈及抗感染治疗时间;取各组治疗前及A、B组治疗第3、7天的透析液,采用流式细胞仪检测透出液中巨噬细胞表面Toll样受体4(TLR-4)表达量及肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)水平。结果A、B组透出液病原微生物分布差异无统计学意义,腹膜炎均痊愈,且A组抗感染治疗时间短于B组(P<0.05)。A、B组治疗前腹腔透出液巨噬细胞表面TLR-4表达量及TNF-α和IL-6水平差异无统计学意义,且均低于C组(P均<0.01);治疗第3、7天,A、B组TLR-4表达量及TNF-α、IL-6水平均较治疗前升高,且A组高于B组(P均<0.05),但治疗第7天B组TLR-4表达量及TNF-α、IL-6水平仍低于C组(P均<0.05)。结论CAPD相关性腹膜炎患者在常规抗感染治疗的基础上给予微生态制剂联合胸腺肽α1治疗,能明显提高腹腔透析液巨噬细胞表面TLR-4表达及TNF-α、IL-6水平,从而缩短抗感染治疗时间。
腹膜透析;腹膜炎;微生态制剂;胸腺肽;Toll样受体;肿瘤坏死因子α;白细胞介素6
持续非卧床腹膜透析(CAPD)是终末期肾衰患者肾脏替代治疗的重要措施之一[1],而感染性腹膜炎是其最常见的并发症[2]。CAPD相关性腹膜炎的发生与腹腔局部免疫功能状态关系密切[3],常规抗感染治疗虽能取得较好疗效,但长期CAPD患者复发率仍较高。2014~2016年,我们观察了微生态制剂联合胸腺肽α1在CAPD相关性腹膜炎治疗中的效果,并探讨其对腹腔透出液中巨噬细胞表面Toll样受体4(TLR-4)表达及炎症介质肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)水平的影响。现报告如下。
1 资料与方法
1.1 临床资料 选择琼海市人民医院收治的50例CAPD相关性腹膜炎患者,符合2005年国际腹膜透析协会推荐指南中腹膜炎的诊断标准[4],采用随机数字表法分为A、B组各25例;选择同期无腹膜炎的腹膜透析患者20例(C组)。A组男17例、女8例,年龄(55.31±11.65)岁;原发病:慢性肾小球肾炎12例,慢性肾盂肾炎6例,糖尿病肾病4例,狼疮性肾炎1例,其他2例;透析时间(12.73±4.38)月,肌酐清除率(CCL)为(75.83±35.56)L/(周·1.73 m2),肾小球滤过率(eGFR)为(3.42±2.13)mL/min。B组男16例、女9例,年龄(54.73±11.94)岁;原发病:慢性肾小球肾炎13例,慢性肾盂肾炎6例,糖尿病肾病4例,狼疮性肾炎1例,其他1例;透析时间(12.14±4.57)月, CCL为(74.52±34.65)L/(周·1.73 m2),eGFR为(3.48±2.21)mL/min。C组男13例、女7例,年龄(53.63±12.36)岁;原发病:慢性肾小球肾炎10例,慢性肾盂肾炎5例,糖尿病肾病3例,狼疮性肾炎1例,其他1例;透析时间(11.81±4.73)月,CCL为(72.64±32.83)L/(周·1.73 m2),eGFR为(3.63±2.28)mL/min。排除其他系统的严重疾病和全身感染以及真菌性腹膜炎患者,排除同时患有胶原病、丙型肝炎等存在自身免疫细胞功能异常的患者。本研究经医院伦理委员会批准,患者均签署知情同意书。三组性别、年龄、原发病、透析时间、CCL、eGFR比较,差异无统计学意义(P均>0.05)。
1.2 方法
1.2.1 治疗方法 患者均给予标准CAPD治疗,换液1 L/次,5次/d,夜间保留时间≥6 h。A、B组在得到药敏结果前给予万古霉素、第3代头孢菌素等经验性治疗,得到药敏结果后调整用药方案。A组另予微生态制剂联合胸腺肽α1治疗:双歧杆菌三联活菌胶囊,2粒/次,3次/d,口服,疗程为2周;胸腺肽α11.6 mg用1 mL生理盐水溶解后皮下注射,2次/周,疗程为2周。
1.2.2 病原菌检测及治疗效果观察 取A、B组治疗前的腹膜透析液50 mL,离心涂片后行革兰染色进行病原菌检测;治疗2周后,以患者腹膜炎症状体征完全消失,且腹膜透析液病原菌检测转阴判断为痊愈;记录抗感染治疗时间。
1.2.3 腹腔透出液中巨噬细胞表面TLR-4检测 取各组治疗前及A、B组治疗第3、7天第一袋透出液50~100 mL,4 ℃下以450 r/min离心10 min,置于RPMI 1640培养基中;按体积比2∶1加入到预先置有淋巴细胞分离液的离心管中,20 ℃下以450 r/min离心25 min。将离心得到较纯的巨噬细胞用培养基洗涤2次,调整细胞密度为1×106/mL,台盼蓝排斥试验证实细胞存活率>99%。取500 μL巨噬细胞悬液,常规应用流式细胞仪检测巨噬细胞表面TLR-4,以相对荧光强度表示其表达量。
1.2.4 腹腔透出液中TNF-α、IL-6检测 取各组治疗前及A、B组治疗第3、7天第一袋透出液50~100 mL,4 ℃下以3 000 r/min离心15 min;取上清10 mL,采用ELISA法检测TNF-α、IL-6。
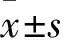
2 结果
2.1 CAPD相关性腹膜炎患者病原微生物分布及临床结局 培养出的G+菌中,A组金黄色葡萄球菌4例、草绿色链球菌4例、G+杆菌3例、溶血葡萄球菌1例、唾液链球菌1例,B组分别为5、2、3、0、1例;培养出的G-菌中,A组大肠埃希菌6例、肺炎克雷伯菌1例、阴沟肠杆菌1例,B组分别为7、1、1例;A组培养阴性4例,B组5例。两组病原微生物分布差异无统计学意义(P>0.05)。A、B组腹膜炎均痊愈,抗感染治疗时间分别为(12.47±4.28)、(15.56±4.79)d,A组抗感染治疗时间短于B组(P<0.05)。
2.2 各组腹腔透出液中巨噬细胞表面TLR-4表达比较 见表1。
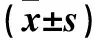
表1 各组腹腔透出液中巨噬细胞表面TLR-4表达比较
注:与C组比较,aP<0.05,bP<0.01;与同组治疗前比较,cP<0.01;与B组同时点比较,dP<0.05。
2.3 各组腹腔透出液中TNF-α和IL-6水平比较 见表2。
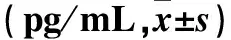
表2 各组腹腔透出液中TNF-α和IL-6水平比较
注:与C组比较,aP<0.05,bP<0.01;与同组治疗前比较,cP<0.01;与B组同时点比较,dP<0.05。
3 讨论
一般情况下,在腹膜透析过程中,病原微生物进入腹腔后,可通过腹腔中的免疫防御系统清除吸收,机体处于微炎症状态,常表现为细胞免疫因子如TNF-α、IL-1、IL-6等水平升高,但并不引起腹膜炎。目前普遍认为,腹膜在长期透析液刺激下,巨噬细胞功能受到明显抑制,腹膜局部免疫防御功能受损,当腹膜感染时透析患者腹腔巨噬细胞功能相关指标如吞噬指数、TNF-α及IL-6等水平均明显降低[5~8]。
TLR-4通过对病原体相关分子模式的识别以及刺激信号的级联反应诱导细胞炎症因子产生[9],在抗感染免疫中发挥着重要作用。巨噬细胞TLR-4信号激活可引起一系列防御机制的启动,如加速巨噬细胞的成熟以及提高自噬作用。吞噬和自噬作用是组织细胞防御病原菌入侵的两种不同但相关的手段,巨噬细胞TLR-4信号通过将自噬和吞噬作用紧密联系,从而起到增强吞噬及杀灭病原菌的作用[10]。因此,TLR-4表达下降及信号反应异常可导致机体天然免疫防御功能受损,导致机体对病原菌的防御能力降低。本研究发现,CAPD相关性腹膜炎患者腹腔透出液巨噬细胞表面TLR-4表达较无腹膜炎的CAPD患者明显降低,且TNF-α、IL-6水平也明显降低。与伍军[11]的研究结论基本一致,均提示巨噬细胞TLR-4表达下降及其信号低下所导致的腹腔局部天然免疫防御功能破坏参与了腹膜炎的发生发展。
微生态制剂双歧杆菌三联活菌胶囊主要由双歧杆菌、乳酸杆菌、粪肠球菌组成,能促进肠道微生态平衡恢复,对肠道菌膜屏障有修复作用;同时使肠道有益菌的菌群优势提高,并定植于黏膜上皮的正常菌群中而形成生物膜样结构,抑制潜在致病菌过度生长、繁殖及定植[12]。周宝华等[12]对肝硬化患者应用双歧杆菌三联活菌胶囊治疗,细菌性腹膜炎发生率较对照组明显降低。另外有研究[13,14]发现,益生菌还能产生非特异的免疫调节因子,具有提高机体免疫力的作用。胸腺肽α1是临床常用的免疫调节剂,它作为生物调节因子,可促进T细胞及NK细胞的分化、成熟,促进致敏T细胞经有丝分裂原或抗原激活后分泌相关细胞因子并提高IL-22受体的表达,使Th细胞免疫功能增强,从而改善透析患者免疫功能缺陷;它作为抗炎因子,具有增强、调节机体细胞免疫功能的作用,即增强巨噬细胞吞噬功能及清除细菌、真菌等成分的能力,并对TNF-α的释放起到调节作用[15]。
本研究结果显示,A组治疗第3、7天时患者腹腔透析液中巨噬细胞表面TLR-4的表达及TNF-α、IL-6水平均较治疗前逐渐升高,并逐渐接近C组水平,且均高于B组。因此,CAPD相关性腹膜炎患者存在腹腔局部免疫防御功能损害,表现为腹腔透析液巨噬细胞表面TLR-4表达以及TNF-α、IL-6水平降低;在常规抗感染治疗的基础上,给予微生态制剂联合胸腺肽α1治疗能明显提高腹腔透析液巨噬细胞表面TLR-4表达及TNF-α、IL-6水平,改善巨噬细胞吞噬及免疫防御功能,促进腹腔细胞因子网络平衡的恢复。
[1] 李晓平,沈丛飞,李洁.健康教育对持续性非卧床腹膜透析患者发生腹膜炎的影响[J].医学临床研究,2010,27(8):1587-1588.
[2] 李晓春,黄怡,谷舜意.五水头孢唑啉钠治疗腹膜透析腹腔感染的疗效观察[J].海峡药学,2011,23(1):72-73.
[3] 罗琼,熊祖应,聂李平,等.CAPD腹膜炎时白细胞、T细胞亚群及白蛋白之间的相关性[J].中国血液净化,2010,9(3):126-128.
[4] Piraino B, Bailie GR, Bernardini J, et al. Peritoneal dialysis-related infections recommendations:2005 update[J]. Perit Dial Int, 2005(25):107-131.
[5] 李琦.肠道微生态与肝、肾疾病的相互影响[J].复旦学报(医学版),2013,40(3):375-378.
[6] 黄云霞.腹膜透析并发腹膜炎28例临床分析[J].浙江临床医学,2009,11(1):54-55.
[7] 何建静,廖蕴华.腹膜透析相关性腹膜炎的病因与治疗进展[J].医学综述,2009,15(1):116-117.
[8] Jones S, Holmes CJ, Mackenzie RK, et al. Continuous dialysis with bicarbonate/lactate-buffered peritoneal dialysis fluids results in a long-term improvement in ex vivo peritoneal macrophage function[J]. J Am Soc Nephrol, 2002,13(Suppl 1):97-103.
[9] 陈亚巍,谢晓华.与免疫相关的Toll样受体4识别内源性配体的研究进展[J].军医进修学院学报,2011,32(12):1291-1293.
[10] 康翼鹏,周颖,薛小燕,等.巨噬细胞吞噬中性粒细胞的协同抗炎作用[J].生理科学进展,2012,43(6):455-458.
[11] 伍军.Toll样受体4表达及其信号异常在腹膜透析相关性腹膜炎发生中的作用[D].广州:中山大学,2009.
[12] 周宝华,舒晋峰.微生态制剂预防肝硬化自发性细菌性腹膜炎的临床效果[J].海峡药学,2012,24(3):208-209.
[13] 赵智刚,任星峰.微生态制剂在重型肝炎自发性细菌性腹膜炎中的应用[J].中国药师,2008,11(1):53-55.
[14] 周华坚,曾宏.三联活菌对肝硬化肠道菌群及免疫功能的影响[J].中国现代医生,2009,47(8):26-27.
[15] 胡国朝,石宏斌.胸腺肽α1对血液透析患者微炎症状态的影响[J].中国中西医结合肾病杂志,2011,12(2):135-137.
本刊2017年57卷第30期108~110页文章《信号蛋白14-3-3生物学功能及其参与炎症反应的机制研究进展》中,基金项目为国家自然科学基金资助项目(81571572),通信作者为徐胜前(E-mail:xsqian-1112@163.com)。特此声明。
本刊编辑部
10.3969/j.issn.1002-266X.2017.34.035
R459.5
B
1002-266X(2017)34-0099-03
2017-04-17)
