壁虎醇提物急性毒性研究
2017-04-01郭梦丽王建刚段一梦
郭梦丽,王建刚,靳 颖,段一梦
壁虎醇提物急性毒性研究
郭梦丽,王建刚,靳 颖,段一梦
目的 观察壁虎醇提物对小白鼠的急性毒性作用。方法 运用急性毒性的实验进行半数致死量(LD50)的计算。预实验用较大范围壁虎醇提物试液少量动物进行实验求出致死范围,然后在全数致死量和零致死量之间将实验用小白鼠分为5组,计算各组剂量公比,每组10只雄性小白鼠,进行正式实验,将实验结果记录后运用改良寇氏法进行计算。结果 灌胃给予壁虎醇提物,小鼠无死亡出现,但活动减少,反应迟钝,1 h后恢复正常,小白鼠每日灌胃的最大耐受量(MTD)为48.0 g·kg-1。经腹腔注射给药的LD50为6.475 g·kg-1,95%可信限为6.862~6.088 g·kg-1。结论 壁虎醇提物毒性极小,临床应用相对较安全。
壁虎醇提物;急性毒性试验;半数致死量;最大耐受量
壁虎作为一种传统中药具有祛风定惊、散结解毒的功能[1]。现代药理学研究发现壁虎有抑制恶性肿瘤、改善组织中血液供应、抑菌、降低血压、平喘等作用,很具药物开发潜力[2]。目前,随着壁虎逐渐应用于临床,其药理作用已有不少报道[3],但其成分复杂,对于测定壁虎的急性毒性作用及安全用量的研究还不是很丰富。本研究用改良寇氏法测定壁虎醇提物半数致死量(median lethal dose,LD50),研究壁虎醇提物的急性毒性作用,为进一步开发壁虎药用价值及其临床应用提供依据。现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 试剂与药品 多疣壁虎粉(安徽省亳州市永刚饮业厂有限公司,批号:090301,经河南科技大学医学院实验动物中心王晓利高级实验师鉴定)。
1.1.2 实验用动物 雄性BALB/c小鼠,120只,体质量18~24 g,河南科技大学医学院实验动物中心提供(合格证号scxk2015-0007)。
1.1.3 主要仪器 电子分析天平(上海梅特勒—托利多仪器有限公司)、高速冷冻离心机(美国赛默飞世尔科技有限公司)、L50胶体磨(上海诺尼轻工机械有限公司)、旋转蒸发仪(上海亚荣生化仪器公司)、加热磁力搅拌器(德国IKA公司)、PHS-3C型pH计(上海仪电科学仪器股份有限公司)、冷冻干燥机(北京博医康实验仪器有限公司)、KQ-250E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 实验方法
1.2.1 壁虎醇提物的制备 取壁虎干粉(多疣壁虎粉)100 g溶解于蒸馏水500 mL中,用磁力搅拌器搅拌至全部溶解为无团状粉末,用胶体磨研磨 4 h。取出胶体磨中匀浆液,置于离心管中,用高速离心机5 500 r·min-1离心5 min,弃去上清,取所剩沉淀。将沉淀用蒸馏水溶解,定容至300 mL,加入无水乙醇367 mL(使乙醇终浓度为55%)搅拌均匀后置4 ℃冰箱,每隔0.5 h搅拌1次(搅拌4 h)后,置于离心管中,用高速离心机5 500 r·min-1离心5 min,弃去沉淀,取上清,用真空旋转蒸发仪旋转蒸发(水浴锅温度控制在50 ℃),蒸去酒精(可回收再利用),负压冷冻干燥机冻干得到壁虎醇提物干粉[4]。
1.2.2 灌胃给药LD50及最大耐受量测定 配制不同浓度(800、667、600、556、500、463 mg·mL-1)壁虎醇提物试液,然后将禁食12 h的小鼠进行灌胃给药(分别以0.3 mL·10 g-1剂量用1 mL 注射器将新配制的不同浓度壁虎醇提物灌胃),空白组小鼠等体积注射用水灌胃,每日给药2次,每次间隔12 h,给药后小鼠常规饲养,自由饮水,自然光照,室温20~25 ℃,相对湿度60%。连续观察7 d小鼠的毒性反应,包括行为活动、精神状态、食欲、大小便、呼吸,口、鼻、眼、耳、肛门等有无异常分泌物,毛发、体质量变化及死亡等情况。使用小鼠能够耐受而不引起死亡的最大耐受量(maximum tolerated dose,MTD)[5]。第8日对未死亡小鼠进行称重并断颈处死,观察小鼠内脏器官的变化。
1.2.3 腹腔注射给药LD50的测定 配制不同浓度(800、714、650、600、550、500 mg·mL-1)壁虎醇提物,然后以0.1 mL·10 g-1剂量用2.5 mL注射器分别将新配制的不同浓度的壁虎醇提物腹腔注射,预实验得引起动物0%死亡的剂量(most non lethal dose, Dn)=0.0500 g·10 g-1,引起动物100%死亡的剂量(minimum lethal dose, Dm)=0.080 g·10 g-1。
根据预实验测试结果,在Dn=500 mg·mL-1和Dm=800 mg·mL-1的剂量范围内设置5个剂量组,各剂量组的动物相等。组间剂量比值(1∶r)。在0%和100%死亡剂量范围内,各剂量组的公比如下式:

公式中n为分组数,则各组剂量分别是Dn,Dn·r,Dn·r2,Dn·r3,Dn·r4。由上述预实验可得出各剂量组的公比r=1.12。各组剂量分别为0.050、 0.056、0.063、0.071、0.080g·10g-1。
将实验小鼠随机分组标号并准确称重记录,以0.1mL·10g-1剂量对小鼠进行腹腔注射。空白组小鼠腹腔注射等体积注射用水。在注射2、4、8、16h,第2、3、4、5、6、7 日分别记录小鼠生存状况及体质量变化,采用改良寇氏法测定壁虎醇提物的LD50。实验7d后,对未死亡小鼠进行断颈处死,观察小鼠内脏器官的变化(死亡率观察时间:根据药物作用快慢,观察10~30min、24~72h,个别为7d。最小剂量药物组的死亡率不得超过20%,而最大剂量药物组的死亡率不得少于80%)。
2 实验结果
2.1 灌胃给药 由于测不出壁虎醇提物的LD50,而其试液最大浓度为0.8g·mL-1,实验组小白鼠按最大给药体积0.3mL·10g-1给药,全部存活,与空白组对照未见任何异常状况,均活动自如。观察7d,第8日称体质量后处死实验组小白鼠,解剖发现胃充盈,肠无胀气。解剖肉眼观察心、肝、脾、肺、肾、肾上腺、胸腺、胃、肠及胸腔、腹腔等器官均无异常。给药前体质量为(24.40±1.60)g,第8日体质量为(28.70±2.40)g。测定出小白鼠每日灌胃的最大耐受量为48.0g·kg-1。
2.2 腹腔注射给药
2.2.1 小鼠死亡情况 最小剂量药物组的死亡率不得超过20%,而最大剂量药物组的死亡率不得少于80%。本实验小白鼠死亡情况结果见表1。当壁虎醇提物注射剂量为5 000mg·kg-1时,该组小鼠无死亡,说明在此浓度下壁虎醇提物对小鼠毒性极小。当壁虎醇提物注射剂量为8 000mg·kg-1时,该组小鼠全死亡,说明在此浓度下壁虎醇提物对小鼠毒性较大。

表1 急性小鼠毒性实验结果
注:LgD即为注射剂量D以10为底的对数。
2.2.2 计算LD50(改良寇氏法) LD50=log-1[Xm-i(ΣP-0.5)](mg·kg-1)。式中Xm为最大剂量的对数(3.903),ΣP为各组动物死亡率总和(230%),i为相邻两组剂量的对数之差(0.05104)或相邻两组剂量比值的对数。将上列各组数代入公式得:LD50=log-1[3.903-0.051 (2.3-0.5)](mg·kg-1)=log-13.811=6474.68(mg·kg-1)≈6.475(g·kg-1)
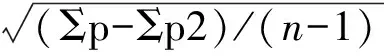
2.2.4 小鼠体质量变化 在注射2、4、8、16 h,第2、3、4、5、6、7 日分别记录小鼠的体质量变化,结果发现,与对照小鼠体质量的变化相比,给药组小鼠随着时间的增加体质量均有增加(若死亡较多则不计平均体质量)。
2.2.5 毒性反应表现 给药后开始出现自发活动明显减少、嗜睡、反应迟钝、不喜动、少食、步履不稳、共济失调、双侧上睑明显下垂;2 h后大剂量组小鼠毒性表现加重,拒食,并出现呼吸困难;4 h后大剂量组小鼠开始出现呼吸抑制、震颤、惊厥,甚至出现了中毒死亡现象。给予实验小鼠注射壁虎醇提物的剂量越大,小鼠的毒性症状则出现得越早且越重,小鼠的死亡率相应越高,且死亡时间相应越短。与对照小鼠解剖后的各内脏器官的变化比较说明实验小鼠腹腔无感染,且小鼠死亡前体质量均有增加。
3 讨论
随着癌症发病率和死亡率的逐年升高,寻找高效并且低毒的抑制癌症的方法或药物有着相当重要的现实意义。常规的化疗方案常伴随有严重的毒副反应及耐药现象,如胃肠道反应、骨髓抑制、免疫功能降低等,限制了全程剂量的使用,从而影响疗效[6-9]。近年来,开发无毒副作用的天然药物治疗癌症已成为众多研究者的焦点[10]。壁虎作为传统中药治病已有悠久的历史[11-13]。壁虎有解毒消坚、排脓生肌作用,对多种恶性肿瘤,尤其是乳腺癌、胃癌、肺癌、宫颈癌肝癌、食管癌等都有很好的疗效[14]。根据大量关于壁虎的临床报道显示,壁虎抑制消化道肿瘤具有独特的疗效,且毒副作用相对较小[15]。因此,壁虎在癌症防治方面具有一定的临床应用价值。壁虎的化学成分经氨基酸测定含有17种氨基酸:甘氨酸、谷氨酸、脯氨酸、精氨酸、组氨酸、酪氨酸、胱氨酸、甲硫氨酸、赖氨酸、丙氨酸、苯丙氨酸、天冬氨酸、丝氨酸、亮氨酸、缬氨酸、苏氨酸、异亮氨酸等,水溶部分经灰化后火焰光谱分析含有18种微量元素(锰、磷、银、钠、钾、铁、钙等),并含维生素C、D和锌。另有研究发现壁虎中还含有水分、灰分、粗蛋白、胡萝卜素、粗纤维、脂肪等[3]。
由于壁虎有效成分的提取和制备方法不同,其成分、含量和稳定性不同,急性毒性不同,作用也不同,比如壁虎中所含抗肿瘤有效成分的类别、结构、性质等尚不明确,在一定程度上限制了壁虎的开发与使用[16],还有待进一步的研究。
本次对壁虎醇提物的急性毒性研究中,灌胃给药结果显示,壁虎醇提物的毒性较小,但能够引起小鼠食欲减退。腹腔注射给药结果显示,低浓度药物的毒性作用较小,不会引起小鼠死亡。给药后短期内实验小鼠食欲不振,精神萎靡,4 h后小鼠状态逐渐恢复正常;但随着药物浓度的增加,开始出现死亡现象,死亡前小鼠眼睛模糊、精神不振,甚至出现惊厥。经改良寇氏法计算出的半数致死量显示壁虎醇提物的毒性不大。两种给药途径小鼠均出现食欲不振、运动失调、眼睛模糊、反应低下等不良反应。但其毒性较小,不会对药效产生太大影响。本研究测定壁虎醇提物经灌胃给药对小白鼠无明显毒性作用。经腹腔注射的LD50为6.475 g·kg-1,说明壁虎醇提物的给药途径不同,其毒性及其表现也不同。因此,临床应用时口服给药较注射给药安全,副作用相对肿瘤化疗药来说较小[17]。本实验中所用的壁虎醇提物的提取方法为无水乙醇提法[18],提取方法不同可能导致其有效活性成分发生变化,应对比不同提取方法的壁虎醇提物的急性毒理进行实验研究。而且,壁虎醇提物对小鼠的毒性作用部位靶器官,需要在慢性毒理实验中进一步明确。
[1] 宋佳玉,王建刚,王晓兰,等.壁虎醇提取物对小鼠肾包膜下移植S180肉瘤的抑制作用[J].时珍国医国药,2010,21(7):1694-1695.
[2] 叶云珍.中药壁虎的研究进展[J].中药材, 2009,32(7):1160-1163.
[3] 张宏波,莫志贤.壁虎的药理作用与临床应用研究进展[J].中医药导报,2010,16(2):76-78.
[4] 崔朝初,王建刚,段冷昕,等.壁虎醇提物诱导人喉癌细胞Hep2 凋亡的实验研究[J].天然产物研究与开发,2013,25(4):551-554.
[5] 孙玲,李晓宇,孙晓倩,等.水沉对益母草醇提物的小鼠急性毒性及毒靶器官的影响[J].中国药物警戒,2015,12(12):711-716.
[6] 王晓兰,王建刚,宋佳玉,等.壁虎醇提物对人食管癌细胞EC9706 增殖及凋亡蛋白表达的影响[J].时珍国医国药,2010,21(4):887-889.
[7] 王晓兰,王淑英,王建刚.壁虎醇提物对人食管鳞癌细胞EC9706 的作用和体内抗肿瘤活性[J].中国中药杂志,2010,35(16):2175.
[8] 李耀辉,刘冬梅,盛继文,等.无蹼壁虎抗肿瘤成分的提取及其对CT-26小鼠结肠腺癌的抑制作用[J].第四军医大学学报,2009,30(12):1103.
[9] 李耀辉,盛继文,耿秀芳,等.无蹼壁虎药用成分抗肿瘤效果[J].陕西中医,2009,30(7): 899-901.
[10]张飞春,李中信,杜文平,等.守宫抗肿瘤研究进展[J].河北中医,2009,31(1):144-145.
[11]张虹,向俊锋,戴玮,等.复方壁虎藤梨根对肝癌细胞的抑制作用研究[J].中药新药与临床药理,2010,21(2):130-133.
[12]李钦青,孙明江,代龙,等.壁虎不同提取工艺成分抗肿瘤作用的研究[J].时珍国医国药,2010,21(7):1629-1630.
[13]徐桂华,毕力夫,苏秀兰,等.抗肿瘤生物活性肽研究进展[J].中国医药生物技术,2007,2(2):130-132.
[14]康建功,张仕状,李耀辉,等.鲜无蹼壁虎抗肿瘤活性成分抑制CT-26肿瘤细胞生长实验研究[J].中国医院药学杂志,2007,27(4):441-444.
[15]张虹,向俊锋,戴玮,等.复方壁虎藤梨根对肝癌细胞的抑制作用研究[J].中药新药与临床药理,2010,21(2):130-133.
[16]施文荣,刘艳,谢佐福.中药壁虎对食管癌大鼠食管组织COX-2mRNA转录水平的影响[J].福建医药杂志,2010,32(6):1-3.
[17]刘秀荣.复方壁虎粉糊剂加放疗治疗食管癌临床探讨[J].右江民族医学院学报,1997,19(4):618-619.
[18]吴本端.复方壁虎粉配合放疗治疗中晚期食管癌观察[J].实用中医药杂志,1999,15(10):16.
Acute Toxicity of Alcohol Extract from Gecko with Mice
GUO Meng-li, WANG Jian-gang, JIN Ying, DUAN Yi-meng
(Key Laboratory of Pharmacology and Medical Molecular Biology,Medical College, Henan University of Science and Technology,Luoyang 471000,China)
ObjectiveTo investigate the acute toxicity of alcohol extract from gecko with mice.MethodsThe median lethal dose (LD50) was investigated by using acute toxicity test. A small amount of mice with large dose range administration of alcohol extract from gecko were used to find out the lethal range in preliminary experiment, and between total and zero lethal dose experimental male mice were divided into five groups(10 male mice per group) and the dose ratio of each group was calculated. The results were calculated with improved Kou′s method.ResultsNo death appeared in mice with intragastric administration, and reduction of activities and languishment were found during one hour after administration. The maximum tolerated dose (MTD) of was 48.0 g·kg-1. LD50 by intraperitoneal injection was 6.475 g·kg-1in mice and 95% confidence limit was 6.862~6.088 g·kg-1.ConclusionThis study suggested that alcohol extract of gecko was very small toxicity and relative safe in clinical application.
gecko alcohol extract;acute toxicity test;median lethal dose;maximum tolerated dose
1672-688X(2017)01-0004-04
10.15926/j.cnki.issn1672-688x.2017.01.02
河南省科技重点攻关基金资助项目(102102310063)
2016-10-18
河南科技大学医学院,药理学与分子生物学实验室,河南洛阳 471003
郭梦丽(1993—),女,河南驻马店人,从事肿瘤药理研究。
王建刚(1961—),男,教授,E-mail:ylwjg@163.com
R285.5
A
